Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cálculo Km y Vmax enzimáticas
Cargado por
Karen TafurTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cálculo Km y Vmax enzimáticas
Cargado por
Karen TafurCopyright:
Formatos disponibles
EJERCICOS
CALCULO DE LA Km y Vmax
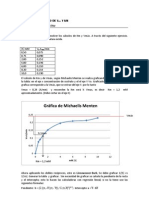
1. Explicar la manera de resolver los cálculos de Km y Vmáx a través del siguiente
ejercicio. Datos para la enzima fosfatasa ácida. (DESARROLADO EN CLASE).
[S] mM Absorbancia
0,50 0,075
0,75 0,090
2,00 0,152
4,00 0,196
6,00 0,210
8,20 0,214
10,0 0,230
Teniendo en cuenta que el factor de conversión = 0.680 mM, 30 minutos de incubación
a. Calcular Km y Vmáx, según la ecuación Michaelis Menten:
b. Calcular Km y Vmáx, aplicando los dobles recíprocos, ecuación de
Lineaweaver-Burk.
2. Se obtuvieron los siguientes datos
[Sustrato], M V0 (μmol/min)
4,0.10-4 130
2,0.10-4 110
1,0.10-4 89
5,0.10-5 62
4,0.10-5 53
2,5.10-5 38
2,0.10-5 32
a. Calcular Km y Vmáx, según la ecuación Michaelis Menten:
b. Calcular Km y Vmáx, aplicando los dobles recíprocos, ecuación de Lineaweaver-
Burk.
3. En 10 mezclas de reacción conteniendo la misma concentración de enzima y
distintas concentraciones de sustrato (sustrato M), se determinaron las
velocidades iniciales:
[Sustrato], M V0 (μmol/min)
1,0.10-3 65
5,0.10-4 63
1,0.10-4 51
5,0.10-5 42
3,0.10-5 33
2,0.10-5 27
1,0.10-5 17
5,0.10-6 9.5
1,0.10-6 2.2
5,0.10-7 1.1
a. Calcular Km y Vmáx, según la ecuación Michaelis Menten:
b. Calcular Km y Vmáx, aplicando los dobles recíprocos, ecuación de Lineaweaver-
Burk.
4. Los siguientes datos se registraron para la reacción S P catalizada
enzimáticamente:
Concentración de Sustrato
v0 (nmoles/l x min)
(molar)
6,25 x 10-6 15,00
7,50 x 10-5 56,25
1,00 x 10-4 60,00
1,00 x 10-3 74,90
1,00 x 10-2 75,00
a. Calcular Km y Vmáx, según la ecuación Michaelis Menten:
b. Calcular Km y Vmáx, aplicando los dobles recíprocos, ecuación de Lineaweaver-
Burk.
c. Cuál sería v si (S) = 2,5.10-5 M; 5,0.10-5 M y 2,5.10-5 M
5. Se mide la velocidad inicial de la reacción enzimática para una serie de distintas
concentraciones iniciales de sustrato. Los datos obtenidos son:
Determínese gráficamente KM y vmáx. mediante el método de Lineweaver-Burk
6. Una enzima que cataliza la reacción X→Y se aisló de dos especies bacterianas
diferentes. Ambas enzimas tienen la misma Vmax pero diferentes valores de Km
para el sustrato. La enzima A tiene una Km de 2.0 μM, mientras que la enzima B
tiene una Km de 0.5 μM. El gráfico representa las cinéticas de reacción llevadas
a cabo con la misma concentración de cada enzima y con [X]= 1 μM. ¿Qué curva
representa a la enzima A y cuál a la enzima B?
7. El estudio de una reacción enzimática que sigue una cinética del tipo Michaelis-
Menten ha aportado los siguientes datos:
[S] (µM) V0 (nM/min)
1 25.
4 40
10 45.5
100 49.5
500 50
1000 50
a. Calcule el valor de Km y Vmax.
b. Si se aumenta la cantidad de enzima en la reacción, ¿variarán Km y Vmax.?
8. Para establecer los parámetros cinéticos de dos enzimas (E1 y E2, PM 65000 y
75000 Da, respectivamente) que catalizan la misma reacción en dos compartimentos
subcelulares distintos, se determinaron las velocidades iniciales de la reacción en
presencia de diferentes concentraciones de sustrato y de 1 µg/ml de enzima en cada
caso. Los ensayos se realizaron en tampón fosfato 0,2 M, pH 7,2 (pKs: 2,1; 7,2; 12,3).
Los resultados obtenidos fueron los siguientes:
¿Cuál será la Vmax y la KM de ambas enzimas y análisis su Km.
También podría gustarte
- Problemas de enzimas: determinación de KM, Vmax, número de recambio y actividad específicaDocumento8 páginasProblemas de enzimas: determinación de KM, Vmax, número de recambio y actividad específicaTonyFontanaAún no hay calificaciones
- Problemas Cinetica EnzimaticaDocumento9 páginasProblemas Cinetica EnzimaticamichypaoAún no hay calificaciones
- Cinética enzimática problemas bioquímicaDocumento7 páginasCinética enzimática problemas bioquímicaVictor Aguirre A75% (4)
- Taller Cinetica Enzimatica Ii 019Documento2 páginasTaller Cinetica Enzimatica Ii 019EDWARD ALEXIS GOMEZ GUACA100% (1)
- Problemas de BioquímicaDocumento7 páginasProblemas de BioquímicaNoe Barboza Linares0% (2)
- Problemas de Cinética EnzimáticaDocumento14 páginasProblemas de Cinética EnzimáticaJhojan Ugarte ChincheroAún no hay calificaciones
- Problemas de Cinética EnzimáticaDocumento3 páginasProblemas de Cinética EnzimáticamcmmartinAún no hay calificaciones
- Taller Cinetica EnzimaticaDocumento2 páginasTaller Cinetica Enzimaticalaura garciaAún no hay calificaciones
- Ejercicios de Cinetica EnzimaticaDocumento39 páginasEjercicios de Cinetica EnzimaticaMichael Thorn50% (2)
- Krebs y Glioxilato PDFDocumento6 páginasKrebs y Glioxilato PDFalexmaras9550% (4)
- PROBLEMAS ENZIMÁTICOSDocumento5 páginasPROBLEMAS ENZIMÁTICOSJulio Cesar Castañeda Mancipe80% (5)
- Revista de Divulgación - Mutagenesis Dirigida AplicacionesDocumento6 páginasRevista de Divulgación - Mutagenesis Dirigida AplicacionesKeren Espinoza100% (1)
- Tutorial Calculos de KM y VmaxDocumento3 páginasTutorial Calculos de KM y VmaxFrancisca Fuentes100% (1)
- Cinetica Enzimatica Ejercicios ResueltosDocumento26 páginasCinetica Enzimatica Ejercicios Resueltospvv1963100% (1)
- APLICACIÓN KLaDocumento2 páginasAPLICACIÓN KLaClau BecerrilAún no hay calificaciones
- Cinetica Enzimatica Ejercicios ResueltosDocumento26 páginasCinetica Enzimatica Ejercicios ResueltosCarlos A. Olivares SalasAún no hay calificaciones
- ProblCineticaEnzimatica. ATCasaDocumento3 páginasProblCineticaEnzimatica. ATCasaJohanna Pilar LlagllaAún no hay calificaciones
- Crecimiento Microbiano y Cálculo de RendimientosDocumento18 páginasCrecimiento Microbiano y Cálculo de RendimientosCorazon Contento100% (2)
- Practica 5 LIIBIDocumento33 páginasPractica 5 LIIBICésar Porras100% (1)
- La InvertasaDocumento2 páginasLa InvertasaDavid Saúl Paredes Puma100% (2)
- Enzimas y cinética enzimáticaDocumento5 páginasEnzimas y cinética enzimáticaJohanna Castillo100% (1)
- Balance D..Documento59 páginasBalance D..Erus Xochitiotzi33% (3)
- Ejercicios de Cinetica EnzimaticaDocumento28 páginasEjercicios de Cinetica EnzimaticaJose Orbegoso LopezAún no hay calificaciones
- Clase Practica 17Documento9 páginasClase Practica 17Kenya SantacruzAún no hay calificaciones
- Guía de Ejercicios #1 Balances de Masa en BioprocesosDocumento7 páginasGuía de Ejercicios #1 Balances de Masa en BioprocesosCatalina Zamora AstudilloAún no hay calificaciones
- Balance Materia en Sistemas de CultivoDocumento19 páginasBalance Materia en Sistemas de CultivoWilfredo TullumeAún no hay calificaciones
- Bioenergética: reacciones termodinámicasDocumento7 páginasBioenergética: reacciones termodinámicasKenya SantacruzAún no hay calificaciones
- Practica Calculos BSDocumento3 páginasPractica Calculos BSEdinson MarquinaAún no hay calificaciones
- Bioquímica Libro de Texto Con Aplicaciones Clínica... - (10 ENZIMAS CLASIFICACIÓN CINÉTICA Y CONTROL)Documento52 páginasBioquímica Libro de Texto Con Aplicaciones Clínica... - (10 ENZIMAS CLASIFICACIÓN CINÉTICA Y CONTROL)Referencista Biblioteca100% (1)
- Guia de Ejercicios Cinetica EnzimaticaDocumento2 páginasGuia de Ejercicios Cinetica Enzimaticarobert ocrospomaAún no hay calificaciones
- Taller RecuentoDocumento9 páginasTaller RecuentoDanielaAún no hay calificaciones
- Tipos de ArnDocumento5 páginasTipos de ArnMiguel Angel Rodas Herrera100% (1)
- Ingeniería Enzimática IPNDocumento10 páginasIngeniería Enzimática IPNBryan Antonio Maza Cordova0% (1)
- Problemas Bioenergética 2018ADocumento5 páginasProblemas Bioenergética 2018AManuel Grano100% (1)
- Problemario Aa y ProteínasDocumento8 páginasProblemario Aa y ProteínasalescrialferAún no hay calificaciones
- Balance de Biorreactor Por Lote AlimentadoDocumento1 páginaBalance de Biorreactor Por Lote AlimentadoLuz RoldanAún no hay calificaciones
- Catalisis Acido BaseDocumento4 páginasCatalisis Acido BaseEdith Reyes LarrauriAún no hay calificaciones
- Tablas GlúcidosDocumento6 páginasTablas GlúcidosPablo LordaAún no hay calificaciones
- Cultivo ContinuoDocumento4 páginasCultivo ContinuoDamnpapAún no hay calificaciones
- Ejercicio N°13 - Bioquímica - OCWDocumento4 páginasEjercicio N°13 - Bioquímica - OCWYan HernándezAún no hay calificaciones
- IPN-UPIBI Métodos Cuantitativos Ejercicios práctica No.1Documento4 páginasIPN-UPIBI Métodos Cuantitativos Ejercicios práctica No.1Arturo Nogueron0% (1)
- Tarea 3Documento2 páginasTarea 3Kagney UralesAún no hay calificaciones
- Práctica 11. Desarrollo Bacteriano Por Vaciado en PlacaDocumento9 páginasPráctica 11. Desarrollo Bacteriano Por Vaciado en PlacaJesús Salazar100% (1)
- Cálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaDe EverandCálculo de parámetros de rapidez en cinética química, cinética enzimática y catálisis heterogéneaCalificación: 5 de 5 estrellas5/5 (1)
- 06 Cinã©tica Enzimã¡ticaDocumento19 páginas06 Cinã©tica Enzimã¡ticaalumnas.vetustAún no hay calificaciones
- Enzimas I 2013Documento6 páginasEnzimas I 2013Miranda Moctezuma MiriamAún no hay calificaciones
- 1 - Práctico - Cinética EnzimáticaDocumento3 páginas1 - Práctico - Cinética EnzimáticaAgustinaAún no hay calificaciones
- Guia PROBLEMAS DE ENZIMOLOGÍA 2018Documento4 páginasGuia PROBLEMAS DE ENZIMOLOGÍA 2018Jazz Soledaskadjk Armijo H100% (1)
- Resumen Analitico en Educacion RaeDocumento8 páginasResumen Analitico en Educacion RaeJorge Alberto Carrillo BernalAún no hay calificaciones
- Probl CineticaDocumento3 páginasProbl Cineticaputa materia0% (1)
- Tarea de Problemas HechoDocumento4 páginasTarea de Problemas HechoalexanderAún no hay calificaciones
- Ejercicios Enzimología BásicaDocumento8 páginasEjercicios Enzimología BásicaJose Natividad AriasAún no hay calificaciones
- Guia Trabajo N°6 Sem 2021-2 GRUPALDocumento3 páginasGuia Trabajo N°6 Sem 2021-2 GRUPALAyrton Azañero PérezAún no hay calificaciones
- Taller enzimas (ejercicios) sobre Km, Vmax, inhibición enzimáticaDocumento5 páginasTaller enzimas (ejercicios) sobre Km, Vmax, inhibición enzimáticawilber menesesAún no hay calificaciones
- 3er TRAB ENCARG BIOQDocumento5 páginas3er TRAB ENCARG BIOQJorge AntonioAún no hay calificaciones
- Ejercicios EnzimasDocumento2 páginasEjercicios EnzimasMarcos VeraAún no hay calificaciones
- Enzimología: Problemas de cálculo de Km, Vmax y velocidades enzimáticasDocumento1 páginaEnzimología: Problemas de cálculo de Km, Vmax y velocidades enzimáticasAstharotAún no hay calificaciones
- Problen Zimas MHDocumento6 páginasProblen Zimas MHGaby BorjaAún no hay calificaciones
- Lab Bioquímica 4.0 PDFDocumento10 páginasLab Bioquímica 4.0 PDFEmanuel PataquivaAún no hay calificaciones
- ENZIMOLOGÍA EXPERIMENTAL - Informe 2Documento7 páginasENZIMOLOGÍA EXPERIMENTAL - Informe 2Francisca Pizarro CastilloAún no hay calificaciones
- Guìa de Aprendizaje 5Documento8 páginasGuìa de Aprendizaje 5Karen TafurAún no hay calificaciones
- Relacion de Grupos - Exposicion Quimica OrganicaDocumento2 páginasRelacion de Grupos - Exposicion Quimica OrganicaKaren TafurAún no hay calificaciones
- Guía de Práctica #01. Zoologia de VertebradosDocumento20 páginasGuía de Práctica #01. Zoologia de VertebradosKaren TafurAún no hay calificaciones
- Orígenes del Perú antiguoDocumento26 páginasOrígenes del Perú antiguoKaren TafurAún no hay calificaciones
- CV marketing auxiliar experienciaDocumento1 páginaCV marketing auxiliar experienciaMirian HermozaAún no hay calificaciones
- Silabo Biologia 2019 B+Documento11 páginasSilabo Biologia 2019 B+Karen TafurAún no hay calificaciones
- CV marketing auxiliar experienciaDocumento1 páginaCV marketing auxiliar experienciaMirian HermozaAún no hay calificaciones
- Serie Cinc3a9tica Enzimc3a1tica ResueltaDocumento8 páginasSerie Cinc3a9tica Enzimc3a1tica ResueltaKaren TafurAún no hay calificaciones
- CV marketing auxiliar experienciaDocumento1 páginaCV marketing auxiliar experienciaMirian HermozaAún no hay calificaciones
- Serie Cinc3a9tica Enzimc3a1tica ResueltaDocumento8 páginasSerie Cinc3a9tica Enzimc3a1tica ResueltaKaren TafurAún no hay calificaciones
- Tarea de FundaDocumento2 páginasTarea de FundaKaren TafurAún no hay calificaciones
- Clave TaxonómicaDocumento3 páginasClave TaxonómicaKaren TafurAún no hay calificaciones
- I Unidadmodulo Historia AnaliticaDocumento26 páginasI Unidadmodulo Historia AnaliticaKaren TafurAún no hay calificaciones
- Atlas de histología vegetal y animal de la UVigoDocumento13 páginasAtlas de histología vegetal y animal de la UVigoluisAún no hay calificaciones
- Avance TecnológicoDocumento3 páginasAvance TecnológicoKaren TafurAún no hay calificaciones
- Efectos Del Uso de La Tecnología Sobre La NaturalezaDocumento5 páginasEfectos Del Uso de La Tecnología Sobre La NaturalezaKaren TafurAún no hay calificaciones
- Actitud PositivaDocumento3 páginasActitud PositivaBryan Aldair Ruiz SalazarAún no hay calificaciones
- Biofisica EjerciciosDocumento13 páginasBiofisica EjerciciosKaren TafurAún no hay calificaciones
- BMC CDocumento4 páginasBMC CKaren TafurAún no hay calificaciones
- DiversidadCultural40Documento26 páginasDiversidadCultural40Karen TafurAún no hay calificaciones
- JUSTIFICACIÓNDocumento2 páginasJUSTIFICACIÓNKaren TafurAún no hay calificaciones
- Leyes de Los GasesDocumento11 páginasLeyes de Los Gasesapi-371953983% (18)
- CONCEPTODocumento2 páginasCONCEPTOKaren TafurAún no hay calificaciones
- Leyes de Los GasesDocumento11 páginasLeyes de Los Gasesapi-371953983% (18)
- RacismoDocumento8 páginasRacismoKaren TafurAún no hay calificaciones
- EcologíaDocumento7 páginasEcologíaKaren TafurAún no hay calificaciones
- PLANTEAMIENTO DEL PROBLEMA - TabacoDocumento1 páginaPLANTEAMIENTO DEL PROBLEMA - TabacoKaren TafurAún no hay calificaciones
- Pregunta 1 CulturaDocumento1 páginaPregunta 1 CulturaKaren TafurAún no hay calificaciones
- Sociedad y cultura en la UNTEDocumento20 páginasSociedad y cultura en la UNTEKaren Tafur100% (1)
- 01 Calderas PirotubularesDocumento11 páginas01 Calderas PirotubularesJesus PerezAún no hay calificaciones
- Diseño y Simulación de Un Molde de Inyección de PlásticoDocumento32 páginasDiseño y Simulación de Un Molde de Inyección de PlásticoFernando Maldonado PáezAún no hay calificaciones
- Ii Examen de Análisis Instrumental PDFDocumento2 páginasIi Examen de Análisis Instrumental PDFLina Chavez OrtegaAún no hay calificaciones
- Cambios de estado en la naturaleza: vapor, líquido y sólidoDocumento3 páginasCambios de estado en la naturaleza: vapor, líquido y sólidoMarcosAndrésValenzuelaHuentrutripaiAún no hay calificaciones
- Allison TransmisionDocumento2 páginasAllison TransmisionxavaAún no hay calificaciones
- Volumetría de neutralizaciónDocumento15 páginasVolumetría de neutralizaciónjersonAún no hay calificaciones
- CircuitosDocumento6 páginasCircuitosKryshna VasquezAún no hay calificaciones
- Geología y Meteorología de Gran CanariaDocumento3 páginasGeología y Meteorología de Gran CanariaEladio MurcianoAún no hay calificaciones
- Hidrocraburos y Radicales AlquilosDocumento5 páginasHidrocraburos y Radicales AlquilosDulce Ortega HerreraAún no hay calificaciones
- Objetivos GeneralesDocumento9 páginasObjetivos GeneralesAlejandro SalazarAún no hay calificaciones
- Dilatación térmica: conceptos básicosDocumento55 páginasDilatación térmica: conceptos básicosdiego alejandro leon zegarraAún no hay calificaciones
- informe de quimica organicaDocumento9 páginasinforme de quimica organicaKiana HuamanAún no hay calificaciones
- Ensayos de Solubilidad y Miscibilidad en Compuestos OrgánicosDocumento13 páginasEnsayos de Solubilidad y Miscibilidad en Compuestos OrgánicosJose Daniel50% (2)
- Fundamentos de La EspectroscopíaDocumento17 páginasFundamentos de La EspectroscopíaGaby CampoverdeAún no hay calificaciones
- Informe N°3 EJERCICIOS PARA LA CASADocumento12 páginasInforme N°3 EJERCICIOS PARA LA CASAEditha BacallaAún no hay calificaciones
- Tecnologia Del Concreto EXPOSICIONDocumento30 páginasTecnologia Del Concreto EXPOSICIONJulio VarAún no hay calificaciones
- FermentaciónDocumento12 páginasFermentaciónEnrique Ruiz TapiaAún no hay calificaciones
- ELECT 2 Intensidad de Campo Eléctrico para Tercer Grado de SecundariaDocumento4 páginasELECT 2 Intensidad de Campo Eléctrico para Tercer Grado de SecundariaJhonny Zacarias Larico HuallpaAún no hay calificaciones
- Determinación del porcentaje de humedad por volatilizaciónDocumento16 páginasDeterminación del porcentaje de humedad por volatilizaciónyajaira castillo huamanAún no hay calificaciones
- S11. Presentación de Cantidad de Movimiento LinealDocumento51 páginasS11. Presentación de Cantidad de Movimiento LinealALEX MARTIN DIAZ ZAPATAAún no hay calificaciones
- Mezclas Alcalinas - Colin PortilloDocumento15 páginasMezclas Alcalinas - Colin PortilloAlejandra TapiaAún no hay calificaciones
- Clase # 1Documento13 páginasClase # 1DALEMBER XAVIER GONZABAY BAILONAún no hay calificaciones
- Guía N°4 de Ejercicios (Balanceo de Ecuaciones) QuimicaDocumento8 páginasGuía N°4 de Ejercicios (Balanceo de Ecuaciones) QuimicaConstanza ArancibiaAún no hay calificaciones
- APENDICEDocumento1 páginaAPENDICEAkiles VaesaAún no hay calificaciones
- Espectroscopia UV-Vis: Transiciones electrónicas y aplicacionesDocumento27 páginasEspectroscopia UV-Vis: Transiciones electrónicas y aplicacionesGABRIEL MARINO MARTINEZ PARRAAún no hay calificaciones
- Procedimiento de Prueba NeumaticaDocumento9 páginasProcedimiento de Prueba NeumaticaElvin Dante Vera VillanesAún no hay calificaciones
- Practica 1Documento27 páginasPractica 1Agus BarrettaAún no hay calificaciones
- Hoja de Seguridad Aditivo SikaDocumento7 páginasHoja de Seguridad Aditivo SikaEmiro OrozcoAún no hay calificaciones
- 5.2 Construcción PilasDocumento30 páginas5.2 Construcción PilasJJ Salgado IIAún no hay calificaciones
- Métodos separación mezclasDocumento2 páginasMétodos separación mezclasCarrada Jasiel67% (6)