Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Docsity Practica de Solubilidad
Cargado por
veronica Rodriguez0 calificaciones0% encontró este documento útil (0 votos)
14 vistas10 páginasEste documento de 9 páginas describe un experimento de solubilidad realizado por estudiantes de la Universidad de Antioquia. El objetivo era entender el concepto de solubilidad mediante la preparación de soluciones de nitrato de potasio y analizar cómo la concentración y temperatura afectan la solubilidad. Explica las fuerzas intermoleculares involucradas en la disolución de un sólido en un líquido y cómo la energía liberada o absorbida determina si un proceso es exotérmico o endotérmico.
Descripción original:
Título original
docsity-practica-de-solubilidad
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento de 9 páginas describe un experimento de solubilidad realizado por estudiantes de la Universidad de Antioquia. El objetivo era entender el concepto de solubilidad mediante la preparación de soluciones de nitrato de potasio y analizar cómo la concentración y temperatura afectan la solubilidad. Explica las fuerzas intermoleculares involucradas en la disolución de un sólido en un líquido y cómo la energía liberada o absorbida determina si un proceso es exotérmico o endotérmico.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
14 vistas10 páginasDocsity Practica de Solubilidad
Cargado por
veronica RodriguezEste documento de 9 páginas describe un experimento de solubilidad realizado por estudiantes de la Universidad de Antioquia. El objetivo era entender el concepto de solubilidad mediante la preparación de soluciones de nitrato de potasio y analizar cómo la concentración y temperatura afectan la solubilidad. Explica las fuerzas intermoleculares involucradas en la disolución de un sólido en un líquido y cómo la energía liberada o absorbida determina si un proceso es exotérmico o endotérmico.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 10
Práctica de Solubilidad
Química
Universidad de Antioquía
9 pag.
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
PRÁCTICA #4
Cuarto informe de laboratorio
Propiedades físicas: solubilidad
Nayrah Camila Mayorga Silva
Laura Camila Bermúdez Fajardo
Docente: Arturo Sánchez Toro
Universidad de Antioquia
Facultad de Ciencias Farmacéuticas y Alimentarias
Medellín
2020
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
Objetivos en determinado solvente de la forma expuesta a
continuación.
Entender el concepto de solubilidad mediante la
preparación de varias soluciones de nitrato de 1. Si las fuerzas intermoleculares de atracción de las
potasio de diferente concentración. moléculas soluto-soluto y solvente-solvente; y las
fuerzas de atracción entre moléculas soluto-
Comprender la influencia de la concentración y la solvente tienen la misma intensidad, las moléculas
temperatura en la solubilidad de soluciones líquido- de soluto y solvente formaran una disolución o
sólido. mezcla homogénea. A este tipo de disoluciones se
les denomina disoluciones ideales.
Comparar las solubilidades experimentales con las
teóricas del cloruro de potasio a diferentes 2. Cuando las fuerzas de atracción entre moléculas
concentraciones. soluto-solvente son más débiles que las fuerzas de
atracción entre moléculas de soluto-soluto y
Analizar las diferencias entre las solubilidades solvente-solvente, pero en pequeña proporción, el
experimentales y teóricas del nitrato de potasio proceso requiere energía para romper las fuerzas
indicando los factores que influyeron en las intermoleculares del solvente y soluto, por lo tanto,
mismas. este proceso en endotérmico.
3. Si las fuerzas de atracción entre moléculas de
soluto-solvente son más débiles que las fuerzas de
Marco teórico atracción entre moléculas de soluto-soluto y
solvente-solvente, pero en una gran proporción, no
Las experiencias cotidianas muestran que la mayoría de se forma la disolución ya que no es posible romper
los solutos son solubles en agua, por ejemplo, la sal se las fuerzas de atracción entre las moléculas ya sea
disuelve en agua, la gelatina se disuelve en agua del soluto o del solvente.
caliente; sin embargo, hay solutos como el aceite que no
se disuelve en agua. Pero ¿por qué el agua no disuelve a 4. Cuando las fuerzas de atracción entre moléculas
todas las sustancias? La respuesta es simple y tiene que soluto-solvente son más fuertes que las fuerzas de
ver con las necesidades energéticas del proceso de atracción de entre moléculas de soluto-soluto y
disolución. solvente-solvente, el proceso es exotérmico por que
En el proceso de disolución, las moléculas de solvente y las interacciones entre moléculas de soluto y
soluto se separan, para lo cual se debe aplicar una solvente liberan más calor que el necesario para
cantidad de energía que rompa las fuerzas separar las moléculas del solvente y el soluto.
intermoleculares tanto en el soluto como en el solvente. La formación de una disolución se lleva a cabo a través
Este proceso consume energía, por lo cual se denomina de un proceso que implica el rompimiento de fuerzas
endotérmico. Una vez separadas las moléculas de soluto intermoleculares de soluto y solvente y la formación de
y solvente, las mismas pasan a unirse entre sí mediante nuevas fuerzas de unión entre moléculas de soluto y
fuerzas débiles, en la formación de dichas fuerzas se solvente con el consumo y liberación de energía. Desde
libera energía por lo cual el proceso es exotérmico, la el punto de vista termodinámico, la energía que absorbe
magnitud y distancia de las fuerzas soluto-solvente y el o libera en un proceso se cuantifica como entalpia y esta
tipo de fuerza depende de la polaridad del soluto y se representa como H y como ∆H (cambio de entalpia
solvente; al final del proceso de disolución todas las cuando se realiza un proceso) por lo cual se utiliza para
moléculas de soluto quedan unidas a las moléculas de calcular el cambio de energía en la formación de una
solvente, y de esta forma, las moléculas de soluto se disolución. Cuando un proceso absorbe energía, es
distribuyen por todo el solvente quedando disueltas y endotérmico y ∆H es positivo, mientras que cuando en
formándose una solución donde no se observan los un proceso libera energía es exotérmico y ∆H es
límites entre solvente y soluto, es decir, una mezcla negativo.
homogénea.
En el proceso de romper las fuerzas intermoleculares
En este sentido, la relación entre la energía necesaria soluto-soluto y solvente-solvente, se requiere aplicar
para romper las fuerzas intermoleculares en el soluto y energía al sistema soluto-solvente, por lo tanto ∆H toma
solvente y la energía liberada en la unión de soluto- valores positivos y el proceso es endotérmico.
solvente, va a determinar si un soluto puede disolverse
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
Por otro lado, en el proceso unión entre moléculas de los cuales quedan rodeados por capas de moléculas de
solvente con moléculas de soluto se libera energía, por agua y dispersos por toda el agua.
lo cual ∆H adquiere valores negativos ya que el sistema
pierde energía, es decir, es exotérmico.
La sumatoria de las entalpías de cada interacción
molecular se obtiene la entalpía general de la
disolución. Si el resultado es un valor negativo, se dice
que la disolución perdió energía (proceso exotérmico),
mientras que si el valor es positivo la disolución
requiere energía (proceso endotérmico).
Interacciones intermoleculares
Las fuerzas intermoleculares son las que mantienen
unidas a las moléculas de determinadas sustancias para Ilustración 1. Red Cristalina del NaCl.
formar sólidos y líquidos. En el caso de los gases, sus
Las moléculas de agua son dipolares, con extremos
moléculas se unen dependiendo de las condiciones
positivos en el hidrogeno y extremos negativos en el
ambientales a las que se someta al gas. Las fuerzas
oxígeno, en el proceso de disolución las moléculas de
intermoleculares son débiles porque requieren un
agua, se unen a la superficie del cristal, dicha unión,
suministro menor de energía para romperlas
está determinada por la carga del ion ya sea Na + o Cl- ;
comparadas con las fuerzas o enlaces que unen a los
de la siguiente forma: el ion sodio (Na +) positivo, atrae
átomos para formar moléculas, los cuales requieren un
el extremo negativo (O) de las moléculas de agua y el
suministro mayor de energía para romperlas, hecho que
ion Cl- negativo, atrae el extremo positivo (H) de
las hace más fuertes.
moléculas de agua, dicha atracción es una fuerza débil
Las fuerzas débiles o intermoleculares son de mucha ion-dipolo.
importancia por que influyen directamente en las
Si las fuerzas de atracción ion-dipolo entre el agua y los
propiedades de la sustancia pues, 1) determinan el punto
iones es mayor que las fuerzas inter-iónicas del cristal
de fusión, ebullición y energía necesaria para para
de NaCl, los iones Na+ y Cl- se separan y se liberan del
romper las fuerzas de atracción entre partículas en los
cristal, rodeados por una capa de moléculas de agua. A
cambios de estado.; y 2) ayudan a determinar la
esta forma de los iones se la llama iones hidratados.
solubilidad de líquidos y sólidos en diversos solventes.
Estos se difunden por el solvente alejándose unos de
Las moléculas de una sustancia química pueden ser otros y se distribuyen por todo el solvente, de esta
iónicas, covalentes polares y covalentes no polares forma, el agua disuelve al compuesto iónico NaCl y por
según el tipo de enlace que se dé entre sus átomos. Esta el mismo mecanismo, a otros compuestos iónicos como:
característica va a determinar el tipo de fuerzas KCl, CaCl2, etc.
intermoleculares entre las moléculas de una sustancia;
El anterior mecanismo de disolución se lo denomina
las moléculas iónicas o compuestos iónicos como el
hidratación cuando el solvente es agua y solvatación
NaCl, se unen mediante fuerzas intermoleculares de
cuando el solvente es diferente del agua.
tipo electrostático (atracción entre iones de carga
opuesta); las moléculas covalentes polares o apolares se En el proceso de disolución de un compuesto iónico
unen mediante dos tipos de fuerzas intermoleculares: como NaCl, con agua como disolvente, las moléculas
puentes de hidrogeno y fuerzas de Van der Waals. de agua descomponen la red cristalina iónica en sus
piezas constitutivas que corresponden a los iones. Dicho
1. Fuerzas electrostáticas
proceso se puede interpretar como la siguiente reacción
En la vida diaria, se utiliza el cloruro de sodio (NaCl) química.
−¿¿
para diversas labores de cocina. La sal se agrega al agua NaCl → Na+¿+Cl ¿
con la que se van a cocer los alimentos y esta, al entrar
en contacto con el agua, se disuelve. En este proceso de 2. Fuerzas de Van der Waals
disolución, el agua, genera un rompimiento de las
Se dan entre moléculas polares que tienen una región
moléculas de sal (NaCl), liberando los iones Na+ y Cl-,
cargada positivamente y otra cargada negativamente. Es
decir, una molécula polar positiva es atraída hacia el
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
extremo negativo de otra, y se unen a través de una
fuerza intermolecular denominada fuerza de atracción
dipolo-dipolo.
Por otro lado, están las moléculas no polares que, por
no tener regiones cargadas, no pueden unirse a una
molécula polar con dipolos permanentes como el agua.
Sin embargo, existen moléculas no polares que se
disuelven en agua como, por ejemplo, el O 2, ¿por qué
sucede esto?
Las moléculas polares como el agua inducen la creación
de un dipolo en moléculas no polares como el oxígeno. Ilustración 3. Nube electrónica del O2 polarizada por acción del H2O.
Al mezclar oxígeno y agua, las moléculas de dichas
Por otra parte, cuando se habla de la estructura
sustancias interactúan entre sí de tal forma que cuando
electrónica, se dice que existe una probabilidad de
una molécula de agua por su extremo negativo (el
encontrar un electrón en determinada región en un
oxígeno) se une o queda en contacto con una molécula
momento dado, según la densidad electrónica. Así
de O2 (cuya nube electrónica se encuentra
mismo, se ha encontrado que es posible que los
simétricamente distribuida entre los dos oxígenos)
electrones se encuentren concentrados en una región de
repele o rechaza algunos electrones de un extremo de la
la molécula, suceso que hace que una molécula no polar
molécula de oxigeno desplazándolos hacia el otro
sea polar por un momento., es decir, se forma un dipolo
extremo, por lo que de esta forma, la molécula de
instantáneo. Cuando esta molécula polar forma un
oxigeno queda en un extremo con déficit de electrones y
dipolo pueden inducir a moléculas cercanas a formar un
en el otro extremo con más electrones. En otras
dipolo, tal como lo hace el agua con el O 2, permitiendo
palabras, la molécula de oxígeno queda con un extremo
que se atraigan y unan. A este tipo de interacciones
negativo y un extremo positivo que caracteriza a un
moleculares se les llama atracción instantánea dipolo
dipolo, y así adquiere un dipolo el cual fue inducido o
- dipolo inducido, fuerzas de dispersión o fuerzas de
creado por el contacto con las moléculas de agua.
London.
Después de que las molécula de oxígeno adquieren un
dipolo inducido (o son polarizadas), las moléculas de El proceso de inducción de un dipolo tiene el nombre de
agua se unen por su extremo negativo al extremo polarización, mientras que el grado en el que la nube
positivo del dipolo inducido de las moléculas de electrónica de un compuesto puede distorsionarse es
oxígeno. A este tipo de interacción se le denomina una propiedad a ala que se le llama polarizabilidad. Esta
atracción dipolo-dipolo inducido y es la fuerza o propiedad aumenta entre más electrones tenga la
enlace débil que permite disolver a sustancias polares y molécula o átomo, y el número de electrones se
no polares como el agua y oxígeno. relaciona directamente con la masa molar. Además, si la
molécula o átomo es más grande, los electrones de
valencia van a estar más alejados del núcleo, y por lo
tanto, la fuerza de atracción de ellos hacia el núcleo va a
ser más débil, lo que permite que se puedan mover más
libremente, logrando así que la polarizabilidad aumente.
Por lo anterior, se dice que la solubilidad de un
compuesto no polar en agua o solventes polares
aumenta a medida que aumenta su masa molar, pues
será más fácil formar la fuerza de atracción dipolo-
dipolo inducido.
3. Puentes de hidrógeno
Para que dos moléculas se unan mediante puentes de
hidrogeno, una molécula debe tener un átomo
fuertemente electronegativo como O, N, S o F con pares
Ilustración 2. Nube electrónica simétrica del O2
de electrones libres no enlazables unido covalentemente
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
a un hidrogeno y la otra molécula debe tener un átomo Solubilidad
fuertemente electronegativo. Las moléculas de agua
cumplen con dicho requisito ya que tienen los grupos O Las moléculas de un soluto en una disolución deben
—H. seguir un proceso cíclico de disolverse en agua y volver
a cristalizarse. Al principio, únicamente se da la
En la ilustración 4se representa un puente de hidrogeno disolución, después, y cuando todo el soluto se ha
entre dos moléculas de agua, donde el oxígeno de una disuelto, algunas moléculas o átomos vuelven al estado
molécula de agua tiene dos pares de electrones no disuelto, es decir, se cristalizan. Si el proceso de
solitarios, cada par de electrones (δ-) atrae la carga disolución se da en la misma proporción y velocidad
parcial positiva (δ+) del hidrogeno de dos moléculas de que el de cristalización, se dice que la solución se
agua vecinas; dicha atracción entre cargas parciales encuentras en un estado de equilibrio dinámico, o sea,
positiva y negativa da como resultado la formación de que la solución es saturada. La saturación ocurre cuando
una fuerza débil denominada puente de hidrogeno; de una solución contiene la máxima cantidad de soluto que
esta manera una molécula de agua puede unirse a través puede interactuar con el solvente sin que sobre soluto.
del oxígeno a dos moléculas de agua mediante puentes A esta concentración de una disolución saturada se le
de hidrogeno. llama solubilidad.
Si en la preparación de una disolución se cuenta con
Adicionalmente, cada molécula de agua tiene dos
menos soluto del necesario para formar una solución
hidrógenos con carga parcial positiva (δ +). Dichas
saturada en determinada cantidad de solvente, se dice
cargas pueden atraer el par de electrones libres del
que es una solución insaturada. En una solución
oxígeno de otras dos moléculas de agua y formar
insaturada no se da el proceso reversible de
puentes de hidrogeno, de esta forma, cada molécula de
cristalización del solvente.
agua puede de unirse a cuatro moléculas de agua que se
Por otro lado, cuando se agrega más soluto del
encuentren a su alrededor. Por lo anterior, se puede
necesario para formar una solución saturada, se dice que
decir que el agua tiene una alta posesividad ya que una
la solución es sobresaturada.
molécula de agua atrae en todas las direcciones a otras
moléculas de agua.
La solubilidad varia con la temperatura, pues, como se
ha dicho anteriormente, las fuerzas intermoleculares
El puente de hidrogeno es una fuerza débil con energía
requieren de cierta energía para romperse. Algunas
de enlace de aproximadamente 20kJ/mol (veintitrés
veces es suficiente la energía que libera la interacción
veces menor que la energía de un enlace covalente
entre moléculas soluto-solvente, mientras que otras
fuerte O-H), lo que significa que un pequeño
veces se requiere aplicar una cantidad de energía para
incremento de la temperatura o el movimiento de las
romper estas fuerzas intermoleculares, lo cual se puede
moléculas de agua puede romper el puente de
lograr aumentando la temperatura, hecho que favorece
hidrogeno, mas sin embargo, este al mismo tiempo se
la solubilidad. En otras palabras, la solubilidad de un
vuelve a formar con otras moléculas de agua vecinas
solvente presenta diferentes valores según a la
por lo cual es inestable e instantáneo.
temperatura a la que este.
Los puentes de hidrogeno que se dan entre moléculas
iguales, como en el agua, se les llama intermoleculares. Resultados y cálculos
Volumen Temp. de Temp. de
Solución Masa del
del agua disolución turbidez
de KNO3 KNO3 (g)
(mL) (ºC) (ºC)
1 4,05 3 86 80
2 4,05 4 65 59
3 4,05 5 60 55
4 4,05 6 58 54
5 4,05 7 49 35
Tabla 1.Temperaturas de disolución y turbidez (solubilidad) para la
misma cantidad de KNO3 en diferentes volúmenes de agua.
Ilustración 4. Puente de hidrogeno entre dos moléculas de H2O.
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
La solubilidad del KNO3 para cada temperatura se (g KNO3/100 g (g KNO3/100 g
(ºC) (ºC)
encontró con la siguiente fórmula. H2O) H2O)
1 80 135,00 80 169,00
g de soluto
S= 2 59 101,25 60 110,00
100g de solvente 3 55 81,000 55 97,775
Cabe destacar que la temperatura de turbidez es 4 54 67,500 54 95,330
equivalente a la temperatura de solubilidad. 5 35 57,857 35 54,000
Tabla 2. Solubilidad experimental y teórica del KNO 3 a diferentes
a) Solución 1: según la tabla, a 80℃ se disolvieron temperaturas.
4,05 gramos de soluto en 3 mL de agua. Para
Las temperaturas teóricas de solubilidad fueron
calcular la solubilidad según la formula anterior se
extraídas del libro “Manual del Ingeniero Químico II
plantea una regla de tres.
Edición” de Robert Perry y Cesar Chilton del año 1986.
4,05 g 3 mL Los valores van originalmente desde 0ºC hasta 125ºC,
= ⟹ x=135 g sin embargo, aquí se tomaron desde 30ºC hasta 80ºC,
x 100 mL como se puede observar en la tabla 3.
Entonces, la solubilidad a esta temperatura es de:
Temperatura
30 40 50 60 70 80
135 g KNO3 (ºC)
S= Solubilidad
100 g H 2 O
(g kNO3/100 g 45,8 63,9 85,55 110 138 169
H2O)
Se hacen los mismos cálculos para las otras soluciones.
Tabla 3. Solubilidad teórica del KNO3 a diferentes temperaturas.
b) Solución 2: a una temperatura de 60ºC.
Ahora bien, para las soluciones 3, 4 y 5, se muestran
temperaturas y solubilidades teóricas que no se pueden
4,0500 g 4 mL
= ⇒ x=101,25 g apreciar en la tabla 3. Estas temperaturas se obtuvieron
x 100 mL seleccionando un rango de dos solubilidades y
temperaturas teóricas (es decir, dos coordenadas de
La solubilidad a 60ºC y con 4 mL de solución es de:
solubilidad y temperatura) e interpolándolas y poniendo
101 g KNO 3 de supuesto un valor teórico extra de temperatura.
S= Los valores de solubilidad se hallaron usando la
100 g H 2 O
fórmula de interpolación.
Obviando los procedimientos anteriores, se calcula la
solubilidad de las tres soluciones siguientes.
c) Solución 3: a una temperatura de 55℃ y con un
S=S 1+(T −T 1) ( S 2−S 1
T 2−T 1 )
volumen de 5 mL, la solubilidad es de Donde S es la solubilidad teórica desconocida, S1
81 g KNO3 representa la menor solubilidad teórica del rango
(primera coordenada), S2 la mayor solubilidad teórica
100 g H 2 O
del rango (segunda coordenada), T1 la menor
d) Solución 4: a una temperatura de 54℃ y con un temperatura teórica del rango (primera coordenada), T 2
volumen de 6 mL, la solubilidad es de la mayor temperatura teórica del rango (segunda
67,5 g KNO3 coordenada), y T el valor de temperatura teórica para el
que se quiere hallar la solubilidad teórica.
100 g H 2 O
e) Solución 5: a una temperatura de 35℃ y con y un Veamos cómo se halló la solubilidad teórica de la
volumen de 7 mL, la solubilidad es de solución 3 a una temperatura de 55ºC.
57,85 g KNO3 Para T = 55ºC, se tomaron los dos valores de 50ºC y
100 g H 2 O 60ºC y sus respectivas solubilidades (63,9 y 85,55), se
identificaron en la fórmula y se procedió a reemplazar
Datos experimentales Datos teóricos cada uno de estos valores.
Solución
Temp. Solubilidad Temp. Solubilidad
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
( )
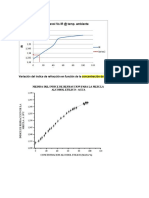
85,55−63,9 Como se puede observar en la gráfica 1, los valores
S=63,9+(55−50) experimentales y teóricos están considerablemente
60−50
alejados en la mayoría de los puntos. Esta información
Donde se corrobora con los datos de la tabla 4, pues allí se
puede visualizar más fácilmente la lejanía de estos
T=55, S1 =63,9, S2 =85,55, T1 =50 y T 2 =60.
valores mediante el porcentaje de error.
Seguidamente, se efectuó el cálculo y se obtuvo que S Comparación de las curvas de solubilidad
es igual a 97,775. Del mismo modo se calcularon las En la gráfica 1 se puede observar que las dos curvas se
solubilidades teóricas de las soluciones 4 y 5. acercan en apenas dos puntos, lo que además, las hace
tener una forma y tendencia distinta. Sabiendo que la
Teniendo en cuenta estos cálculos y los valores de la temperatura corresponde al eje x y la solubilidad al eje
tabla 3, se realizó una gráfica que permite comparar los y, se puede decir que la curva experimental presenta un
valores teóricos y experimentales de la solubilidad de comportamiento casi constante desde x=35 hasta x=54,
KNO3 en agua a distintas temperaturas, tal y como se y de x=54 hasta x=59, empieza a crecer abruptamente,
observa en la tabla 2. para finalmente, presentar un crecimiento relativamente
lineal desde x=59 hasta x=80.
Por su parte, la curva teórica registra una tendencia
continua y creciente, que a su vez es relativamente
lineal, lo que es un indica que el crecimiento de la
temperatura y la solubilidad se da en proporciones
relativamente equivalentes.
Porcentajes y posibles fuentes de error
Como se mencionó anteriormente, los altos porcentajes
de error consignados en la tabla 4 son una consecuencia
de las notables diferencias entre los valores
experimentales y teóricos de la solubilidad. Estos
porcentajes pudieron estar sujetos a todos o la mayoría
de los siguientes factores.
Gráfico 1. Curva de solubilidad teórica vs experimental del KNO3. I. Errores de mínima relevancia
Por otra parte, también se puede calcular el porcentaje a. Respecto a la medición
de error de las solubilidades mediante la fórmula: Error en la medición de los 4,05 g de KNO 3, pues la
balanza constantemente oscilaba entre 4,04 y 4,05 g.
|S . experimental−S . teórica|
% Error= × 100 %
S . experimental Errores en la visualización de la medida marcada por
el menisco de la pipeta para transferir el agua al tubo
En la tabla 4 se pueden observar los porcentajes de error de ensayo.
para cada una de las cinco soluciones a las temperaturas
determinadas. Diferente observador en la realización de las
mediciones de volumen, pues cada quien ve las
Solució T. experimental Porcentaje de
n (ºC) error cosas según su entorno.
1 80 20,12
2 59 8,182 Al transferir la sal al tubo de ensayo, se iban
cayendo cantidades mínimas de sal a la balanza, y
3 55 17,16
aunque fueran limpiadas con el pincel, podían
4 54 29,19
quedar restos de muestra, alterando la medición de la
5 35 6,666 masa del nitrato de potasio.
Tabla 4. Porcentaje de error de las solubilidades experimentales del
KNO3 a distintas temperaturas.
Error de diseño y fabricación.
Error por desgaste del instrumento.
Análisis y discusión
Error por precisión y forma de los contactos.
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
Incertidumbre del instrumento. Diferencia en las concentraciones experimentales y
teóricas del KNO3. Esta es la fuente de error más
b. Respecto a la concentración importante, pues, como se mencionó anteriormente,
Pérdida mínima de líquido al transferir el agua la primera solución alcanzó su punto de ebullición
desde la pipeta al tubo de ensayo. y empezó a evaporarse, factor que alteraría la
concentración de cada una de las soluciones, pues
Previa presencia de agua en la pipeta y el tubo de la pérdida de agua significaría una concentración
ensayo por haberlos lavado antes de usar, factor que mayor a la registrada en las cinco soluciones, es
influye en la medición de la masa y el volumen en decir, se tendrían soluciones más saturadas. En
el caso del tubo de ensayo, y del volumen en el consecuencia, esto afectaría el cálculo de la
caso de la pipeta.
solubilidad, pues el mismo está basado en la
supuesta cantidad de agua con la que debía contar
II. Errores de alta relevancia
cada solución, y no con la que realmente contaba
Registro equívoco de las temperaturas de turbidez
(que era prácticamente imposible de determinar sin
y disolución. Aunque solo se tomaron en cuenta las
ocasionar errores mayores). Además, el posterior
temperaturas experimentales de turbidez para hacer
flameado de las otras soluciones también ocasionó
la curva de solubilidad, evidentemente hubo un
una pérdida de agua.
error en la medición de las mismas. La turbidez se
En teoría, entre más saturada esté una solución
da al aparecer el primer cristal en la solución luego
líquido-sólido, será más difícil que se solubilice y
de que esta se disuelva. Sin embargo, para algunas
consecuentemente, requerirá de más calor para
soluciones se registró la temperatura después de la
hacerlo. Por esto, las solubilidades teóricas de la
formación de varios cristales, pensando que ésta era
tabla 2 son mayores a las experimentales, pues las
la temperatura correcta de turbidez. Este hecho fue
solubilidades experimentales realmente son
muy notorio en las soluciones 1 y 3, donde se
menores a las allí registrados, razón por la que
registran los mayores porcentajes de error.
también presentan estas altas temperaturas.
Enfriamiento incompleto de las soluciones o
Error en la observación de las temperaturas de
reposo insuficiente del termómetro. Una vez
solubilidad y turbidez. Cuando se llevó a cabo el
registrada la temperatura de disolución, el tubo de
primer ensayo para la solución 2, se observó una
ensayo se retiraba del calor y se ponía en reposo
temperatura de aproximadamente 70ºC, y una vez
para posteriormente registrar la temperatura de
se efectuó su repetición, el termómetro marcó 59ºC,
turbidez. Luego, se enfriaba en un baño de hielo.
dos valores que estaban alejados por más de 10ºC.
Probablemente se pudo observar mal la graduación
Una posible fuente de error pudo haber sido el
del termómetro y se pudo haber registrado un valor
enfriamiento incompleto de las soluciones, (aunque
incorrecto.
es más probable que sea el reposo insuficiente del
termómetro) pues en este proceso el termómetro
Error implícito de la interpolación. Aunque es un
aún seguía marcando temperaturas relativamente
buen método para hallar puntos desconocidos
altas (de 35º a 40ºC), lo que ocasionaba que
partiendo de un conjunto de puntos conocidos, está
registrara temperaturas muy altas de solubilidad,
sujeto inevitablemente a un error, pues no garantiza
que algunas veces obligó a nuestro grupo a repetir
que el punto hallado sea el punto exacto por donde
los ensayos.
pasa la gráfica.
También es importante destacar que en algunas
Cabe destacar que mientras más pequeño sea el
ocasiones las soluciones se encontraban entre tibias
rango que encierre el punto del cual se quiere hallar
y frías, factor que de alguna u otra manera también
la imagen, es más exacta la interpolación. En este
pudo influir cualitativamente en los porcentajes de
caso, el rango de temperaturas era de 10, lo que
error.
pudo significar un error moderado del método, pues
no es lo mismo un rango de 1, por ejemplo, que
Repetición de los ensayos. El flameado de la
uno de 10.
solución 1 se repitió una vez debido a que en la
primera oportunidad no se pudo observar con
claridad el momento exacto en el que el nitrato de Conclusiones
potasio se disolvió en agua, lo mismo que ocurrió
con algunas de las otras soluciones.
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
Se entendió y profundizó experimentalmente el
concepto de solubilidad a través de la práctica de
laboratorio.
Se comprendió la influencia de la concentración y
la temperatura en las soluciones líquido-sólido
usando nitrato de potasio como soluto y agua como
solvente.
Se demostró de manera experimental que la
solubilidad es directamente proporcional a la
temperatura en una solución de nitrato de potasio.
Se comparararon las solubilidades experimentales
con las teóricas del cloruro de potasio a diferentes
concentraciones.
Se analizaron las diferencias entre las solubilidades
experimentales y teóricas del nitrato de potasio.
Bibliografía
Petrucci R. H. Química General. Octava edición.
Pearson Education. S.A. Madrid, 2008.
Kotz J.C. Química y Reactividad Química.
Bautista, Gerardo. Química II. Páginas 50 a 56.
Universidad Industrial de Santander.
Document shared on www.docsity.com
Downloaded by: veronicaale04 (veronicar9922@gmail.com)
También podría gustarte
- Explicación de Solubilidad Como Fenómeno FísicoDocumento3 páginasExplicación de Solubilidad Como Fenómeno FísicoYodiOlaza100% (5)
- Organica I Previo Practica 1 SolubilidadDocumento24 páginasOrganica I Previo Practica 1 SolubilidadElizabeth100% (2)
- Elaboracion de Electrodo RevestidoDocumento11 páginasElaboracion de Electrodo RevestidoBrandon FlorezAún no hay calificaciones
- Determinacion de Hierro Por PermanganometriaDocumento7 páginasDeterminacion de Hierro Por PermanganometriaJOHANNA BUSTOSAún no hay calificaciones
- Guia de TPR Quimica II 2018Documento15 páginasGuia de TPR Quimica II 2018Tarzani CauilisAún no hay calificaciones
- Práctica 1 y 2 Laboratorio de OrganicaDocumento19 páginasPráctica 1 y 2 Laboratorio de OrganicaNayra Belén Valdivia FrancoAún no hay calificaciones
- Seminario 3Documento16 páginasSeminario 3Rosario IxtlilxochitlAún no hay calificaciones
- Informe de SolubilidadDocumento7 páginasInforme de Solubilidadnicolasvelandia610Aún no hay calificaciones
- Efq. Teoria Disoluciones.-1Documento75 páginasEfq. Teoria Disoluciones.-1Kity FollenAún no hay calificaciones
- Organica I Previo Practica 1 SolubilidadDocumento24 páginasOrganica I Previo Practica 1 SolubilidadJuan AlmarazAún no hay calificaciones
- Cuestionario 1 Inorganica III-1Documento57 páginasCuestionario 1 Inorganica III-1Valeria QuirozAún no hay calificaciones
- Organic ADocumento22 páginasOrganic ACarla RosalesAún no hay calificaciones
- Capitulo 12 Raymond ChangDocumento17 páginasCapitulo 12 Raymond ChangSantiagoAlcantaraAún no hay calificaciones
- Exposición Diapositiva Por DiapositivaDocumento21 páginasExposición Diapositiva Por DiapositivaDaniel Alejandro RomeroAún no hay calificaciones
- Reporte de Inorganica Prac. 12 KDocumento5 páginasReporte de Inorganica Prac. 12 KAniraklezti VillanuevaAún no hay calificaciones
- Examen de Quimica EpmDocumento2 páginasExamen de Quimica EpmetsonAún no hay calificaciones
- Fuerzas Intermoleculares y SolubilidadDocumento8 páginasFuerzas Intermoleculares y SolubilidadVALERIA HERNANDEZ GONZALEZAún no hay calificaciones
- ResumenTP2Agua PequenasMoleculasDocumento22 páginasResumenTP2Agua PequenasMoleculasDaniel RondonAún no hay calificaciones
- Prelab Práctica IDocumento8 páginasPrelab Práctica Inatmicmic2002Aún no hay calificaciones
- Conferencia #7. DisolucionesDocumento13 páginasConferencia #7. DisolucionesFreddy HermesAún no hay calificaciones
- Practica de Laboratorio # 2Documento20 páginasPractica de Laboratorio # 2Juan Alxander BriceñoAún no hay calificaciones
- Unidad 5. Liquidos y SolidosDocumento62 páginasUnidad 5. Liquidos y SolidosJOSUE SEBASTIAN VALENCIA CUENCAAún no hay calificaciones
- QG T6 Mio PDFDocumento5 páginasQG T6 Mio PDFMARTA 036Aún no hay calificaciones
- CLASE DE C T TEMA 31-3RO. DE SECUNDARIA y Tarea Nº 30Documento3 páginasCLASE DE C T TEMA 31-3RO. DE SECUNDARIA y Tarea Nº 30dayanis mamaniAún no hay calificaciones
- 23.4 Quimica 2021clase 2Documento45 páginas23.4 Quimica 2021clase 2Camii MariqueoAún no hay calificaciones
- Fuerzas IntermolecularesDocumento6 páginasFuerzas Intermoleculareshenry molinaAún no hay calificaciones
- Relación Entre La Estructura de Un Compuesto Químico Orgánico y Sus PropiedadesDocumento31 páginasRelación Entre La Estructura de Un Compuesto Químico Orgánico y Sus PropiedadestessAún no hay calificaciones
- Solubilidad y Clasificación Por Solventes 1 InformeDocumento6 páginasSolubilidad y Clasificación Por Solventes 1 InformeDaniela Cortés Mñoz0% (1)
- PracticaDocumento3 páginasPracticaAline Aguirre CamachoAún no hay calificaciones
- MA Fuerzas Intermoleculares QII CipDocumento19 páginasMA Fuerzas Intermoleculares QII CipGaspar AndradeAún no hay calificaciones
- PRACTICA 5. - Efecto Del Disolvente en La Manifestación Del Carácter IonicoDocumento7 páginasPRACTICA 5. - Efecto Del Disolvente en La Manifestación Del Carácter IonicoBrenda CarreñoAún no hay calificaciones
- Fuerzas IntermolecularesDocumento4 páginasFuerzas IntermolecularesSamuel LambertinoAún no hay calificaciones
- SolvataciónDocumento3 páginasSolvataciónEva Torres Salas0% (1)
- Previo1 SolubilidadDocumento11 páginasPrevio1 SolubilidadRaúl Jair Cortés CabañasAún no hay calificaciones
- Fuerzas IntermolecularesDocumento10 páginasFuerzas IntermolecularesIvan JimenezAún no hay calificaciones
- Practica de Laboratorio 4 Efecto Del Disolvente en Manifestacion de Caracter Ionico - FinalDocumento5 páginasPractica de Laboratorio 4 Efecto Del Disolvente en Manifestacion de Caracter Ionico - Finalclau1255Aún no hay calificaciones
- Cap 7 SolucionesDocumento48 páginasCap 7 SolucionesDaniel Eliazar Fernández AcuñaAún no hay calificaciones
- Disolucion y SolubilidadDocumento29 páginasDisolucion y SolubilidadJavier SandovalAún no hay calificaciones
- Fuerzas IntermolecularesDocumento9 páginasFuerzas IntermolecularesEDWING ANGEL GODINEZ FONSECAAún no hay calificaciones
- Análisis de Las Propiedades de Compuestos y SolucionesDocumento39 páginasAnálisis de Las Propiedades de Compuestos y SolucionesLurgrea CentralAún no hay calificaciones
- DisolcionesDocumento11 páginasDisolcionesMelanie Daniela Castillo AguilarAún no hay calificaciones
- QCA1-T-Unidad VDocumento38 páginasQCA1-T-Unidad VSalud AdolescenciaAún no hay calificaciones
- Propiedades Físicas de Los Compuestos OrgánicosDocumento22 páginasPropiedades Físicas de Los Compuestos OrgánicosCristopher Kennedy100% (1)
- Cap 7 SolucionesDocumento46 páginasCap 7 SolucionesJason Johann Tapia FriasAún no hay calificaciones
- Fuerzas IntermolecularesDocumento3 páginasFuerzas IntermolecularesLuz AnitaAún no hay calificaciones
- Desolucion InformacionDocumento18 páginasDesolucion InformacionyelsenAún no hay calificaciones
- 5 Líquidos y SólidosDocumento7 páginas5 Líquidos y SólidosLuana GiuntaAún no hay calificaciones
- El Proceso de DisoluciónDocumento3 páginasEl Proceso de DisoluciónJavier Andres UrreaAún no hay calificaciones
- Práctica N°4Documento7 páginasPráctica N°4Jaider Orozco PinedaAún no hay calificaciones
- Universidad Nacional de IngenieríaDocumento13 páginasUniversidad Nacional de IngenieríaDanielito Chilin TolentinoAún no hay calificaciones
- Preparacion Laboratorio 6Documento4 páginasPreparacion Laboratorio 6Angela BustamanteAún no hay calificaciones
- Biofísica Clase 4 - AGUADocumento9 páginasBiofísica Clase 4 - AGUAmeliAún no hay calificaciones
- Qué Es La SolvataciónDocumento3 páginasQué Es La SolvataciónDavid Vargas100% (2)
- Teoria Trabajo 1Documento10 páginasTeoria Trabajo 1miguelAún no hay calificaciones
- Discusión Informe Laboratorio 2Documento3 páginasDiscusión Informe Laboratorio 2CAMILA ALEJANDRA MACIAS ALMEIDAAún no hay calificaciones
- Teoría Unidad #6Documento13 páginasTeoría Unidad #6Martin Angel AñezAún no hay calificaciones
- Soluciones en El Cuerpo HumanoDocumento27 páginasSoluciones en El Cuerpo HumanoGiancarlo David Viviano Reyes0% (3)
- Química Unidad 2 Lys PDFDocumento51 páginasQuímica Unidad 2 Lys PDFMariaAún no hay calificaciones
- Base Física de La Vida 5to B SecDocumento25 páginasBase Física de La Vida 5to B SecValentine CrialesAún no hay calificaciones
- DisolucionesDocumento22 páginasDisolucionesChristopher Harris100% (1)
- Practica de Quimica #4Documento8 páginasPractica de Quimica #4Miguel ParamoAún no hay calificaciones
- 4 Cogeneración 2016Documento10 páginas4 Cogeneración 2016veronica RodriguezAún no hay calificaciones
- Informe P2Documento10 páginasInforme P2veronica RodriguezAún no hay calificaciones
- Documento Traducir Reaccion PermanganatoDocumento11 páginasDocumento Traducir Reaccion Permanganatoveronica RodriguezAún no hay calificaciones
- MetodosDocumento2 páginasMetodosveronica RodriguezAún no hay calificaciones
- Simón BolívarDocumento13 páginasSimón Bolívarveronica RodriguezAún no hay calificaciones
- Resultados Practica 2 UnetDocumento1 páginaResultados Practica 2 Unetveronica RodriguezAún no hay calificaciones
- Terminado. Efecto de La Temperatura en La Velocidad de Reaccion de Permanganato y OxalatoDocumento14 páginasTerminado. Efecto de La Temperatura en La Velocidad de Reaccion de Permanganato y Oxalatoveronica RodriguezAún no hay calificaciones
- Propiedades Biologicas Del Agua-1Documento10 páginasPropiedades Biologicas Del Agua-1veronica RodriguezAún no hay calificaciones
- Activad 2. Unitarias 2Documento5 páginasActivad 2. Unitarias 2veronica RodriguezAún no hay calificaciones
- Efecto Del Pretratamiento Mecanico y Pretratamiento Alcalino Sobre La Hidrólisis Ácida de Biomasa LignocelulosicaDocumento4 páginasEfecto Del Pretratamiento Mecanico y Pretratamiento Alcalino Sobre La Hidrólisis Ácida de Biomasa Lignocelulosicaveronica RodriguezAún no hay calificaciones
- Covenin 1375-79Documento8 páginasCovenin 1375-79veronica RodriguezAún no hay calificaciones
- EJERCICIO UNET EaDocumento2 páginasEJERCICIO UNET Eaveronica RodriguezAún no hay calificaciones
- Calculos Maria ProyectoDocumento4 páginasCalculos Maria Proyectoveronica RodriguezAún no hay calificaciones
- Correspondencia:: Pfalconr@unasam - Edu.peDocumento13 páginasCorrespondencia:: Pfalconr@unasam - Edu.peveronica RodriguezAún no hay calificaciones
- .PARCIAL III REACCIONES. Grupo 2. Veronica Carlos LeopoldoDocumento7 páginas.PARCIAL III REACCIONES. Grupo 2. Veronica Carlos Leopoldoveronica RodriguezAún no hay calificaciones
- Tesisdefinitiva Cuji UNEFMDocumento218 páginasTesisdefinitiva Cuji UNEFMveronica RodriguezAún no hay calificaciones
- Curva Indice de Refraccion Del EtanolDocumento3 páginasCurva Indice de Refraccion Del Etanolveronica RodriguezAún no hay calificaciones
- Estudio Sobre La Composicion de Madera de Especies de Zona AridaDocumento63 páginasEstudio Sobre La Composicion de Madera de Especies de Zona Aridaveronica RodriguezAún no hay calificaciones
- Desarrollo Primer ObjetivoDocumento18 páginasDesarrollo Primer Objetivoveronica RodriguezAún no hay calificaciones
- Effects of Lignocellulose Degradation PRDocumento6 páginasEffects of Lignocellulose Degradation PRveronica RodriguezAún no hay calificaciones
- Determinaciondelosprincipalescomponentesdelabiomasa LignocelulosicaDocumento7 páginasDeterminaciondelosprincipalescomponentesdelabiomasa Lignocelulosicaveronica RodriguezAún no hay calificaciones
- Toaz - Info Aoac 97318 PRDocumento2 páginasToaz - Info Aoac 97318 PRveronica RodriguezAún no hay calificaciones
- Calculos. Avance IIDocumento15 páginasCalculos. Avance IIveronica RodriguezAún no hay calificaciones
- Bases TeóricasDocumento30 páginasBases Teóricasveronica RodriguezAún no hay calificaciones
- Avance I TesisDocumento50 páginasAvance I Tesisveronica RodriguezAún no hay calificaciones
- ANTECEDENTESDocumento7 páginasANTECEDENTESveronica RodriguezAún no hay calificaciones
- Avance Ii. Grupo 5Documento82 páginasAvance Ii. Grupo 5veronica RodriguezAún no hay calificaciones
- Reforzamiento Estructural de Columnas en Monumentos Historicos (Palacio de Gobierno de Aguascalientes)Documento61 páginasReforzamiento Estructural de Columnas en Monumentos Historicos (Palacio de Gobierno de Aguascalientes)Víctor Manuel Castro AlvarezAún no hay calificaciones
- Mantenimiento Mecanico Informe 831Documento26 páginasMantenimiento Mecanico Informe 831Diego Jara SchulzAún no hay calificaciones
- Deber SoldabilidadDocumento7 páginasDeber SoldabilidadDavid GarciaAún no hay calificaciones
- Mecanismo de La Conducción ElectroliticaDocumento8 páginasMecanismo de La Conducción ElectroliticaLiving NafAún no hay calificaciones
- Uso de Enzimas Como Indices de CalidadDocumento9 páginasUso de Enzimas Como Indices de CalidadCarMarquzAún no hay calificaciones
- Tabla 9Documento2 páginasTabla 9Stephanie PintadoAún no hay calificaciones
- Normas y Legislacion Esterilización PDFDocumento41 páginasNormas y Legislacion Esterilización PDFernejose0% (1)
- PDF. Control Alimentario. Tema 5Documento12 páginasPDF. Control Alimentario. Tema 5XiQi Taun TaunAún no hay calificaciones
- Pauta Corte S60Documento47 páginasPauta Corte S60SP GLASSAún no hay calificaciones
- Ficha Tecnica Harina Fortificada Nacional We - 19068 (O) (Molineras ) #2Documento2 páginasFicha Tecnica Harina Fortificada Nacional We - 19068 (O) (Molineras ) #2yes hisAún no hay calificaciones
- Metodos ElectricosDocumento56 páginasMetodos ElectricosCARLOS DANIEL LOPEZ LOPEZAún no hay calificaciones
- Practica 7 Equilibrio QuimicoDocumento14 páginasPractica 7 Equilibrio Quimicogabrielrs0505Aún no hay calificaciones
- Catalogo CompletoDocumento47 páginasCatalogo CompletoWilliam Dante Mescco SaireAún no hay calificaciones
- Práctica 09 - HalogenosDocumento3 páginasPráctica 09 - HalogenosfranklinAún no hay calificaciones
- 3.hojas MSDSDocumento17 páginas3.hojas MSDSmultiservicios industrialesAún no hay calificaciones
- DETERMINACIÓN DE AMINAS BIOGENAS (HISTAMINA) Método HPLC MEDocumento8 páginasDETERMINACIÓN DE AMINAS BIOGENAS (HISTAMINA) Método HPLC MEisaac snakeAún no hay calificaciones
- Planteamiento Del ProblemaDocumento6 páginasPlanteamiento Del Problemayusleivis torresAún no hay calificaciones
- Wuolah Free ADN y ARNDocumento13 páginasWuolah Free ADN y ARNzurelyAún no hay calificaciones
- Tema 3 Sistemas MaterialesDocumento13 páginasTema 3 Sistemas MaterialesMar López TalaveraAún no hay calificaciones
- Licor de MentaDocumento12 páginasLicor de Menta再開 ルイスAún no hay calificaciones
- Ejercicios Dureza VickersDocumento8 páginasEjercicios Dureza VickersOSCAR ALFREDO CASTILLO MELGOSAAún no hay calificaciones
- Evaluacion - Ciencias 4Documento4 páginasEvaluacion - Ciencias 4Claudia FuentesAún no hay calificaciones
- Manual Calefon 10 Lts A Dic 2010Documento16 páginasManual Calefon 10 Lts A Dic 2010sandrarociolaime50% (2)
- BIOFISICADocumento3 páginasBIOFISICAErik Joel Rosales RisalveAún no hay calificaciones
- Ciencia de Los MaterialesDocumento367 páginasCiencia de Los MaterialesvictoredcAún no hay calificaciones
- IntroduccionDocumento12 páginasIntroduccionMariana LacoaAún no hay calificaciones
- Columnas CompuestasDocumento30 páginasColumnas CompuestasReynaldo Tejada PiñerezAún no hay calificaciones