Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Resultados Practica 2 Unet
Cargado por
veronica Rodriguez0 calificaciones0% encontró este documento útil (0 votos)
4 vistas1 páginaEste documento presenta datos experimentales de tres experimentos diferentes: 1) la determinación de la constante de un calorímetro, 2) la entalpía de neutralización entre un ácido fuerte y una base fuerte, y 3) la entalpía de neutralización entre un ácido débil y una base fuerte. Proporciona temperaturas iniciales y máximas alcanzadas, calor absorbido/liberado, y los resultados de las constantes del calorímetro y las entalpías de neutralización.
Descripción original:
Título original
resultados practica 2 unet
Derechos de autor
© © All Rights Reserved
Formatos disponibles
XLSX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEste documento presenta datos experimentales de tres experimentos diferentes: 1) la determinación de la constante de un calorímetro, 2) la entalpía de neutralización entre un ácido fuerte y una base fuerte, y 3) la entalpía de neutralización entre un ácido débil y una base fuerte. Proporciona temperaturas iniciales y máximas alcanzadas, calor absorbido/liberado, y los resultados de las constantes del calorímetro y las entalpías de neutralización.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como XLSX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
4 vistas1 páginaResultados Practica 2 Unet
Cargado por
veronica RodriguezEste documento presenta datos experimentales de tres experimentos diferentes: 1) la determinación de la constante de un calorímetro, 2) la entalpía de neutralización entre un ácido fuerte y una base fuerte, y 3) la entalpía de neutralización entre un ácido débil y una base fuerte. Proporciona temperaturas iniciales y máximas alcanzadas, calor absorbido/liberado, y los resultados de las constantes del calorímetro y las entalpías de neutralización.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como XLSX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
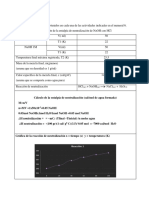
Datos experimentales para la determinación de la A B
constante del calorímetro
Temperatura del agua fría (°C) 23.4 23.8
Temperatura del agua caliente (°C) 50.1 51.6
Temperatura máxima alcanzada por la mezcla (°C) 36.9 35.8
Datos experimentales para la determinación de la entalpía de
neutralización entre ácido fuerte y una base fuerte
Temperatura de solución de HCl 24.3
Temperatura de solución de NaOH 24.9
Temperatura máxima alcanzada por la mezcla 30.4
Datos experimentales para la determinación de la entalpía de
neutralización ácido débil y una base fuerte
Temperatura de la solución de CH3COOH 24
Temperatura de la solución de NaOH 25.1
Temperatura máxima alcanzada por la mezcla 30.2
Resultados obtenidos en la determinación de la A B
constante del calorímetro
Calor liberado por el agua caliente (cal) 1320 1580
Calor absorbido por agua fria (cal) 1350 1200
Calor absorbido por el calorímetro (cal) -30 380
Variación de la temperatura 13.5 12
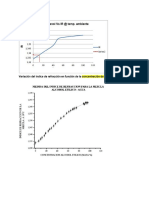
Constante del calorímetro -2.22 31.67
Resultados obtenidos para la mezcla de HCl + NaOH
Carlor absorbido por el calorimetro (cal) 174.185
Calor absorbido por la mezcla (cal) 1129.89
Moles de agua producidos (mol) 2.5
Entalpía de neutralización (cal/mol H2O) 521.63
Resultados obtenidos para la mezcla de CH3COOH + NaOH
Calor absorbido por el calorímetro (cal) 161.211
Calor absorbido por la mezcla (cal) 1121.797
Moles de agua producidos (mol) 401
Entalpía de neutralización (cal / mol H2O) 3.2
También podría gustarte
- Entalpia de NautralizacionDocumento6 páginasEntalpia de Nautralizacionantony usecheAún no hay calificaciones
- Informe P2Documento10 páginasInforme P2veronica RodriguezAún no hay calificaciones
- Practica. Calor de Neutralizacion 1 1Documento9 páginasPractica. Calor de Neutralizacion 1 1Ana Maria RiveraAún no hay calificaciones
- Calor de Disolución y Neutralización Daniel-DeicyDocumento4 páginasCalor de Disolución y Neutralización Daniel-DeicyCatalina Duque HenaoAún no hay calificaciones
- Determinación Del Calor de NeutralizaciónDocumento11 páginasDeterminación Del Calor de NeutralizaciónLUIS ALBERTO PEREZ GARCIA100% (1)
- Calor de Reacción en Solución (B1)Documento5 páginasCalor de Reacción en Solución (B1)Andres Felipe Plaza SanchezAún no hay calificaciones
- Termoquimica2 Laboratorio de Fisicoquimica UNMSMDocumento19 páginasTermoquimica2 Laboratorio de Fisicoquimica UNMSMwaldir marcelinoAún no hay calificaciones
- Practica #5 CALOR DE REACCION PDFDocumento7 páginasPractica #5 CALOR DE REACCION PDFDeymis AlborAún no hay calificaciones
- Informe Calor de NeutralizaciónDocumento9 páginasInforme Calor de NeutralizaciónVALENTINA LÓPEZ PÉREZ100% (2)
- Calor de NeutralizacionDocumento11 páginasCalor de NeutralizacionErik Anchivilca ZavaletaAún no hay calificaciones
- l8 BorraDocumento16 páginasl8 BorraErika GarciaAún no hay calificaciones
- Informe # 6 FQ1. Calor de NeutralizaciónDocumento10 páginasInforme # 6 FQ1. Calor de NeutralizaciónMONROY RAMIREZ ANDRES FELIPEAún no hay calificaciones
- LFQ P2Documento9 páginasLFQ P2Alejandro SánchezAún no hay calificaciones
- Calor de NeutralizaciónDocumento3 páginasCalor de NeutralizaciónjenieblesAún no hay calificaciones
- INFORME-7Documento7 páginasINFORME-7AnaisBriggitJacintoChavezAún no hay calificaciones
- Calor de Neutralizacion TermodinamicaDocumento8 páginasCalor de Neutralizacion TermodinamicaHugo BarrosoAún no hay calificaciones
- Calorimetría 2Documento4 páginasCalorimetría 2Ronald Javier CuellarAún no hay calificaciones
- Practica No 11determinacion Del Calor de Neutralizacion Del Acido Clorhidrico Con Hidroxido de SodioDocumento5 páginasPractica No 11determinacion Del Calor de Neutralizacion Del Acido Clorhidrico Con Hidroxido de Sodiocristhian andreAún no hay calificaciones
- Informe de FisicoquimicaDocumento19 páginasInforme de FisicoquimicaLuis Alberto Orbegoso HuancaAún no hay calificaciones
- Lab 3. Determinaciones CalorimétricasDocumento10 páginasLab 3. Determinaciones Calorimétricaswilmer alexander ortega pabonAún no hay calificaciones
- Reporte EstudianteDocumento16 páginasReporte EstudianteKaren Zamora AcuñaAún no hay calificaciones
- Informe 9Documento4 páginasInforme 9Bayron pachecoAún no hay calificaciones
- PRACTICA de Calorimetria IIIDocumento6 páginasPRACTICA de Calorimetria IIIalexander ruelas zapata0% (1)
- Practica #5 CALOR DE REACCIONDocumento7 páginasPractica #5 CALOR DE REACCIONDeymis Albor100% (1)
- Informe Fisicoquimica - Componete PracticoDocumento13 páginasInforme Fisicoquimica - Componete PracticoJoe PayAún no hay calificaciones
- TP 3 Termoquímica Rev BDocumento17 páginasTP 3 Termoquímica Rev BJuli HolgadoAún no hay calificaciones
- Práctica No. 2 CALOR DE NEUTRALIZACIÓNDocumento9 páginasPráctica No. 2 CALOR DE NEUTRALIZACIÓNAlejandro SánchezAún no hay calificaciones
- Practica No. 2 - Equipo 4Documento8 páginasPractica No. 2 - Equipo 4ash oyervidesAún no hay calificaciones
- Informe TermoDocumento7 páginasInforme TermoDARLYNTH BRIYITH RAMIREZ MARROQUINAún no hay calificaciones
- Determinación Del Calor de Combustión de Un Ácido y Una Base Fuerte Mediante Técnica CalorimétricaDocumento19 páginasDeterminación Del Calor de Combustión de Un Ácido y Una Base Fuerte Mediante Técnica CalorimétricaAlejandro SánchezAún no hay calificaciones
- Informe 1 TerminadoDocumento7 páginasInforme 1 TerminadoKAROL VALENTINA ERASO MORAAún no hay calificaciones
- Informe Calor de NeutralizacionDocumento5 páginasInforme Calor de NeutralizacionValentina LópezAún no hay calificaciones
- Calorimetria InformeDocumento10 páginasCalorimetria InformeAmanda Catalina Duarte100% (2)
- Exposicion NeutralizacionDocumento29 páginasExposicion NeutralizacionJefferson Gutierrez ZorrillaAún no hay calificaciones
- Práctica N°8. Determinación Del Calor de NeutralizaciónDocumento3 páginasPráctica N°8. Determinación Del Calor de NeutralizaciónMARIA FERNANDA CARO FONSECAAún no hay calificaciones
- INFORME Nº4 Grupo - 2Documento12 páginasINFORME Nº4 Grupo - 2Angela Anyels Castillón IngaAún no hay calificaciones
- Parte Discusion de Resultados TermoquimicaDocumento2 páginasParte Discusion de Resultados TermoquimicaDillan Cari SolanoAún no hay calificaciones
- Calor de NeutralizacionDocumento9 páginasCalor de NeutralizacionAnonymous NEoRkE9100% (1)
- Calordeneutralizaci N 2Documento9 páginasCalordeneutralizaci N 2Laura Bustamante CalleAún no hay calificaciones
- Determinacion Calor de SolucionDocumento14 páginasDeterminacion Calor de SolucionDionisio MayorgaAún no hay calificaciones
- CONCLUSIONESDocumento13 páginasCONCLUSIONESLucy JonesAún no hay calificaciones
- Problemas Bloque 2Documento6 páginasProblemas Bloque 2Saioa VegaAún no hay calificaciones
- Calor de Neutralización PDFDocumento4 páginasCalor de Neutralización PDFVeronica CaizaAún no hay calificaciones
- Calor de NeutralizaciónDocumento8 páginasCalor de NeutralizaciónDarryAún no hay calificaciones
- Segundo Examen Practico Fisico Quimica - Santiago Avila Lucia LorenaDocumento5 páginasSegundo Examen Practico Fisico Quimica - Santiago Avila Lucia LorenaLucía lorenaAún no hay calificaciones
- Calculos Practica 4Documento18 páginasCalculos Practica 4Melisa HernandezAún no hay calificaciones
- Capacidad Calorífica Del Calorimetro, Calor Especifico para MetalesDocumento5 páginasCapacidad Calorífica Del Calorimetro, Calor Especifico para MetalesBrayan Stiven Mosquera YuleAún no hay calificaciones
- Efecto Calorífico de Las Reacciones QuímicasDocumento24 páginasEfecto Calorífico de Las Reacciones QuímicasDanielAún no hay calificaciones
- Informe Numero 7Documento12 páginasInforme Numero 7Breyner SanchezAún no hay calificaciones
- RESULTADOS Y DISCUSIONES - TermoquimicaDocumento3 páginasRESULTADOS Y DISCUSIONES - TermoquimicaLourdes LuqueAún no hay calificaciones
- PRÁCTICA 2 Determinación de Calores de ReacciónDocumento4 páginasPRÁCTICA 2 Determinación de Calores de ReacciónJulioAún no hay calificaciones
- Informe 2. Calor de Reaccià N en Solucià NDocumento21 páginasInforme 2. Calor de Reaccià N en Solucià NMafeDiazGarciaAún no hay calificaciones
- Laboratorio 2Documento7 páginasLaboratorio 2xiomara Villena UrrutiaAún no hay calificaciones
- Reporte de Laboratorio N°3-2022-1Documento17 páginasReporte de Laboratorio N°3-2022-1Angel MarellaAún no hay calificaciones
- Calor de NeutralizacionDocumento21 páginasCalor de Neutralizacioncristhian yark chavez lloccllaAún no hay calificaciones
- Informe 1 Quimica Silva SantanaDocumento7 páginasInforme 1 Quimica Silva SantanaAngie SilvaAún no hay calificaciones
- Informe 6 FisicoquímicaDocumento16 páginasInforme 6 FisicoquímicaAngela Abanto BelloAún no hay calificaciones
- Calor de Neutralizaciòn TzaDocumento5 páginasCalor de Neutralizaciòn TzaAlex Santiago100% (3)
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Curso Práctico de Química GeneralDe EverandCurso Práctico de Química GeneralCalificación: 4 de 5 estrellas4/5 (4)
- 4 Cogeneración 2016Documento10 páginas4 Cogeneración 2016veronica RodriguezAún no hay calificaciones
- Documento Traducir Reaccion PermanganatoDocumento11 páginasDocumento Traducir Reaccion Permanganatoveronica RodriguezAún no hay calificaciones
- MetodosDocumento2 páginasMetodosveronica RodriguezAún no hay calificaciones
- Simón BolívarDocumento13 páginasSimón Bolívarveronica RodriguezAún no hay calificaciones
- Docsity Practica de SolubilidadDocumento10 páginasDocsity Practica de Solubilidadveronica RodriguezAún no hay calificaciones
- Terminado. Efecto de La Temperatura en La Velocidad de Reaccion de Permanganato y OxalatoDocumento14 páginasTerminado. Efecto de La Temperatura en La Velocidad de Reaccion de Permanganato y Oxalatoveronica RodriguezAún no hay calificaciones
- Propiedades Biologicas Del Agua-1Documento10 páginasPropiedades Biologicas Del Agua-1veronica RodriguezAún no hay calificaciones
- Activad 2. Unitarias 2Documento5 páginasActivad 2. Unitarias 2veronica RodriguezAún no hay calificaciones
- Efecto Del Pretratamiento Mecanico y Pretratamiento Alcalino Sobre La Hidrólisis Ácida de Biomasa LignocelulosicaDocumento4 páginasEfecto Del Pretratamiento Mecanico y Pretratamiento Alcalino Sobre La Hidrólisis Ácida de Biomasa Lignocelulosicaveronica RodriguezAún no hay calificaciones
- Covenin 1375-79Documento8 páginasCovenin 1375-79veronica RodriguezAún no hay calificaciones
- EJERCICIO UNET EaDocumento2 páginasEJERCICIO UNET Eaveronica RodriguezAún no hay calificaciones
- Calculos Maria ProyectoDocumento4 páginasCalculos Maria Proyectoveronica RodriguezAún no hay calificaciones
- Correspondencia:: Pfalconr@unasam - Edu.peDocumento13 páginasCorrespondencia:: Pfalconr@unasam - Edu.peveronica RodriguezAún no hay calificaciones
- .PARCIAL III REACCIONES. Grupo 2. Veronica Carlos LeopoldoDocumento7 páginas.PARCIAL III REACCIONES. Grupo 2. Veronica Carlos Leopoldoveronica RodriguezAún no hay calificaciones
- Tesisdefinitiva Cuji UNEFMDocumento218 páginasTesisdefinitiva Cuji UNEFMveronica RodriguezAún no hay calificaciones
- Curva Indice de Refraccion Del EtanolDocumento3 páginasCurva Indice de Refraccion Del Etanolveronica RodriguezAún no hay calificaciones
- Estudio Sobre La Composicion de Madera de Especies de Zona AridaDocumento63 páginasEstudio Sobre La Composicion de Madera de Especies de Zona Aridaveronica RodriguezAún no hay calificaciones
- Desarrollo Primer ObjetivoDocumento18 páginasDesarrollo Primer Objetivoveronica RodriguezAún no hay calificaciones
- Effects of Lignocellulose Degradation PRDocumento6 páginasEffects of Lignocellulose Degradation PRveronica RodriguezAún no hay calificaciones
- Determinaciondelosprincipalescomponentesdelabiomasa LignocelulosicaDocumento7 páginasDeterminaciondelosprincipalescomponentesdelabiomasa Lignocelulosicaveronica RodriguezAún no hay calificaciones
- Toaz - Info Aoac 97318 PRDocumento2 páginasToaz - Info Aoac 97318 PRveronica RodriguezAún no hay calificaciones
- Calculos. Avance IIDocumento15 páginasCalculos. Avance IIveronica RodriguezAún no hay calificaciones
- Bases TeóricasDocumento30 páginasBases Teóricasveronica RodriguezAún no hay calificaciones
- Avance I TesisDocumento50 páginasAvance I Tesisveronica RodriguezAún no hay calificaciones
- ANTECEDENTESDocumento7 páginasANTECEDENTESveronica RodriguezAún no hay calificaciones
- Avance Ii. Grupo 5Documento82 páginasAvance Ii. Grupo 5veronica RodriguezAún no hay calificaciones