Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Modulo 5 Sangre y Analisis Clinicos
Cargado por
Mathías AcuñaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Modulo 5 Sangre y Analisis Clinicos
Cargado por
Mathías AcuñaCopyright:
Formatos disponibles
EDDIS EDUCATIVA
CURSO:
“ASISTENTE DE LABORATORIO Y ANÁLISIS
CLÍNICOS”
MÓDULO 5:
SANGRE Y ANÁLISIS CLÍNICOS
Curso: Asistente de Laboratorio y Análisis Clínicos Página 1
EDDIS EDUCATIVA
EXTRACCIÓN DE LA MUESTRA
MÉTODOS GENERALES DE EXTRACCIÓN
PUNCIÓN VENOSA (venopuntura): la zona de preferencia en adultos y niños son las venas de la
flexura del codo (región ante cubital)
PUNCIÓN PERIFÉRICA (micropuntura): En adultos: del tercer o cuarto dedo de la mano o del
lóbulo de la oreja En niños de corta edad: del talón o dedo gordo del pie
TÉCNICA DE EXTRACCIÓN DE SANGRE VENOSA: es la técnica más empleada tanto en adultos
como en niños.
Esta técnica está basada en la extracción de sangre de una vena o arteria y puede realizarse en
antebrazo (pliegue del codo), o en los casos de ser necesario en la mano, pierna o pie. Para esta
tarea necesitamos un lazo de goma o mango hemostático. La jeringa descartable dependerá de
la cantidad de análisis que se van a realizar pudiendo ser de 5, 10 o 20 ml; con respecto a la aguja
descartable, como mínimo su calibre debe ser de 25 o 21 G, un menor calibre puede provocar
que se tape por restos de tejido tisular o micro coágulos imposibilitando esto la extracción de
sangre.
Verificar la orden médica para saber que tubos necesito y que volumen de muestra
Constatar los datos del paciente y rotular los tubos
Preguntar al paciente si hizo el ayuno conveniente, si está anti coagulado, etc. Esta
charla con el paciente por un lado contribuye a que el mismo se relaje y por el otro
obtener datos importantes como por ej. si es diabético, etc.
Informar al paciente que se le va a hacer
Posicionar al paciente apropiadamente
Pedirle al paciente que cierre el puño
Seleccionar la vena adecuada. Se prefiere la cubital media o la cefálica. Si un brazo tiene
una vía endovenosa se debe sacar del otro.
Curso: Asistente de Laboratorio y Análisis Clínicos Página 2
EDDIS EDUCATIVA
Limpiar con etanol al 70%. Empezar en la zona de puntura y seguir con movimiento
circular. Dejar secar. No volver a tocar.
Fijar el torniquete, para provocar el aumento del calibre de las venas.
Fijar la vena con la otra mano.
Punzar. Penetrar en ángulo de 150° con el brazo, con el bisel de la aguja hacia arriba.
Punzar con suavidad, no enterrar la aguja. Tirar suavemente del émbolo para no
producir hemolisis.
Liberar el torniquete cuando la sangre comience a fluir y nunca sacar la aguja con el
torniquete puesto.
Permitir que el paciente se relaje
Colocar un algodón sobre la punción y que el paciente se mantenga apretado sin
flexionar el codo. Descartar la aguja en recipiente adecuado sin volver a enfundarla.
Existen descartadores especiales para no remover la aguja con la mano.
Colocar un apósito
Invertir para mezclar los tubos con anticoagulante sin agitar. Los tubos deben llenarse
sin la aguja puesta y suavemente para evitar la hemólisis.
Chequear que el paciente este bien
Llevar los tubos al laboratorio para su procesamiento.
Muestras biológicas
Las muestras biológicas contienen sustancias analizables y éstas están estrechamente
vinculadas al tipo de muestra obtenida y al tipo de estudio solicitado. A groso modo se pueden
dividir, según el tipo de estudio, en: - Sustancias analizables en estudios bioquímicos.
Sustancias analizables en estudios hematológicos.
Sustancias analizables en estudios inmunológicos.
Sustancias analizables en estudios microbiológicos.
Sustancias analizables en estudios genéticos.
Según su naturaleza, las sustancias pueden ser: inorgánicas, orgánicas, células y sus organelas.
Dentro de las sustancias orgánicas se van a analizar distintos hidratos de carbono, proteínas y
lípidos. Son, en resumen, numerosísimas las sustancias.
Curso: Asistente de Laboratorio y Análisis Clínicos Página 3
EDDIS EDUCATIVA
Normas generales para tratamiento de muestras biológicas
INTRODUCCIÓN
La calidad de los resultados de los análisis clínicos de muestras biológicas de pacientes en unidad
de cuidados intensivos pediátricos y neonatales comienza con la solicitud del facultativo y una
correcta obtención de la muestra. Igual de importante es su manipulación, conservación,
transporte y procesado. Una buena metodología de trabajo por parte del personal de
enfermería y el resto del equipo asegura la fiabilidad de los datos obtenidos reduciendo al
mínimo errores que conllevan el rechazo de las muestras, repetición de los análisis y un perjuicio
para el paciente disminuyendo la calidad del servicio, aumentando la exposición del profesional
y el gasto económico.
DEFINICIÓN
Una vez obtenida la muestra, normas para la correcta manipulación, conservación y transporte
para un correcto procesamiento en laboratorio.
OBJETIVO
Tratamiento adecuado de las muestras biológicas para obtener un resultado fiable y de calidad
de cara a la continuidad de los cuidados.
En la práctica clínica la sangre es la muestra biológica más solicitada para el análisis por la gran
cantidad de información que ofrece sobre la enfermedad. Se estudia de diversos métodos y
distintos objetivos.
PRUEBAS PARA ESTUDIO HEMATOLÓGICO Y BIOQUÍMICO
Las pruebas más frecuentes que se solicitan para el estudio hematológico son:
Hemograma o hematimetría: donde se van a cuantificar los diferentes grupos celulares de la
sangre (hematíes, leucocitos y plaquetas) otros parámetros relacionados con su cantidad, forma
y contenido (hemoglobina, hematocrito, volumen corpuscular medio)
Estudio de Coagulación: que consta, además de otros parámetros, de tiempo de protrombina
(T.P.) que mide la integridad de la vía extrínseca del sistema de coagulación sanguínea y el
tiempo de tromboplastina activada (APTT) que mide la vía intrínseca.
Velocidad de sedimentación globular (VSG) de la 1ª y 2ª hora: Se mide para detectar procesos
inflamatorios o infecciosos.
El estudio bioquímico de la sangre determina como están las substancias concentradas en la
parte líquida de la sangre (suero)
Material
La sangre debe ser recolectada en tubos de vidrio o plástico, preferiblemente cristal siliconado
e irrompible, con sistema de vacío, estériles y herméticos.
En otro tipo de estudios se utilizan láminas portaobjetos de vidrio o plástico comercial
(extensiones para formula y recuento leucocitario, parásitos en sangre, biopsia de la medula
ósea, observación microscópica de células)
Es importante conocer si el tubo debe llevar anticoagulante y seleccionar el apropiado para el
estudio que se quiere realizar.
Los más utilizados son:
EDTA (ETILENDIAMINO TETRACETATO) Anticoagulante líquido utilizado principalmente
en el estudio de recuento de células.
Curso: Asistente de Laboratorio y Análisis Clínicos Página 4
EDDIS EDUCATIVA
CITRATO DE SODIO Anticoagulante líquido, generalmente se utiliza en estudios de
coagulación.
HEPARINA Su presentación puede incluir concentraciones de sodio y litio. Normalmente
la heparina con litio es utilizada para estudios bioquímicos y la sódica en recuento
celular.
OXALATO Anticoagulante en polvo utilizado sobre todo en determinación de
alcoholemia, estudios del metabolismo de la glucosa.
Existen códigos de colores estandarizados para las diferentes presentaciones comerciales de los
tubos.
TAPÓN ROJO CAPACIDAD 9 cc Tubo seco sin anticoagulante, se obtiene suero tras
retracción del coágulo. Se utiliza para pruebas cruzadas en banco de sangre.
TAPÓN ROJO, MARRÓN, AMARILLO, CAPACIDAD 3,5 cc, 5 cc.
TAPÓN AMARILLO MICROMETODO CAPACACIDAD 500 microlambdas.
Tubo con gelosa, se centrifuga y se separa el suero de las células. Se utiliza para análisis
bioquímico de la sangre.
TAPÓN VIOLETA: CAPACIDAD 2 cc, 2,5 cc, 3cc. TAPÓN VIOLETA MICROMÉTODO
CAPACIDAD 250, 500 microlambdas.
Con anticoagulante EDTA. Se utiliza para hemograma.
TAPÓN VERDE O BLANCO
Capacidad hasta 4 cc con anticoagulante heparina sódica. Se utiliza para cariotipo.
TAPÓN NEGRO Capacidad 1 +/- 0,2 ml con anticoagulante citrato, tubo de dos
elementos utilizado para VSG.
No confundir con el modelo de tapón negro para pruebas de alcoholemia, capacidad 4 ml y con
anticoagulante oxalato potásico y fluoruro sódico.
TAPÓN AZUL
Capacidad 1.8 cc, 2.5 cc, 4 cc con anticoagulante citrato de sodio 3.8% se utiliza para
estudio de coagulación.
Normas de recepción y rechazo de muestras
La muestra debe ir debidamente identificada con una etiqueta o escrita a mano y acompañada
de una petición escrita por el médico. Se rechaza si carece de identificación o esta es errónea,
también si no es remitida o llega sin volante al laboratorio.
El tubo debe estar íntegro, sin fracturas o grietas, sin defectos, con vacío, dentro del periodo
que indica la fecha de caducidad, con la cantidad adecuada de aditivo o anticoagulante.
El tubo debe ser el indicado para el tipo de análisis con el aditivo o anticoagulante adecuado.
Por ejemplo un hemograma no se puede solicitar en un tubo con gelosa, no tiene
anticoagulante.
Volumen adecuado de sangre en el tubo. El volumen total extraído debe ser suficiente para
realizar el análisis en su totalidad. Para determinar un mayor número de parámetros
bioquímicos se requiere más cantidad de sangre. En extracciones pediátricas se utilizan micro
tubos y los analizadores permiten realizar múltiples determinaciones con volúmenes pequeños
de sangre. La muestra insuficiente debe ser rechazada, pero también si se introduce más
cantidad de la adecuada, como ocurre en los tubos de estudio de coagulación o hemograma si
no se respeta la proporción sangre – anticoagulante.
Curso: Asistente de Laboratorio y Análisis Clínicos Página 5
EDDIS EDUCATIVA
La sangre debe mezclarse inmediatamente con el anticoagulante una vez que ha entrado en el
tubo. Invertir suavemente varias veces o colocarlo en rotores para obtener muestras
homogéneas, nunca agitar enérgicamente.
Cumplir las condiciones de preparación del paciente ya que la ingesta de alimentos altera
numerosos parámetros como la concentración de glucosa, colesterol o ácido úrico. Hay estudios
que requieren guardar ayuno. En el caso de los niños el tiempo de ayuno se relaciona con el
peso y la talla y no debe prolongarse demasiado. A veces la muestra de ser obtenida en un
intervalo de tiempo preciso debido a que el paciente toma alguna medicación que altera el
análisis o hay alguna variación biológica que queremos evitar.
Evitar la contaminación de las muestras.
Las muestras contaminadas están hemodiluidas o presentan substancias que pueden alterar los
valores del análisis.
Esto puede ocurrir en diversas situaciones:
Pacientes sometidos a procedimientos terapéuticos o diagnósticos antes de realizar la
extracción. P. Ej. Contrastes, quimioterapia, isótopos radiactivos.
Pacientes portadores de catéteres periféricos y que reciben una solución IV y en los que se ha
realizado una extracción en el mismo brazo por encima del catéter sin interrumpir la
administración y sin esperar al menos dos minutos. O cuando se extrae del mismo catéter sin
desechar sangre suficiente para lavar la vía. También ocurre con las vías centrales y en
reservorios heparinizados. Por ello los estudios de coagulación no deben extraerse del catéter,
porque incluso cantidades mínimas de heparina pueden alterar resultados. Lo ideal es que se
extraigan individualmente mejor que como una parte de la extracción para varias muestras.
En general y sobre todo con las muestras obtenidas por punción capilar tener en cuenta si se
ha utilizado povidona yodada, porque si la sangre está contaminada pueden encontrarse niveles
falsos elevados de potasio, fósforo y ácido úrico.
Transporte adecuado de la muestra.
El tiempo excesivo o la temperatura inadecuada de la muestra hacen que se deteriore y sea
rechazada o aporte datos erróneos.
Hay determinaciones que han de enviarse de forma inmediata para su análisis o conservación
en el laboratorio hasta que este se realice, por ejemplo el amonio o las catecolaminas.
Otras necesitan refrigerarse inmediatamente después de la extracción, por ejemplo la gastrina
o actividad de renina.
A veces es necesaria la congelación de la muestra como en la determinación de ACTH (hormona
adenocorticotropa).
Hay análisis como los de las crioglobulinas o el de ácido láctico donde la muestra necesita una
temperatura de 37º y un transporte rápido al laboratorio.
Con la correcta conservación y rápido transporte de la muestra se evita formación de amoniaco,
glicólisis, degradación de las proteínas, alteración de las substancias por la luz y otros procesos
que alteran los resultados.
Hay otros factores relacionados con el rechazo de la muestra que aun siendo evitables dependen
más de la técnica del profesional y de la propia muestra que de los protocolos.
Muestra hemolizada.
La hemólisis es la ruptura de los hematíes que libera hemoglobina y otras substancias en el
plasma y este adquiere un color entre rosa y rojo. Esto afecta a varias determinaciones por el
aumento en el suero de la sustancia a medir por ejemplo sodio o potasio o también por
interferencia óptica o química durante la fase analítica.
Curso: Asistente de Laboratorio y Análisis Clínicos Página 6
EDDIS EDUCATIVA
Hay varias causas:
Relacionadas con la extracción sanguínea:
Aguja demasiado fina, hay que elegir calibre 22G,20G.
Se aspira demasiado fuerte durante la extracción. Desplazar el embolo suavemente.
Se fuerza el paso de la sangre al tubo a través de la aguja. Es mejor quitar el tapón y
dejar resbalar la sangre por las paredes del tubo.
Evitar venas muy pinchadas para no extraer sangre de un hematoma.
Relacionadas con la manipulación en el laboratorio.
La muestra debe centrifugarse antes de que esté completamente coagulada si el tubo
no contiene anticoagulante, como el tubo con gelosa. Hay que centrifugar las muestras
a las revoluciones adecuadas y en aparatos bien calibrados.
Relacionados con el paciente:
Reacción antígeno anticuerpo, reacción postransfusional, anemia hemolítica,
enfermedades hepáticas. Muestra coagulada.
Debido a una extracción difícil de larga duración, por no mezclar la sangre en los tubos
adecuadamente o por las características del paciente.
Muestra con ictericia.
La presencia de bilirrubina en la sangre puede alterar algunas determinaciones pero no
se considera error dado que no está relacionado con la extracción o el tratamiento de
la muestra.
Muestra lipémica .
Son las que tienen alto contenido en grasa y aspecto lechoso y se pueden presentar en
pacientes que no han guardado el ayuno recomendado y con una ingesta copiosa de
alimentos. También en muestras contaminadas de pacientes sometidos a nutrición
parenteral.
Hematopoyesis
Lugares del cuerpo en donde se producen eritrocitos. En las primeras semanas de la vida
embrionaria, los eritrocitos nucleados se producen en el saco vitelino. Durante el segundo
trimestre de gestación, el hígado es el principal órgano productor de eritrocitos, pero también
se produce un número razonable en el bazo y en los ganglios linfáticos. Después, durante el
último mes de gestación y tras el nacimiento, los eritrocitos se producen exclusivamente en la
médula ósea. Como se muestra en la figura 32-1, la médula ósea de casi todos los huesos
produce eritrocitos hasta que una persona tiene 5 años de edad. Las médulas de los huesos
largos, excepto las porciones proximales de los húmeros Edad (años). Intensidades relativas de
producción de eritrocitos en la médula ósea de diferentes huesos en diferentes edades. y las
tibias, se hacen muy grasas y no producen más eritrocitos después de los 20 años. Más allá de
esta edad, la mayoría de los eritrocitos continúa produciéndose en la médula de los huesos
membranosos, como las vértebras, el esternón, las costillas y los ilíacos. Incluso en estos huesos,
la médula ósea es menos productiva a medida que aumenta la edad.
Curso: Asistente de Laboratorio y Análisis Clínicos Página 7
EDDIS EDUCATIVA
Génesis de los eritrocitos
Células precursoras hematopoyéticas pluripotenciales, inductores del crecimiento e inductores
de la diferenciación.
Las células sanguíneas comienzan sus vidas en la médula ósea a partir de un solo tipo de célula
llamado célula precursora hematopoyética pluripotencial, de la cual derivan todas las células de
la sangre.
A medida que se reproducen estas células, una pequeña parte de ellas permanece exactamente
igual que las células pluripotenciales originales y se queda en la médula ósea para mantener el
aporte, aunque su número disminuye con la edad. Pero la mayoría de las células reproducidas
se diferencia hasta formar los otros tipos celulares. Las células en un estadio intermedio son
muy parecidas a las células precursoras pluripotenciales, aunque ya estén comprometidas en
una línea celular en particular y reciben el nombre de células precursoras comprometidas.
Regulación de la producción de eritrocitos:
Función de la eritropoyetina. La masa total de eritrocitos en el sistema circulatorio está regulada
dentro de límites estrechos, de manera que: 1) siempre se dispone de un número adecuado de
eritrocitos que transporten suficiente oxígeno desde los pulmones hasta los tejidos, aunque 2)
las células no se hacen tan numerosas como para impedir el flujo sanguíneo.
La eritropoyetina estimula la producción de eritrocitos y su formación aumenta en respuesta a
la hipoxia. El principal estímulo para la producción de eritrocitos en los estados de escasez de
oxígeno es una hormona circulante llamada eritropoyetina, una glucoproteína. Si no hay
eritropoyetina, la hipoxia tiene poco o ningún efecto estimulador sobre la producción de
eritrocitos. Pero cuando el sistema de la eritropoyetina es funcional, la hipoxia aumenta mucho
la producción de eritropoyetina, y esta potencia a su vez la formación de eritrocitos hasta que
se alivie la hipoxia.
Participación de los riñones en la formación de eritropoyetina.
Normalmente, alrededor del 90% de toda la eritropoyetina se forma en los riñones; el resto se
forma sobre todo en el hígado. Algunos estudios sugieren que la eritropoyetina es secretada
principalmente por células intersticiales de tipo fibroblasto que rodean a los túbulos en la
corteza y la médula exterior, donde tiene lugar buena parte del consumo de oxígeno en los
riñones. Es probable que otras células, entre ellas las células epiteliales renales en sí, secreten
también la eritropoyetina como respuesta a hipoxia.
SANGRE.
La sangre es un tejido líquido, compuesto por agua y sustancias orgánicas e inorgánicas (sales
minerales) disueltas, que forman el plasma sanguíneo y tres tipos de elementos formes o células
sanguíneas: glóbulos rojos, glóbulos blancos y plaquetas.
Plasma sanguíneo: es líquido y está formado en un 90 por ciento de agua y en un 10 por
ciento de otras sustancias como azúcares, proteínas, grasas y sales minerales. Es salado,
de color amarillento y en él flotan los demás componentes de la sangre, también lleva
los alimentos y las sustancias de desecho recogidas de las células. El plasma cuando se
coagula la sangre, origina el suero sanguíneo.
Glóbulos rojos: conocidos también como eritrocitos o hematíes. Son el componente
más abundante de la sangre, y actúan transportando el oxígeno molecular (O2). Tienen
forma de disco bicóncavo y son tan pequeños que en cada milímetro cúbico hay cuatro
a cinco millones, midiendo unas siete micras de diámetro. No tienen núcleo, por lo que
se consideran células muertas. Como su nombre lo indica, son células de color rojo por
Curso: Asistente de Laboratorio y Análisis Clínicos Página 8
EDDIS EDUCATIVA
su contenido de hemoglobina (pigmento rojo encargado del transporte de oxígeno
desde los pulmones a las células). Se fabrican en la médula roja de algunos huesos largos
y una insuficiente fabricación de hemoglobina o de glóbulos rojos por parte del
organismo, da lugar a una anemia, de etiología variable, pues puede deberse a un déficit
nutricional, a un defecto genético o a diversas causas más.
Glóbulos blancos: también se les denomina leucocitos, y tienen un tamaño mayor que
los glóbulos rojos. Cumplen la función de defender al cuerpo de los microorganismos
infecciosos mediante mecanismos de limpieza (Fagocitos) y de defensa (linfocitos). Son
mayores en tamaño que los glóbulos rojos, pero menos numerosos (unos siete mil por
milímetro cúbico). Son células vivas que se trasladan, se salen de los capilares y se
dedican a destruir los microbios y las células muertas que encuentran por el organismo.
También producen anticuerpos que neutralizan los microbios que producen las
enfermedades infecciosas y se fabrican en la médula ósea.
Plaquetas: También llamadas trombocitos, son los corpúsculos más pequeños de los
componentes de la sangre), son fragmentos de células y su función es permitir la
coagulación. Porque sirven para taponar las heridas y evitar, así, las hemorragias.
Formación de la sangre Los glóbulos rojos, los glóbulos blancos y las plaquetas que
conforman la sangre se producen en la parte esponjosa (médula) de algunos huesos del
esqueleto (esos son: el esternón, los huesos del cráneo, las costillas, el hueso ilíaco y las
terminaciones de los huesos de los miembros superiores e inferiores. En la médula ósea
roja de los huesos se encuentran las células hematopoyéticas pluripotenciales de las que
derivan todas las células de la sangre. Hasta los 5 años de edad estas células dan origen
a los compuestos de la sangre en, prácticamente, todos los huesos del cuerpo. Después
de los 20 años, los glóbulos rojos, blancos y plaquetas son producidos principalmente
por la médula de los huesos planos, como las vértebras, el esternón y las costillas.
Elementos figurados de la sangre: glóbulos blancos GB (leucocitos), plaquetas (trombocitos) y
glóbulos rojos GR (hematíes o eritrocitos).
Todos se forman en la médula ósea a partir de una célula única llamada STEM CELL pluripotente,
que es aquella que da lugar a numerosas células hijas con diferentes funciones. Todas estas
células provenientes de la división de la Stem cell (o célula madre) se denominan BLASTOS
INMADUROS que van a ir madurando y diferenciándose morfológicamente hasta que pasan a
circulación los elementos maduros que se observan en sangre periférica. Por lo tanto la
secuencia que se sigue es la siguiente: CELULAS MADRES NO DIFERENCIADAS → TEJIDOS
HEMATOPOYETICOS: Maduración de Blastos Inmaduros (adoptan diferentes nombres a medida
que van madurando y según la serie de que se trate; BLANCA, ROJA O PLAQUETAS) → SANGRE
PERIFERICA: Glóbulos rojos, plaquetas y glóbulos blancos.
SERIE BLANCA: 1) CLASIFICACION Granulocitos o PMN (polimorfonucleares): Neutrófilos,
eosinófilos y basófilos Monomorfonucleares: linfocitos y monocitos C/u tiene una función
específica pero básicamente la serie blanca participa del sistema inmunitario (defensa del
organismo); los eosinófilos intervienen además en las reacciones alérgicas y se encuentran
también aumentados en infecciones parasitarias. Los neutrófilos actúan principalmente en las
infecciones agudas y los monocitos en infecciones crónicas. Los linfocitos pueden a su vez
clasificarse en Linfocitos T y Linfocitos B; los primeros participan de la inmunidad celular
destruyendo células extrañas como las cancerosas y ciertas bacterias y virus y los segundos
pueden transformarse en las llamadas células plasmáticas productoras de anticuerpos que son
proteínas que reaccionan contra los agentes extraños, fundamentalmente bacterias, que
ingresan en el organismo (inmunidad humoral).
Curso: Asistente de Laboratorio y Análisis Clínicos Página 9
EDDIS EDUCATIVA
HEMATOLOGÍA CLÍNICA
Hoy en día la inmensa mayoría de los laboratorios dispone de autoanalizadores que permiten la
determinación de los principales parámetros hematológicos de la sangre. No obstante, el
médico es insustituible para una adecuada interpretación de los resultados obtenidos. Además,
el ojo humano sigue siendo imprescindible a la hora de la detección de Numerosas alteraciones
morfológicas que se pueden observar en una extensión de sangre periférica o en un
medulograma.
SERIE ROJA
Hemograma
Un hemograma completo comprende las siguientes determinaciones:
Recuento de glóbulos rojos
Recuento de glóbulos blancos
Concentración de Hemoglobina Hb
Hematocrito HTO
Fórmula leucocitaria
Índices hematimétricos
El recuento de plaquetas
Curso: Asistente de Laboratorio y Análisis Clínicos Página
10
EDDIS EDUCATIVA
Hematíes,eritrocitos, glóbulos rojos.
Los valores normales de hematíes circulantes son de alrededor de 4,5 a 5 millones/mm . Sin
embargo, para una adecuada valoración de la existencia de una anemia o una poliglobulia es
necesario determinar la concentración de hemoglobina y el hematocrito.
Hemoglobina
La concentración normal de hemoglobina en sangre en los adultos es 12 a 16 g/dl en la mujer y
16 a 18 g/dl en el varón. El aumento de la concentración de hemoglobina, junto con un aumento
del número de hematíes circulantes, determina la existencia de una poliglobulia, mientras que
se entiende por anemia la disminución de la concentración de hemoglobina,
independientemente de la cifra de eritrocitos.
Hematocrito
Representa la proporción de glóbulos rojos frente a la fracción plasmática en la sangre. El valor
normal en un varón adulto es del 47% y de 36 % en la mujer. El valor del hematocrito depende
no sólo del número de glóbulos rojos circulantes, sino también de su forma y tamaño, lo que
disminuye en cierta medida su utilidad clínica, que reside principalmente en la valoración de las
variaciones en un mismo paciente. El hematocrito aumenta en cuadros de poliglobulia
verdadera o secundaria a hemoconcentración (por disminución del volumen plasmático en
situaciones de deshidratación). Por el contrario, el hematocrito desciende en las anemias y en
los estados de hemodilución.
Volumen corpuscular medio
El volumen corpuscular medio (VCM) es un índice del volumen eritrocitario que se calcula:
VCM = Valor del hematocrito x 10/Número de hematíes.
Se considera normal un VCM entre 83 y 97 fentolitros (fl). Este índice resulta de utilidad a la
hora de clasificar las anemias. Cuando el VCM es menor de 83 fl se habla de anemia microcítica
(típica de la ferropenia y de las talasemias); cuando el VCM es normal se denomina anemia
normocítica; si el VCM es superior a 97 fl se trata de una anemia macrocítica (p. ej., en las
deficiencias de vitamina B 1 2 o ácido fólico, hipotiroidismo, hepatopatías -sobre todo la
alcohólica-, síndromes mielodisplásicos).
Sin embargo, no hay que olvidar que en ocasiones el valor del VCM que ofrece el autoanalizador
puede estar artefactado por diferentes situaciones (aumento de hematíes jóvenes
[reticulocitos], presencia de hematíes aglutinados, etc.), por lo que la realización de una
morfología de sangre periférica tiene un importante valor.
Hemoglobina corpuscular media y concentración
Corpuscular media de hemoglobina La hemoglobina corpuscular media (HCM) expresa el
contenido de hemoglobina promedio de cada hematíe. El valor normal oscila entre 28 a 32 pg.
Los hematíes con una HCM disminuida se denominan hipocrómicos (típicos de la ferropenia).
Otra forma de determinar la concentración de hemoglobina por eritrocito es la concentración
corpuscular media de hemoglobina (CCMH) que se calcula de la siguiente manera:
CCMH = Hemoglobina (g/dl) x 100/Hematocrito (%) El valor normal de la CCMH es 33 y 37 g/dl.
Se consideran hipocrómicas las anemias con una CCMH inferior a 32 g/dl. Casi siempre que
aumenta el contenido hemoglobínico del hematíe (HCM) se debe a la existencia de un aumento
del VCM, por lo que la CCMH suele permanecer normal. No obstante, la CCMH puede aumentar
Curso: Asistente de Laboratorio y Análisis Clínicos Página
11
EDDIS EDUCATIVA
en la esferocitosis hereditaria (por un menor volumen de los eritrocitos) y en algunas
hemoglobinopatías.
MORFOLOGÍA DE LOS ERITROCITOS
ALTERACIONES DEL TAMAÑO
• Microcitosis: predominio de hematíes de menor tamaño de lo normal (< 80 fl). Muy
frecuente en las anemias ferropénicas, talasemias, anemia de enfermedades crónicas.
• Macrocitosis: predominio de hematíes de mayor tamaño de lo normal (> 100 fl). Frecuente
en las deficiencias de folatos o vitamina B 1 2 (anemia megaloblástica), mielodisplasia,
hepatopatías crónicas.
• Anisocitosis: desigualdad en el tamaño de los hematíes. De carácter inespecífico.
ALTERACIONES DE LA FORMA
• Poiquilocitosis: desigualdad de la forma de los hematíes. También de carácter inespecífico.
• Esferocitos: hematíes de morfología esférica, generalmente de menor tamaño, sin
aclaramiento central. Típicos de la esferocitosis hereditaria (por defecto en la membrana del
eritrocito), o anemias hemolíticas autoinmunes.
• Eliptocitos: hematíes de forma elíptica. Hallazgo inespecífico aunque típico en la eliptocitosis
hereditaria.
• Estomatocitos: hematíes con una depresión central en forma de boca. Alteración presente en
la estomatocitosis hereditaria, hepatopatías, alcoholismo, algunas anemias hemolíticas
autoinmunes.
• Dacriocitos: hematíes con forma de lágrima. Frecuentes en cuadros de mielofibrosis, o
mieloptisis de otras etiologías (ocupación tumoral de la médula ósea). También en otras anemias
graves.
• Esquistocitos: presencia de hematíes fragmentados. Típicos de las hemolisis intravasculares
(hemolisis mecánica por CID, hemangiomas, anemia de la marcha, anemias microangiopáticas).
• Dianocitos: hematíes con un aumento del área clara central, que corresponde a hemoglobina.
Aparecen en hemoglobinopatías (talasemias, hemoglobinopatía C), hepatopatías, o anemia
ferropénica severa(dianas microcíticas).
• Drepanocitos (células falciformes): característicos de las hemoglobinopatías, especialmente
la anemia falciforme por presencia de hemoglobina S.
• Acantocitos: hematíes con morfología espiculada. Se observan en hepatopatías,a-(3-
lipoproteinemia congenita. También en anemias hemolíticas microangiopáticas, déficit de
pimvatocinasa, carcinomas y uremia.
Alteraciones de la coloración (cromemia)
• Hipocromía: hematíes pálidos, que se tifien débilmente. Se asocia con la anemia ferropénica.
• Policromatofilia: presencia de hematíes basófilos por persistencia del sistema reticular
(hematíes jóvenes). Propios de las anemias regenerativas.
Anemia
Se entiende por anemia la disminución de la concentración sanguínea de hemoglobina. Los
valores de hemoglobina varían con la edad, si bien se considera anemia cuando la concentración
de hemoglobina es inferior a 13 g/dl en el caso de varones adultos, e inferior a 12 g/dl en mujeres
adultas.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
12
EDDIS EDUCATIVA
No es el objeto de este texto la relación minuciosa de los distintos tipos y causas de anemia,
pero sí recordar que el conocimiento de algunos datos analíticos complementarios puede
ayudar en la identificación de su etiología.
Por un lado se pueden distinguir distintos tipos de anemias en función del tamaño de los
hematíes y de la cromemia:
1. Anemias microcíticas e hipocromas (VCM < 83 fl, HCM < 27 pg, CCMH < 3 2 % ) : La causa más
frecuente de una anemia microcítica e hipocroma es la anemia ferropénica. Esta ferropenia
puede deberse a pérdidas hemorrágicas (comúnmente de origen ginecológico en la mujer en
edad fértil, y en el aparato gastrointestinal en el varón y mujeres de edad más avanzada),
aporte dietético insuficiente, malabsorción intestinal del hierro (aclorhidria, pacientes
gastrectomizados, enfermedad celíaca, etc.), aumento de los requerimientos o consumo
exagerado (embarazo, infecciones, neoplasias, etc.) o más infrecuentemente por alteración
en el transporte del hierro (atransferrinemias congénitas o adquiridas).
También se observa una anemia microcítica e hipocroma en las anemias sideroblásticas, en
las que existe una alteración en la utilización del hierro, aumentando los depósitos del hierro
así como el hierro circulante.
Otra causa de anemia microcítica e hipocroma son los síndromes talasémicos, y en ocasiones
también se observa microcitosis en la anemiaasociada a enfermedad inflamatoria crónica y
en la intoxicación por plomo.
2. Anemias macróticas (VCM > 97 fl): El ejemplo típico de anemia macrocítica es la anemia
megaloblástica (presencia de precursores de tamaño muy superior al normal en médula
ósea).
La anemia megaloblástica se produce por una deficiencia de vitamina B a 2 o de ácido fólico.
a) Deficiencia de vitamina B a 2
- De origen nutricional, en vegetarianos estrictos.
- Por malabsorción. De origen gástrico (anemia perniciosa, pacientes gastrectomizados,
deficiencia congénita de factor intrínseco) o intestinal (síndrome de asa ciega,
contaminación bacteriana, enfermedad inflamatoria intestinal, esprue, síndromes
linfoproliferativos intestinales, síndrome de Zollinger-Ellison, pancreatitis crónica,
radiación intestinal, enfermedad de Immerslund, infestación por Diphyllobothríum
latum, etc.).
- También puede deberse a determinados fármacos (colchicina, neomicina), tabaquismo
o a la deficiencia congénita de transcobalamina
II.
b) Deficiencia de ácido fólico.
- De origen nutricional.
- Por malabsorción intestinal (esprue, enfermedad inflamatoria intestinal, linfomas
intestinales, resecciones, etc.).
- Por aumento de las necesidades (embarazo y lactancia, hemolisis crónicas, neoplasias,
hipertiroidismo, enfermedades inflamatorias crónicas, etc.).
- También asociada a determinados fármacos (anticonvulsionantes, metotrexato,
pirimetadina, trimetoprima, pentamidina).
Otras causas de anemias macrocíticas sin megaloblastos son el hipotiroidismo,
síndromes mielodisplásicos, la existencia de reticulocitosis (anemias regenerativas),
alcoholismo, y en ocasiones la anemia aplásica.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
13
EDDIS EDUCATIVA
3. Anemias normocíticas, normocrómicas (VCM = 8 3 - 9 7 fl, HCM 28-32 pg): La mayoría
de las anemias asociadas a enfermedades crónicas (como artritis reumatoide), anemias
aplásicas, invasión de la médula ósea (mieloptisis), hemorragia aguda reciente, anemias
hemolíticas (salvo importante reticulocitosis).
Otra forma de clasificar las anemias es en función de si se conserva o no la capacidad de
producción medular:
1. Anemias regenerativas (periféricas): con aumento del número de reticulocitos.
2. Principalmente las anemias hemolíticas y la anemia posthemorrágica aguda.
Anemias arregenerativas (centrales): con descenso de los reticulocitos.
Por alteraciones de la médula ósea: aplasias, síndromes mielodisplásicos, invasión
medular.
SERIE BLANCA
En el hemograma se refleja, además de la cifra total de leucocitos (normalmente entre 6.000 y
10.000/ixl), el porcentaje de cada tipo celular, la denominada fórmula leucocitaria. Los valores
normales de los distintos tipos leucocitos en términos absolutos y relativos son los siguientes:
Neutrófilos 55-65% infecciones agudas.
Linfocitos 25-35% inmunidad humoral lin B producen antg. Lin T inmunidad celular destruyen
células extrañas, bacterias, virus.
Monocitos 4-8% infecciones crónicas.
Eosinófilos 0,5-4%infecciones parasitarias.
Basófilos 0,5-1%reacciones alérgicas.
Existen dos tipos de fórmulas:
Absoluta: expresa la cantidad de cada tipo de leucocito /mm3 sangre y para su cálculo es
indispensable conocer el recuento de glóbulos blancos totales.
Porcentual o relativa: se expresa la cantidad de cada tipo de glóbulo blanco por ciento de
leucocitos. Esta fórmula es el paso indispensable para el cálculo de la fórmula absoluta que es la
que tiene el valor clínico real.
Leucocitosis
Es el aumento de la cifra total de leucocitos por encima de 10.000/pl. En la mayoría de los casos,
se debe a un aumento de los neutrófilos, y la causa más frecuente de la misma son las
infecciones de cualquier origen (bacterianas, virales, fúngicas o parasitarias).
Existe también una leucocitosis «fisiológica» en el recién nacido (generalmente con linfocitosis),
a final del embarazo, o tras esfuerzos intensos.
Causas no infecciosas de leucocitosis incluyen el dolor agudo, procesos inflamatorios,
colagenosis, situaciones posthemorrágicas, hipertermia no infecciosa, quemaduras extensas, la
gota, feocromocitoma y otras neoplasias sólidas y hematológicas (leucemias y síndromes
linfoproliferativos con expresión periférica), coma diabético, intoxicaciones por metales pesados
o monóxido de carbono, sin olvidarnos de determinados fármacos (principalmente los
corticoides y factores de crecimiento como el G-CSF o el GM-CSF).
Curso: Asistente de Laboratorio y Análisis Clínicos Página
14
EDDIS EDUCATIVA
PLAQUETAS
El hemograma nos aporta información acerca del recuento plaquetario. Los valores normales
oscilan entre 150.000 y 350.000/pl . Cuando la cifra de plaquetas se encuentra por encima de la
normalidad se trata de una trombocitosis, mientras que se entiende por trombocitopenia la
presencia de una cifra de plaquetas por debajo de la normalidad.
Trombocitosis
Se puede distinguir entre trombocitosis reactivas (secundarias) o primarias. Entre las posibles
causas de una trombocitosis secundaria seincluyen la hemorragia reciente, anemia ferropénica,
infecciones agudas, el postoperatorio de cirugías mayores, tras una esplenectomía, tumores
(especialmente en la enfermedad de Hodgkin), enfermedades autoinmunes (enfermedad
inflamatoria intestinal, artritis reumatoide, espondilit
is anquilopoyética, etc.), síndrome de Cushing, así como durante larecuperación tras
tratamientos con radioterapia o quimioterapia. La trombocitosis primaria constituye un tipo de
síndrome mieloproliferativo crónico conocido como trombocitemia esencial hemorrágica, que
se caracteriza por la existencia de una cifra de plaquetas superior a 600.000/pl.
Este trastorno cursa de forma característica tanto con episodios trombóticos(por la
trombocitosis) como hemorrágicos de repetición, ya que las plaquetas suelen ser
disfuncionantes. También puede existir cierta trombocitosis acompañante en otros síndromes
mieloproliferativos crónicos, como la leucemia mieloide crónica, policitemia vera o mielofibrosis
primaria.
Reticulocitos
Los reticulocitos son hematíes inmaduros, anucleados, pero en los que persisten algunas
organelas citoplasmáticas como mitocondrias, ribosomas y sistema reticuloendoplásmico. El
tamaño es superior al de un hematíe adulto y conserva cierta basofilia-policromatofilia (tinción
vital). Los reticulocitos abandonan la médula ósea y su maduración finalizaen la sangre
periférica, donde persisten unas 24 horas. El número de reticulocitos en sangre periférica es un
dato útil para diferenciar en el estudio de la anemia el carácter regenerativo (Aumento del
número de reticulocitos, como ocurre en las anemias hemolíticas) o arregenerativo disminución
de los reticulocitos, como p. ej., en las anemias carenciales, síndromes mielodisplásicos) de la
misma.
Presentan en su interior ARN que precipita con colorantes como azul brillante de cresilo y/o azul
de metileno y permite así diferenciarlos. Además de estas coloraciones, existe otra forma de
teñirlos y poder así efectuar su recuento.
El recuento se hace en sangre con EDTA y se puede efectuar hasta 24 hs si la muestra se conservó
refrigerada 4°C; a temperatura ambiente su valor decae a las 6 hs, por lo que su conteo debe
efectuarse lo antes posible.
V.N. en sangre: 0,5 – 1 % y en el recién nacido 2- 6 %.
En condiciones normales permanecen 2-3 días en la médula y terminan su maduración en sangre
en 24 hs, convirtiéndose en GR maduro y es por esta razón que el extendido y coloración debe
efectuarse dentro de las 2 hs de la extracción para evitar un recuento erróneo por su progresiva
maduración.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
15
EDDIS EDUCATIVA
INMUNOLOGÍA.
Introducción:
Los animales de diferente complejidad presentan una diversidad de respuestas que excluyen o
destruyen a los microorganismos, a otros invasores extraños y a células que no son típicamente
propias. Estas respuestas dependen de una variedad de tipos de leucocitos, todos los cuales son
la progenie de las células madre que se autogeneran en la médula ósea. La llamada respuesta
inflamatoria no específica implica la liberación de histaminas y otras sustancias químicas que
provocan distensión de los capilares sanguíneos, un incremento local de la temperatura y la
movilización de granolucitos fagocíticos y de macrófagos al sitio de la infección. Los interferones
proveen otro tipo muy diferente de defensa no específica, dirigida contra los virus. Son proteínas
de bajo peso molecular producidas por células infectadas por virus que estimulan a las células
vecinas a defenderse contra la infección viral; también estimulan a las células que intervienen
en la respuesta inmune.
La respuesta inmune es altamente específica e involucra dos tipos de células:
Los linfocitos B y los linfocitos T.
Cuando los responsables de la respuesta inmune son los linfocitos B se dice que la respuesta
inmune es humoral. Los linfocitos B son los protagonistas principales de la formación de
anticuerpos.
En cambio, si los linfocitos responsables de la respuesta efectora son los linfocitos T, la respuesta
inmune es celular.
La respuesta inmune específica o adaptativa
La respuesta inmune específica o adaptativa difiere de los otros mecanismos de defensa del
cuerpo en que identifica específicamente al invasor a través de estructuras de la superficie de
un tipo particular de glóbulos blancos, los linfocitos.
El primer contacto del sistema inmune con un antígeno inicia la respuesta primaria la que lleva
a la eliminación del invasor y, simultáneamente, provoca la diferenciación de células que quedan
"pre adaptadas" a un nuevo contacto con el antígeno -las células de memoria. En posteriores
encuentros con el mismo antígeno, se produce una respuesta secundaria, más rápida y de mayor
magnitud.
Las respuestas de defensa desarrolladas por el propio individuo constituyen la inmunidad activa.
En ciertas condiciones fisiológicas (embarazos) o terapéuticas, se produce una transferencia de
los productos de la respuesta inmune, lo que constituye un proceso de inmunidad pasiva.
La especificidad de la respuesta inmune deriva de las acciones e interacciones de los linfocitos B
y los linfocitos T. Los sitios primarios de diferenciación y proliferación de estas células son la
médula ósea (para los B) y el timo (para los T), un órgano esponjoso y bilobulado que se
encuentra en la zona superior del tórax. El escenario en que operan estas células se conoce como
sistema inmune.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
16
EDDIS EDUCATIVA
Los principales integrantes del sistema inmune humano son la médula ósea y el timo, órganos
de diferenciación inicial de los linfocitos B y T, que son los ejecutores de la respuesta inmune.
Otros órganos importantes del sistema son los vasos linfáticos, los numerosos ganglios linfáticos,
el bazo y el sistema asociado a mucosas que incluye a las amígdalas, el apéndice, las placas de
Peyer, las adenoides y los acúmulos linfoides asociados a los bronquios.
Los linfocitos B y la formación de anticuerpos
Los linfocitos B son los protagonistas principales de la respuesta inmune humoral e intervienen
en la formación de anticuerpos, proteínas globulares complejas - conocidas también como
inmunoglobulinas - que presentan en su estructura combinaciones tridimensionales precisas
capaces de interactuar con moléculas que el cuerpo reconoce como extrañas o no propias.
Algunos linfocitos B "patrullan" el cuerpo humano; se aglomeran en los ganglios linfáticos, el
bazo y otros tejidos linfoides, donde están expuestos a la sangre y la linfa circulantes. Los
linfocitos B son células pequeñas, redondas, que no se dividen. Insertos en su membrana y,
sobresaliendo de su superficie, se encuentran los anticuerpos con especificidad para reconocer
a un determinado antígeno.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
17
EDDIS EDUCATIVA
Componentes solubles en la respuesta inmune.
• Inmunoglobulinas.
• Complemento.
• Citoquinas.
Las inmunoglobulinas son proteínas que pueden estar fijadas a las células, o pueden secretarse
en forma soluble como anticuerpos.
Hay dos tipos de IgG:
• Polimeros: IgM; IgA.
• Monomeros: IgG; IgE; IgD.
•
IgM: Primera clase de inmunoglobulina que aparece en el suero de los lactantes en desarrollo y
la primera detectable en las respuestas inmunes primarias. Constituye el 5 a 10 % de las Ig en el
suero normal. Son de gran tamaño poco transferibles al líquido instersticial.
IgG: entre el 75 Y 80 % distribuidas igual intravascular y extravascular. Atraviesa placenta.
IgA : entre el 10 y 15 %. La mayor parte son secreciones mucosas proteje el epitelio basal de la
invasión bacteriana y viral.
IgE: el valor absoluto es minimo. Es responsable de eventos de ipersencibilidad inmediata como
el asam, fiebre de heno y reacciones anafilácticas. (Alergias)
IgD: El suero contiene vestigios, su función es inespecífica.
GRUPOS SANGUÍNEOS SISTEMA ABO Y RH
El tipo de sangre que usted tenga depende de si hay o no ciertas proteínas, llamadas antígenos,
en sus glóbulos rojos. Los grupos sanguíneos son una forma de agrupar ciertas características
que posee la sangre, basándonos en los antígenos y anticuerpos que están presentes en los
eritrocitos y el plasma sanguíneo de cada individuo.
Los humanos pueden presentar cuatro grupos sanguíneos diferentes, según la presencia o
ausencia de antígenos en los eritrocitos, y de anticuerpos en el plasma sanguíneo.
Los antígenos son aglutinógenos que actúan como sustancias aglutinables de la sangre. Estos
aglutinógenos se encuentran en los eritrocitos o glóbulos rojos.
Las anticuerpos son aglutininas que actúan como sustancias aglutinantes de la sangre y se
encuentran en el plasma o suero sanguíneo. Este sistema separa los tipos de sangre en cuatro
tipos: (ABO)
Tipo A
Tipo B
Tipo AB
Tipo O
Su tipo de sangre (o grupo sanguíneo) depende de los tipos que haya heredado de sus padres.
GRUPO 0: el G.R. del grupo cero no tiene Ag en su superficie y en el plasma o suero
de estos individuos por lo tanto van a estar presentes los Ac o aglutininas Anti-A y Anti-B.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
18
EDDIS EDUCATIVA
GRUPO A: el G.R. tiene en su superficie el Ag A (por eso se denomina grupo A, lleva el nombre
del antígeno que el glóbulo rojo lleva en su superficie) y por lo tanto en el plasma se encuentran
aglutininas o Ac. Anti-B.
GRUPO B: el glóbulo rojo tiene en su superficie el Ag B y en el plasma o suero tendríamos los
Anti-A.
GRUPO AB: El G.R. tiene en su superficie los Ag A y B y por lo tanto en el plasma no existen Ac o
aglutininas.
REACCION ANTIGENO-ANTICUERPO
Aglutinación:
La aglutinación sanguínea se da cuando se mezclan aglutinógenos y aglutininas del mismo tipo,
y se debe a que las aglutininas tienen 2 sitios de unión (tipo IgG) o 10 sitios de unión (tipo IgM),
siendo así, una aglutinina puede unirse a dos o más eritrocitos juntándolos, y esto hace que los
glóbulos rojos se agrupen, lo que causa el "aglutinamiento" de los mismos.
Hemólisis:
Estas aglutinaciones taponan vasos sanguíneos pequeños por todo el sistema circulatorio del
cuerpo, tras unas horas, los leucocitos fagocíticos (Neutrófilos y Macrófagos) destruyen los
eritrocitos aglutinados, rompiendo su membrana y liberando la hemoglobina al plasma
sanguíneo
Existen dos tipos de antígenos (aglutinógenos) llamados A y B, y dos tipos de anticuerpos
(aglutininas) llamadas Anti-A y Anti-B (que actúan sobre el aglutinógeno correspondiente,
dentro del sistema ABO).
La sangre en cuyos eritrocitos exista el aglutinógeno A, obviamente no presentará aglutininas
Anti-A en su plasma, dado a que esto causaría el aglutinamiento de sus eritrocitos, esta sangre
pertenece al grupo "A". En el caso de los aglutinógenos B sucede lo mismo con su respectiva
aglutinina, perteneciendo entonces al grupo sanguíneo "B".
Hay casos en los que la sangre de un individuo puede presentar ambos aglutinógenos A y B en
sus eritrocitos, en ese caso, el plasma no presenta aglutininas de ningún tipo y pertenece al
grupo "AB". También se da el caso de que la sangre del individuo no presenta ningún
aglutinógeno en sus eritrocitos, pero sí ambas aglutininas Anti-A y Anti-B en el plasma
sanguíneo, es aquí donde nace el cuarto y último grupo, el grupo "O".
Curso: Asistente de Laboratorio y Análisis Clínicos Página
19
EDDIS EDUCATIVA
Al hacer transfusiones de sangre es indispensable tener en cuenta los grupos sanguíneos del
donante y del paciente, para evitar así que se junten aglutinógenos y aglutininas del mismo tipo,
esto se denomina incompatibilidad ABO. Al analizar los grupos sanguíneos, podemos notar que
hay dos casos especiales.
Los individuos pertenecientes al grupo sanguíneo AB, no poseen aglutininas en su plasma
sanguíneo, por lo que al transfundirle sangre, no aglutinarían los glóbulos rojos que posean
cualquiera de los aglutinógenos, y si los eritrocitos no poseen aglutinógeno alguno, mucho
menos, por eso se dice que el grupo sanguíneo AB es el "receptor universal".
Otro caso muy interesante es el de los individuos pertenecientes al grupo sanguíneo O, que
como ya vimos, no poseen aglutinógeno alguno en sus glóbulos rojos, lo que les da la capacidad
de donar sus eritrocitos a cualquier otro grupo sanguíneo. Ya que éstos, posean la aglutinina
que sea en su plasma, no tendrá aglutinógenos que aglutinar. Por esto se denomina al grupo O
como el "donante universal".
Herencia genética del grupo sanguíneo
Aplicando el cuadro genético de Mendel podemos determinar el grupo sanguíneo resultante de
la combinación de los grupos sanguíneos de los padres de un individuo.
Nota: la siguiente tabla se basa sólo en padres puros homocigotos, la combinación entre padres
heterocigotos puede dar un resultado distinto.
Entre los grupos sanguíneos, A y B son dominantes, mientras que O es recesivo, por lo que
padres con el grupo sanguíneo O sólo tendrán hijos con el mismo grupo sanguíneo. Y en hijos
con padre A y/o B y madre O el hijo será heterocigoto AO o BO siendo el grupo A o B el que
domine y se vea representado en el grupo del hijo.
FACTOR RH
Los términos Rh positivo y Rh negativo se refieren a la presencia o ausencia de los antígenos D
en los glóbulos rojos. Los antígenos D son rasgos genéticos que se transmiten en forma
autosómica dominante. El gen que codifica el sistema Rh se halla en el cromosoma 1.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
20
EDDIS EDUCATIVA
Significado clínico
En medicina transfusional el antígeno D es el más importante después del A y el B. la formación
de anti-D suele resultar de la exposición a glóbulos rojos con el antígeno D durante una
transfusión o gestación. Para evitarlo se estudian los antígenos D en receptores y donantes para
asegurar que los pacientes D negativos reciban sangre D negativa. Los anticuerpos anti-D no
son naturales como los del sistema AB0 sino que son adquiridos o sensibilizates, es decir que se
forman por sensibilización previa Ej: embarazos, transfusiones.
Estos anticuerpos anti-D además tienen la capacidad de atravesar la barrera placentaria y
producir la enfermedad hemolítica del recién nacido, que se da en embarazos de madres RH
negativas que gestan hijos RH positivos, caracterizada por anemia, ictericia (amarillos por
aumento de bilirrubina) y hepato y esplenomegalia (aumento del tamaño del hígado y bazo
respectivamente) por la excesiva destrucción de los glóbulos rojos.
Caso clínico: mamá RH negativa que gesta un primer hijo RH positivo; los G.R. RH + del bebé
ingresan al torrente sanguíneo materno durante el nacimiento provocando una respuesta
inmunitaria post nacimiento llamada inmunización materno-fetal. Al 1er hijo no le ocurrirá
nada, pero si a ésta mamá no se le da gamma globulina para neutralizar ésta inmunización, si
gesta un segundo hijo RH +, los Ac anti RH generados previamente, atravesarán la placenta y
destruirán los G.R. fetales. Por lo tanto cuando una mujer es RH negativa y su pareja es RH +, en
los embarazos se controlan en el laboratorio la presencia o no de Ac anti RH a través de una
determinación llamada PRUEBA DE COOMBS INDIRECTA.
Método de tipificación
Es un método para decirle cuál es el tipo específico de sangre que usted tiene. La sangre a
menudo se clasifica de acuerdo con el sistema de tipificación ABO.
Forma en que se realiza el examen
Expanda sección
Se necesita una muestra de sangre y ésta se extrae de una vena.
El examen para determinar el grupo sanguíneo se denomina sistema o tipificación ABO. Su
sangre se mezcla con anticuerpos contra sangre tipo A y tipo B, y la muestra se revisa para ver
si los glóbulos sanguíneos se pegan o aglutinan. Si dichos glóbulos se aglutinan, eso significa que
la sangre reaccionó con uno de los anticuerpos.
El segundo paso se llama tipificación o prueba inversa. La parte líquida de la sangre sin células
(suero) se mezcla con sangre que se sabe que pertenece al tipo A o al tipo B. Las personas con
sangre tipo A tienen anticuerpos anti-B y las que tienen sangre tipo B tienen anticuerpos anti-A.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
21
EDDIS EDUCATIVA
El tipo de sangre O contiene ambos tipos de anticuerpos. Estos dos pasos pueden determinar
con precisión su tipo de sangre.
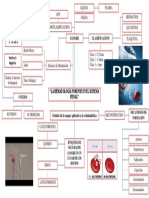
HEMOSTASIA Y COAGULACION.
Se denomina HEMOSTASIA a un conjunto de reacciones químicas en las que intervienen
alrededor de 15 sustancias diferentes contenidas en la sangre y que tiende a evitar la pérdida
de la misma de los vasos. Cuando la sangre circula por los vasos sanguíneos lo hace al estado
líquido y si es extraída del organismo pasa al estado sólido que es lo que se conoce como
coagulación.
El conjunto de mecanismos que intervienen en la hemostasia son 3:
1. VASCULAR
2. PLAQUETARIO
3. PLASMATICO O COAGULACION
Si se produce una herida, la misma en un 1er momento sangra, pero luego cesa por
vasoconstricción o compresión de las paredes vasculares por reflejo o respuesta nerviosa.
A continuación intervienen las plaquetas agrupándose formando el trombo plaquetario y
consecuentemente la liberación por parte de las mismas de las sustancias vasoconstrictoras que
mantienen el cierre de la herida.
Cuando aún el problema persiste, se desata la cascada de coagulación que cierra
definitivamente la herida.
Un coágulo se compone de fibrina; por el plasma sanguíneo circula una proteína inactiva llamada
protrombina que es activada por los factores de coagulación transformándose en trombina que
a su vez transforma el fibrinógeno disuelto en el plasma en filamentos de fibrina que componen
una tela de araña que se adhiere a los extremos de la herida. Como dijimos en dicha red quedan
atrapados los glóbulos rojos (eritrocitos o hematíes), los leucocitos, plaquetas y otros
componentes sanguíneos. Así el coágulo formado aumenta su tamaño y densidad.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
22
EDDIS EDUCATIVA
Finalmente el coágulo se retrae eliminándose la porción de líquido contenido en el mismo y esto
permite que se acerquen los bordes de la herida para su cicatrización. La parte visible del
coágulo sanguíneo se seca sobre la piel y es la costra o cascarita que visualizamos.
Un coagulograma completo comprende:
• Tiempo de coagulación y sangría
• Recuento de plaquetas
• KPTT
• Tiempo de Quick
Para el estudio de coagulación se emplea como anticoagulante CITRATO TRISODICO (TP); Este
es el anticoagulante de elección para la VSG o eritrosedimentación, tiempo de protrombina y
KPTT.
En la cascada de la coagulación, existen dos vías:
1. VIA EXTRINSECA de activación por contacto con las cargas negativas del colágeno del epitelio
in vivo o el vidrio in Vitro (al realizar pruebas en el laboratorio)
2. VIA INTRINSECA donde el factor III tisular de la membrana celular epitelial se une al factor VII
de coagulación.
Luego de varias reacciones en cascada donde participan diferentes factores de coagulación,
ambas vías se unen dando una vía común que culmina con la transformación del factor II
PROTROMBINA a TROMBINA que a su vez convierte el FACTOR I o FIBRINOGENO en monómeros
de fibrina solubles que forman polímeros de fibrina y finalmente con la formación de polímeros
de fibrina estabilizados insolubles (coágulo)
TIEMPO DE PROTOMBINA O DE QUICK (TPR):
Mide la vía extrínseca de la coagulación; es el tiempo que tarda en coagular un plasma incubado
a 37 °C y donde el reactivo que se emplea es el SOLUPLASTIN.
V.N.: 10 a 14 segundos
TIEMPO DE TROMBOPLASTINA ACTIVADA O KPTT:
Mide la vía intrínseca de la coagulación. El reactivo se reconstituye con agua destilada y consiste
en cloruro de calcio.
V.N.: 33 a 48 seg.
TIEMPO DE SANGRIA:
Se punza el lóbulo de la oreja y se cuenta con cronómetro cuántos segundos dura la hemorragia.
V.N.: 1 a 3 min.
TIEMPO DE COAGULACION:
Se cronometra cuanto tiempo tarda en formarse el coágulo del tubo con sangre sin anticoagular
colocado en el baño termostatizado. V.N.: 5 a 10 min. También se observa la retracción del
coágulo si es normal.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
23
EDDIS EDUCATIVA
PLAQUETAS:
Son los elementos más pequeños en sangre periférica, que en realidad no son células sino restos
celulares originados por fragmentación de sus precursores (megacariocitos) en la médula ósea.
Intervienen en la hemostasia (detención de la pérdida de sangre cuando se lesionan los vasos
sanguíneos) o coagulación, ya que tienen capacidad de adhesión al endotelio del vaso; de
agregación plaquetaria (formación del trombo o tapón plaquetario); contribuyen a la retracción
del coágulo permitiendo al tejido o endotelio vascular lesionado repararse rápidamente; liberan
sustancias vasoconstrictoras (cuando se lesiona algún vaso sanguíneo pequeño, se produce
vasoconstricción del mismo para evitar que siga perdiendo sangre) y también liberan sustancias
que intervienen en la formación del coágulo. Como mencionamos anteriormente, si la lesión no
es muy grande, con el tapón plaquetario basta pero si el daño producido es mayor o se trata de
un vaso de mayor calibre se inicia otro proceso, que es la coagulación sanguínea (cascada de
coagulación) cuyo producto final es la formación de un COAGULO que impide la pérdida de
sangre y la entrada de microorganismos invasores.
El V.N. de las plaquetas= 150.000 – 300.000/mm3 aunque este valor varía de acuerdo al método
de recuento empleado.
FACTORES DE COAGULACIÓN
Curso: Asistente de Laboratorio y Análisis Clínicos Página
24
EDDIS EDUCATIVA
La coagulación determina la transformación de una proteína soluble del plasma, EL
FIBRINOGENO, en FIBRINA, esta precipita forma filamentos, entrelazándose, detienen el
sangrado y forman un coagulo. La conversión de fibrinógeno en fibrina requiere la intervención
de una enzima la trombina presente en forma inactiva, la protrombina.
VSG (velocidad de sedimentación de los G.R) O ERITROSEDIMENTACION
Es la propiedad que tienen los GR de sedimentar en reposo dejando sobrenadante (plasma).
Uno de los métodos que se emplea es el de Westergreen que usa una pipeta de 30 cm de largo
y 2,5 mm de ancho, con una capacidad aproximadamente de 1 ml.
Como dijimos, el anticoagulante de elección para la VSG es el citrato aunque puede hacerse a
partir del hemograma también (sangre con EDTA) haciendo algunas correcciones con citrato.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
25
EDDIS EDUCATIVA
Técnica operatoria: se carga por pipeteo, la pipeta de Westergreen y se la coloca en posición
vertical en un soporte y al cabo de una hora se lee la columna de plasma (algunos expresan
también la lectura a las 2 hs).
V.N.: hombre = 0 a 5 mm y en la mujer = 0 a 10 mm.
Entonces un incremento en la VSG indicaría algún daño inespecífico, es decir alguna patología
sin indicar alguna en particular Ej: se observan marcados incrementos en la eritrosedimentación
en procesos inflamatorios e infecciosos y también se dan aumentos fisiológicos en embarazo y
vejez.
Velocidad de sedimentación globular
Fundamento bioquímico. La velocidad de sedimentación globular (VSG) se modifica siempre que
existe un desequilibrio humoral que afecta a las proteínas plasmáticas, acelerándose cuando
aumenta la proporción de fibrinógeno - q u e recubre los hematíes y los adhiere entre sí
formando rouleaux- o la proporción de globulinas. La elevación de la VSG es indicativa de
aumento de reactantes de fase aguda (fibrinógeno,
a2-macroglobulina, etc.). Este aumento es resultado de una reacción biológica mediada por
citocinas (principalmente interleucna 6) que se desencadena en asociación con procesos
inflamatorios y neoplásicos.Sus valores normales son de 3 a 10 mm en la primera hora. A
continuación se expone su utilidad y sus limitaciones.
Pera de goma para pipeta.
Pera de goma para pipeta.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
26
EDDIS EDUCATIVA
El sistema endocrino
Tanto los vertebrados como los invertebrados presentan hormonas. La estructura química, así
como los efectos de las hormonas de los invertebrados suele diferir sustancialmente de las de
los vertebrados. En general, el sistema endocrino provee una comunicación más lenta que la
provista por el sistema nervioso, pero más generalizada.
Las hormonas son moléculas señalizadoras secretadas en una parte de un organismo, que
difunden o, en los vertebrados, son transportadas por el torrente sanguíneo a otros órganos y
tejidos, donde ejercen efectos específicos. Las principales glándulas endocrinas de los
vertebrados incluyen la hipófisis, el hipotálamo, el tiroides, las paratiroides, la corteza
suprarrenal y la médula suprarrenal, el páncreas (también una glándula exocrina), la pineal y las
gónadas (ovarios o testículos).
La producción de muchas hormonas es regulada por sistemas de retroalimentación negativa que
involucran al lóbulo anterior de la glándula hipófisis y al hipotálamo. El hipotálamo es la fuente
de por lo menos nueve hormonas. Estas hormonas actúan estimulando o inhibiendo la secreción
de otras hormonas por parte de la hipófisis anterior. Además de producir hormonas peptídicas
(en algunas ocasiones llamadas hormonas liberadoras) que actúan sobre el lóbulo anterior de la
hipófisis, el hipotálamo produce las hormonas antidiurética (ADH) y oxitocina, que son
almacenadas en el lóbulo posterior de la hipófisis y liberadas desde allí. La hipófisis se encuentra
bajo la influencia directa del hipotálamo. Según las hormonas que reciba del hipotálamo, la
hipófisis produce hormonas tróficas que, a su vez, estimulan a las glándulas blancas para que
produzcan otras hormonas. Estas hormonas actúan luego sobre la hipófisis o el hipotálamo (o
sobre ambos) inhibiendo la producción de las hormonas tróficas. Además de producir las
hormonas tróficas, el lóbulo anterior de la hipófisis también secreta somatotrofina (hormona
del crecimiento) y prolactina. La producción de la hormona tiroidea y de las hormonas esteroides
de la corteza suprarrenal y gónadas es regulada por el sistema hipotálamo-hipofisario.
La glándula tiroides produce la hormona tiroxina, un aminoácido combinado con cuatro átomos
de yodo. Esta glándula se encuentra bajo la influencia de su hormona estimulante (TSH)
secretada por la hipófisis.
Las glándulas suprarrenales están compuestas por dos zonas claramente diferenciables en
cuanto a su estructura y a su función: la corteza y la médula suprarrenal. La corteza suprarrenal
-la capa externa de la glándula- es la fuente de varias hormonas esteroides. En los seres humanos
hay dos grupos principales de hormonas esteroides: los glucocorticoides y los
mineralocorticoides. La médula suprarrenal está formada por células neurosecretoras cuyas
terminales secretan adrenalina y noradrenalina en el torrente sanguíneo.
Las células de los islotes del páncreas son la fuente de tres hormonas implicadas en la regulación
de la glucosa sanguínea: la insulina, el glucagón y la somatostatina. El azúcar sanguíneo también
se encuentra bajo la influencia de la adrenalina (epinefrina) y la noradrenalina (norepinefrina) -
que se liberan de la édula suprarrenal en situaciones de estrés-, el cortisol y otros
glucocorticoides, liberados de la corteza suprarrenal en tiempos de estrés, y la somatotrofina.
La glándula pineal es la fuente de melatonina que interviene en la regulación de los cambios
fisiológicos estacionales y de los circadianos. Esta glándula secreta una hormona, la melatonina,
en forma rítmica e interviene en la regulación de los cambios fisiológicos estacionales y de los
ritmos circadianos.
Las prostaglandinas son un grupo de ácidos grasos que se asemejan a otras hormonas, pero que
frecuentemente actúan sobre los mismos tejidos que las producen. Se forman en casi todos -si
Curso: Asistente de Laboratorio y Análisis Clínicos Página
27
EDDIS EDUCATIVA
no en todos- los tejidos del cuerpo y afectan funciones tan diversas como la contracción del
músculo liso, la aglutinación de plaquetas y la respuesta inmune.
Las hormonas actúan al menos por dos mecanismos diferentes. Algunas entran libremente a las
células, se combinan con un receptor intracelular y ejercen una influencia directa sobre la
transcripción de RNA. Otras se combinan como moléculas receptoras sobre la superficie de las
membranas de las células blancas, la combinación hormona-receptor puede ingresar al
citoplasma o puede provocar la liberación de un "segundo mensajero" que desencadena una
serie de acontecimientos dentro de la célula.
La neuroendocrinología estudia la interacción entre los sistemas endocrino y nervioso. Por un
lado, la actividad neuronal controla la secreción hormonal de muchas glándulas, en general a
través del sistema nervioso autónomo. Asimismo, el ambiente hormonal, a través de la
interacción con receptores específicos, modifica la actividad nerviosa, regulando
comportamientos tan variados como la conducta sexual, la agresividad o la conducta
alimenticia.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
28
EDDIS EDUCATIVA
Curso: Asistente de Laboratorio y Análisis Clínicos Página
29
EDDIS EDUCATIVA
La hipófisis, del tamaño de un poroto, está situada en la base del cerebro, en el centro
geométrico del cráneo. Está formada por tres lóbulos: el anterior, el intermedio y el posterior.
El lóbulo anterior es la fuente de al menos seis hormonas diferentes, producida cada una por
células distintas. Una de éstas es la somatotrofina, la cual estimula la síntesis proteica y
promueve el crecimiento de lo huesos. Esta hormona también afecta el metabolismo de la
glucosa, inhibiendo la absorción y la oxidación de glucosa por algunos tipos de células. También
estimula la degradación de ácidos grasos, conservando así la glucosa. La hipófisis anterior
también produce prolactina, que estimula la secreción de leche en los mamíferos.
Su producción es controlada por una hormona inhibidora producida por el hipotálamo.
La glándula tiroides
El tiroides, bajo la influencia de su hormona estimulante (TSH) secretada por la hipófisis, produce
la hormona tiroxina, que es un aminoácido combinado con cuatro átomos de yodo.
Las glándulas paratiroides
Las glándulas paratiroides están ubicadas por detrás o dentro de la tiroides. Producen la
hormona paratiroidea -parathormona-, que desempeña un papel esencial en el metabolismo
mineral, en especial en la regulación de los iones calcio y fosfato, que existen en una relación
recíproca en la sangre.
Páncreas
El páncreas es una glándula con una función hormonal dual. Por un lado secreta hormonas de
actividad exocrina, enzimas hidrolíticas y soluciones de pH básico, ambas con acción digestiva.
Por otra parte, tiene una función endocrina llevada a cabo por las células de los islotes de
Langerhans del páncreas, fuente de insulina y glucagón, que intervienen en la regulación del
metabolismo de la glucosa. La insulina es secretada en respuesta a un incremento en la
Curso: Asistente de Laboratorio y Análisis Clínicos Página
30
EDDIS EDUCATIVA
concentración de azúcar o de aminoácidos en la sangre y baja la concentración de azúcar en la
sangre, estimulando su absorción y utilización de glucosa por las células y su conversión en
glucógeno. Cuando hay una deficiencia de insulina, como ocurre en personas con diabetes
mellitus, la concentración de azúcar en la sangre se incrementa tanto que no toda la glucosa que
entra al riñón puede ser reabsorbida. La pérdida de glucosa está acompañada por pérdida de
agua y la eshidratación resultante, que puede llevar a un colapso de la circulación, es una de las
causas de muerte en un diabético no tratado.
Niveles hormonalesen base al ciclo de la mujer.
La muestra a utilizarse para realizar estudios de hormonas va a ser suero por lo tanto se
recolectara la muestra en un tubo seco u bien con gel, salvo para la hormona ACTH que la
muestra será tomada en un tuvo con EDTA.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
31
EDDIS EDUCATIVA
QUÍMICA CLÍNICA.
GLUCEMIA
La glucosa es un azúcar simple formado por seis átomos de carbono. Su metabolismo oxidativo
proporciona la mayor parte de la energía utilizada por el organismo, por lo que existen distintos
mecanismos de control homeostático para mantener unas concentraciones constantes que
oscilan entre 70 y 110 mg/dl en ayunas.
Para su medición antiguamente se utilizaban sistemas de determinación de glucosa en sangre
total que hoy en día han sido sustituidos por métodos enzimáticos más exactos que realizan la
determinación de glucosa en suero. Esta diferenciación es importante ya que la concentración
de glucosa en el suero es mayor que en la sangre total. Al contener esta última más proteínas
que el suero posee menor porcentaje de agua y, por tanto, la concentración de glucosa disuelta
es menor.
Los glucómetros portátiles han supuesto un notable avance en el autocontrol de los valores de
glucemia en pacientes diabéticos. Sin embargo, el hecho de que utilicen para la determinación
de la glucemia sangre completa puede originar discrepancias con los valores obtenidos en
laboratorios convencionales donde se analizan los valores de glucosa en suero. Estas
discrepancias pueden verse incrementadas en situaciones de anemia (cantidad insuficiente de
hematócritos) que tendería a elevar los valores de glucemia o de oliglobulia (aumento del
número de hematócritos) que originaría el efecto contrario.
Es por ello por lo que, en pacientes que realizan controles periódicos con glucómetros
personales, es aconsejable verificar periódicamente los resultados con determinaciones
convencionales de laboratorio para constatar que las diferencias se enclavan dentro de límites
aceptables (± 1 5% respecto al resultado del laboratorio de referencia).
HEMOGLOBINA GLICOSILADA
La glucosa se une a la hemoglobina en un porcentaje determinado y de manera casi irreversible
durante los 120 días de vida de los hematíes. Por tanto, la concentración de la hemoglobina
glicosilada (HbAl c ) es proporcional a la concentración plasmática media de glucosa durante ese
período de tiempo (6-12 semanas previas). Su valor normal oscila entre el 4 y el 7%. Su principal
utilidad es que contribuye a monitorizar de forma global la glucemia en el paciente diabético y
sirve de guía al tratamiento, ya que es un excelente predictor de progresión de las
complicaciones. De esta forma cuando la HbAl c media anual es 1,7 veces mayor que el límite
superior (aproximadamente el 1 2 % ) , se producen complicaciones en la mayoría de casos. Se
considera que cuando su valor es superior al 7% en 2 determinaciones consecutivas debe
considerarse un cambio en la estrategia de tratamiento de la diabetes.
UREA PLASMÁTICA Y NITRÓGENO UREICO
La urea es el producto final del catabolismo proteico, se consideran cifras normales valores entre
12 y 54 mg/dl. En determinados laboratorios, particularmente en los países anglosajones, la
determinación plasmática de urea se sustituye por la del nitrógeno ureico (BUN)3 , cuyovalor
normal es de 8-25 mg/dl.Debido a su alta correlación con los síntomas urémicos, el valor de
uremia es un buen predictor de la necesidad de diálisis, y ésta se debe tener en cuenta cuando
las cifras superan los 200 mg/dl.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
32
EDDIS EDUCATIVA
CREATININA PLASMÁTICA
La creatinina es el producto resultante del catabolismo muscular, y se consideran normales
valores entre 0,5 y 1,3 mg/dl en el varón y entre 0,3 y 1,1 mg/dl en la mujer. Se elimina casi en
su totalidad por el riñon y no sufre reabsorción tubular, por lo que, a diferencia de la urea, las
concentraciones plasmáticas de creatinina guardan una estrecha relación con el volumen de
filtrado glomerular. Igualmente, su valor es menos dependiente de la dieta y no se modifica ni
con el ejercicio ni con las variaciones del metabolismo proteico. Por todo ello, este parámetro
es mejor índice que la urea para determinar la función renal.
PROTEÍNAS PLASMÁTICAS
Las proteínas plasmáticas, componente fundamental del plasma, tienen diversas e importantes
funciones: mantienen la presión oncótica GLOBULINAS
Alfaglobulinas
Las alfaglobulinas se separan electroforéticamente en arglobulinas y a2-globulinas. El significado
clínico de sus variaciones es similar en muchos aspectos, por lo que se comentan
conjuntamente. Las alfaglobulinas se encuentran aumentadas en:
• Procesos inflamatorios agudos: infecciones, procesos autoinmunes en fase
aguda. Existe correlación entre la intensidad y la extensión del proceso
inflamatorio y la magnitud del incremento.
• Neoplasias: tanto sólidas como hematológicas.
• Procesos que cursan con necrosis tisular: infarto de miocardio, cerebral,
pulmonar.
• Síndrome nefrótico.
- Por el contrario, se encuentran disminuidas en:
• Inflamaciones crónicas con reacción mesenquimatosa: cirrosis hepática,
poliartritis crónica, etc.
SODIO PLASMÁTICO
El sodio es el determinante primario de la osmolaridad plasmática y contribuye a la regulación
del volumen extracelular. Los valores normales de sodio oscilan entre 135 y 144 mEq/1.
Hiponatremia
Definida como una concentración plasmática de sodio menor de 135 mEq/1, adquiere, sin
embargo, significado clínico con valores inferiores a 130 mEq/1. Es una situación relativamente
frecuente en la clínica, que presenta una incidencia y una prevalencia diaria de alrededor del 1
y 2,5% respectivamente en pacientes hospitalizados.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
33
EDDIS EDUCATIVA
CLORO PLASMÁTICO
Su valor normal es de 96-109 mEq/1. Habitualmente se modifica en la misma dirección que el
sodio, excepto en la acidosis metabólica con depleción de bicarbonato y en la alcalosis
metabólica con exceso de bicarbonato, en cuyo caso los niveles plasmáticos de sodio pueden
ser normales.
POTASIO PLASMÁTICO
El potasio interviene en diversos procesos enzimáticos, pero su efecto fisiológico más
importante reside en su influencia sobre los mecanismos de activación de los tejidos excitables,
como el corazón, el músculo esquelético y el músculo liso. Las principales manifestaciones
clínicas asociadas a la hipopotasemia e iperpotasemia están provocadas por alteraciones en los
fenómenos eléctricos transmembrana de los tejidos excitables y se traducen en trastornos de
la conducción cardíaca y de la función neuromuscular.
MAGNESIO
Su valor normal oscila entre 1,9 y 2,5 mg/dl. Las alteraciones del magnesio generalmente no
producen manifestaciones clínicas significativas, salvo que sean extremas (v. el apartado sobre
hipomagnesemia)
CALCEMIA
El calcio es necesario para la contracción muscular, la transmisión del impulso nervioso, la
secreción hormonal, coagulación, división y motilidad celular, etc.
FOSFATO/HIPERFOSFOREMIA
Las concentraciones plasmáticas normales de fósforo en el adulto oscilan entre 2,5 y 4,5 mg/dl
(0,80-1,45 mmol/1). En los niños y adolescentes el límite superior de la normalidad es de 6 mg/dl
(1,9 mmol/1). Durante el embarazo desciende discretamente, pero se mantiene dentro de los
límites normales. Tiende a aumentar durante el trabajo muscular.
LÍPIDOS PLASMÁTICOS
Triglicéridos
Los triglicéridos son lípidos cuya función principal es transportar energía .hasta los órganos de
depósito. El interés de su medición viene dado-por constituir uno de los factores de riesgo
cardiovascular, aunque más débil que los clásicos -hipercolesterolemia, hipertensión, diabetes
y consumo tabáquico-, y por poder ser causa, en los casos de elevación intensa, de pancreatitis.
Los triglicéridos son transportados por lipoproteínas, el 8 0 % por las lipoproteíñas de muy baja
densidad (VLDL) y el 1 5 % por las lipoproteínas de baja densidad (LDL). Su valor normal en
plasma, variable según el laboratorio, oscila entre 40 y 150 mg/dl.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
34
EDDIS EDUCATIVA
Colesterol
El colesterol es un lípido que interviene de forma esencial en la constitución de las membranas
celulares y en la síntesis de las hormonas tiroideas. El interés de su medición viene dado
fundamentalmente porque el exceso de concentración plasmática es uno de los 4 factores de
riesgo cardiovascular principales, junto con la hipertensión arterial, la diabetes y el hábito
tabáquico. El colesterol es transportado en el plasma por 3 lipoproteínas:
• Las LDL, que transportan el colesterol desde el hígado a las células. El 7 0% del colesterol
circulante es vehiculizado por esta lipoproteína, y es la fracción de colesterol más
aterogénica (la que se deposita en vasos sanguíneos, con la consiguiente formación de la
placa de ateroma).
• Las VLDL, que después de liberarse de los triglicéridos endógenos absorbidos vehiculiza
colesterol de la circulación al hígado. Sólo el 10% del colesterol circulante va ligado a esta
lipoproteína, y es ligeramente aterogénico.
• Las HDL (lipoproteínas de alta densidad), que transportan el colesterol cedido por las
células hasta el hígado (el cual puede eliminarlo a bilis, convertirlo a sales biliares o
reincorporarlo a VLDL). Las HDL, por llevar a cabo el transporte centrípeto del colesterol,
son protectoras frente a la aterogénesis. El 20-25% del colesterol está ligado a estas
lipoproteínas.
HIERRO SÉRICO
El hierro es un oligoelemento utilizado en la síntesis de la hemoglobina y otras heminas
celulares. Su absorción intestinal se realiza en el duodeno y en las primeras porciones del
yeyuno, y es transportado por la transferrina y almacenado intracelularmente en forma de
ferritina. La concentración normal del hierro contenido en el plasma -unido a la transferrina- es
de 80-150 |xg/dl (14-27 p.mol/1) en el varón y de 60-140 |xg/dl (11-25 pjTiol/1) en la mujer. Sus
concentraciones en plasma son variables según el sexo - y a reflejado en los distintos valores de
la normalidad-, la edad - m á s alto en la pubertad-, el momento del día -mayor por la mañana-,
el tono vegetativo y el tipo de alimentación. Los lugares de depósito de hierro son los
hepatocitos (depósitos parenquimatosos de hierro) y el sistema mononuclear fagocítico
(depósitos reticulares de hierro). Las concentraciones de ferritina sérica (de 40-375 ng/1 en el
varón; 10-170 ng/1 en la mujer premenopáusica y 25-280 ng/1 en la postmenopáusica) reflejan
los depósitos totales de hierro del organismo, pero ha de tenerse en cuenta que los procesos
inflamatorios o las enfermedades causantes de necrosis hepatocelular producen una elevación
de la ferritinemia por encima de los valores que corresponderían a los depósitos del metal.
AMILASEMIA
La amilasa es una enzima que se origina en el páncreas, las glándulas salivares y, en menor
medida, en las trompas de Falopio, el músculo esquelético, el intestino, la próstata y el ovario.
Se elimina por la orina y su valor sérico normal es de 35-115 U/1, aunque con variaciones entre
Curso: Asistente de Laboratorio y Análisis Clínicos Página
35
EDDIS EDUCATIVA
laboratorios según el método de medida empleado. Se pueden determinar las isoenzimas de la
amilasa para distinguir su origen: pancreático (isoenzima P, con subfracciones P l, P2 y P3) o
salivar (isoenzima S, con subfracciones S i , S2, S3, S4), aunque en la práctica clínica se utiliza
poco.
BILIRRUBINA
La bilirrubina es un compuesto tetrapirrólico derivado del catabolismo del heme de la
hemoglobina y de las enzimas hemínicas, y es predominante con diferencia la primera fuente.
En c o n d i c i o n e s normales la mayor parte de la bilirrubina se produce por destrucción de
eritrocitos viejos en las células del sistema mononuclear fagocítico en el bazo. La bilirrubina
indirecta o no conjugada pasa al torrente sanguíneo por difusión pasiva y circula unida a la
albúmina. Una o varias proteínas transportadoras captan la bilirrubina y la transportan al interior
del hepatocito, donde se conjuga con una o dos moléculas de ácido glucurónico mediante la
acción de la enzima UDP-GT (bilirrubina uridinofosfato glucuroniltransferasa). La bilirrubina
conjugada o directa pasa a la b i l i s y, a continuación, al intestino, donde es transformada por
la ñora intestinal en urobilinógeno y estercobilina. El urobilinógeno es reabsorbido en parte y
excretado por la orina como urobilina. La concentración normal de bilirrubina total en suero es
inferior a 1 mg/dl (17 (xmol/1), y la de bilirrubina directa inferior a 0,4 mg/dl (7 |xmol/l), con
pequeñas variaciones entre los distintos laboratorios.
TRANSATVIINASAS (GPT o ALT y GOT o AST)
Son enzimas que transfieren un aminoácido a un cetoácido aceptor para dar lugar a aminoácidos
distintos de los originales. En el hígado se han detectado no menos de 60 reacciones de
transaminación, pero las únicas transaminasas con valor clínico son la aspartato-
aminotransferasa o transaminasa glutámico-oxalacética (AST o GOT) y la
alaninoaminotransferasa o transaminasa glutamic o-pirúvic a (ALT o GPT). Estas enzimas no son
específicas del hígado (aunque la GPT lo es más) y se encuentran también en el músculo, el
corazón, el páncreas y elcerebro. La GOT está constituida por dos isoenzimas, una citoplasmática
y otra mitocondrial, mientras que la GPT es exclusivamente citoplasmática. Las concentraciones
normales en plasma traducen la normal destrucción de las células que las contienen, y sus
valores séricos dependen de la técnica empleada para su determinación, pero oscilan entre 9 y
35 U/1. El cociente normal GOT/GPT es aproximadamente de 1,3.
FOSFATASA ALCALINA
Corresponde a un grupo de enzimas que intervienen en la hidrólisis de las uniones éster del
ácido ortofosfórico a pH alcalino. La fosfatasa alcalina sérica tiene varios orígenes (hígado, riñón,
placenta, intestino, huesos-leucocitos), aunque las fuentes más importantes son el hígado, los
huesos y el intestino. Los valores séricos normales dependen del método usado para su
Curso: Asistente de Laboratorio y Análisis Clínicos Página
36
EDDIS EDUCATIVA
determinación; uno de los más empleados es el de Bessey-Lowry, con el que la cifra normal es
de 60-170 U/1 en unidades internacionales equivale a 0,75-1,92 |xkat/l.
GAMMAGLUTAMILTRANSPEPTIDASA (GGT)
Conocida también como gammaglutamiltransferasa, cataliza la transferencia de grupos
gammaglutamil de un péptido a otro o de un péptido a un aminoácido. El tejido más rico en esta
enzima es el hígado, seguido del páncreas, el bazo y el pulmón. En las células se localiza en las
membranas, fundamentalmente del retículo endoplásmico liso, en los microsomas, en la
fracción soluble del citoplasma y en los conductillos biliares. Los valores'séricos normales de
GGT difieren en ambos sexos; son más elevados en los varones (hasta 40 U/dl) que en las
mujeres (hasta 28 U/dl), con variaciones entre los laboratorios
NUCLEOTIDASA
Se utiliza muy poco porque se cuenta con otros marcadores de colestasis técnicamente más
fáciles de determinar. Su valor normal es inferior a 17 U/1. Su aumento puede tener lugar en las
siguientes circunstancias:
• Colestasis intrahepática o extrahepática, sin que aumente con el crecimiento, afecciones óseas
ni el embarazo.
• Hepatitis y cirrosis: aumentos mínimos.
• Tumores o metástasis hepáticas.
• Granulomas hepáticos.
LACTATO DESHIDROGENASA (LDH)
La lactato deshidrogenasa o deshidrogenasa del ácido láctico (LDH) es una enzima presente en
múltiples tejidos orgánicos se libera al plasma como consecuencia de la destrucción celular
(fisiológica o patológica) y es un marcador de destrucción celular sensible aunque poco
específico. Es posible distinguir 5 isoenzimas de la LDH, que permiten diferenciar hasta cierto
punto el órgano u órganos de procedencia. Así, la LDH-1procede en el 6 0% del músculo cardíaco,
mientras que la LDH-5 procede mayoritariamente del hígado y la piel. Sin embargo, la
determinación de isoenzimas está siendo abandonada de forma progresiva por ser sólo
relativamente específicas y disponer hoy día de otros marcadores más eficaces (así p. ej., en el
diagnóstico de la necrosis miocárdica resulta más útil la determinación de troponinas que la
determinación de LDH-1 ya que ésta es sólo relativamente específica del corazón y su elevación
es más tardía). El valor normal de la LDH oscila entre 100 y 220 U/1 (1,83-3,62 |xkat/l), con
variaciones según el laboratorio de referencia.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
37
EDDIS EDUCATIVA
CREATINFOSFOCINASA (CPK) E ISOENZIMAS
La creatinfosfocinasa es una enzima que se encuentra en el músculo estriado, tanto esquelético
como miocárdico, y en el cerebro. Es un dímero compuesto por dos subunidades: M y B, cuya
proporción varía según el tejido considerado, dando lugar así a 3 isoenzimas:
• La BB o rápida, que en el tejido cerebral supone el 9 0% del total de CPK.
Exámenes de sangre: bioquímica hemática 107
• La MB o intermedia, que está mayoritariamente en el músculo cardíaco (en este tejido
representa el 6% del total de CPK), mientras que es mucho menor en el músculo
esquelético y, sobre todo, en el cerebro.
• La MM o lenta, que supone el 9 6% de la CPK del músculo esquelético. Los porcentajes
de distribución de las isoenzimas en los tejidos permiten deducir aproximadamente cuál
es su procedencia. Este hecho tiene una particular aplicación en el caso de la necrosis
miocárdica reciente. Su valor normal, variable según el laboratorio, oscila entre 55 y 170
U/1 para varones y 45-135 U/1 para mujeres.
TROPONINA T Y TROPONINA I
Las troponinas son proteínas presentes en las fibras musculares. El hecho de que manifiesten
diferentes secuencias aminoacídicas en el músculo cardíaco frente al esquelético, y también que
no se liberen a la sangre o lo hagan mínimamente en condiciones normales, junto con el
desarrollo de técnicas que permiten su detección en suero han determinado que actualmente
se hayan convertido en los marcadores bioquímicos de elección en el diagnóstico del infarto
agudo de miocardio. Como hemos señalado anteriormente, su valor normal en suero es cercano
a 0, aunque se aceptan como valores normales hasta 0,1 ng/ml para la troponina T y hasta 1,6
ng/ml para la troponina I, con pequeñas variaciones según el laboratorio.
SEROLOGIA.
INMUNOHISTOQUÍMICA
Es el conjunto de técnicas basadas en la detección de antígenos sobre cortes tisulares utilizando
anticuerpos conjugados con proteínas con actividad enzimática, como la peroxidasa del rábano
o fosfatasa alcalina. La fijación por los anticuerpos de sustratos apropiados permite teñir las
estructuras tisulares que expresan el antígeno de interés. Tiene gran aplicación en los
laboratorios de anatomía patológica para el diagnóstico y clasificación de las lesiones tumorales.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
38
EDDIS EDUCATIVA
ELISA
Es la abreviatura del término inglés EnzymeLinkedImmunoabsorbent
Assay (ensayo de inmunoabsorción acoplado a enzima). Es un conjunto de técnicas de detección
de antígenos o anticuerpos basada en la absorción de proteínas a pocillos de una placa de
plástico tratada para favorecer su capacidad de absorber proteínas (antígenos o anticuerpos),
de forma que en los pocillos se pueden incubar con soluciones muestra que contienen
anticuerpos o antígenos. La reacción antígeno anticuerpo se revela mediante una reacción
enzimática que cambia el color y se cuantifica por la absorbencia de luz del fluido a una
determinada longitud de onda. Permite detectar antígenos presentes en una muestra compleja
y cuantificarlos de acuerdo con una serie de diluciones patrón de concentración conocida, así
como para cuantificar anticuerpos presentes en el suero u otro fluido biológico cuando se utiliza
el antígeno adsorbido al plástico y se determina la máxima dilución del suero que mantiene
actividad (título). Por su sencillez, las pruebas en éste y parecidos formatos se utilizan en
múltiples tests diagnósticos cualitativos y cuantitativos. Las técnicas de ELISA han sustituido a
las técnicas basadas en mareaje radioactivo de antígenos o anticuerpos (como el
radioinmunoensayo) por su sencillez. Sin embargo, la mayor sensibilidad de la detección de
isótopos radioactivos reserva las técnicas de radioinmunoensayo para la detección y
cuantificación de polipéptidos, que como algunas hormonas, fluctúan su concentración a valores
inferiores a las decenas de pg/ml.
INMUNOBLOTO WESTERN BLOT
Son técnicas de detección de antígeno en las que las proteínas de una suspensión complejas son
separadas mediante electroforesis utilizando habitualmente una técnica que las dispone en un
gel separadas en función de su tamaño o peso molecular. El contenido del gel se transfiere a una
matriz superpuesta de papel de nitrocelulosa o una sustancia similar en la que quedan fijadas
las proteínas en idéntica disposición a la que tenían en el gel. Esta matriz de nitrocelulosa se
incuba con anticuerpos específicos de una proteína y se revela con una reacción enzimática que
permite visualizar o no la banda de interés que aparece en el peso molecular correspondiente.
TOLL LIKE RECEPTORS
El toll like receptors (TLR) es el conjunto de receptores expresados por leucocitos que permiten
la detección de sustancias que denotan la presencia de gérmenes (patrones moleculares de
gérmenes). Son importantes para poner en marcha la respuesta inflamatoria innata y para
permitir la puesta en marcha de la respuesta inmunitaria adaptativa mediada por anticuerpos
y por linfocitos T específicos. Se llaman así por su parecido al receptor TOLL de la mosca del
vinagre que detecta la presencia de infecciones fúngicas y pone en marca la producción de
sustancias fungicidas. Se conocen 11 TLR en el genoma humano con capacidad de detectar
patrones moleculares asociados a patógenos como el lipopolisacárido (TLR-4), ácido
lipotecoideo y otras sustancias de hongos y bacterias Gram+ (TLR2), Flagelina bacteriana (TLR-
5), ADN de carácter ísticas de células procarióticas (TLR-9), ARN de doble cadena o de
características virales (TLR-3 y TLR-7). El reconocimiento de estas sustancias pone en marcha el
sistema inmunitario innato con la producción de mediadores de la inflamación, péptidos
bactericidas (defensinas) y promueve la presentación antigénica productiva a linfocitos T para
desencadenar la respuesta adaptativa.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
39
EDDIS EDUCATIVA
CITOCINAS
Son polipéptidos o proteínas segregadas por células no endocrinas (endotelio, fibroblastos o
leucocitos) que influyen sobre las funciones biológicas de células del entorno. Regulan todos los
procesos biológicos importantes, incluyendo el crecimiento y la activación celular, la
inflamación, la reparación tisular, la fibrosis, la morfogénesis y la inmunidad. Proceden de genes
específicos y actúan como mediadores sobre las células diana con receptores apropiados de
membrana. Comprenden las interleucinas (citocinas producidas por leucocitos), los interferones
(descritos originalmente como sustancias capaces de interferir con la infección viral de cultivos
celulares tratados con estas proteínas), los factores de necrosis tumoral, los factores
estimulantes de colonias que controlan la hematopoyesis y las quimiocinas (polipéptidos
endógenos con actividad quimiotáctica para diferentes poblaciones de leucocitos). A
continuación se enumeran algunas de las más conocidas:
MARCADORES TUMORALES
El cáncer se origina de células en el cuerpo. Las células normales se multiplican cuando el cuerpo
las necesita y mueren cuando se dañan o cuando el cuerpo ya no las necesita. El cáncer parece
ocurrir cuando el material genético de una célula cambia. Eso provoca que las células crezcan
fuera de control. Las células se dividen demasiado rápido y no mueren de la manera normal.
Existen muchos tipos diferentes de cáncer. Puede aparecer en casi cualquier órgano o tejido,
como el pulmón, el colon, los senos, la piel, los huesos o el tejido nervioso.
Curso: Asistente de Laboratorio y Análisis Clínicos Página
40
EDDIS EDUCATIVA
Existen múltiples factores de riesgo para el cáncer como:
Benceno y otros químicos
Beber demasiado alcohol
Toxinas ambientales, como ciertos hongos venenosos y un tipo de tóxico que puede
formarse en las plantas de cacahuete (aflatoxinas)
Problemas genéticos
Obesidad
Exposición a la radiación
Demasiada exposición al sol
Virus
La causa de muchos cánceres sigue siendo desconocida.
¿Qué son los Marcadores Tumorales?
Los marcadores de tumores son sustancias producidas por las células cancerosas o por otras
células del cuerpo como respuesta al cáncer o a ciertas afecciones benignas (no cancerosas). La
mayoría de los marcadores de tumores son producidos tanto por las células normales como por
las células cancerosas; sin embargo, se producen en concentraciones más altas en
enfermedades cancerosas. Estas sustancias pueden encontrarse en la sangre, en la orina, en la
materia fecal, en tejido de tumores o en otros tejidos o líquidos del cuerpo de algunos pacientes
con cáncer. La mayoría de los marcadores de tumores son proteínas. Sin embargo, más
recientemente, los patrones de expresión de los genes y los cambios de ADN han empezado a
usarse como marcadores de tumores. Los marcadores del segundo tipo se evalúan
específicamente en el tejido tumoral. Los marcadores de tumores se usan para ayudar a
detectar, a diagnosticar y a controlar algunos tipos de cáncer. Aunque una concentración
Curso: Asistente de Laboratorio y Análisis Clínicos Página
41
EDDIS EDUCATIVA
elevada de un marcador de tumores puede sugerir la presencia de cáncer, este hecho solo no es
suficiente para diagnosticar cáncer. Por lo tanto, las mediciones de los marcadores tumorales se
combinan en general con otras pruebas, como con biopsias, para diagnosticar el cáncer
Tipos de Marcadores Tumorales
Alfa-fetoproteína (AFP)
Tipos de cáncer: Cáncer de hígado y tumores de células germinativas
Tejido analizado: Sangre
Cómo se usó: Para ayudar a diagnosticar cáncer de hígado y vigilar la reacción al
tratamiento; para evaluar el estadio, el pronóstico y la reacción al tratamiento de tumores
de células germinativas
Antígeno carcinoembrionario (CEA)
Tipos de cáncer: Cáncer colorrectal y cáncer de seno
Tejido analizado: Sangre
Cómo se usó: Para revisar si el cáncer colorrectal se ha diseminado; para buscar la
recidiva del cáncer de seno y evaluar la reacción al tratamiento
Antígeno prostático específico (PSA)
Tipo de cáncer: Cáncer de próstata
Tejido analizado: Sangre
Cómo se usó: Para ayudar en el diagnóstico, evaluar la reacción al tratamiento y buscar
la recurrencia (recidiva)
CA15-3/CA27.29
Tipo de cáncer: Cáncer de seno
Tejido analizado: Sangre
Cómo se usó: Para evaluar si el tratamiento está funcionando o si la enfermedad ha
regresado
CA19-9
Tipos de cáncer: Cáncer de páncreas, cáncer de vesícula biliar, cáncer de conducto biliar
y cáncer gástrico
Tejido analizado: Sangre
Cómo se usó: Para evaluar si el tratamiento está funcionando
CA-125
Tipo de cáncer: Cáncer de ovarios
Tejido analizado: Sangre
Cómo se usó: Para ayudar en el diagnóstico, en la evaluación de la reacción al
tratamiento y en la evaluación de la recidiva
Curso: Asistente de Laboratorio y Análisis Clínicos Página
42
EDDIS EDUCATIVA
Calcitonina
Tipo de cáncer: Cáncer medular de tiroides
Tejido analizado: Sangre
Cómo se usó: Para ayudar en el diagnóstico, para revisar si el tratamiento está
funcionando y evaluar la recidiva
CD20
Tipo de cáncer: Linfoma no Hodgkin
Tejido analizado: Sangre
Cómo se usó: Para determinar si el tratamiento con una terapia dirigida es el adecuado
Cromogranina A (CgA)
Tipo de cáncer: Tumores neuroendocrinos
Tejido analizado: Sangre
Cómo se usó: Para ayudar en el diagnóstico, en la evaluación de la reacción al
tratamiento y en la evaluación de la recidiva
Fragmentos de citoqueratina 21-1
Tipo de cáncer: Cáncer de pulmón
Tejido analizado: Sangre
Cómo se usó: Para ayudar en la vigilancia de recurrencia (recidiva)
Gonadotropina coriónica humana ß (Beta-hCG)
Tipos de cáncer: Coriocarcinoma y cáncer de testículo
Tejido analizado: Orina o sangre
Cómo se usó: Para evaluar el estadio, el pronóstico y la reacción al tratamiento
HE4
Tipo de cáncer: Cáncer de ovarios
Tejido analizado: Sangre
Cómo se usó: Para evaluar el avance de la enfermedad y vigilar la recurrencia (recidiva)
Inmunoglobulinas
Tipos de cáncer: Mieloma múltiple y macroglobulinemia de Waldenström
Tejido analizado: Sangre y orina
Cómo se usó: Para ayudar a diagnosticar la enfermedad, evaluar la reacción al
tratamiento y buscar si ha habido recurrencia (recidiva)
Lactato deshidrogenasa
Tipo de cáncer: Tumores de células germinativas
Tejido analizado: Sangre
Curso: Asistente de Laboratorio y Análisis Clínicos Página
43
EDDIS EDUCATIVA
Cómo se usó: Para evaluar el estadio, el pronóstico y la reacción al tratamiento
Microglobulina ß-2 (B2M)
Tipos de cáncer: Mieloma múltiple, leucemia linfocítica crónica y algunos linfomas
Tejido analizado: Sangre, orina o líquido cefalorraquídeo
Cómo se usó: Para determinar el pronóstico y vigilar la reacción al tratamiento
Proteína de matriz nuclear 22 (NMP22)
Tipo de cáncer: Cáncer de vejiga
Tejido analizado: Orina
Cómo se usó: Para vigilar la reacción al tratamiento
Sello de 5 proteínas (Ova1)
Tipo de cáncer: Cáncer de ovarios
Tejido analizado: Sangre
Cómo se usó: Para evaluar la masa pélvica antes de operación para lo que se sospecha
ser cáncer de ovario
Tiroglobulina
Tipo de cáncer: Cáncer de tiroides
Tejido analizado: Sangre
Cómo se usó: Para evaluar la reacción al tratamiento y buscar la recurrencia (recidiva)
Curso: Asistente de Laboratorio y Análisis Clínicos Página
44
EDDIS EDUCATIVA
BIBLIOGRAFÍA.
MANUAL DE BIOSEGURIDAD EN EL LABORATORIO OMS
LA CLÍNICA Y EL LABORATORIO ALFONSO BALCELLS
BIOLOGÍA ELENA CURTIS
FISIOLOGIÍA MÉDICA GUYTON Y HALL
Curso: Asistente de Laboratorio y Análisis Clínicos Página
45
También podría gustarte
- Guía práctica para técnico superior de laboratorio de diagnóstico clínico y biomédicoDe EverandGuía práctica para técnico superior de laboratorio de diagnóstico clínico y biomédicoCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Interpretación de análisis clínicos en perros y gatosDe EverandInterpretación de análisis clínicos en perros y gatosCalificación: 5 de 5 estrellas5/5 (2)
- Interpretación Rápida De La Gasometría Arterial: Gasometría Arterial En 4 PasosDe EverandInterpretación Rápida De La Gasometría Arterial: Gasometría Arterial En 4 PasosAún no hay calificaciones
- Procedimientos clínicos en endodonciaDe EverandProcedimientos clínicos en endodonciaCalificación: 4 de 5 estrellas4/5 (2)
- Biometría Hemática Completa: Laboratorios de Análisis ClínicosDocumento2 páginasBiometría Hemática Completa: Laboratorios de Análisis ClínicosAnonymous qtdEKRyv100% (2)
- SangreDocumento16 páginasSangreLiliana Miranda A100% (2)
- Práctica n3. Hematologia. Extracción SangreDocumento14 páginasPráctica n3. Hematologia. Extracción SangreLuis Angel Gomez GarciaAún no hay calificaciones
- Práctica 2 - Hemostasia y Grupos SanguíneosDocumento8 páginasPráctica 2 - Hemostasia y Grupos SanguíneosDavid Emmanuel Pérez CruzAún no hay calificaciones
- Preanalisis Laboratorio ClinicoDocumento21 páginasPreanalisis Laboratorio ClinicoCésar Rosado Avila ToñoAún no hay calificaciones
- RecuentoPlaquetasDirectoDocumento7 páginasRecuentoPlaquetasDirectocalizredAún no hay calificaciones
- Cuadernillo Banco de SangreDocumento38 páginasCuadernillo Banco de SangreManuel Morales Salazar100% (1)
- Procesos y técnicas de conservación o embalsamamiento de cadáveres con productos biocidas. SANP0108De EverandProcesos y técnicas de conservación o embalsamamiento de cadáveres con productos biocidas. SANP0108Calificación: 5 de 5 estrellas5/5 (2)
- Laboratorio ClinicoDocumento25 páginasLaboratorio ClinicoMinerva No Aplica Jrusta VAún no hay calificaciones
- Manual Laboratorios Centros SaludDocumento38 páginasManual Laboratorios Centros SaludRobert Caballero Bardales100% (1)
- Practica HBDocumento10 páginasPractica HBJhenny1995Aún no hay calificaciones
- Guias Practicas Laboratorio ClinicoDocumento76 páginasGuias Practicas Laboratorio ClinicoRicardo Jean Pool CabelloAún no hay calificaciones
- Manual de Hematología Facultad Bioanálisis VeracruzDocumento103 páginasManual de Hematología Facultad Bioanálisis VeracruzMarjorie RoAún no hay calificaciones
- Preanalisis Laboratorio Clinico PDFDocumento21 páginasPreanalisis Laboratorio Clinico PDFCésar Rosado Avila Toño100% (1)
- CLASE N 22 CuidadosDocumento12 páginasCLASE N 22 CuidadosDEBORA MICAELA VETTORIAún no hay calificaciones
- Toma de Muestras en NiñosDocumento27 páginasToma de Muestras en Niñosleo96xdAún no hay calificaciones
- 3CM3, AGWP, Reporte Practica No.3Documento8 páginas3CM3, AGWP, Reporte Practica No.3Wendy AguileraAún no hay calificaciones
- Tubos de LaboratorioDocumento10 páginasTubos de LaboratorioEnrique De La Hoz CastellarAún no hay calificaciones
- Recoleccion de MuestrasDocumento9 páginasRecoleccion de MuestrasMichell GarcíaAún no hay calificaciones
- Folleto de Análisis ClínicoDocumento104 páginasFolleto de Análisis ClínicoINGALL LADY RIVERA LOORAún no hay calificaciones
- Toma de MuestraDocumento11 páginasToma de MuestraSandra LindaoAún no hay calificaciones
- Informe de actividades en laboratorio clínicoDocumento24 páginasInforme de actividades en laboratorio clínicoJhossue Yesús CastañedaAún no hay calificaciones
- Práctica #1 Hematologia BonifacciniDocumento6 páginasPráctica #1 Hematologia BonifacciniGiselle BonifacciniAún no hay calificaciones
- Protocologo Toma de Muestras de Laboratorio ClinicoDocumento10 páginasProtocologo Toma de Muestras de Laboratorio Clinicocmartinez_487001Aún no hay calificaciones
- Informe 3 de DiseñoDocumento23 páginasInforme 3 de DiseñoGINA THALIA LOBATON ALMONACIDAún no hay calificaciones
- Muestras de LaboratorioDocumento17 páginasMuestras de LaboratorioyuksigtAún no hay calificaciones
- Guia para La Toma de Muestras de LaboratorioDocumento11 páginasGuia para La Toma de Muestras de Laboratoriojadd9100% (1)
- Bioseguridad y Calidad LaboratorioDocumento57 páginasBioseguridad y Calidad LaboratorioAndrea GuanoluisaAún no hay calificaciones
- Practica 1Documento5 páginasPractica 1Tamara VeraAún no hay calificaciones
- Manejo de Muestras BiologicasDocumento37 páginasManejo de Muestras BiologicasVictor Medina Rodríguez100% (1)
- Curso 2019Documento5 páginasCurso 2019HEATHAún no hay calificaciones
- Toma, Conservacion y Envio de Muestras AlDocumento24 páginasToma, Conservacion y Envio de Muestras AlNoris CabarcasAún no hay calificaciones
- Bioseguridad en el laboratorio clínico: Toma de muestraDocumento15 páginasBioseguridad en el laboratorio clínico: Toma de muestraMilagrosMaidanaAún no hay calificaciones
- Guia Completa de Toma de Muestras Tecnsalud 2022Documento11 páginasGuia Completa de Toma de Muestras Tecnsalud 2022Ingrid MosqueraAún no hay calificaciones
- Manual HematologíaDocumento85 páginasManual Hematologíamarmol13100% (1)
- Analisis Clinico Nuevo 2Documento38 páginasAnalisis Clinico Nuevo 2Margot Mendoza SalasAún no hay calificaciones
- Practica 1 Toma de MuestraDocumento6 páginasPractica 1 Toma de MuestraCristinaGarciaGuerreroAún no hay calificaciones
- Preanalisis para 1-800 PDFDocumento21 páginasPreanalisis para 1-800 PDFCésar Rosado Avila ToñoAún no hay calificaciones
- Manual de Toma de Muestras: U.G.C. de LaboratoriosDocumento30 páginasManual de Toma de Muestras: U.G.C. de LaboratoriosDaleska CT100% (1)
- Extraccion de Snagre 02Documento11 páginasExtraccion de Snagre 02Beberly Reyes EspinozaAún no hay calificaciones
- Recolección de muestras sanguíneas: aspectos fundamentales para garantizar la calidadDocumento36 páginasRecolección de muestras sanguíneas: aspectos fundamentales para garantizar la calidadAlejandra CastilloAún no hay calificaciones
- Manual de Procedimientos de Hematologicos PDFDocumento53 páginasManual de Procedimientos de Hematologicos PDFblackdvd03100% (4)
- Manual de Hematología Serie BlancaDocumento24 páginasManual de Hematología Serie BlancaDanyEchevarriaCruzAún no hay calificaciones
- Manual Bioquimica ClinicaDocumento129 páginasManual Bioquimica ClinicaRocío Hernández100% (1)
- Flebotomía: Toma de muestra de sangre venosaDocumento10 páginasFlebotomía: Toma de muestra de sangre venosaLourdes Mariana Adán GüemesAún no hay calificaciones
- Ensayo Sobre Extracción SanguíneaDocumento11 páginasEnsayo Sobre Extracción SanguíneaPamela Garcia OrtizAún no hay calificaciones
- Manual de Practicas de Hemostasia CompletoDocumento47 páginasManual de Practicas de Hemostasia CompletoAna0687100% (3)
- Manual de Practicas de HemostasiaDocumento47 páginasManual de Practicas de HemostasiaErick Valente Rodriguez SegoviaAún no hay calificaciones
- Obtención Sangre ManualDocumento46 páginasObtención Sangre ManualherosadddAún no hay calificaciones
- Extraccion - Sangre - Venosa - Manual de Protocolos y Procedimientos Generales de La EnfermeríaDocumento6 páginasExtraccion - Sangre - Venosa - Manual de Protocolos y Procedimientos Generales de La EnfermeríaPoleth SarahiAún no hay calificaciones
- Tema 20Documento13 páginasTema 20Ana Cabrera CostaAún no hay calificaciones
- Practica 1-Toma de MuestrasDocumento6 páginasPractica 1-Toma de MuestrasLa super hojaAún no hay calificaciones
- Trabajo de Muestra SanguineaDocumento10 páginasTrabajo de Muestra Sanguineamilagros barreraAún no hay calificaciones
- 4toma de Muestra ListoDocumento15 páginas4toma de Muestra ListoEva Cerda CaamañoAún no hay calificaciones
- Práctica No. 5. Toma de Muestra y Manejo de RPBIDocumento8 páginasPráctica No. 5. Toma de Muestra y Manejo de RPBIJesús SalazarAún no hay calificaciones
- Libreta de LaboratorioDocumento207 páginasLibreta de LaboratorioJosé Alejandro JaimesAún no hay calificaciones
- Manual To Mamu Est RaDocumento31 páginasManual To Mamu Est RaJose NovoaAún no hay calificaciones
- Guía de Prácticas InmunologiaDocumento33 páginasGuía de Prácticas InmunologiaLUIS FERNANDO ORTEGA ESPINOZAAún no hay calificaciones
- REPORTE DE PRACTICAS 3 Y 4 - Rocha Wong Luis Angel Equipo #2Documento11 páginasREPORTE DE PRACTICAS 3 Y 4 - Rocha Wong Luis Angel Equipo #2luis.rochaAún no hay calificaciones
- Teoria de Toma de Muestras en Laboratorio ClinicoDocumento10 páginasTeoria de Toma de Muestras en Laboratorio ClinicoArisquewisAún no hay calificaciones
- Trombocitopenia ResumenDocumento9 páginasTrombocitopenia ResumenEgly TuarezAún no hay calificaciones
- Resumen HemostasiaDocumento30 páginasResumen HemostasiaYadira JayaAún no hay calificaciones
- Homograma de SchillingDocumento11 páginasHomograma de SchillingSandro OrtizAún no hay calificaciones
- 3era SemanaDocumento4 páginas3era SemanamierdactmAún no hay calificaciones
- 2.4 LeucocitosDocumento40 páginas2.4 Leucocitosapi-19964939Aún no hay calificaciones
- Tabla de Sistemas de Grupos Sanguíneos - BdsDocumento6 páginasTabla de Sistemas de Grupos Sanguíneos - BdsAngelAún no hay calificaciones
- Teoria 3Documento75 páginasTeoria 3Fatima AlvarezAún no hay calificaciones
- Anemia NeonatologiaDocumento8 páginasAnemia NeonatologiaMar SolísAún no hay calificaciones
- VCM, reticulocitos y frotis en el diagnóstico de anemiasDocumento2 páginasVCM, reticulocitos y frotis en el diagnóstico de anemiasCANAún no hay calificaciones
- Banco de Preguntas D 82402 Downloadable 1712129Documento11 páginasBanco de Preguntas D 82402 Downloadable 1712129Brayan Octavio Kajatt MalasquezAún no hay calificaciones
- Sistema Sanguíneo MnsDocumento17 páginasSistema Sanguíneo MnscarlosdanielfonsecaAún no hay calificaciones
- Guia HematoDocumento36 páginasGuia HematoVerónica Mercado DíazAún no hay calificaciones
- SEMIOLOGÍA Anemia FerropénicaDocumento20 páginasSEMIOLOGÍA Anemia Ferropénicasharon130802Aún no hay calificaciones
- Hematología 5Documento36 páginasHematología 5Pargo-Aún no hay calificaciones
- Manejo de Hemoderivados.gDocumento13 páginasManejo de Hemoderivados.gAlvaro RiveraAún no hay calificaciones
- Patología Semana 13 Trastornos de Los EritrocitosDocumento2 páginasPatología Semana 13 Trastornos de Los EritrocitosCARLOS MANUEL MARI�OS CARRANZAAún no hay calificaciones
- Protocolo en ExtensoDocumento20 páginasProtocolo en ExtensoAlejandro de la RosaAún no hay calificaciones
- TESISDocumento7 páginasTESISHARVIN VICTOR HUAROC ROSALESAún no hay calificaciones
- 2022-09-20 613006404DB 1035390084Documento9 páginas2022-09-20 613006404DB 1035390084hector123ab_53062002Aún no hay calificaciones
- Grupos RH y ABODocumento2 páginasGrupos RH y ABOEmmanuel Caballero RomeroAún no hay calificaciones
- Reacciones de Aglutinación en Medio SalinoDocumento4 páginasReacciones de Aglutinación en Medio SalinoKowe xDAún no hay calificaciones
- La Hematología Forense en El Sistema PenalDocumento1 páginaLa Hematología Forense en El Sistema PenalJhosua MckenleyAún no hay calificaciones
- Celulas SanguineasDocumento6 páginasCelulas SanguineasDaniela ArguelloAún no hay calificaciones
- Hemorragia Post Parto Lista de ChequeoDocumento8 páginasHemorragia Post Parto Lista de ChequeoCatalina Moreno TorresAún no hay calificaciones
- Diagrama de Flujo de Tipo Sanguineo en TuboDocumento1 páginaDiagrama de Flujo de Tipo Sanguineo en TuboManuel MirandaAún no hay calificaciones
- Citología Hemática Con HistogramaDocumento65 páginasCitología Hemática Con Histogramamipdance67% (3)