Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Guia 5.m
Cargado por
Fátima LucíaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Guia 5.m
Cargado por
Fátima LucíaCopyright:
Formatos disponibles
UNIVERSIDAD NACIONAL
AUTONOMA DE NICARAGUA,
PRODUCTOS NATURALES
FACULTAD DE CCQQ,
FARMACIA
PRACTICA N° 5
Cuantificación de cafeína en muestras vegetales
INTODUCCIÓN
La cafeína es un compuesto químico que se encuentra de forma natural en algunos vegetales
como los granos de cacao y café, las hojas de té, las bayas de guaraná y la nuez de cola.
También se añade a gran una variedad de alimentos como pasteles, helados, dulces, bebidas
energéticas y bebidas de cola. Se encuentra, asimismo, en combinación con la p-sinefrina en
una serie de suplementos alimenticios que se comercializan con fines adelgazantes y para
mejorar el rendimiento deportivo. Algunos medicamentos y cosméticos contienen también
cafeína. Según las encuestas cubiertas por la base de datos de consumo de alimentos de la
EFSA el café constituye la fuente más importante de cafeína de los adultos, y representa entre
el 40 % y el 94 % de la ingesta total. En Irlanda y en el Reino Unido, el té es la fuente
principal, y representa el 59 % y el 57 % respectivamente de la ingesta total de cafeína. En la
mayoría de países, el chocolate y las bebidas de cacao es la fuente predominante de cafeína en
niños de entre 3 y 10 años, seguida del té y las bebidas de cola.
Competencia
Aplica técnicas para el control de calidad, validación de métodos y la estabilidad do de los
productos fitofarmacéuticos.
Alcance
Esta práctica se realizará en las instalaciones del Departamento de farmacia industrial
Responsabilidades.
Es responsabilidad del instructor, dirigir, designar y evaluar a los estudiantes
Es responsabilidad de los estudiantes, asistir, elaborar y entregar el informe en tiempo y forma
al instructor responsable de cada grupo de laboratorio.
DEPARTAMENTO DE FARMACIA INDUSTRIAL Página 1 de 7
UNIVERSIDAD NACIONAL
AUTONOMA DE NICARAGUA,
PRODUCTOS NATURALES
FACULTAD DE CCQQ,
FARMACIA
Desarrollo.
PREPARACIÓN DE MUESTRAS PATRÓN PARA ELABORAR LA RECTA DE
CALIBRADO
Preparación de las muestras patrón
Primero se ha preparado la disolución patrón de cafeína, a partir de 40 mg de cafeína
(previamente secada que se disuelven, en matraz aforado de 100 ml, en agua Milli-Q
(400ppm). Seguidamente, se traspasan, con ayuda de pipeta aforada, 10 ml de esta disolución
a otro matraz aforado de 100 ml y se lleva a enrase con la misma agua Milli-Q (40 ppm). A
partir de esta última solución patrón de c0
1afeína de 40 ppm, se preparan 5 soluciones más diluidas de concentraciones de 4, 8, 16, 24 y
32 microgramos de cafeína por mililitro:
(5 ml de solución patrón de cafeína de 40 ppm+2 ml HCl 0,01 M)/50 ml de agua (4 ppm)
(5 ml de solución patrón de cafeína de 40 ppm+1 ml HCl 0,01 M)/25 ml de agua (8 ppm)
(10 ml de solución patrón de cafeína de 40 ppm+1 ml HCl 0,01 M)/25 ml de agua (16 ppm)
(15 ml de solución patrón de cafeína de 40 ppm+1 ml HCl 0,01 M)/25 ml de agua (24 ppm)
(20 ml de solución patrón de cafeína de 40 ppm+ 1 ml HCl 0,01 M)/25 ml de agua (32 ppm)
MUESTRAS DE CAFEÍNA DE CAFÉ
PROCEDIMIENTOS DE SEPARACIÓN DE LA
CAFEÍNA DEL CAFÉ
1. Se pesan aproximadamente 300 mg y se ponen a reflujo con 200 ml de Agua Milli-Q
durante 15 minutos.
2. Seguidamente, se filtra la solución en caliente y se añaden 5 g de Na2CO3 hasta la
total disolución.
3. Se deja enfriar y se agregan 15 ml cloroformo que se extraen agitando suavemente
durante unos minutos y se repite esta operación una vez más.
4. Después de la separación de las dos fases, se añaden pequeñas cantidades de Na2SO4
para absorber el agua.
DEPARTAMENTO DE FARMACIA INDUSTRIAL Página 2 de 7
UNIVERSIDAD NACIONAL
AUTONOMA DE NICARAGUA,
PRODUCTOS NATURALES
FACULTAD DE CCQQ,
FARMACIA
5. Se filtra la fase clorofórmica haciéndola pasar por papel filtro hacia un matraz
erlenmeyer o balón, y se deja evaporar hasta sequedad.
6. Una vez eliminado el cloroformo, se añade al mismo matraz o balón, 50 ml de Agua
Milli-Q y se agita bien hasta perfecta disolución.
7. Posteriormente, mediante un embudo se enrasa a 100 ml en un matraz aforado.
8. Finalmente, se toman 10 ml de esta última solución, se añade 1 ml de la solución de
ácido clorhídrico 0,01 M y se enrasa a 25 ml con Agua Milli-Q.
9. Lecturas en HPLC
Condiciones cromatograficas
Fase Movil: Agua; Acetonitrilo (20:80)
Columna: Nucleosil 100 C18, 5 micrómetros, 100 x 4,6 mm.
Detector: UV (273 nm).
Flujo: 1 mL/min
Volumen de inyección: 20 μL
Lecturas en espectrofotometro UV-vis
Agilent 8453 Sistema de Espectroscopía UV-Visible
Cubeta de cuarzo de 10 mm
Reactivos: Cafeína anhidra
Agua Milli-Q (Millipore).
Ácido clorhídrico 0,01 M
Longitud de onda: 271 nm -273 nm
DEPARTAMENTO DE FARMACIA INDUSTRIAL Página 3 de 7
UNIVERSIDAD NACIONAL
AUTONOMA DE NICARAGUA,
PRODUCTOS NATURALES
FACULTAD DE CCQQ,
FARMACIA
FUNDAMENTO TEORICO
Cafeína anhidra
El término anhidra significa que no contiene agua. La cafeína anhidra es la cafeína
deshidratada.
A diferencia de la cafeína tradicional encontrada frecuentemente en el café o el té, la
cafeína anhidra se encuentra en los productos de nutrición deportiva en tabletas, píldoras,
etc. Este tipo de cafeína es absorbida más rápidamente que la cafeína de origen natural,
pudiéndose sentir sus efectos en tan solo 5 minutos después de su consumo. La acción de
este tipo de cafeína suele durar de 20 a 60 minutos aproximadamente.
La cafeína anhidra parece ser más efectiva en la mejora del rendimiento que si se
suministra en forma de cafeína natural.
Calibración
El método de calibración es un procedimiento analítico muy utilizado en análisis
cuantitativo en química analítica que implica la construcción de una “curva de
calibración” para determinar la concentración de una sustancia (analito) en una muestra
problema. Una curva de calibración es la representación gráfica de una señal que se mide
en función de la concentración de un analito. Conociendo esta relación funcional, será
posible conocer la concentración en una muestra dada mediante la medida de esa señal.
DEPARTAMENTO DE FARMACIA INDUSTRIAL Página 4 de 7
UNIVERSIDAD NACIONAL
AUTONOMA DE NICARAGUA,
PRODUCTOS NATURALES
FACULTAD DE CCQQ,
FARMACIA
INSTRUMENTOS
DEPARTAMENTO DE FARMACIA INDUSTRIAL Página 5 de 7
UNIVERSIDAD NACIONAL
AUTONOMA DE NICARAGUA,
PRODUCTOS NATURALES
FACULTAD DE CCQQ,
FARMACIA
REACTIVOS
Fórmula: Na₂CO₃
Masa molar: 105.9888 g/mol
Densidad: 2540 kg/m³; 2,54 g/cm³
Solubilidad en agua: 30.7 g por cada 100 g de agua (25 °C)
Punto de fusión: 1124 K (851 °C)
Acidez: 10,33 pKa
Fórmula: CHCl₃
Densidad: 1.49 g/cm³
Masa molar: 119.38 g/mol
Punto de ebullición: 334,2 K (61 °C)
Solubilidad en agua: 0,8 g/100 ml 293,15 K (20 °C)
Acidez: 15.7 (20 °C) pKa
Apariencia: Incoloro
Fórmula: Na2SO4
Masa molar: 142.04 g/mol
Solubilidad en agua: 4.76 g/100 mL (0°C) 42.7 g/100 mL (100°C)
Densidad: 2.664 g/cm³ (anhidro) kg/m³; 1.464 g/cm³ (decahidrato) g/cm³
Punto de fusión: 1157,15 K (884 °C)
Fórmula molecular HCl
Apariencia líquido incoloro o
levemente amarillo
Densidad 1190 (solución 37 %)
1160 solución 32 %
1120 solución 25 % kg/m³; 1,12 g/cm³
Masa molar 36.458 g/mol
DEPARTAMENTO DE FARMACIA INDUSTRIAL Página 6 de 7
UNIVERSIDAD NACIONAL
AUTONOMA DE NICARAGUA,
PRODUCTOS NATURALES
FACULTAD DE CCQQ,
FARMACIA
Punto de fusión 247 K (−26 °C)
Punto de ebullición 321 K (48 °C)
Viscosidad 2,259
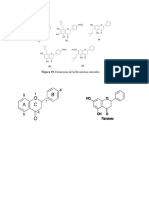
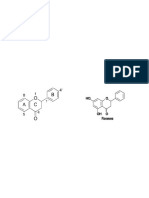
Formula Molecular: C8H10N4O2
Peso Molecular: 194,19
Registro
El instructor de cada grupo, registrará en formato Excel la nota correspondiente del informe a
cada estudiante asignado. El informe se entregara por vía electrónica dos días hábiles después
de haber finalizado el laboratorio teniendo como hora límite 6 pm, en caso contrario este
informe no será revisado.
DEPARTAMENTO DE FARMACIA INDUSTRIAL Página 7 de 7
También podría gustarte
- Taller Extracción Liquido - LiquidoDocumento7 páginasTaller Extracción Liquido - LiquidoAndrea Rojas VargasAún no hay calificaciones
- Propuesta de Control de Calidad de CafeinaDocumento6 páginasPropuesta de Control de Calidad de CafeinaDante FlowersAún no hay calificaciones
- CAFEINADocumento10 páginasCAFEINAKarem LuisAún no hay calificaciones
- GuiaDocumento11 páginasGuiaFátima LucíaAún no hay calificaciones
- Práctica 2. Purificacion de Cafeína-24Documento11 páginasPráctica 2. Purificacion de Cafeína-24Carolina Quiroz NájeraAún no hay calificaciones
- Extracción de CafeínaDocumento5 páginasExtracción de CafeínaClaudioPachecoAún no hay calificaciones
- Avance Proyecto CristalizaciónDocumento4 páginasAvance Proyecto CristalizaciónAna RosaAún no hay calificaciones
- PROYECTO de Laboratorio de Productos NaturalesDocumento9 páginasPROYECTO de Laboratorio de Productos NaturalesJhojan SeguraAún no hay calificaciones
- 5 Laboratorio #5 Determinación de Cafeína en Bebidas GaseosasDocumento24 páginas5 Laboratorio #5 Determinación de Cafeína en Bebidas GaseosasXimena Merma SAún no hay calificaciones
- Informe Procedimiento Cafeina LCBIIIDocumento11 páginasInforme Procedimiento Cafeina LCBIIIMancilla García Bruno AndrésAún no hay calificaciones
- FinalDocumento8 páginasFinalvaleska ceaAún no hay calificaciones
- Cafeina HPLC Corregido - Odt PDFDocumento9 páginasCafeina HPLC Corregido - Odt PDFXabier EgiluzAún no hay calificaciones
- Pract 4 - Extracción de Cafeina. Lavado - CruzDocumento6 páginasPract 4 - Extracción de Cafeina. Lavado - CruzMaria SaldarriagaAún no hay calificaciones
- Informe 4 - Análisis Instrumental - Daleska CanalesDocumento7 páginasInforme 4 - Análisis Instrumental - Daleska CanalesDaleska C. GalarzaAún no hay calificaciones
- Extraccion de CafeinaDocumento4 páginasExtraccion de CafeinaAndres VasquezAún no hay calificaciones
- Extraccion de Cafeina AnalisisDocumento7 páginasExtraccion de Cafeina AnalisisMaríaAún no hay calificaciones
- AchachairúDocumento6 páginasAchachairúEmanuel Ortega VidalAún no hay calificaciones
- Determinación de Cafeína en Bebidas EnergizantesDocumento4 páginasDeterminación de Cafeína en Bebidas EnergizantesCarlos Felipe Jaramillo LópezAún no hay calificaciones
- Bioprocesos 23 Oct Part 1Documento4 páginasBioprocesos 23 Oct Part 1Nicolas miovich barredaAún no hay calificaciones
- PRÁCTICA #10 Aislamiento de CafeinaDocumento9 páginasPRÁCTICA #10 Aislamiento de CafeinaJean Pierre Cirilo SosaAún no hay calificaciones
- Extraccion LiquidoDocumento3 páginasExtraccion LiquidoGabriel LeonAún no hay calificaciones
- Determinacion de CafeinaDocumento11 páginasDeterminacion de CafeinamariaAún no hay calificaciones
- PRÁCTICA 3 AnaliticaDocumento8 páginasPRÁCTICA 3 AnaliticaCésar PorrasAún no hay calificaciones
- Determinación de Cafeína en Red Bull. Patricia Pieters Informe Nro. 2 Lab de CSC IIIDocumento27 páginasDeterminación de Cafeína en Red Bull. Patricia Pieters Informe Nro. 2 Lab de CSC IIINohely LinaresAún no hay calificaciones
- Determinación de Catequinas en Te Verde Por HPLCDocumento4 páginasDeterminación de Catequinas en Te Verde Por HPLCAnonymous pCIauPOGAún no hay calificaciones
- CafeinaDocumento6 páginasCafeinaRoger Chavez Mendez100% (1)
- Juan Velásquez-164004542 y Ángel Silva-164004538Documento8 páginasJuan Velásquez-164004542 y Ángel Silva-164004538Lukas BurbanoAún no hay calificaciones
- Informe Aislamiento de La Cafeina Del Grano de CafeDocumento6 páginasInforme Aislamiento de La Cafeina Del Grano de Cafemariana mendezAún no hay calificaciones
- Experimento 2 Aislamiento de Purinas Cafeína Química IIDocumento4 páginasExperimento 2 Aislamiento de Purinas Cafeína Química IIgotchalpAún no hay calificaciones
- Trabajo de Evidencias de BioprocesosDocumento13 páginasTrabajo de Evidencias de BioprocesosJesus Osuna TapiaAún no hay calificaciones
- Proyecto CafDocumento5 páginasProyecto CafangelAún no hay calificaciones
- Extracción de La Cafeína de BebidasDocumento15 páginasExtracción de La Cafeína de BebidasHector AriasAún no hay calificaciones
- Practica N°7 - Extraccion de La CafeinaDocumento15 páginasPractica N°7 - Extraccion de La CafeinaLUIS ALBERTO SAAVEDRA DEL CASTILLOAún no hay calificaciones
- Monografia SacarinaDocumento9 páginasMonografia SacarinaEsme HernándezAún no hay calificaciones
- CafeinaDocumento9 páginasCafeinaKarla VTAún no hay calificaciones
- Practica 11Documento4 páginasPractica 11Rob HBAún no hay calificaciones
- 1-Extracción de CafeínaDocumento4 páginas1-Extracción de CafeínaMilagros JaimesAún no hay calificaciones
- Optimización de Néctar de Lactosuero Enriquecido Con Zumo de Naranja y Controlado Con Radiación Ultraviolet1Documento13 páginasOptimización de Néctar de Lactosuero Enriquecido Con Zumo de Naranja y Controlado Con Radiación Ultraviolet1Kevin Yengle PerezAún no hay calificaciones
- Ailsamiento Cafec3adnaDocumento8 páginasAilsamiento Cafec3adnadavid garciaAún no hay calificaciones
- Fuentes Fuentes García - Determinación de Cafeína en Café Mediante Cromatografía Líquida de Alta ...Documento9 páginasFuentes Fuentes García - Determinación de Cafeína en Café Mediante Cromatografía Líquida de Alta ...Arturo PeñablassiAún no hay calificaciones
- Practica 4 - HPLC Analisis InstrumentalDocumento5 páginasPractica 4 - HPLC Analisis Instrumentaljuan camilo ortiz pinzonAún no hay calificaciones
- Informe de HPLCDocumento3 páginasInforme de HPLCKaterine Quimbayo AgredaAún no hay calificaciones
- Determinación de La Concentración de Cafeína en Un Bebida EnergizanteDocumento8 páginasDeterminación de La Concentración de Cafeína en Un Bebida EnergizanteIdaly IdalyAún no hay calificaciones
- P-Final QUIMICA (2) MICHELDocumento11 páginasP-Final QUIMICA (2) MICHELDiana Yuleysi Benavidez RubioAún no hay calificaciones
- NV - Coca ColaDocumento6 páginasNV - Coca ColaBrando Abel VelasquezAún no hay calificaciones
- Informe Extraccion de CafeinaDocumento6 páginasInforme Extraccion de CafeinaVane Varillas100% (2)
- Informe 16 Completo BioagroDocumento8 páginasInforme 16 Completo BioagroDENNIS RICOPA VASQUEZAún no hay calificaciones
- Cafeina de La Coca ColaDocumento3 páginasCafeina de La Coca ColaDavid SaavedraAún no hay calificaciones
- Determinación de La Concentración de Cafeína en Un Bebida EnergizanteDocumento8 páginasDeterminación de La Concentración de Cafeína en Un Bebida EnergizanteIdaly IdalyAún no hay calificaciones
- Guia de Laboratorio AzucaresDocumento39 páginasGuia de Laboratorio AzucaresAlejandro Saravia AlcócerAún no hay calificaciones
- Determinación de Fructuosa y Xilosa en Mucilago de Café Por HPLCDocumento8 páginasDeterminación de Fructuosa y Xilosa en Mucilago de Café Por HPLCLuz Ena BeleñoAún no hay calificaciones
- Guia Practica CafeinaDocumento5 páginasGuia Practica CafeinaKml GaezAún no hay calificaciones
- GUIAnANALISISnDEnPRODUCTOSnCARNICOSnn1n 67636696e809791Documento6 páginasGUIAnANALISISnDEnPRODUCTOSnCARNICOSnn1n 67636696e809791antonio perezAún no hay calificaciones
- Informe Analisis InstrumentalDocumento18 páginasInforme Analisis InstrumentalCatalina Andrea Constanzo SánchezAún no hay calificaciones
- Extraccion Alcaloides Diferentes Fuentes PDFDocumento4 páginasExtraccion Alcaloides Diferentes Fuentes PDFJULIÿN DAVID RUBIO GÿMEZAún no hay calificaciones
- La Súper Enciclopedia Del Café Tomo 3 De 7: Tips para preparar y conseguir el mejor café: Todo sobre el café, #3De EverandLa Súper Enciclopedia Del Café Tomo 3 De 7: Tips para preparar y conseguir el mejor café: Todo sobre el café, #3Calificación: 4.5 de 5 estrellas4.5/5 (3)
- Elaboración y presentación de postres de cocina. HOTR0509De EverandElaboración y presentación de postres de cocina. HOTR0509Aún no hay calificaciones
- Reutilización de aguas residuales en la industria azucarera y AlcoholeraDe EverandReutilización de aguas residuales en la industria azucarera y AlcoholeraAún no hay calificaciones
- Elaboración de leches para el consumo. INAE0209De EverandElaboración de leches para el consumo. INAE0209Aún no hay calificaciones
- Priducto Naturales3Documento9 páginasPriducto Naturales3Fátima LucíaAún no hay calificaciones
- Producto 1Documento7 páginasProducto 1Fátima LucíaAún no hay calificaciones
- Estructura en Word de ComputDocumento2 páginasEstructura en Word de ComputFátima LucíaAún no hay calificaciones
- ESTRUCTURADocumento2 páginasESTRUCTURAFátima LucíaAún no hay calificaciones
- Seminario 2Documento2 páginasSeminario 2Fátima LucíaAún no hay calificaciones
- GerenciaDocumento20 páginasGerenciaFátima LucíaAún no hay calificaciones
- Universidad Nacional Autónoma de NicaraguaDocumento3 páginasUniversidad Nacional Autónoma de NicaraguaFátima LucíaAún no hay calificaciones
- Medicinal BaDocumento8 páginasMedicinal BaFátima LucíaAún no hay calificaciones
- XΣχ1 PRO-N2Documento6 páginasXΣχ1 PRO-N2Fátima LucíaAún no hay calificaciones
- DixonDocumento8 páginasDixonFátima LucíaAún no hay calificaciones
- Guia de Econometria 1Documento8 páginasGuia de Econometria 1Fátima LucíaAún no hay calificaciones
- Medicinal BaDocumento8 páginasMedicinal BaFátima LucíaAún no hay calificaciones
- Trabajo de Investigación Documental OFF - PrototipoDocumento8 páginasTrabajo de Investigación Documental OFF - PrototipoFátima LucíaAún no hay calificaciones
- Conclusión 22Documento2 páginasConclusión 22Fátima LucíaAún no hay calificaciones
- Universidad Nacional Autónoma de NicaraguaDocumento3 páginasUniversidad Nacional Autónoma de NicaraguaFátima LucíaAún no hay calificaciones
- Noveno Educacion Financiera PDFDocumento2 páginasNoveno Educacion Financiera PDFEdgar MorenoAún no hay calificaciones
- Guia para Higiene de Genitales Masculino y FemeninoDocumento6 páginasGuia para Higiene de Genitales Masculino y Femeninoelizabeth suarez belloAún no hay calificaciones
- Guia Rápida de La NOM-009-STPS-1999Documento14 páginasGuia Rápida de La NOM-009-STPS-1999Carlos Martinez100% (1)
- Carta de Consentimiento MasajeDocumento4 páginasCarta de Consentimiento MasajeNoemi GuzmanAún no hay calificaciones
- Desarrollo Humano Semana 4Documento11 páginasDesarrollo Humano Semana 4valerinmAún no hay calificaciones
- Trastorno Del Desarrollo IntelectualDocumento8 páginasTrastorno Del Desarrollo IntelectualjmonscaAún no hay calificaciones
- Qué Son Los FrijolesDocumento3 páginasQué Son Los FrijolesJhordy Jhoyi Ruiz PioleAún no hay calificaciones
- Areas de Intervencion Del TS CompletoDocumento14 páginasAreas de Intervencion Del TS CompletoMaru Cdo100% (4)
- Lección 1Documento2 páginasLección 1William CanencioAún no hay calificaciones
- Pelvis MasculinaDocumento233 páginasPelvis MasculinaMaria Freire SaltosAún no hay calificaciones
- Cuestionario EpidemiologiaDocumento14 páginasCuestionario EpidemiologiaALISSON ALEJANDRA SARMIENTOAún no hay calificaciones
- E-Book - Selección de EjerciciciosDocumento20 páginasE-Book - Selección de EjerciciciosFco Raul Milla SanchezAún no hay calificaciones
- Guion CondicionamientosDocumento2 páginasGuion Condicionamientosmaria rojasAún no hay calificaciones
- Como Gestionar La FrustraciónDocumento4 páginasComo Gestionar La FrustraciónMaría HerreraAún no hay calificaciones
- Prospecto PropessDocumento2 páginasProspecto PropessMario MuñozAún no hay calificaciones
- Cancer de MamaDocumento2 páginasCancer de MamaFernanda PerezAún no hay calificaciones
- Respiracion VegetalDocumento7 páginasRespiracion VegetalCesarManuelCastilloCamachoAún no hay calificaciones
- La Bi Los CaídosDocumento76 páginasLa Bi Los CaídosFrederich GucciAún no hay calificaciones
- DP Lid Rate 1 PDFDocumento3 páginasDP Lid Rate 1 PDFVioleta Rodriguez GarciaAún no hay calificaciones
- Gestion Coka CalvoDocumento56 páginasGestion Coka CalvoAri León ContrerasAún no hay calificaciones
- Agua Embotellada Esta Contaminada Con Microplasticos PDFDocumento12 páginasAgua Embotellada Esta Contaminada Con Microplasticos PDFsalvabarbosaAún no hay calificaciones
- Participación - Open Class Semana 1Documento3 páginasParticipación - Open Class Semana 1Samantha InicialAún no hay calificaciones
- Scribd Vpdfs Com Revista de La Sociedad Espanola de OrtodonciaDocumento98 páginasScribd Vpdfs Com Revista de La Sociedad Espanola de OrtodonciaKizzy SarriaAún no hay calificaciones
- Munual Lopardo PDFDocumento358 páginasMunual Lopardo PDFYanet FrancoAún no hay calificaciones
- Caso Clinico R1Documento17 páginasCaso Clinico R1Jhonny AlvarezAún no hay calificaciones
- Valoracion y Anamnesis Luz Marina OsorioDocumento9 páginasValoracion y Anamnesis Luz Marina OsorioValentina Diaz BarriosAún no hay calificaciones
- Ministerio de Salud y Deportes de Bolivia - Ministerio de Salud - BoliviaDocumento4 páginasMinisterio de Salud y Deportes de Bolivia - Ministerio de Salud - Boliviasanto p hAún no hay calificaciones
- Focusing de Gendlin Descrito Por GreenbergDocumento5 páginasFocusing de Gendlin Descrito Por GreenbergJorge CamusAún no hay calificaciones
- Hemorragia ObstetricaDocumento7 páginasHemorragia ObstetricaMonica HernandezAún no hay calificaciones
- Pobreza y Sus Determinantes (Trabajo)Documento3 páginasPobreza y Sus Determinantes (Trabajo)Altiplano AndinoAún no hay calificaciones