Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Taller
Cargado por
Aldair Orozco UlloaTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Taller
Cargado por
Aldair Orozco UlloaCopyright:
Formatos disponibles
Área de Química
Orgánica
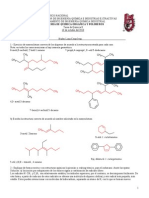
1. Dibuje las fórmulas estructurales de los siguientes alquenos:
a. trans-2-Metil-3-hexeno k. 3-Ciclopropil-1-propeno
b. 2-Metil-2-hexeno l. Ciclopropileteno
c. 2-Metil-1-buteno m. 2-Cloropropeno
d. 3-Etil-3-metil-1-penteno n. Tetracloroetileno
e. 2,3-Dimetil-2-buteno o. 1-Clorociclohexeno
f. cis-2-Pentene p. 6-Isopropil-2,3-dimetilnonano
g. (Z)-1-Cloropropeno q. 4-tert-butil-3-metilheptano
h. 3-Metilciclohexeno r. 4-Isobutil-1,1-dimetilciclohexano
i. 1-Isopropil-4-metilciclohexeno s. sec-Butilcicloheptano
j. (E)-2,6-Dimetil-2,6-octadieno t. 10-(1-Metilpentil)pentacosano
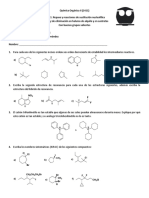
2. Escriba fórmulas estructurales para cada uno de los siguientes compuestos:
3. Asigne la configuración E o Z de estos ácidos dicarboxílicos.
4. ¿Qué alqueno existe como par de isómeros cis, trans? Para cada uno, dibuje los isómeros trans.
5. Existen cuatro estereoisómeros para 3-penten-2-ol
a. Explique cómo pueden existir estos cuatro estereoisómeros.
b. Dibuje los estereoisómeros que tienen configuración E alrededor del doble enlace carbono-carbono y la
configuración R alrededor del centro quiral.
6. Discuta cuál de los dos alcoholes siguientes, 2-metil-2-pentanol y 2-metil-3-pentanol, se deshidratará con mayor
facilidad por tratamiento con ácidos y proponga estructuras para los productos, indicando cual es el mayoritario en
cada caso. Explique mediante mecanismos de reacción la formación de cada compuesto.
7. Cuando 1-cloro-2-buteno reacciona en acetona acuosa del 50% se obtiene una mezcla de dos alcoholes, como lo
muestra la siguiente ecuación:
La reacción transcurre a través de un catión estabilizado por resonancia llamado catión alilo. ¿Por qué es tan estable?
¿Cuál es su estructura? Escribe el mecanismo detallado de esta transformación.
8. Deduzca la estructura del compuesto de fórmula molecular C7H13Br que da cada alqueno como producto exclusivo
de eliminación E2.
1 Profesor Dency José Pacheco Alquenos
Área de Química
Orgánica
9. El cloruro de mentilo y el cloruro de neomentilo tienen las estructuras mostradas. Uno de estos estereoisómeros
experimenta eliminación por tratamiento con etóxido de sodio en etanol mucho más rápidamente que el otro. ¿Cuál
de los dos reacciona más rápido? ¿Por qué?
10. El compuesto A (C4H10) forma dos diferentes monocloruros por cloración fotoquímica. El Tratamiento de estos dos
monocloruros con tert-butóxido de potasio en dimetil sulfóxido produce el mismo alqueno (C4H8) como único
producto. Deducir la estructura del compuesto A, la de los dos monocloruros y la del alqueno B.
11. Un compuesto X, C5H9Br, de estructura desconocida, no reacciona con bromo, ni con KMnO4 diluido. Cuando se
trata X con tert-butóxido potásico, da un único producto, Y, C5H8. Al contrario que X, Y sí decolora el bromo, y
cambia una disolución de permanganato de púrpura a marrón. Ozonólisis-reducción de Y da Z, C5H8O2. Proponga
estructuras coherentes de X, Y y Z.
12. Dibuje fórmulas estructurales de las carbocationes isoméricos formados en el tratamiento de cada alqueno con HCl.
Marque cada carbocatiòn como 1º, 2º o 3º y establezca cuál carbocatiòn se forma más rápidamente.
13. Escoge el alqueno de cada pareja que reaccione màs rápido con HI y explique las bases de su predicción. Dibuje la
fòrmula estructural del producto mayoritario formado en cada caso.
14. Prediga el(los) producto(s) orgánico(s) de la reacción de 2-buteno con cada uno de los siguientes reactivos
a. H2O (H2SO4) c. Br2 e. Cl2
b. Br2 en agua d. HI f. Cl2 en agua
15. Dibuje la fórmula estructural de un alqueno que experimente hidratación catalizada por ácido para dar cada alcohol
como producto mayoritario (más de un alqueno puede dar cada alcohol como producto mayoritario)
a. 3-hexanol c. 1-metilciclobutanol
b. 2-metil-2-butanol d. 2-propanol
16. Empareje los siguientes alquenos con el calor apropiado de hidrogenación
Calores de hidrogenaciòn en kJ/mol (kcal/mol): 151 (36,2), 122 (29,3), 114 (27,3), 111 (26,5), 105 (25,1)
17. Una mezcla de tres alquenos (a, B y C) se obtuvo por deshidratación de 1,2-dimetilciclohexanol. La composición de
la mezcla fue A (3%), B (31%) y C (66%). Hidrogenación catalítica de A, B o C dio 1,2-dimetilciclohexano. Los tres
alquenos pueden ser equilibrados calentándolo con ácido sulfúrico para dar una mezcla que contiene A (0%), B (15%)
y C (85%). Identifique los compuestos A, B y C.
18. La reacción de 3,3-dimetil-1-buteno con yoduro de hidrógeno (HI) produce dos compuestos A y B, los cuales tienen
fórmula molecular C6H13I, en relación A:B = 90:10. El compuesto A, al ser calentado con KOH en 2-propanol, produjo
únicamente 3,3-dimetil-1-buteno. El compuesto B experimenta eliminación bajo estas condiciones para dar 2,3-
dimetil-2-buteno como producto mayoritario. Prediga la estructura de los compuestos A y B, y escriba un mecanismo
razonable para la formación de cada uno de ellos.
2 Profesor Dency José Pacheco Alquenos
Área de Química
Orgánica
19. La siguiente reacción fue realizada como parte de un programa de investigación patrocinado por National Institute
of Health de USA para desarrollar agentes terapéuticos para el tratamiento de la adicción a la cocaína. Teniendo en
cuenta lo que sabe acerca de las reacciones de halógenos con alquenos, proponga un mecanismo para este proceso.
20. Cada una de las siguientes reacciones ha sido reportada en la literatura química. Dé la estructura del producto orgánico
principal en cada caso
21. Dibuje la fórmula estructural del alqueno indicado por la fórmula molecular que produce el compuesto mostrado
como el producto mayoritario (más de un alqueno puede dar el mismo compuesto como producto mayoritario)
22. Dibuje la fórmula estructural del cicloalqueno con la fórmula molecular C6H10 que reacciona con Cl2 para producir
cada compuesto
23. Terpina, preparada comercialmente por la hidratación ácido-catalizada de limoneno, se usa medicinalmente como
expectorante
a. Proponga una formula estructural para la terpina y un mecanismo para su formación
b. Cuántos isómeros cis-trans son posible para la fórmula estructural que propone
24. Dibuje la fórmula estructural del alcohol que se forma tratando cada alqueno con borano en tetrahidrofurano (THF)
seguido por H2O2 en NaOH acuoso y especifique la estereoquímica donde sea apropiado
25. Cada carbocatión mostrado es capaz de rearreglar a un carbocatión más estable. Limitándonos a un desplazamiento
1,2, sugiera la estructura para el carbocatiòn después del rearreglo.
3 Profesor Dency José Pacheco Alquenos
Área de Química
Orgánica
26. Dibuje la fórmula estructural del alqueno formado por el tratamiento de cada haluro de alquilo con etóxido de sodio
en etanol. Asuma que la eliminación ocurre por un mecanismo E2.
27. Dibuje la fórmula estructural de todos los cloroalcanos que experimentan deshidrohalogenación cuando se tratan con
KOH para dar cada alqueno como producto mayoritario. En algunos, solo un cloroalcano da el producto deseado
como producto principal. En otros, pueden ser dos cloroalcanos.
28. El bromo se adiciona a cis- y trans-2-buteno para dar diferentes diastereoisómeros de 2,3-dibromobutano. ¿Qué dice
esto acerca del modo de adición de bromo a estos alquenos?
29. Los diastereoisómeros I y II de 3-bromo-3,4-dimetilhexano. Al tratarlo con etóxido de sodio en etanol, cada uno
produce 3,4-dimetil-3-hexeno como producto principal. Un diastereoisómero da el alqueno E, y el otro da el alqueno
Z. ¿Cuál diastereoisómero da cuál alqueno? Explique la estereoselectividad de cada β-eliminación.
30. Escriba los productos de la siguiente secuencia de reacciones.
4 Profesor Dency José Pacheco Alquenos
También podría gustarte
- Examen Parcial de Química Orgánica UPCHDocumento6 páginasExamen Parcial de Química Orgánica UPCHpruebascribd0% (1)
- Guia de Estudio 2 PDFDocumento5 páginasGuia de Estudio 2 PDFLuisa Rojas100% (1)
- Actividad AlquenosDocumento5 páginasActividad AlquenosKmilo MurielAún no hay calificaciones
- Taller No.6A Alquenos Eliminaciones Sept.2021)Documento9 páginasTaller No.6A Alquenos Eliminaciones Sept.2021)ALEJANDRA MARULANDA GALLEGOAún no hay calificaciones
- Radicales AlquílicosDocumento8 páginasRadicales AlquílicosKiimPossible92% (12)
- Taller - 6 Alquenos Alquinos 2016 1Documento2 páginasTaller - 6 Alquenos Alquinos 2016 1York De Moya LlanosAún no hay calificaciones
- Taller 3-Alquenos-2017-2Documento4 páginasTaller 3-Alquenos-2017-2Aldair Orozco UlloaAún no hay calificaciones
- Seminario de Hidrocarburos IDocumento3 páginasSeminario de Hidrocarburos Itere_figueroaAún no hay calificaciones
- Cuadenillo de Problemas - Quimica Organica - G.bioquimicaDocumento8 páginasCuadenillo de Problemas - Quimica Organica - G.bioquimicaJessM84Aún no hay calificaciones
- Ejercicios de AlcanosDocumento3 páginasEjercicios de AlcanosNyFa RozenAún no hay calificaciones
- Problemas de AlquenosDocumento2 páginasProblemas de Alquenosallan100% (1)
- Guia Ejercicios Quimica OrganicaDocumento15 páginasGuia Ejercicios Quimica OrganicaBarbara DumasAún no hay calificaciones
- Practica Tercer Parcial-Grupo ADocumento3 páginasPractica Tercer Parcial-Grupo AEfrain MiguelAún no hay calificaciones
- Ejercicios de AlcanosDocumento3 páginasEjercicios de AlcanosNyFa RozenAún no hay calificaciones
- Ejercicios Alcanos Alquenos AlquinosDocumento18 páginasEjercicios Alcanos Alquenos AlquinosSebastian Duque MoralesAún no hay calificaciones
- Serie 2. Alquenos y AlquinosDocumento6 páginasSerie 2. Alquenos y AlquinosCynthia MarcelinoAún no hay calificaciones
- Taller Unidad Alquenos y Alquinos (2020) PDFDocumento8 páginasTaller Unidad Alquenos y Alquinos (2020) PDFMaria Isabella Trochez PumalpaAún no hay calificaciones
- Qoii T5u2Documento3 páginasQoii T5u2Daniela San Juan MoraAún no hay calificaciones
- Guia N°7 - AlquinosDocumento2 páginasGuia N°7 - AlquinosNazareno LorenzattoAún no hay calificaciones
- Taller HidrocarburosDocumento4 páginasTaller HidrocarburosMaria Camila AlvarezAún no hay calificaciones
- Taller UA5 (Acidos Carboxilicos y Sus Derivados) - 2023)Documento5 páginasTaller UA5 (Acidos Carboxilicos y Sus Derivados) - 2023)SARAY NICOLE VILLADA MARINAún no hay calificaciones
- Problemas de Química OrgánicaDocumento6 páginasProblemas de Química OrgánicaThomas Ramirez ZumaránAún no hay calificaciones
- Guia 2 Qmc200Documento6 páginasGuia 2 Qmc200Miriam Llanque CallisayaAún no hay calificaciones
- PruebaDocumento35 páginasPruebaDarlenys ReyesAún no hay calificaciones
- Seminario N°5 - Alquenos y Alquinos - 1C - 2023Documento4 páginasSeminario N°5 - Alquenos y Alquinos - 1C - 2023Paola VargasAún no hay calificaciones
- Practica No 1 Quimica OrganicaDocumento10 páginasPractica No 1 Quimica OrganicaArmenio Silva ManzanedaAún no hay calificaciones
- Quimica de Hidrocarburos 2013 SEgundo AprcialDocumento13 páginasQuimica de Hidrocarburos 2013 SEgundo AprcialCINL123Aún no hay calificaciones
- Taller Alquenos & AlquinosDocumento8 páginasTaller Alquenos & AlquinosJ Mora GañanAún no hay calificaciones
- GuiaTPA - Ing Alimentos - 2021 - Parte 1Documento16 páginasGuiaTPA - Ing Alimentos - 2021 - Parte 1Alejandro FernandezAún no hay calificaciones
- Taller Unidad IV-Alquenos y Alquinos (2021)Documento6 páginasTaller Unidad IV-Alquenos y Alquinos (2021)OSCAR DANIEL ARREDONDO GAÑANAún no hay calificaciones
- Capitulo VDocumento15 páginasCapitulo VStella AguirreAún no hay calificaciones
- Tarea 5 OPCIONALDocumento6 páginasTarea 5 OPCIONALValeria Aragon CerqueraAún no hay calificaciones
- Practica 2do Parcial OrganicaDocumento4 páginasPractica 2do Parcial OrganicaNatalia Jauregui GumucioAún no hay calificaciones
- Guía N°11Documento9 páginasGuía N°11Ariana SanchezAún no hay calificaciones
- Actividad AlquenosDocumento2 páginasActividad AlquenosKmilo MurielAún no hay calificaciones
- Guía de Ejercicios Capítulo VIDocumento31 páginasGuía de Ejercicios Capítulo VIcristianvaras3Aún no hay calificaciones
- Serie 1 Organica II Qfbs 32371Documento11 páginasSerie 1 Organica II Qfbs 32371Javier QuezadaAún no hay calificaciones
- Unidad III. Alcanos, Estudio de Reacciones, Metodos de Obtencion y Reacciones Tipicas.Documento4 páginasUnidad III. Alcanos, Estudio de Reacciones, Metodos de Obtencion y Reacciones Tipicas.Yulieth Elizabeth Carrasquero SeniorAún no hay calificaciones
- Taller Haluros de AlquiloDocumento4 páginasTaller Haluros de AlquiloDaniela RomeroAún no hay calificaciones
- Problemas de Alcoholes y Eteres 2011Documento2 páginasProblemas de Alcoholes y Eteres 2011Pablo Gutierrez100% (1)
- Preguntas Extra para Ejercitación 1er. Parcial-Com. 2053-2014Documento2 páginasPreguntas Extra para Ejercitación 1er. Parcial-Com. 2053-2014Didier DetchemendyAún no hay calificaciones
- Guía de ProblemasDocumento26 páginasGuía de ProblemasXiomara Rey0% (1)
- Taller Sem2-11Documento5 páginasTaller Sem2-11David BeltranAún no hay calificaciones
- Enolatos 2Documento9 páginasEnolatos 2DANIELA ALARCÓN SILVAAún no hay calificaciones
- Ejercicio de Preparación de Examen .Quim Organica Parte A Sin Respuestas PDFDocumento7 páginasEjercicio de Preparación de Examen .Quim Organica Parte A Sin Respuestas PDFMarisol Gonsalez GarzonAún no hay calificaciones
- Señala El Nombre Correcto para Estos CompuestosDocumento20 páginasSeñala El Nombre Correcto para Estos Compuestosteresasf75% (4)
- Taller Haluros de AlquiloDocumento4 páginasTaller Haluros de AlquiloDaniela Romero0% (1)
- Taller No5 2018-IDocumento3 páginasTaller No5 2018-IKaren Izaguirre0% (2)
- Ejercicios Quimica OrganicaDocumento10 páginasEjercicios Quimica OrganicaFederico OrueAún no hay calificaciones
- Ejercicios U3 PDFDocumento1 páginaEjercicios U3 PDFDante KillerAún no hay calificaciones
- TEÓR-PRÁC UNIDAD 2 VetDocumento3 páginasTEÓR-PRÁC UNIDAD 2 VetShofibriel Cardozo de PucheroAún no hay calificaciones
- Acfrogcghfwjlaa0vj Wp0qdfl63ovqokvj30oj5yo2dlgvviprynflvktu69izkpack 3tkykisq98qdvhg3hji1d2o3uyfpp8glqu8yxvk0qbug5 Wn0y5rjuijvmnk2fz2wxnhg Ctuhju6hDocumento4 páginasAcfrogcghfwjlaa0vj Wp0qdfl63ovqokvj30oj5yo2dlgvviprynflvktu69izkpack 3tkykisq98qdvhg3hji1d2o3uyfpp8glqu8yxvk0qbug5 Wn0y5rjuijvmnk2fz2wxnhg Ctuhju6hyairAún no hay calificaciones
- Ejercicios PropuestosDocumento3 páginasEjercicios PropuestosMarcial Fuentes EstradaAún no hay calificaciones
- Ejercicios Temas 13 y 14-Ác Carboxílicos y Der-2021-22Documento9 páginasEjercicios Temas 13 y 14-Ác Carboxílicos y Der-2021-22andreaAún no hay calificaciones
- Taller de Reacciones de AlquenosDocumento3 páginasTaller de Reacciones de Alquenoselfa0% (1)
- PROBLEMASDEQUIMICAORGÁNICADocumento15 páginasPROBLEMASDEQUIMICAORGÁNICAIvan OsorioAún no hay calificaciones
- Boletín Quimica Organica 22-23Documento6 páginasBoletín Quimica Organica 22-23Viqui R.Aún no hay calificaciones
- Guia de Problemas 2021Documento27 páginasGuia de Problemas 2021Fran IgarzabalAún no hay calificaciones
- E - Diagramas - de - Latimer1 PDFDocumento9 páginasE - Diagramas - de - Latimer1 PDFFelipe Sagitarius0% (1)
- 8 FormacioncomplejosDocumento10 páginas8 FormacioncomplejosCristian PaulsenAún no hay calificaciones
- Espectrometria VibracionalDocumento13 páginasEspectrometria VibracionalAndres FragosoAún no hay calificaciones
- 6tema6 - Espectroscopia ElectronicaDocumento47 páginas6tema6 - Espectroscopia ElectronicaMargaret Solano RomaniAún no hay calificaciones
- Teoria Simetria2 PDFDocumento10 páginasTeoria Simetria2 PDFOrlando GutiérrezAún no hay calificaciones
- Diagramas PourbaixDocumento6 páginasDiagramas PourbaixFritos De MaízAún no hay calificaciones
- Celdas Combustible HidrogenoDocumento4 páginasCeldas Combustible HidrogenoheracliomcAún no hay calificaciones
- Simetria Inorganica PDFDocumento14 páginasSimetria Inorganica PDFMarcelitha DimateAún no hay calificaciones
- Tema1LQ Inorgànica IIDocumento51 páginasTema1LQ Inorgànica IIIza BorgesAún no hay calificaciones
- Tema 3Documento11 páginasTema 3yzavelitaAún no hay calificaciones
- Teoría de Grupos Aplicada A La SimetríaDocumento8 páginasTeoría de Grupos Aplicada A La SimetríaSebastian Simpson ArmstrongAún no hay calificaciones
- Teoria Coordinacion21 PDFDocumento12 páginasTeoria Coordinacion21 PDFalmudenaAún no hay calificaciones
- QCE GradoQuimica Apuntes Tema14Documento41 páginasQCE GradoQuimica Apuntes Tema14Aldair Orozco UlloaAún no hay calificaciones
- 3 AromáticosDocumento21 páginas3 AromáticosAldair Orozco UlloaAún no hay calificaciones
- Analisis Retrosintético I Diapos Clase PDFDocumento18 páginasAnalisis Retrosintético I Diapos Clase PDFAldair Orozco UlloaAún no hay calificaciones
- Tabla PerodicaDocumento27 páginasTabla PerodicaAlex Ch GonzalesAún no hay calificaciones
- Grupos Protectores en Química OrgánicaDocumento40 páginasGrupos Protectores en Química Orgánicafernandopessoa25Aún no hay calificaciones
- Condensacion AldoholicaDocumento18 páginasCondensacion AldoholicaAldair Orozco UlloaAún no hay calificaciones
- ELECTROQUÍMICADocumento3 páginasELECTROQUÍMICAAldair Orozco UlloaAún no hay calificaciones
- Claisen Michael Knoevenagel Mannich Wittig EtcDocumento43 páginasClaisen Michael Knoevenagel Mannich Wittig EtcKevinVivarezAún no hay calificaciones
- Nomenclatura Organica PDFDocumento105 páginasNomenclatura Organica PDFCarlos Correa DefazAún no hay calificaciones
- Análisis Retrosintético IDocumento28 páginasAnálisis Retrosintético IEsther IsabelAún no hay calificaciones
- Examen Electroquímica DescargadoDocumento14 páginasExamen Electroquímica DescargadoAldair Orozco UlloaAún no hay calificaciones
- 5886 13539 1 PBDocumento7 páginas5886 13539 1 PBAldair Orozco UlloaAún no hay calificaciones
- Como Se Produce El BiodieselDocumento5 páginasComo Se Produce El BiodieselAldair Orozco UlloaAún no hay calificaciones
- QUÍMICA DE LA COORDINACION (Espectroscopia)Documento30 páginasQUÍMICA DE LA COORDINACION (Espectroscopia)Aldair Orozco UlloaAún no hay calificaciones
- Untitled DiagramDocumento2 páginasUntitled DiagramAldair Orozco UlloaAún no hay calificaciones
- CabelloDocumento17 páginasCabelloAldair Orozco UlloaAún no hay calificaciones
- Fermentacion LacticaDocumento4 páginasFermentacion LacticaKelly CruzAún no hay calificaciones
- TEMA 2. Proteínas. 1era Parte. Aa, Enlace Peptidico.Documento18 páginasTEMA 2. Proteínas. 1era Parte. Aa, Enlace Peptidico.Daniela Rengifo YendisAún no hay calificaciones
- Ejercicios EstereoisomeriaDocumento1 páginaEjercicios EstereoisomeriaJoakoo De Pablo PerezAún no hay calificaciones
- Taller 5carbohidratosDocumento6 páginasTaller 5carbohidratosDaniel Felipe CañonAún no hay calificaciones
- U1 Diapo 2021 PDFDocumento117 páginasU1 Diapo 2021 PDFFacundo Nahuel Palazzo CabanaAún no hay calificaciones
- CAPITULO 2.qmcorDocumento18 páginasCAPITULO 2.qmcorAgustín SilesAún no hay calificaciones
- JUARISTI Introduccion A La EstereoquimicaDocumento37 páginasJUARISTI Introduccion A La EstereoquimicaJaznine FloresAún no hay calificaciones
- Nomenclatura Cahn-IngoldDocumento3 páginasNomenclatura Cahn-IngoldBujanosAún no hay calificaciones
- Nomenclatura de AlquenosDocumento6 páginasNomenclatura de AlquenosJesus OrtizAún no hay calificaciones
- Quimica OrganicaDocumento11 páginasQuimica OrganicaMauricio Peña PortilloAún no hay calificaciones
- Química Orgánica - Sem-11 - Sesión-11 - 2021-2Documento43 páginasQuímica Orgánica - Sem-11 - Sesión-11 - 2021-2Gonzalo RondanAún no hay calificaciones
- Preguntas 2do Parcial EcologiaDocumento14 páginasPreguntas 2do Parcial EcologiaBarbara GaonaAún no hay calificaciones
- Poder Cariogénico de La Sacarosa. 2018Documento8 páginasPoder Cariogénico de La Sacarosa. 2018isabel stanham herreraAún no hay calificaciones
- Isomeria GeometricaDocumento5 páginasIsomeria GeometricaMariana OlivaresAún no hay calificaciones
- AndreaDocumento10 páginasAndreaJuan FranciaAún no hay calificaciones
- Quimica de La CoordinacionDocumento21 páginasQuimica de La CoordinacionFabian RegaladoAún no hay calificaciones
- Jenny Gomez Tarea 1Documento20 páginasJenny Gomez Tarea 1Vanessa GomezAún no hay calificaciones
- Confe 2 Precursores de MacromoleculasDocumento78 páginasConfe 2 Precursores de MacromoleculasVanilson BorgesAún no hay calificaciones
- CarbohidratosDocumento119 páginasCarbohidratossandihernandezillaAún no hay calificaciones
- Capitulo 5 EstereoquimicaDocumento45 páginasCapitulo 5 EstereoquimicaDoktor transmisionesAún no hay calificaciones
- Guia de Problemas 2013Documento73 páginasGuia de Problemas 2013anon_690638977Aún no hay calificaciones
- Isómeros ConformacionalesDocumento30 páginasIsómeros ConformacionalesGonzalez ScAún no hay calificaciones
- Karp 7a c02 Bases Quimicas VidaDocumento71 páginasKarp 7a c02 Bases Quimicas VidaJoelAún no hay calificaciones
- Práctica 7 Síntesis de Acido FumáricoDocumento3 páginasPráctica 7 Síntesis de Acido FumáricoALPHAROCK AMRAún no hay calificaciones
- ALCANOSDocumento43 páginasALCANOSLeodan Mamani100% (1)
- Cuestionario y Guía de Problemas de Química Del Carbono PDFDocumento6 páginasCuestionario y Guía de Problemas de Química Del Carbono PDFalejandrocousido0% (1)
- Estereoquimica UAM-X 2011 FinalDocumento156 páginasEstereoquimica UAM-X 2011 FinalAngel OsorioAún no hay calificaciones
- EnantiomerosDocumento70 páginasEnantiomerosBELEN BENALCAZARAún no hay calificaciones
- Clase Coordinacion2 FinalDocumento159 páginasClase Coordinacion2 FinalQuintín BuenoAún no hay calificaciones