Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Circulación Renal y Tasa de Filtración Glomerular
Cargado por
Daniela ArellanoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Circulación Renal y Tasa de Filtración Glomerular
Cargado por
Daniela ArellanoCopyright:
Formatos disponibles
Circulación renal y tasa de filtración glomerular
El aporte sanguíneo a los riñones por término medio es el 20% del volumen cardiaco. La sangre entra en
el riñón a través de las arterias renales y pasa a través de varias porciones (interlobar, arcuata,
interlobular) antes de entrar en el glomérulo por la pared capilar, después abandona el glomérulo por las
arteriolas eferentes y entra en los capilares posglomerulares. En la corteza, estos capilares discurren
paralelos a los túbulos contiguos, aunque no necesariamente a los segmentos tubulares del mismo
glomérulo. Además, las porciones de las arteriolas eferentes de los glomérulos yuxtamedulares entran en
la médula y forman los capilares vasa recta. La sangre regresa a la circulación a través de venas similares
en nombre y localización a las arterias.
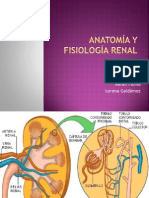
Anatomía y función glomerular
El glomérulo está formado por una madeja de capilares que se interponen entre las arteriolas aferente y
eferente. Cada glomérulo se encuentra rodeado de una cápsula de células epiteliales (cápsula de
Bowman). De este modo, la pared capilar glomerular, a través de la cual debe pasar el filtrado, consta de
tres capas: la célula endotelial fenestrada, la membrana basal glomerular (MBG) y la célula epitelial. Las
células epiteliales están unidas a la MBG mediante sencillos sistemas pediculados. Los poros entre los
procesos pediculados (poros fisurados) están cerrados mediante una fina membrana denominada
diafragma de fisuras, que funciona como una unión adhesiva modificada. La MBG es un producto
fusionado de material de membrana basal producido por las células endoteliales y epiteliales del
glomérulo. Realiza múltiples funciones, incluida la del mantenimiento de la arquitectura glomerular
normal, el anclaje de las células contiguas y además actúa como una barrera para la filtración de
macromoléculas. Consta principalmente de colágeno tipo IV y una variedad de sustancias que ocupan
completamente los espacios entre los cordones, incluyendo la laminina, nidogén, y proteoglicanos
heparán sulfato.
Barrera de filtración y excreción proteica
Una de las principales funciones del glomérulo es permitir la filtración de solutos pequeños (como el
sodio y la urea) y el agua, mientras se restringe el paso de moléculas grandes. Los solutos de mayor
tamaño que la inulina (peso molecular 5.200) se filtran de forma libre. Por otra parte, la mioglobina (peso
molecular 17.000) se filtra menos completamente que la inulina, mientras que la albúmina (peso
molecular 69.000) se filtra sólo en menor grado. La filtración también se limita en los iones o fármacos
que están ligados a la albúmina, como el 40% del calcio circulante. Esta diferencia en la filtración de los
solutos es de gran importancia fisiológica, puesto que la libre filtración del sodio, potasio y urea, por
ejemplo, permite al riñón mantener un estado estable por la excreción de la carga derivada del aporte
dietético y del metabolismo endógeno. Por otra parte, la filtración restringida de las proteínas grandes
evita el problema potencial de un balance de nitrógeno negativo, del desarrollo de hipoalbuminemia y de
la infección debida a la pérdida de gammaglobulinas (IgG).
Sistema de renina-angiotensina
La arteriola aferente de cada glomérulo contiene células especializadas, denominadas células
yuxtaglomerulares. Estas células sintetizan el precursor prorrenina que se divide en la renina, que es la
enzima proteolíticamente activa. La renina activa es almacenada y liberada desde gránulos secretores. Las
células más proximales de las arterias interlobulares pueden también ser reclutadas para la liberación de
renina cuando el estímulo sea prolongado. La hipoperfusión renal, producida por hipotensión o por
depleción de volumen, y el aumento de la actividad simpática son los principales estímulos fisiológicos
para la secreción de renina. La renina inicia una secuencia de pasos que comienzan con la escisión del
decapéptido angiotensina I desde el sustrato de la renina (angiotensinógeno), una α2 globulina producida
en el hígado (y otros órganos, incluyendo el riñón). La angiotensina I después se convierte en el
octapéptido angiotensina II. Esta reacción está catalizada por una enzima denominada enzima
convertidora de la angiotensina (ECA), localizada en el pulmón, la membrana luminal de las células
endoteliales vasculares, el propio glomérulo y otros órganos.
Acciones de la angiotensina II
La angiotensina II tiene dos efectos sistémicos principales: la vasoconstricción sistémica y la retención de
agua y sodio. Estas dos acciones tienden a revertir la hipovolemia o la hipotensión, que generalmente es
la responsable de la estimulación de la secreción de renina. Los efectos de la angiotensina II están
mediados por la unión a los receptores específicos de la angiotensina II: AT1, y AT2. Las acciones
vascular y tubulorrenal están principalmente mediadas por los receptores AT1. Se conocen menos los
efectos de los receptores AT2; pueden contribuir a las acciones tubulares de la angiotensina II y a la
regulación de la proliferación celular en la pared arterial.
Control de la secreción de renina
En los sujetos normales, el principal determinante de la secreción de renina es el aporte de Na+: un aporte
alto expande el volumen extracelular y disminuye la liberación de renina, mientras que un aporte bajo (o
pérdida de fluidos desde cualquier punto) produce una reducción del volumen extracelular y la
estimulación de la secreción de renina. Los aumentos bruscos en la secreción de renina, como en la
depleción de volumen, reflejan fundamentalmente la liberación de renina preformada desde los gránulos
secretores. Los estímulos más crónicos producen un aumento de síntesis de nuevas prorrenina y renina.
Los cambios asociados a la producción de angiotensina II y aldosterona inducida por la renina permiten
entonces al Na+ ser excretado con la expansión de volumen retenido con la depleción de volumen. La
angiotensina II producida dentro del riñón probablemente desempeña un papel de cooperador en esta
respuesta, como demuestra el aumento del RNAm, tanto de la renina como del sustrato de angiotensina,
en la corteza renal que sigue a una dieta baja en sodio. Estos cambios en el volumen se aprecian
fundamentalmente en tres puntos y producen la activación de efectores que controlan la secreción de
renina. (1) barorreceptores (o receptores de distensión) en la pared de la arteriola aferente; (2) los
barorreceptores cardiacos y arteriales, que regulan la actividad neural simpática y el nivel de
catecolaminas circulantes, que estimulan la secreción de renina por la vía de los receptores adrenérgicos;
y (3) las células de la mácula densa y del principio del túbulo distal, que parecen ser estimuladas por la
reducción en el aporte de cloro, especialmente por la concentración de CI en el fluido administrado a este
nivel.
Determinantes de la tasa de filtración glomerular
El paso Inicial de la formación de orina es la separación de un ultrafiltrado de plasma a través de la pared
del capilar glomerular. Como con otros capilares, el movimiento del líquido a través del glomérulo se rige
por las Leyes de Starling, es proporcional a la permeabilidad de la membrana y al equilibrio entre los
gradientes de presión hidráulica y oncótica:
Lp es la unidad de permeabilidad (o porosidad) de la pared capilar, S es el área de superficie capacitada
para la filtración, Pgc y Pbs son las presiones hidráulicas en el capilar glomerular y en el espacio de
Bowman, πp y πbs son las presiones oncóticas en el plasma que entra al glomérulo y al espacio de
Bowman, y s representa el coeficiente de reflexión de las proteínas a través de la pared del capilar con
valores que varían
desde 0 si es completamente permeable, a 1 si es completamente impermeable). Puesto que el filtrado está
principalmente libre de proteínas, πbs es 0 y s es 1. De este modo:
La TFG en adultos normales es aproximadamente de 95 ± 20 ml/min en mujeres y 120 ± 25 ml/min en
hombres. Este grado de filtración es más de 1.000 veces mayor que el de los capilares musculares. Dos
factores justifican esta diferencia: (1) la LpS de los glomérulos es de 50 a 100 veces la de un capilar
muscular, y (2) la presión hidráulica del capilar y por lo tanto, el principal gradiente a favor de la
filtración (Pgc-Pbs-πp), es mucho mayor en el capilar del glomérulo que en del músculo. Aunque casi todos
los electrolitos y el agua filtrados se reabsorben, se requiere una TFG más alta para permitir la filtración y
la excreción posterior de una diversidad de productos metabólicos de desecho, como urea y creatinina.
Regulación de la tasa de filtración glomerular y del flujo plasmático renal
La regulación de la hemodinámica renal se alcanza fundamentalmente mediante cambios en la resistencia
arteriolar, los cuales pueden afectar tanto al FPR y a la TFG (por la alteración de la P cg y del FPR. En
sujetos normales, por ejemplo, los cambios en la postura o en la dieta pueden producir alteraciones en la
presión de perfusión renal. En este contexto, dos fenómenos intrarrenales íntimamente relacionados, la
autorregulación y el feedback tubuloglomerular interactúan para mantener la TFG y el FPR a un nivel
relativamente constante. En comparación, los estados fisiopatológicos, tales como la depleción de
volumen, pueden llevar a la activación de factores neurohumorales sistémicos que pueden invalidar estos
efectos intrarrenales.
También podría gustarte
- Sistema RenalDocumento8 páginasSistema RenalJoyas Cosmeticos SolangeAún no hay calificaciones
- Filtracion GlomerularDocumento56 páginasFiltracion GlomerularAdhemarAún no hay calificaciones
- Clases Fisiologia 2Documento45 páginasClases Fisiologia 2Yael Yomira Ramos TatajeAún no hay calificaciones
- Cápsula Filtrado RenalDocumento8 páginasCápsula Filtrado RenalagustinaAún no hay calificaciones
- Nefrofisiologia (Guyton and Hall) RESUMENDocumento46 páginasNefrofisiologia (Guyton and Hall) RESUMENCarlos Urrutia Ramos100% (1)
- Resumen de La Función Renal.2Documento13 páginasResumen de La Función Renal.2Yair CrooZzAún no hay calificaciones
- Eli Seminario Info Filtrado Glomerular-1Documento12 páginasEli Seminario Info Filtrado Glomerular-1Elizabeth Venero SilvaAún no hay calificaciones
- Renal MonografiaDocumento22 páginasRenal MonografiaSara0% (1)
- FormacionorinDocumento30 páginasFormacionorinMayra PGAún no hay calificaciones
- Cuestionario Riñon 2Documento59 páginasCuestionario Riñon 2Kelly DavenportAún no hay calificaciones
- Preg 3 y 4 RiñonDocumento2 páginasPreg 3 y 4 RiñonLeslie RosadoAún no hay calificaciones
- Apuntes Tema 10Documento7 páginasApuntes Tema 10Alba EstebanAún no hay calificaciones
- Fisiología de Los RiñonesDocumento65 páginasFisiología de Los RiñonesEmilia NarvaezAún no hay calificaciones
- Filtración GlomerularDocumento3 páginasFiltración GlomerularJuan Diego Leon AguilarAún no hay calificaciones
- RiñónDocumento18 páginasRiñónGaly SoberanisAún no hay calificaciones
- CLASE 1 Funcion RenalDocumento38 páginasCLASE 1 Funcion RenalSaul Flores OcampoAún no hay calificaciones
- Aparat YuxtaglomerularDocumento17 páginasAparat Yuxtaglomerularana paolaAún no hay calificaciones
- Lesión Renal Aguda y RabdomiolisisDocumento14 páginasLesión Renal Aguda y RabdomiolisisDIANA DE LOS SANTOSAún no hay calificaciones
- Fisiología RenalDocumento8 páginasFisiología Renalc.auditorbravocarlosAún no hay calificaciones
- Tubulopatías (Soneivi)Documento18 páginasTubulopatías (Soneivi)Victor MonsalveAún no hay calificaciones
- SEMINARIO 16 DiureticosDocumento28 páginasSEMINARIO 16 DiureticosyanettAún no hay calificaciones
- Seminario 10 - Dipositivas (Exposicion)Documento27 páginasSeminario 10 - Dipositivas (Exposicion)Luis Enrique Cayao FigueroaAún no hay calificaciones
- Farmacologia Del Riñon JeidyDocumento14 páginasFarmacologia Del Riñon JeidySandra Patricia Peña VelezAún no hay calificaciones
- Fisiología RenalDocumento30 páginasFisiología RenalFatima AcostaAún no hay calificaciones
- Fisiologia, Fisiopatologia Renal y Enfermedades Glomerulares DiapositivasDocumento107 páginasFisiologia, Fisiopatologia Renal y Enfermedades Glomerulares DiapositivasgluveAún no hay calificaciones
- Apuntes NefronaDocumento8 páginasApuntes NefronaNinfa Esther Montejo de la CruzAún no hay calificaciones
- Manual de EgoDocumento47 páginasManual de EgoRosenda DLAún no hay calificaciones
- Renal - Tarea 1-5Documento31 páginasRenal - Tarea 1-5barrioslissette87Aún no hay calificaciones
- Fisiología Del Sistema RenalDocumento43 páginasFisiología Del Sistema RenalipqcueramaroAún no hay calificaciones
- Filtración GlomerularDocumento3 páginasFiltración GlomerularMilena DiazAún no hay calificaciones
- Renal IntroduccionDocumento60 páginasRenal IntroduccionINGRID JOHANNA CUESTA JIMENEZAún no hay calificaciones
- Sistema RenalDocumento18 páginasSistema RenalAna LuleAún no hay calificaciones
- Bloque Viii. Patologia Renal PDFDocumento63 páginasBloque Viii. Patologia Renal PDFNelson BelloAún no hay calificaciones
- RESUMEN DE LA FUNCIÓN RENAL AlumnosDocumento16 páginasRESUMEN DE LA FUNCIÓN RENAL AlumnosEmmanuel Salas NavarreteAún no hay calificaciones
- MicroDocumento3 páginasMicroLauraAún no hay calificaciones
- Fisiologia RenalDocumento11 páginasFisiologia RenalJEAN SALDARRIAGA LEONAún no hay calificaciones
- Nefrología IDocumento7 páginasNefrología ISary LealRAún no hay calificaciones
- UntitledDocumento5 páginasUntitledIngris PalmarAún no hay calificaciones
- Fisiología Semana 10Documento4 páginasFisiología Semana 10GERARDO ANDREE COTRINA MU�OZAún no hay calificaciones
- Fisiología de Producción de OrinaDocumento7 páginasFisiología de Producción de OrinaKarime LopezavilaAún no hay calificaciones
- Teoría - Función Renal - MEHU 632Documento27 páginasTeoría - Función Renal - MEHU 632Sara ParedesAún no hay calificaciones
- Generalidades de RiñónDocumento7 páginasGeneralidades de RiñónOri SbocciaAún no hay calificaciones
- Clase 7 (Metabolismo Renal)Documento42 páginasClase 7 (Metabolismo Renal)Francisco Bladimir Ramírez BeltránAún no hay calificaciones
- Tema 13 FHDocumento9 páginasTema 13 FHMaria MingAún no hay calificaciones
- TEMA 7 Intro RenalDocumento18 páginasTEMA 7 Intro RenalvtedosoAún no hay calificaciones
- Anatomia y Fisiologia RenalDocumento48 páginasAnatomia y Fisiologia RenalAhuitzolt BravoAún no hay calificaciones
- Sistema Renal. ApuntesDocumento9 páginasSistema Renal. ApuntesFernanda BlancoAún no hay calificaciones
- Seminario 12 - Función Glomerular y TubularDocumento7 páginasSeminario 12 - Función Glomerular y TubularuwuAún no hay calificaciones
- Apuntes NefrologiaDocumento12 páginasApuntes NefrologiaVale ReynosoAún no hay calificaciones
- Folleto Complementario de NefrologíaDocumento14 páginasFolleto Complementario de NefrologíaOffman VacaAún no hay calificaciones
- Anatomía y Fisiología RenalDocumento16 páginasAnatomía y Fisiología RenalLole Galdámez de Aguilar100% (1)
- Formacion de La OrinaDocumento9 páginasFormacion de La OrinaLuzmila Levano VillanuevaAún no hay calificaciones
- Tema 5: Dinámica de La Filtración Glomerular 5.1 Dinámica de Filtración GlomerularDocumento5 páginasTema 5: Dinámica de La Filtración Glomerular 5.1 Dinámica de Filtración GlomerularmarielizAún no hay calificaciones
- Anatomia Funcional Del RiñonDocumento7 páginasAnatomia Funcional Del RiñonKaren ReynosoAún no hay calificaciones
- Función Renal, Nefrona y Función TubularDocumento32 páginasFunción Renal, Nefrona y Función TubularRafael Vides IrvingAún no hay calificaciones
- Resumen de Funcion RenalDocumento7 páginasResumen de Funcion RenalCristian MontejoAún no hay calificaciones
- Copia de Unidad 5. Fisiología RenalDocumento36 páginasCopia de Unidad 5. Fisiología RenalGarcía Gutiérrez Yanelli AlexandraAún no hay calificaciones
- Bioquimica RenalDocumento75 páginasBioquimica RenalJosue OrdoñezAún no hay calificaciones
- Insuficienciarenal 3Documento19 páginasInsuficienciarenal 3Aurora EspinozaAún no hay calificaciones
- Introducción Básica a la Microcirculación de la Sangre: La Siguiente Generación en Cuidados de la SaludDe EverandIntroducción Básica a la Microcirculación de la Sangre: La Siguiente Generación en Cuidados de la SaludAún no hay calificaciones
- Universidad de Guayaquil Facultad de Ciencias Médicas Escuela de Medicina Cátedra de Pediatría IIDocumento7 páginasUniversidad de Guayaquil Facultad de Ciencias Médicas Escuela de Medicina Cátedra de Pediatría IIDaniela ArellanoAún no hay calificaciones
- Hemorragia IntracranealDocumento4 páginasHemorragia IntracranealDaniela ArellanoAún no hay calificaciones
- Hematopoyesis: Teoría MonofiléticaDocumento4 páginasHematopoyesis: Teoría MonofiléticaDaniela ArellanoAún no hay calificaciones
- Universidad de Guayaquil Facultad de Ciencia Médicas Carrera de MedicinaDocumento5 páginasUniversidad de Guayaquil Facultad de Ciencia Médicas Carrera de MedicinaDaniela ArellanoAún no hay calificaciones
- Encefalo de OvejaDocumento3 páginasEncefalo de OvejaErin PhillipsAún no hay calificaciones
- Pruiebas Bioquimica SecundariasDocumento16 páginasPruiebas Bioquimica SecundariasAna Karen Pelcastre LAún no hay calificaciones
- Diferencias Tiempos de Reacción Según La Modalidad SensorialDocumento22 páginasDiferencias Tiempos de Reacción Según La Modalidad SensorialAndrea LuceroAún no hay calificaciones
- Vitaminas y Minerales en El DeporteDocumento4 páginasVitaminas y Minerales en El DeporteIzack VillaAún no hay calificaciones
- AerosolterapiaDocumento12 páginasAerosolterapiaFelipe PAún no hay calificaciones
- BioinsecticidasDocumento89 páginasBioinsecticidasJavier Cobos MoraAún no hay calificaciones
- Genética MendelianaDocumento17 páginasGenética Mendelianaasancheztome1550100% (4)
- Ayudas Biomecanicas...Documento8 páginasAyudas Biomecanicas...Erick Incio EsquivesAún no hay calificaciones
- Análisis Del Video Escafandra y Mariposa.Documento2 páginasAnálisis Del Video Escafandra y Mariposa.SOMBRERO10000% (1)
- Músculos AntebrazoDocumento5 páginasMúsculos AntebrazoPerla RetanaAún no hay calificaciones
- 3.-Abordajes Quirurgicos en ToraxDocumento108 páginas3.-Abordajes Quirurgicos en ToraxGabriela Ruiz BautistaAún no hay calificaciones
- Quistes de Tejidos Blandos (Informe)Documento10 páginasQuistes de Tejidos Blandos (Informe)Angelica Reiki100% (1)
- Taller GlandulasDocumento5 páginasTaller GlandulasUm UmmAún no hay calificaciones
- Evaluacion Sumativa Ciencias Naturales Cuarto BasicoDocumento7 páginasEvaluacion Sumativa Ciencias Naturales Cuarto BasicoJAVIERA PENAAún no hay calificaciones
- BacteriasDocumento7 páginasBacteriasyorkaAún no hay calificaciones
- Estructura de Las TripasDocumento13 páginasEstructura de Las TripasFrezia N. Reyes Paz100% (1)
- 5 SistemaexcretorDocumento104 páginas5 SistemaexcretorMarloSisnieguesLarreaAún no hay calificaciones
- Vii ConversatorioDocumento2 páginasVii ConversatorioMax Bellido SanchezAún no hay calificaciones
- 1 PPT Sistema NerviosoDocumento23 páginas1 PPT Sistema NerviosoFelipe GarcíaAún no hay calificaciones
- Histologia de La HipofisisDocumento17 páginasHistologia de La HipofisisMaría José Celi CeliAún no hay calificaciones
- Fisiopatologia Del DolorDocumento15 páginasFisiopatologia Del DolorOmar Bazaldua100% (1)
- Proyecto Planarias ..Documento39 páginasProyecto Planarias ..Marco Antonio Trinidad DiazAún no hay calificaciones
- Porque Los Hombres No Escuchan y Las Mujeres No Entienden Los Mapas (Allan & Barbara Pease)Documento25 páginasPorque Los Hombres No Escuchan y Las Mujeres No Entienden Los Mapas (Allan & Barbara Pease)Manuel MartínezAún no hay calificaciones
- Insulina Glucagon y DM - Dr. CadimaDocumento35 páginasInsulina Glucagon y DM - Dr. CadimaHenry Palomino GutierrezAún no hay calificaciones
- Sistema NerviosoDocumento2 páginasSistema NerviosoThanrry DuarteAún no hay calificaciones
- Recomendaciones Nutricionales para Niños y AdolescentesDocumento56 páginasRecomendaciones Nutricionales para Niños y AdolescentesRayssa RomeroAún no hay calificaciones
- AnatoFisio Renal CIRDocumento35 páginasAnatoFisio Renal CIRjavgomAún no hay calificaciones
- Neuropsicologia de La Conducta SexualDocumento22 páginasNeuropsicologia de La Conducta SexualLuis Stanley SalinasAún no hay calificaciones
- De La Emoción Al LesiónDocumento16 páginasDe La Emoción Al Lesiónprincipechocolate100% (3)
- TP 0 Ciclo Sexual Resuelto1 FSH UNLAMDocumento8 páginasTP 0 Ciclo Sexual Resuelto1 FSH UNLAMDayannelopes123Aún no hay calificaciones