Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Discusión de Los Resultados
Cargado por
juan gabriel0 calificaciones0% encontró este documento útil (0 votos)
8 vistas1 páginaDe acuerdo al análisis de los resultados, el tiempo y la temperatura afectaron las fases del agua, con la presión del vapor aumentando. Inicialmente el agua estaba en fase líquida subenfriada, la cual al aplicarle calor pasó a evaporación formando un líquido saturado que se mantuvo constante como una mezcla de agua-vapor. Luego se convirtió en vapor saturado, y con más aplicación de calor llegó a vapor sobrecalentado a más de 100 psia.
Descripción original:
Título original
Discusión de Los Resultados (1)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoDe acuerdo al análisis de los resultados, el tiempo y la temperatura afectaron las fases del agua, con la presión del vapor aumentando. Inicialmente el agua estaba en fase líquida subenfriada, la cual al aplicarle calor pasó a evaporación formando un líquido saturado que se mantuvo constante como una mezcla de agua-vapor. Luego se convirtió en vapor saturado, y con más aplicación de calor llegó a vapor sobrecalentado a más de 100 psia.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
8 vistas1 páginaDiscusión de Los Resultados
Cargado por
juan gabrielDe acuerdo al análisis de los resultados, el tiempo y la temperatura afectaron las fases del agua, con la presión del vapor aumentando. Inicialmente el agua estaba en fase líquida subenfriada, la cual al aplicarle calor pasó a evaporación formando un líquido saturado que se mantuvo constante como una mezcla de agua-vapor. Luego se convirtió en vapor saturado, y con más aplicación de calor llegó a vapor sobrecalentado a más de 100 psia.
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 1
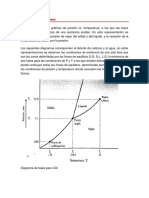
Discusión de los resultados
De acuerdo a nuestros resultados, podemos analizar cómo el tiempo y la temperatura
fueron factores importantes para las fases en el agua. Así mismo, la presión del vapor fue
en aumento. Las fases del agua van cambiando, el líquido sub-enfriado tiene menos
temperatura, menos presión e incluso menos entalpía a comparación de un vapor
sobrecalentado en donde todos sus propiedades aumentan.
Inicialmente se tiene un líquido subenfriado al que se le aplicará calor y es así como este
pasará a la evaporación, en donde obtendremos un líquido saturado, este se mantendrá
constante, por lo que se convierte en una mezcla de agua-vapor, las cuales tienen
propiedades iguales, ya que, es el punto crítico. Después de un determinado tiempo, este
ahora será un vapor saturado, continuando con el tiempo en el que se le aplica calor al
agua, llegará a un sobrecalentamiento que llega a más de 100 psia.
También podría gustarte
- 6-Informe de Laboratorio - Cambios de FaseDocumento5 páginas6-Informe de Laboratorio - Cambios de Faseandrea delgadoAún no hay calificaciones
- 02 Cambio de FaseDocumento14 páginas02 Cambio de FaseMichell Hernández RiveraAún no hay calificaciones
- Informe Tema 7 Lab - FisicoquimicaDocumento11 páginasInforme Tema 7 Lab - FisicoquimicaDaniel Vargas TrujilloAún no hay calificaciones
- Conceptos de CalorimetríaDocumento13 páginasConceptos de CalorimetríaRodríguez Cázarez Luisa FernandaAún no hay calificaciones
- Módulo I - Segunda ParteDocumento25 páginasMódulo I - Segunda PartemonicaAún no hay calificaciones
- Puto El Que Lo AbraDocumento15 páginasPuto El Que Lo AbraRaúl Núñez GonzálezAún no hay calificaciones
- Cuestionario 1, 2, 3, 4 y 5Documento3 páginasCuestionario 1, 2, 3, 4 y 5Julio Rodríguez BerrocalAún no hay calificaciones
- Yacimiento IIIDocumento11 páginasYacimiento IIIsolangeAún no hay calificaciones
- Termo Cap 3Documento14 páginasTermo Cap 3Fraraccio IngenieriaAún no hay calificaciones
- Comportamiento PVT CalidadDocumento18 páginasComportamiento PVT CalidadAnderson ArrietaAún no hay calificaciones
- Ensayo 2 TermodinamicaDocumento9 páginasEnsayo 2 TermodinamicaJat VAAún no hay calificaciones
- Propiedades de Los VaporesDocumento19 páginasPropiedades de Los VaporesDeisy Lorena Zapata DiazAún no hay calificaciones
- Calor LatenteDocumento4 páginasCalor LatenteJossuet MaldonadoAún no hay calificaciones
- Chichi Doria Klor Latente y VaporizacionDocumento4 páginasChichi Doria Klor Latente y VaporizacionSaudith MoscoteAún no hay calificaciones
- Termo LecturaDocumento3 páginasTermo LecturajoselinAún no hay calificaciones
- TermodinamicaDocumento25 páginasTermodinamicaEduard CastellanosAún no hay calificaciones
- CONCLUSIÓNDocumento1 páginaCONCLUSIÓNpamelaaguilarh02Aún no hay calificaciones
- Propiedades de Las Sustancias Puras y MezclasDocumento21 páginasPropiedades de Las Sustancias Puras y MezclasLUIS DANIEL GARCÍA CIENFUEGOSAún no hay calificaciones
- Calorimetria IiDocumento2 páginasCalorimetria IiJose Fernando Lozano PanibraAún no hay calificaciones
- Tablas de VaporDocumento29 páginasTablas de VaporluzmilaAún no hay calificaciones
- Documento de ExposiciónDocumento5 páginasDocumento de ExposiciónLourdes FrancoAún no hay calificaciones
- Conceptos Básicos RefrigeraciónDocumento5 páginasConceptos Básicos RefrigeraciónXavier Jaimes100% (5)
- Análisis de Los Componentes de Una Refinería Así Como Su Funcionamiento y La Influencia de Estos en El Proceso Del PetróleoDocumento17 páginasAnálisis de Los Componentes de Una Refinería Así Como Su Funcionamiento y La Influencia de Estos en El Proceso Del PetróleoJesús BautistaAún no hay calificaciones
- Propiedades Termodinámicas de Las Sustancias PurasDocumento17 páginasPropiedades Termodinámicas de Las Sustancias PuraskevinAún no hay calificaciones
- Cambios de Estado de La MateriaDocumento12 páginasCambios de Estado de La Materiaana100% (1)
- Termodinamica 141 143Documento3 páginasTermodinamica 141 143Luisa FernandaAún no hay calificaciones
- Investigacion TermoDocumento7 páginasInvestigacion TermoFernando SantiagoAún no hay calificaciones
- Termo 2Documento18 páginasTermo 2Karenka ZeltzinAún no hay calificaciones
- Practica 4 TermoDocumento13 páginasPractica 4 TermojcbmunAún no hay calificaciones
- CAPÍTULO 3 TERMODINÁMICA 7ma EDICIÓNDocumento40 páginasCAPÍTULO 3 TERMODINÁMICA 7ma EDICIÓNanierbtaAún no hay calificaciones
- Diseño Del Calentamiento de Una PiscinaDocumento61 páginasDiseño Del Calentamiento de Una PiscinaCarlosGordillo100% (1)
- Practica 1 - Quimica BasicaDocumento8 páginasPractica 1 - Quimica BasicaFernandoxstop23Aún no hay calificaciones
- Apunte Vapor 2021 Rv05Documento86 páginasApunte Vapor 2021 Rv05Gonza GOicocheaAún no hay calificaciones
- Trabajo Escrito TermodinamicaDocumento42 páginasTrabajo Escrito TermodinamicaJorge Omar Sanchez VenegasAún no hay calificaciones
- Clase 1oct2020.punto de Fusión y Ebullición.Documento8 páginasClase 1oct2020.punto de Fusión y Ebullición.JUAN JOSE PRADA GALEANOAún no hay calificaciones
- Cambios de Fase y Calor LatenteDocumento13 páginasCambios de Fase y Calor LatenteDaniAún no hay calificaciones
- Cambios de Estados de La MateriaDocumento2 páginasCambios de Estados de La MateriaWilliam Piscoya ChanaméAún no hay calificaciones
- Ebullicion y CondensacionDocumento20 páginasEbullicion y CondensacionDaniel LopezAún no hay calificaciones
- Calor Latente, Punto Triple, Transición VitreaDocumento19 páginasCalor Latente, Punto Triple, Transición VitreaJocelynAún no hay calificaciones
- Calor Latente de FusiónDocumento2 páginasCalor Latente de FusiónSandovalgmzAún no hay calificaciones
- Unidad 4 Calor PDFDocumento7 páginasUnidad 4 Calor PDFLucia RolonAún no hay calificaciones
- PRESIÓN DE VAPOR (Lunes 7 NOVIEMBRE 2022)Documento9 páginasPRESIÓN DE VAPOR (Lunes 7 NOVIEMBRE 2022)EliGaby MoralesAún no hay calificaciones
- Procesos FyqDocumento12 páginasProcesos FyqAndrew K-rolina0% (2)
- Conclusión TermodinamicaDocumento2 páginasConclusión TermodinamicaDomitila CorreaAún no hay calificaciones
- 1 Agua CambiaDocumento8 páginas1 Agua CambiaMARIANNY CUELLOAún no hay calificaciones
- Material de Estudio 1 - Principios Basicos de La Ingenieria Del VaporDocumento17 páginasMaterial de Estudio 1 - Principios Basicos de La Ingenieria Del VapormaikevilAún no hay calificaciones
- Cambios de EstadoDocumento3 páginasCambios de EstadoAlba Johanna Castillo RojasAún no hay calificaciones
- Calor LatenteDocumento4 páginasCalor LatenteFran FrancoAún no hay calificaciones
- Practica 1 Cambio de FasesDocumento8 páginasPractica 1 Cambio de FasesDaniel MLAún no hay calificaciones
- Informe 9 Calor LatenteDocumento10 páginasInforme 9 Calor LatenteJosé Eduardo Pezo CastroAún no hay calificaciones
- Presión de VaporDocumento6 páginasPresión de VaporYonathan ArevaloAún no hay calificaciones
- Resumen Unidad 9 TermodinamicaDocumento10 páginasResumen Unidad 9 TermodinamicaFer NandomAún no hay calificaciones
- Punto de EbulliciónDocumento4 páginasPunto de EbulliciónEtthel Camend100% (1)
- Curvas de Calentamiento Del AguaDocumento6 páginasCurvas de Calentamiento Del AguaFederico Fabio RamosAún no hay calificaciones
- IntroducciónDocumento2 páginasIntroducciónHernández HéctorAún no hay calificaciones
- Propiedades de Sustencias PurasDocumento28 páginasPropiedades de Sustencias PurasSebastián LagosAún no hay calificaciones
- Resumen Capítulo 3 - Yunus CengelDocumento9 páginasResumen Capítulo 3 - Yunus CengelMiguelAngelGha100% (3)
- Aprender sobre la energía geotérmica (Finding Out about Geothermal Energy)De EverandAprender sobre la energía geotérmica (Finding Out about Geothermal Energy)Aún no hay calificaciones
- Examen-Primer ParcialDocumento4 páginasExamen-Primer Parcialjuan gabrielAún no hay calificaciones
- Técnico Superior Universitario en Proceso Alimentarios (Calidad)Documento8 páginasTécnico Superior Universitario en Proceso Alimentarios (Calidad)juan gabrielAún no hay calificaciones
- Examen Unidad IIIDocumento4 páginasExamen Unidad IIIjuan gabrielAún no hay calificaciones
- 7 Herramientas de Calidad Con Un Ejemplo de Su Uso en La Industria AlimentariaDocumento7 páginas7 Herramientas de Calidad Con Un Ejemplo de Su Uso en La Industria Alimentariajuan gabrielAún no hay calificaciones
- Examen Quimica BasicaDocumento4 páginasExamen Quimica Basicajuan gabrielAún no hay calificaciones
- Cuadro ComparativoDocumento1 páginaCuadro Comparativojuan gabrielAún no hay calificaciones
- Cuestonario de Organelos CelularesDocumento3 páginasCuestonario de Organelos Celularesjuan gabrielAún no hay calificaciones
- Tipos de DeshidratadoresDocumento1 páginaTipos de Deshidratadoresjuan gabrielAún no hay calificaciones
- Mapa Conseptual de La Liofilizacion y Su ProcesoDocumento1 páginaMapa Conseptual de La Liofilizacion y Su Procesojuan gabrielAún no hay calificaciones
- Cinética Química Reacciones QuímicasDocumento10 páginasCinética Química Reacciones Químicasjuan gabrielAún no hay calificaciones
- Examen de Quimica en AlimentosDocumento5 páginasExamen de Quimica en Alimentosjuan gabrielAún no hay calificaciones
- Cuadro de Dentificacion de O.U en Los Distintos TalleresDocumento2 páginasCuadro de Dentificacion de O.U en Los Distintos Talleresjuan gabrielAún no hay calificaciones
- Algebra VectorialDocumento1 páginaAlgebra Vectorialjuan gabrielAún no hay calificaciones
- FORMATO MAQUINARIA Y EQUIPO AlexDocumento3 páginasFORMATO MAQUINARIA Y EQUIPO Alexjuan gabrielAún no hay calificaciones
- Practica de AnalisisssssssDocumento6 páginasPractica de Analisisssssssjuan gabrielAún no hay calificaciones
- Practica 6Documento9 páginasPractica 6juan gabrielAún no hay calificaciones
- Introducción TERMODINAMICADocumento1 páginaIntroducción TERMODINAMICAjuan gabrielAún no hay calificaciones
- Examen U Iii 2022Documento5 páginasExamen U Iii 2022juan gabrielAún no hay calificaciones
- Trabajo de Quimica en AlimentosDocumento4 páginasTrabajo de Quimica en Alimentosjuan gabrielAún no hay calificaciones
- Pasteurización en Un JugoDocumento1 páginaPasteurización en Un Jugojuan gabrielAún no hay calificaciones
- Procesos Alimentario3Documento5 páginasProcesos Alimentario3juan gabrielAún no hay calificaciones
- Examen de Primera OportunidadDocumento4 páginasExamen de Primera Oportunidadjuan gabrielAún no hay calificaciones