Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Guia de Estudios 1
Cargado por
Alfredo AlfaroTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Guia de Estudios 1
Cargado por
Alfredo AlfaroCopyright:
Formatos disponibles
UNIVERSIDAD AUTÓNOMA DE SAN LUIS
POTOSÍ FACULTAD DE CIENCIAS QUÍMICAS
LABORATORIO DE INGENIERÍA QUÍMICA
REPORTE DE PRÁCTICAS
LABORATORIO DE TRANSFERENCIA DE MASA I
NOMBRE DEL ALUMNO: José Alfredo Alfaro Martínez
PRÁCTICA No. 1
NOMBRE DE LA PRÁCTICA: Destilación diferencial
PROFESOR: Brenda Berenice Zermeño Reséndiz
CLAVE DEL GRUPO: 99992
FECHA: 09/ 02/ 2022
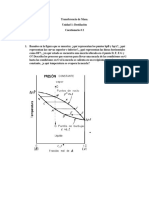
DESTILACIÓN DIFERENCIAL
1. OBJETIVOS
a. Relacionar al estudiante con la destilación diferencial, la cual es un
caso típico en la operación de un sistema intermitente o por lotes.
b. Reafirmar los conceptos básicos de equilibrio entre fases vapor -
líquido, así como las leyes que lo rigen para comprender mejor
los fundamentos de la destilación.
GUÍA DE ESTUDIOS
1. ¿A qué se le llama destilación?
Método que se usa para separar los componentes de una solución líquida,
que depende de la distribución de estos componentes entre una fase vapor
y una fase líquida y se aplica en los casos en que todos los componentes
están presentes en las dos fases. La fase vapor se origina de la fase líquida
por vaporización al punto de ebullición.
2. ¿Qué factores influyen en la destilación?
Composición y temperatura.
Para cualquier fuente de composición específica, las principales variables
que afectan la pureza de los productos en la destilación continua son la
relación de reflujo y el número de etapas de equilibrio teóricas,
determinadas en la práctica por el número de placas o la altura del relleno.
3. ¿Cuántos tipos de destilación hay?
Destilación simple
Destilación fraccionada
Destilación al vacío
Destilación azeotrópica
Destilación por arrastre de vapor
Destilación seca
Destilación mejorada
Destilación diferencial
4. ¿En qué consiste la destilación simple y de cuantas maneras se puede
llevar a cabo?
La destilación simple se utiliza cuando la mezcla de productos líquidos a
destilar contiene únicamente una sustancia volátil, o bien, cuando ésta
contiene más de una sustancia volátil, pero el punto de ebullición del líquido
más volátil difiere del punto de ebullición de los otros componentes en, al
menos, 80 ºC.
Destilación simple a presión atmosférica
Destilación simple a presión reducida
5. Enunciar y explicar las reglas de las fases
Φ=𝐶−𝑃+2
El propósito de esta regla es clasificar los equilibrios y establecer el
número de
Variables independientes y los grados de libertad.
Así:
C = número de componentes
P= número de fases
Φ = Número de grados de libertad
6. Enunciar y explicar las leyes de Raoult y Henry:
La ley de Raoult nos da un modelo realista del comportamiento eficiente
para una clase de sistemas y a la vez es útil para realizar los cálculos de
equilibrio vapor líquido de manera sencilla. Asimismo, funciona para
cualquier especie con una fracción mol cercano a uno, siempre y cuando la
fase vapor sea un gas ideal.
𝑦𝑖𝑃 = 𝑥𝑖𝑃𝑖 𝑠𝑎𝑡
Donde xi es una fracción mol de la fase líquida, yi es una fracción mol de la
fase vapor y Pi^sat es la presión de vapor de las especies puras. El
producto yi P es la presión parcial de la especie (Pi).
La ley de Henry dice que la presión parcial de una especie en fase vapor es
directamente proporcional a su fracción mol en la fase líquida. de este modo
el enunciado anterior es útil para una especie que su temperatura crítica sea
menor que la de aplicación. Esta ley aplica para una especie cuando se
acerque a dilución infinita dentro de una solución binaria.
𝑦𝑖𝑃 = 𝑥𝑖ℋ𝑖
Hi se sustituye por la Pi^sat en la Ley de Raoult, y es la constante de Henry.
Estos valores Son experimentales.
7. ¿Cómo se calculan los datos para construir un diagrama de punto de
ebullición y una curva de equilibrio?
Con las ecuaciones.
Para diferentes temperaturas que estén dentro de los puntos de ebullición
de los componentes, sacanso los valores para graficar las curvas en un solo
grafico
8. ¿Por qué hay desventajas de la idealidad y cuándo se llama
desviación positiva y cuándo negativa?
𝑃i > 𝑃ii𝑑𝑒𝑎𝑙, o lo que es lo mismo 𝛾i > 1. El sistema presenta una desviación
positiva de la Ley de Raoult. Estas desviaciones positivas ocurren cuando
los componentes de la mezcla prefieren estar cerca de moléculas de su
mismo tipo en lugar de estar cerca de las moléculas del otro componente.
En estos casos, el azeótropo es un máximo en el diagrama P − x − y y un
mínimo en el T − x − y. Puesto que las fases de vapor y líquido son
equivalentes en este punto, entonces un tambor o columna de destilación
no podrá ser utilizado para separar una mezcla cuando se alcance dicho
punto.
En cuyo caso Pi<Piideal y 𝛾i < 1. En estos sistemas se presenta una
desviación negativa de la ley de Raoult.
Estas desviaciones suelen presentarse en soluciones en que las moléculas
de distintas clases tienden a atraerse entre sí, dificultando la tendencia al
escape de las moléculas en proceso de vaporización. De esta manera, el
azeótropo es un mínimo en el diagrama T-x-y y un máximo en el P-x-y.
9. ¿Qué es una mezcla azeotrópica?
Es una mezcla de 2 o más componentes que están en estado líquido y su
Comportamiento es como si fuera uno solo compuesto. El comportamiento
de estas mezclas nos permite observar las ventajas de una mezcla como
pura.
10. ¿A qué se le llama volatilidad relativa?
Es una medida de la diferencia entre la presión de vapor de los
componentes más volátiles de una mezcla líquida y la presión de vapor de
los componentes menos volátiles de la mezcla.
Indica la facilidad o dificultad de utilizar la destilación para separar los
componentes más volátiles de los componentes menos volátiles en una
mezcla.
cuanto mayor es la volatilidad relativa de una mezcla líquida, más fácil es
separar los componentes de la mezcla por destilación. Por convención, la
volatilidad relativa es típicamente denotada como la letra griega alfa, α.
𝑌𝐴X𝐴 = 𝑌(1 − X𝐴)
𝖺𝐴𝐵= X (1 − )
𝑌𝐵 X𝐴 𝐴 𝐴
11. Deducir la ecuación de Rayleigh.
Si se considera en un momento cualquiera una cantidad del líquido inicial
Lo, que hay en el destilador, cuya composición en fracción molar referida al
componente más volátil es X; la cantidad de vapor formado en un espacio
de tiempo infinitamente pequeño sería una diferencial del líquido dL de
composición Y. Por lo tanto, al transformarse cierta cantidad del líquido a
vapor, quedará una cantidad de líquido residual
Efectuando un balance de materia entre ambos estados aplicado al
componente más volátil resulta:
LX=(L-dL)(X-dX)+YdL
Efectuando la operación
LX=LX-LdX-XdL+dLdX+YdL
Despreciando dXdL
LX=LX-LdX-XdL+YdL
Eliminado LX y despejando XdL
XdL=YdL-
LdX LdX=(Y-
X)dL
Agrupando términos
𝑑𝑥 𝑑𝐿
=
(𝑦 − 𝑥) 𝐿
Integrando entre limites (cantidad inicial y final) también XLo y XL
concentraciones inicial y final en el destilador, se obtiene la ecuación de
Rayleigh.
12. ¿Cómo se obtiene teóricamente la composición promedio del
destilado?
Mediante un balance de materia.
LoXLO=LXL+DYprom
13. ¿Cómo se podría conocer experimentalmente la composición del
destilado y del residuo?
Si se parte de una mezcla de dos sustancias en la que sólo una de ellas es
volátil, se pueden separar ambas mediante una destilación. El componente
más volátil se recogerá por condensación del vapor y el compuesto no
volátil quedará en el matraz de destilación.
Bibliografía
Facultad de Ciencias Químicas UASLP. (2021). Manual de Prácticas de Laboratorio de
Transferencia de Masa I. San Luis Potosí.
Smith, J., Van Ness, H., & Abbott, M. (2007). Introducción a la Ingeniería Química
(Séptima ed.). D.F., México: McGrawHill Interamericana.
Apuntes de clases operaciones unitarias I
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Ley de Raoult InformeDocumento17 páginasLey de Raoult InformeMaría Argomedo ReyesAún no hay calificaciones
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Pre Examen TermodinamicaDocumento4 páginasPre Examen TermodinamicaJean Pierre Cirilo SosaAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- LEY de HENRY Y RAOULTDocumento26 páginasLEY de HENRY Y RAOULTAndrew HernandezAún no hay calificaciones
- Normativa Técnica de Instalaciones para Clientes Finales en Redes FTTH-GPON - 2019 PDFDocumento71 páginasNormativa Técnica de Instalaciones para Clientes Finales en Redes FTTH-GPON - 2019 PDFAlexander Lapo Cordova100% (1)
- OF1417 EspDocumento2 páginasOF1417 EspFrancisco GastaldiAún no hay calificaciones
- Practica 4 Equilibrio Liquido Vapor de Una Mezcla Binaria Ley de RaoultDocumento38 páginasPractica 4 Equilibrio Liquido Vapor de Una Mezcla Binaria Ley de RaoultAdrian lopezAún no hay calificaciones
- LOpU1 Pre1 GascónCastilloAsafJoshuaDocumento4 páginasLOpU1 Pre1 GascónCastilloAsafJoshuaAsaf Joshua Gascón CastilloAún no hay calificaciones
- Practica 4 Lab Int 2Documento14 páginasPractica 4 Lab Int 2YulissaAún no hay calificaciones
- Pre1 OperacionesDocumento6 páginasPre1 OperacionesIngeniera Pau JerezAún no hay calificaciones
- PreLab Transferencia de MasaDocumento5 páginasPreLab Transferencia de MasaCristo Xavier Muñoz Mtz.Aún no hay calificaciones
- Op1 Pre1Documento5 páginasOp1 Pre1FernandoAún no hay calificaciones
- Práctica No. 3 Diagrama de FasesDocumento7 páginasPráctica No. 3 Diagrama de FasesFlor JacoboAún no hay calificaciones
- Pre1.TM Miguel Eduardo FloresDocumento5 páginasPre1.TM Miguel Eduardo FloresMiguel FloresAún no hay calificaciones
- Pre1.OUl Alviso - Camacho.AlejandroDocumento4 páginasPre1.OUl Alviso - Camacho.AlejandroMiguel FloresAún no hay calificaciones
- Guia TDM DestilaciónDocumento4 páginasGuia TDM DestilaciónEdwin BozaAún no hay calificaciones
- Practica 5Documento8 páginasPractica 5Alejandra MezaAún no hay calificaciones
- Unidad I DestilaciónDocumento32 páginasUnidad I DestilaciónKAREN ESTEFANíA HERNáNDEZ OCAMPOAún no hay calificaciones
- Equilibrio Líquido Vapor en Un Sistema No IdealDocumento3 páginasEquilibrio Líquido Vapor en Un Sistema No IdealDeyaniraAún no hay calificaciones
- Práctica 4. LTEL-Equilibrio-liquido Vapor de Una Mezcla BinariaDocumento37 páginasPráctica 4. LTEL-Equilibrio-liquido Vapor de Una Mezcla BinariaGODLOVEAún no hay calificaciones
- Ley de RaoultDocumento16 páginasLey de RaoultMara ArellanoAún no hay calificaciones
- Equilibrio en Sistemas No IdealesDocumento33 páginasEquilibrio en Sistemas No IdealesirmaAún no hay calificaciones
- Pre3 Termo2Documento5 páginasPre3 Termo2Valeria AlpucheAún no hay calificaciones
- Marco Teorico TxyDocumento4 páginasMarco Teorico TxyCraven HorrorsAún no hay calificaciones
- Elv Etanol AguaDocumento18 páginasElv Etanol AguaJuan Montalvo CerronAún no hay calificaciones
- p5 Reposicion ReDocumento41 páginasp5 Reposicion ReAreli AltamiranoAún no hay calificaciones
- Practica 1 Lab Opiii (Equilibrio Líquido-Vapor y Diagramas de Equilibrio)Documento18 páginasPractica 1 Lab Opiii (Equilibrio Líquido-Vapor y Diagramas de Equilibrio)vidaurre_89Aún no hay calificaciones
- 1 Preexamen Termodinamica de Procesos IIDocumento24 páginas1 Preexamen Termodinamica de Procesos IIPaul Ruiz BaldeonAún no hay calificaciones
- Tema 3 DestilacionDocumento17 páginasTema 3 DestilacionCuan TAún no hay calificaciones
- Equilibrio Líquido-Vapor en Sistemas Liquidos BinariosDocumento7 páginasEquilibrio Líquido-Vapor en Sistemas Liquidos BinarioslupitaAún no hay calificaciones
- Resumen - Procesos de Separación Vapor LíquidoDocumento11 páginasResumen - Procesos de Separación Vapor LíquidoNICOLAS CASTELLANOS TAMAYOAún no hay calificaciones
- La Ley de Raoult y HenryDocumento11 páginasLa Ley de Raoult y HenryCarlos SamaniegoAún no hay calificaciones
- p4. Lab Termo 1Documento15 páginasp4. Lab Termo 1Castillo Pérez PaulinaAún no hay calificaciones
- Pre1 Ou1 MuñizreynaDocumento8 páginasPre1 Ou1 MuñizreynaAngel ReynaAún no hay calificaciones
- Liquido Vapor CorregidoDocumento21 páginasLiquido Vapor CorregidoGiselle SanchezAún no hay calificaciones
- Antecedentes Práctica 4Documento6 páginasAntecedentes Práctica 4Naomi GuerreroAún no hay calificaciones
- Informe de Termodinámica Liquido VaporDocumento13 páginasInforme de Termodinámica Liquido VaporStiven K. Rosales CasasAún no hay calificaciones
- 03 DestilacionDocumento14 páginas03 DestilacionLuis MolloAún no hay calificaciones
- Termo Practica 4Documento24 páginasTermo Practica 4Odin Noe DoroteoAún no hay calificaciones
- Practica 8 Lab Fsq....Documento8 páginasPractica 8 Lab Fsq....Felipe KevinAún no hay calificaciones
- Termodinamica II.Documento14 páginasTermodinamica II.María AlejandraAún no hay calificaciones
- Destilación Por Arrastre de VaporDocumento3 páginasDestilación Por Arrastre de Vaporlui_sgtzAún no hay calificaciones
- Procesos de Separacion y Ejemplos Sobre Tipos de SeparacionDocumento9 páginasProcesos de Separacion y Ejemplos Sobre Tipos de SeparacionCes CrAún no hay calificaciones
- Informe N°13 DestilacionDocumento32 páginasInforme N°13 DestilacionRosa Mariia Quezada ArteagaAún no hay calificaciones
- CUESTIONARIO3Documento16 páginasCUESTIONARIO3Yennifer Giselle MartinezAún no hay calificaciones
- La FugocidadDocumento9 páginasLa FugocidadaddddddddfffffAún no hay calificaciones
- Practida Ley RaoultDocumento29 páginasPractida Ley RaoultBerenice Abichuela Rivera LunaAún no hay calificaciones
- Informe N°9 - Equilibrio Líquido - VaporDocumento13 páginasInforme N°9 - Equilibrio Líquido - VaporDevra GomezAún no hay calificaciones
- Practica 5 Equilibrio Liquido VMB Ley de Raoult ModificadaDocumento66 páginasPractica 5 Equilibrio Liquido VMB Ley de Raoult ModificadaAreli AltamiranoAún no hay calificaciones
- Laboratorio Intgral 2Documento44 páginasLaboratorio Intgral 2David M GaytanAún no hay calificaciones
- 2PM32 Practica 5 E5 RecuperacionDocumento32 páginas2PM32 Practica 5 E5 RecuperacionDaniel Quevedo GonzálezAún no hay calificaciones
- Informe de FugacidadDocumento9 páginasInforme de FugacidadLuis MoreyAún no hay calificaciones
- Facultad de Ciencias Químicas: Equilibrio Líquido Vapor en Un Sistema No IdealDocumento4 páginasFacultad de Ciencias Químicas: Equilibrio Líquido Vapor en Un Sistema No IdealSofiia Miranda Díaz de LeónAún no hay calificaciones
- Soluciones IdealesDocumento9 páginasSoluciones Idealescampanas0Aún no hay calificaciones
- LAB 4: EQUILIBRIO LÍQUIDO VAPOR DE UN SISTEMA BINARIO y Aplicación Segunda Ley de TermodinámicaDocumento10 páginasLAB 4: EQUILIBRIO LÍQUIDO VAPOR DE UN SISTEMA BINARIO y Aplicación Segunda Ley de TermodinámicaJaviera Navarrete RiverosAún no hay calificaciones
- Trabajo Final de InvestigaciónDocumento5 páginasTrabajo Final de InvestigaciónAguirre Carbajal José LeonardoAún no hay calificaciones
- Unidad 3 Problemario EquipoDocumento20 páginasUnidad 3 Problemario EquipoFTopnite 08Aún no hay calificaciones
- Practica #5Documento5 páginasPractica #5Augusto Brasil Ocampo Medina0% (1)
- Equilibrio LíquidoDocumento9 páginasEquilibrio LíquidoJuan Diego Mamanchura FilinichAún no hay calificaciones
- Cues To Nario 2 MasaDocumento3 páginasCues To Nario 2 MasaJulissaAún no hay calificaciones
- Perímetros y Problemas Con Áreas para Sexto Grado de Primaria OkDocumento5 páginasPerímetros y Problemas Con Áreas para Sexto Grado de Primaria OkNoelia Sottile100% (1)
- Regresion Lineal MartinezDocumento6 páginasRegresion Lineal MartinezEdgar Fernando Martinez SanchezAún no hay calificaciones
- Procesadores Intel CeleronDocumento7 páginasProcesadores Intel CeleronPruebaAún no hay calificaciones
- Filtros PasivosDocumento31 páginasFiltros PasivosMiguel Gabriel TunAún no hay calificaciones
- Resolviendo Ejercicios de Division de Numeros Decimales Por CasosDocumento4 páginasResolviendo Ejercicios de Division de Numeros Decimales Por CasosArcadio Zanabria RivasAún no hay calificaciones
- 6° Maquinas Mecanismos EstructurasDocumento13 páginas6° Maquinas Mecanismos Estructurasjackelin_ctoledoAún no hay calificaciones
- Unsch: Capitulo 5 Mínimos Cuadrados RestringidosDocumento8 páginasUnsch: Capitulo 5 Mínimos Cuadrados RestringidosJUAN ALBERTO HUARIPUMA VARGASAún no hay calificaciones
- FMX 380-420-460-500 8x4R Vocacional 2020 (VTCM0045 ED02)Documento2 páginasFMX 380-420-460-500 8x4R Vocacional 2020 (VTCM0045 ED02)Jose germanAún no hay calificaciones
- PG PaDocumento20 páginasPG PaIngeSharing50% (2)
- Descarboxilacion Oxidativa Del PiruvatoDocumento8 páginasDescarboxilacion Oxidativa Del PiruvatoSofia Micaela Franco ZevallosAún no hay calificaciones
- Introducción A PrecalculoDocumento5 páginasIntroducción A PrecalculoAlex GlezAún no hay calificaciones
- PREVIOS 22 - Trabajo PracticoDocumento6 páginasPREVIOS 22 - Trabajo PracticoDaniela Soledad RíosAún no hay calificaciones
- Pre Amplificador de Audio de Señal DébilDocumento5 páginasPre Amplificador de Audio de Señal DébilJuanita CastroAún no hay calificaciones
- SB75-M17-25H (Une 2012 Anexo C) 12-65 210931Documento11 páginasSB75-M17-25H (Une 2012 Anexo C) 12-65 210931Gabriel AngelAún no hay calificaciones
- Clases de Palabras PDFDocumento14 páginasClases de Palabras PDFN D YAún no hay calificaciones
- 1 Propiedades de La Roca Porosidad MaterialDocumento41 páginas1 Propiedades de La Roca Porosidad MaterialManuel Azancot100% (1)
- TR1 Reparacion de MotoresDocumento10 páginasTR1 Reparacion de MotoresROMAN CULQUIAún no hay calificaciones
- VT - Polimeros Inteligentes y AplicacionesDocumento86 páginasVT - Polimeros Inteligentes y AplicacionesDiana RAAún no hay calificaciones
- Flujo Newtoniano Entre Dos Placas PlanasDocumento6 páginasFlujo Newtoniano Entre Dos Placas PlanasJuan Manuel OliverosAún no hay calificaciones
- SOLDADURADocumento47 páginasSOLDADURAFredericGaheteRayegoAún no hay calificaciones
- Cuaderno de Informe MantenimientoDocumento11 páginasCuaderno de Informe MantenimientoBeto RffoBalTAún no hay calificaciones
- Examen Semanal 2Documento2 páginasExamen Semanal 2EdwinLuisZegarraRiosAún no hay calificaciones
- Sesion 14 - M - P4Documento6 páginasSesion 14 - M - P4Sharol Estefani QUISPE DE LA CRUZAún no hay calificaciones
- Guía Básica de Cálculo Con XfoilDocumento14 páginasGuía Básica de Cálculo Con XfoilAriel Gamarra RcAún no hay calificaciones
- Ejemplo de La Técnica de SOl-GELDocumento14 páginasEjemplo de La Técnica de SOl-GELdanielAún no hay calificaciones
- Cisaprida en NiñosDocumento5 páginasCisaprida en NiñosCF PonceAún no hay calificaciones
- TA5 - Expresiones Algebraicas FCMFAUTO5Documento10 páginasTA5 - Expresiones Algebraicas FCMFAUTO5MarianaAún no hay calificaciones
- Diagnostico DiferencialDocumento26 páginasDiagnostico DiferencialDiana SalvadorAún no hay calificaciones