Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Rodriguez Oscar Practica 5
Cargado por
Oscar UrielDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Rodriguez Oscar Practica 5
Cargado por
Oscar UrielCopyright:
Formatos disponibles
Rodríguez Pacheco Oscar Uriel
Clave:13
5/04/22
Química Orgánica III (1506-05)
Práctica No. 5
CONDENSACIÓN ALDÓLICA
2. Ecuación(es) de la(s) reacción(es) con nombre de todas las sustancias involucradas.
3. Cuadro de datos estequiométricos.
Benzaldehído Acetona E,E-Dibenzalacetona
Masa molar (g/mol) 106.12 58.08 234.29
Volumen (mL) 0.3 0.1 ------
Densidad (g/mL) 1.04 0.784 ------
Cantidad de sustancia (mmol) 0.0029 0.00130 0.0012
Equivalentes químicos 2 1 1
4. Procedimiento experimental. Diagrama de flujo.
5. Análisis del procedimiento (justificar cada paso realizado)
El primer paso es necesario para realizar la reacción aldólica, posteriormente al agregar la acetona gota
a gota con control de temperatura a 30°C y por 30 minutos favorece la cinética de la reacción para
formar más producto, posteriormente al enfriar en baño de hielo favorecemos la formación de cristales,
los cuales filtraremos y lavamos con agua fría hasta llegar a pH=7, al recristalizar con etanol se purificará
nuestro producto.
6. Resultados: estado físico, p. f., p. eb., color, etc.
Producto Estado físico Punto de fusión (°C) Punto de ebullición
(estado, color) (°C)
E,E-Dibenzalacetona Solido amarillento Teo.: 110-111 °C -
Exp.: 109 °C
7. Cálculo del rendimiento
(moles de producto / moles de reactivo limitante) * 100
=(0.0012 / 0.001465) * 100 =81.9112
81.91 % de rendimiento.
8. Análisis de resultados
Podemos decir que la práctica fue realizada de manera correcta ya que nuestro rendimiento fue, en la
parte de la temperatura de fusión hemos obtenido un valor muy cercano al reportado en la literatura,
mostrándonos que, aunque durante el proceso de síntesis se pudo haber perdido algo de materia prima,
o haber mezclado algunas impurezas que no se eliminaron por completo de nuestra mezcla de reacción
(según la etapa del experimento), se cumplió el objetivo de obtener la dibenzalacetona. Como dato
extra mencionar que se cuidó de mucho mejor manera el control de la temperatura que en prácticas
anteriores, lo cual, ante los buenos resultados mostrados, es evidente como esto beneficia a la reacción
y a la pureza de nuestro producto a obtener.
9. Cuestionario
1) ¿Por qué es tan importante el orden de adición de los reactivos?
Se debe adicionar primero para que se puede generar el ión enolato, ya que el benzaldehído tiene
hidrógenos ácidos y la acetona no, por lo que no puede formar este ión.
Se debe hacer de esa forma para que al adicionar la acetona, la cual contiene el grupo carbonilo sobre el
cual se efectuará el ataque nucleofílico.
2) ¿Qué pasaría si se adiciona primero la disolución de NaOH a la acetona en vez que al benzaldehído?
Reaccionarían entre ellas, cuando lo que se busca es que reaccionen, en diferentes etapas o fases del
experimento, con el benzaldehído, es decir estaríamos sintetizando un producto diferente al deseado.
3) Indique ¿Por qué́ se pierde fácilmente 1 molécula de agua (reacción de eliminación) en medio alcalino
en el producto de adición?
Porque reacciona con los intermediarios, el agua suele perder protones y por eso se pierde fácilmente la
molécula durante la reacción.
4) ¿Cuál es el objetivo de realizar lavados con agua hasta pH =7 previo a realizar la recristalización?
Para favorecer la obtención de cristales
Porque es el pH esperado a esa fase, el producto que se desea recristalizaren disolución posee un pH
alrededor de 7, de proceder con la recristianización sin tener el pH descrito, probablemente haya
impurezas en el producto a la hora de nuestra recristalización, afectando nuestro rendimiento en la
reacción y, por ende en nuestra pureza
5) ¿Por qué es tan importante no exceder el calentamiento de 30 o C?
Se pierde producto, algunos de los reactivos se evaporan a altas temperaturas y entonces, de no vigilar la
temperatura durante el proceso, podría perderse y, además, como tal, quemar al producto.
6) ¿Cuál es la temperatura máxima que podría llevarse esta reacción en específico?
Al rededor de los 56 °C, pues es el punto de ebullición de la acetona y podría evaporarse de la mezcla de
reacción, lo cual, evidentemente, no es deseado pues la acetona forma parte del mecanismo de
reacción.
7) ¿Qué características presentan los H ś alfa al grupo carbonilo, investiga su valor de pKa?
Los H de los alcanos tienen muy poca acidez (pKa = 50). La razón es que si se perdiera un protón de un
alcano, el ion formado tendría un par de electrones sobre un átomo de carbono. Dada la
electronegatividad intermedia de este átomo, ese carbanión sería extremadamente inestable.
10. Conclusiones
La condensación aldólica en un medio básico es la reacción de un grupo carbonilo que contiene
hidrógeno en posición alfa, con un ion enolato para dar como producto un aldol, en cuyo casi aquí
presente fue la dibenzalacetona. Estas reacciones son de importancia para la síntesis de productos
comerciales, como lo es la dibenzalacetona la cual es utilizada para la producción de productos
farmacéuticos ya sean medicamentos o cosméticos, con lo cual es importante conocer este tipo de
reacciones.
También podría gustarte
- Masa Molar (G/mol) Volumen (ML) Densidad (G/ML) Cantidad de Sustancia (Mmol) Equivalentes QuímicosDocumento4 páginasMasa Molar (G/mol) Volumen (ML) Densidad (G/ML) Cantidad de Sustancia (Mmol) Equivalentes QuímicosOscar UrielAún no hay calificaciones
- Práctica 7 SÍNTESIS DE PIRIMIDINASDocumento2 páginasPráctica 7 SÍNTESIS DE PIRIMIDINASVanya MenesesAún no hay calificaciones
- ChavarriaArias InformeP5Documento3 páginasChavarriaArias InformeP5Daniel ChavarriaAún no hay calificaciones
- QO LLL Meneses Carlos Reporte Práctica No. 5Documento6 páginasQO LLL Meneses Carlos Reporte Práctica No. 5Oscar UrielAún no hay calificaciones
- Informe de Laboratorio Estequiometria y Estado GaseosoDocumento8 páginasInforme de Laboratorio Estequiometria y Estado Gaseosojuan david acevedo cubidesAún no hay calificaciones
- Reacciones de síntesis y descomposición en laboratorio de química general IDocumento9 páginasReacciones de síntesis y descomposición en laboratorio de química general IPatricia CastroAún no hay calificaciones
- Practica 2. Organica Industrial Obtencion de La BenzoinaDocumento2 páginasPractica 2. Organica Industrial Obtencion de La BenzoinaOfelia RodriguezAún no hay calificaciones
- Producción Del EtilterbutileterDocumento12 páginasProducción Del Etilterbutileterejidh aeqweAún no hay calificaciones
- Trabajo Práctico Nº1 QobDocumento6 páginasTrabajo Práctico Nº1 QobMiyer RiveroAún no hay calificaciones
- InformeDocumento6 páginasInformeJuan MontoyaAún no hay calificaciones
- Universidad de San Carlos de Guatemala: Estequiometría de las reacciones de descomposiciónDocumento15 páginasUniversidad de San Carlos de Guatemala: Estequiometría de las reacciones de descomposiciónArnoldo DanielAún no hay calificaciones
- Purificación de ácido benzoico y acetanilidaDocumento9 páginasPurificación de ácido benzoico y acetanilidaEduardo Marambio LuceroAún no hay calificaciones
- Reaccion de DesidratacionDocumento9 páginasReaccion de DesidratacionFernanda MartinezAún no hay calificaciones
- Reporte 5 PirazolonasDocumento4 páginasReporte 5 PirazolonasAnonymous enA4SSAún no hay calificaciones
- Halogenacion de ParafinasDocumento9 páginasHalogenacion de ParafinasJuly Sandoval100% (2)
- Informe Formacion de HalurosDocumento6 páginasInforme Formacion de HalurosCatty DelgadoAún no hay calificaciones
- Sintesis de DiabenzalacetonaDocumento13 páginasSintesis de DiabenzalacetonaGustavo Javier Pérez ContrerasAún no hay calificaciones
- Practica 2 Calor de ReaccionDocumento8 páginasPractica 2 Calor de ReaccionAxel Moreno ModestoAún no hay calificaciones
- Reporte Diels Alder-1Documento5 páginasReporte Diels Alder-1Eduardo Hernández HuertaAún no hay calificaciones
- Informe 1 - Orgánica IIIDocumento5 páginasInforme 1 - Orgánica IIIItzel Fernández AlcántaraAún no hay calificaciones
- P5 Nitracion Del Benzoato de MetiloDocumento7 páginasP5 Nitracion Del Benzoato de MetiloandresaoOPAún no hay calificaciones
- Condensación Claisen-Schmidt reacción carbonilo grupoDocumento7 páginasCondensación Claisen-Schmidt reacción carbonilo grupoMoy Ortega MuliaAún no hay calificaciones
- Informe de Laboratorio N2 ORGA 2 - Sintesis de La P NitroacetanilidaDocumento12 páginasInforme de Laboratorio N2 ORGA 2 - Sintesis de La P Nitroacetanilidakelvin Carrero100% (1)
- Lab ROF-5Documento8 páginasLab ROF-5Liliana CalixtoAún no hay calificaciones
- Síntesis de DibenzalacetonaDocumento5 páginasSíntesis de DibenzalacetonaDaniela Rios100% (1)
- Obtención de n-octanoDocumento6 páginasObtención de n-octanopulidochimal2Aún no hay calificaciones
- Síntesis p-nitroacetanilidaDocumento14 páginasSíntesis p-nitroacetanilidamilukrAún no hay calificaciones
- Preparacion Del Acetato N-ButiloDocumento4 páginasPreparacion Del Acetato N-ButiloMelina Villegas100% (1)
- Lab 7 Cristian Uribe 30 OctDocumento4 páginasLab 7 Cristian Uribe 30 OctCarlos MendozaAún no hay calificaciones
- Rodriguez Pacheco P4Documento4 páginasRodriguez Pacheco P4Oscar UrielAún no hay calificaciones
- Práctica 2 Deshidratación de AlcoholesDocumento6 páginasPráctica 2 Deshidratación de AlcoholesCR RG0% (1)
- Informe Reacción Claisen SchmidtDocumento7 páginasInforme Reacción Claisen SchmidtJUAN PABLO OCAMPO SANCHEZAún no hay calificaciones
- GUÍA PARA PREPARARSE Y REALIZAR EL PREINFORME Práctica No. 8 Esterificación Catalítica y SublimaciónDocumento9 páginasGUÍA PARA PREPARARSE Y REALIZAR EL PREINFORME Práctica No. 8 Esterificación Catalítica y SublimaciónDaniel Dario Hernandez TobonAún no hay calificaciones
- Síntesis de Benzocaína a partir de PABA con distintos catalizadoresDocumento6 páginasSíntesis de Benzocaína a partir de PABA con distintos catalizadoresEmilyAún no hay calificaciones
- 142 QI-Acido Fenoxiacetico-MARLENDocumento22 páginas142 QI-Acido Fenoxiacetico-MARLENGIovanni MurguiaAún no hay calificaciones
- Obtención del éter β-naftil metílico (nerolina)Documento11 páginasObtención del éter β-naftil metílico (nerolina)MyriamAún no hay calificaciones
- N - OctanoDocumento5 páginasN - OctanoYareFloresAún no hay calificaciones
- Practica 7Documento7 páginasPractica 7Valery.Aún no hay calificaciones
- Química Orgánica: Síntesis de Octanoato de EtiloDocumento5 páginasQuímica Orgánica: Síntesis de Octanoato de EtiloGabriela RodriguezAún no hay calificaciones
- Reporte Práctica 8 Orgánica 2Documento7 páginasReporte Práctica 8 Orgánica 2Mariana MezaAún no hay calificaciones
- Marco Teorico AldehidosDocumento7 páginasMarco Teorico AldehidosKrlos Alvarez0% (1)
- Reacciones QuímicasDocumento7 páginasReacciones QuímicasEduardo J Romero PAún no hay calificaciones
- Informe de Laboratorio 6 de QuimicaDocumento9 páginasInforme de Laboratorio 6 de QuimicaJuan Camilo CalderonAún no hay calificaciones
- Obtención de 1-Fenil-2,5-DimetilpirrolDocumento6 páginasObtención de 1-Fenil-2,5-DimetilpirrolJesús HernándezAún no hay calificaciones
- Descomposicion Del Peroxido de HidrogenoDocumento11 páginasDescomposicion Del Peroxido de HidrogenoAzul_fqaazAún no hay calificaciones
- Ejercicios de síntesis orgánicaDocumento4 páginasEjercicios de síntesis orgánicaCasandra AguirreAún no hay calificaciones
- Laboratorio 1.1 - DibenzilideneacetonaDocumento11 páginasLaboratorio 1.1 - DibenzilideneacetonaElvis RenzoAún no hay calificaciones
- Plan de Trabajo 8Documento10 páginasPlan de Trabajo 8raqueteteAún no hay calificaciones
- AcetanilidaDocumento11 páginasAcetanilidagladysdcarloAún no hay calificaciones
- Práctica #8Documento11 páginasPráctica #8jorge zapataAún no hay calificaciones
- Liq IV Practica 1.2Documento2 páginasLiq IV Practica 1.2Kristhian ZavalaAún no hay calificaciones
- Síntesis de dibenzalacetona por condensación aldólicaDocumento4 páginasSíntesis de dibenzalacetona por condensación aldólicaCamila Cardenas LancherosAún no hay calificaciones
- Condensacion Aldolica Reporte AutoguardaDocumento7 páginasCondensacion Aldolica Reporte AutoguardaCindy VillacisAún no hay calificaciones
- Evaluación de la inactivación enzimática de catalasa y peroxidasa en acelga tratada térmicamenteDocumento7 páginasEvaluación de la inactivación enzimática de catalasa y peroxidasa en acelga tratada térmicamentePio AvilaAún no hay calificaciones
- Producción de ETBE - SÍNTESISDocumento55 páginasProducción de ETBE - SÍNTESISEduardo Manrique Hidalgo100% (1)
- Practica 3 Deshidratación de Alcoholes Reparado La BuenaDocumento5 páginasPractica 3 Deshidratación de Alcoholes Reparado La BuenaElie floresAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Diseño de plásmidos recombinantes con SnapGeneDocumento10 páginasDiseño de plásmidos recombinantes con SnapGeneOscar UrielAún no hay calificaciones
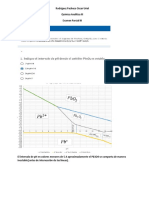
- El Intervalo de PH en Valores Menores de 5.4 Aproximadamente El Pb3O4 Se Comporta de Manera Inestable (Antes de Intersección de Las Líneas)Documento10 páginasEl Intervalo de PH en Valores Menores de 5.4 Aproximadamente El Pb3O4 Se Comporta de Manera Inestable (Antes de Intersección de Las Líneas)Oscar UrielAún no hay calificaciones
- Modelo de Reaccion de Oxidos No Metalicos, Acidos Y Sales-Estructura de Formulas Quimicas Inorganicas-Tipos de Reacciones Quimicas InorganicacasDocumento2 páginasModelo de Reaccion de Oxidos No Metalicos, Acidos Y Sales-Estructura de Formulas Quimicas Inorganicas-Tipos de Reacciones Quimicas InorganicacasOscar UrielAún no hay calificaciones
- Articulo de OpinionDocumento2 páginasArticulo de OpinionOscar UrielAún no hay calificaciones
- Procedimiento-XRDDocumento2 páginasProcedimiento-XRDOscar UrielAún no hay calificaciones
- Comportamiento de Pb3O4 a diferentes pHDocumento13 páginasComportamiento de Pb3O4 a diferentes pHOscar UrielAún no hay calificaciones
- El Intervalo de PH en Valores Menores de 5Documento12 páginasEl Intervalo de PH en Valores Menores de 5Oscar UrielAún no hay calificaciones
- IF4 QAE1 Ourp A-BDocumento1 páginaIF4 QAE1 Ourp A-BOscar UrielAún no hay calificaciones
- PRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Documento11 páginasPRÁCTICA Tris (Dialquilditiocarbamatos) de Bismuto (III)Oscar UrielAún no hay calificaciones
- Práctica No.3 Estaño - PlomoDocumento8 páginasPráctica No.3 Estaño - PlomoOscar UrielAún no hay calificaciones
- Ingeniería Genética y Biotecnología, Capitulo 11 Del BrockDocumento6 páginasIngeniería Genética y Biotecnología, Capitulo 11 Del BrockOscar UrielAún no hay calificaciones
- TiotetrazolesDocumento6 páginasTiotetrazolesOscar UrielAún no hay calificaciones
- Rodríguez Pacheco Oscar Uriel Química Analítica III Examen Parcial IIIDocumento13 páginasRodríguez Pacheco Oscar Uriel Química Analítica III Examen Parcial IIIOscar UrielAún no hay calificaciones
- Qui 2Documento2 páginasQui 2Oscar UrielAún no hay calificaciones
- Jefe empaque México experiencia química UNAMDocumento5 páginasJefe empaque México experiencia química UNAMOscar UrielAún no hay calificaciones
- Práctica No.1 ExplosivosDocumento6 páginasPráctica No.1 ExplosivosOscar UrielAún no hay calificaciones
- I3 Qae1 Ourp CVDocumento2 páginasI3 Qae1 Ourp CVOscar UrielAún no hay calificaciones
- Concierto. Rodriguez Oscar C&ADocumento7 páginasConcierto. Rodriguez Oscar C&AOscar UrielAún no hay calificaciones
- QAE1 OURP RedoxDocumento2 páginasQAE1 OURP RedoxOscar UrielAún no hay calificaciones
- Caracterización de la sal de Fremy mediante espectroscopia IR y susceptibilidad magnéticaDocumento6 páginasCaracterización de la sal de Fremy mediante espectroscopia IR y susceptibilidad magnéticaOscar UrielAún no hay calificaciones
- Rodríguez Oscar TAREA TaxonomíaDocumento1 páginaRodríguez Oscar TAREA TaxonomíaOscar UrielAún no hay calificaciones
- Yo Fui - Rodriguez OscarDocumento1 páginaYo Fui - Rodriguez OscarOscar UrielAún no hay calificaciones
- Oscar Uriel Rodríguez Pacheco: Experiencia LaboralDocumento5 páginasOscar Uriel Rodríguez Pacheco: Experiencia LaboralOscar UrielAún no hay calificaciones
- I5 Qae1 Ourp ComDocumento1 páginaI5 Qae1 Ourp ComOscar UrielAún no hay calificaciones
- DeterminaNaClSoluciónDocumento2 páginasDeterminaNaClSoluciónOscar UrielAún no hay calificaciones
- Centro de Estudios Científicos y Tecnológicos NDocumento1 páginaCentro de Estudios Científicos y Tecnológicos NOscar UrielAún no hay calificaciones
- REACCIONES EXPLOSIVAS EN QUÍMICA COVALENTEDocumento9 páginasREACCIONES EXPLOSIVAS EN QUÍMICA COVALENTEOscar UrielAún no hay calificaciones
- Portada FisicaDocumento4 páginasPortada FisicaOscar UrielAún no hay calificaciones
- Yo Soy-Rodriguez OscarDocumento1 páginaYo Soy-Rodriguez OscarOscar UrielAún no hay calificaciones
- UNAM Facultad de Química comunicación sobre el ego dependienteDocumento1 páginaUNAM Facultad de Química comunicación sobre el ego dependienteOscar UrielAún no hay calificaciones
- Practica 1º Parcial 721Documento8 páginasPractica 1º Parcial 721alvarito2012Aún no hay calificaciones
- AlquinosDocumento2 páginasAlquinoslizAún no hay calificaciones
- PROBLEMAS DE ESPECTROFOTOMETRÍA Y CALIBRACIÓNDocumento13 páginasPROBLEMAS DE ESPECTROFOTOMETRÍA Y CALIBRACIÓNUkeAún no hay calificaciones
- Alr L: AlmidónDocumento9 páginasAlr L: AlmidónVerónica SánchezAún no hay calificaciones
- Terpenos: metabolitos secundarios de gran importanciaDocumento22 páginasTerpenos: metabolitos secundarios de gran importanciaCielo DomínguezAún no hay calificaciones
- La FERMENTACIÓN LÁCTICA Es Un Proceso Celular Anaeróbico Donde Se Utiliza GLUCOSA para Obtener ENERGÍA y Donde El Producto de Desecho Es El ÁCIDO LÁCTICODocumento4 páginasLa FERMENTACIÓN LÁCTICA Es Un Proceso Celular Anaeróbico Donde Se Utiliza GLUCOSA para Obtener ENERGÍA y Donde El Producto de Desecho Es El ÁCIDO LÁCTICOGabriela V. OchoaAún no hay calificaciones
- Informe Jabones y DetergentesDocumento3 páginasInforme Jabones y DetergentesSebastianVasquezMolinaAún no hay calificaciones
- Higado de Pollo y Agua OxigenadaDocumento3 páginasHigado de Pollo y Agua OxigenadaRamy Olivera73% (40)
- Terminos PDFDocumento6 páginasTerminos PDFAbelardo Centeno TevesAún no hay calificaciones
- Examen Mesa 3226 B II-2020Documento1 páginaExamen Mesa 3226 B II-2020erik gomezAún no hay calificaciones
- Teorias Del Origen de Los Hidrocarburos (VASCONEZGIOVANNY)Documento9 páginasTeorias Del Origen de Los Hidrocarburos (VASCONEZGIOVANNY)Geovany VasconezAún no hay calificaciones
- Clase 8 Sem 4 - NitrógenoDocumento25 páginasClase 8 Sem 4 - NitrógenoEliane AriasAún no hay calificaciones
- Fibras TextilesDocumento5 páginasFibras TextilesGustavo Noj0% (1)
- TPDocumento4 páginasTPAlfonso PepeAún no hay calificaciones
- Elaboracion de Una EtiquetaDocumento5 páginasElaboracion de Una EtiquetaDavvid LunaAún no hay calificaciones
- Propiedades Físicas y Químicas de Los Derivados HalogenadosDocumento8 páginasPropiedades Físicas y Químicas de Los Derivados HalogenadosCarlos MendivilAún no hay calificaciones
- Síntesis de DibenzalacetonaDocumento8 páginasSíntesis de DibenzalacetonaLalo AguerrilaAún no hay calificaciones
- Ficha 3 HidrocarburosDocumento6 páginasFicha 3 HidrocarburosMario Martin50% (2)
- Transporte PasivoDocumento13 páginasTransporte PasivoliyimerAún no hay calificaciones
- Pre Informe N°6Documento5 páginasPre Informe N°6Yared OrihuelaAún no hay calificaciones
- Ge BioquimicaDocumento8 páginasGe BioquimicaMeLy ArriagaAún no hay calificaciones
- Clase 22 Sistema Digestivo PDFDocumento26 páginasClase 22 Sistema Digestivo PDFQuimica TecnologiaAún no hay calificaciones
- La Célula-Estrutura Y Funciones.. DAGC2018Documento28 páginasLa Célula-Estrutura Y Funciones.. DAGC2018Duvan GómezAún no hay calificaciones
- Extraccion de AlmidonDocumento13 páginasExtraccion de AlmidonVeronica ValdaAún no hay calificaciones
- Síntesis Del Complejo Polioxometalato OctamolibdatoDocumento6 páginasSíntesis Del Complejo Polioxometalato OctamolibdatoSofia Castillo MoralesAún no hay calificaciones
- Unidad 4 Anillos de Cuatro MiembrosDocumento40 páginasUnidad 4 Anillos de Cuatro MiembrosAlexis ZavalaAún no hay calificaciones
- LacaCatalizadoraAcidoDocumento1 páginaLacaCatalizadoraAcidoLaura RiveraAún no hay calificaciones
- Plantilla en Excel Formulario EAI-2014Documento15 páginasPlantilla en Excel Formulario EAI-2014Sanjuriel SanchezAún no hay calificaciones
- Aplicaciones de AlcoholesDocumento26 páginasAplicaciones de AlcoholesDaniel GarabitoAún no hay calificaciones
- Verificacion Diaria de VehiculosDocumento3 páginasVerificacion Diaria de VehiculosJonathan Martinez GuerraAún no hay calificaciones