100% encontró este documento útil (2 votos)
619 vistas41 páginasRegulación del Equilibrio Ácido-Base
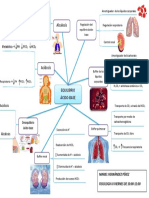
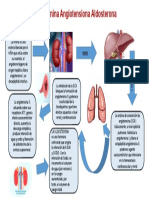
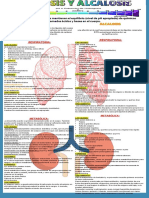
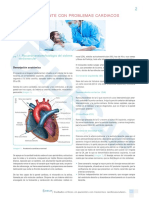
El documento describe los principales sistemas de regulación del equilibrio ácido-base en el cuerpo humano. El pH de los fluidos corporales se mantiene entre 7.35-7.45 a través de los sistemas amortiguadores del bicarbonato, las proteínas y la hemoglobina. Estos sistemas amortiguan los iones hidrógeno generados como subproductos del metabolismo celular a través de reacciones químicas que implican dióxido de carbono, fosfatos y amonio. Los pulmones y riñones también juegan
Cargado por
Läürä Puitiza AltamiranoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PPTX, PDF, TXT o lee en línea desde Scribd
100% encontró este documento útil (2 votos)
619 vistas41 páginasRegulación del Equilibrio Ácido-Base
El documento describe los principales sistemas de regulación del equilibrio ácido-base en el cuerpo humano. El pH de los fluidos corporales se mantiene entre 7.35-7.45 a través de los sistemas amortiguadores del bicarbonato, las proteínas y la hemoglobina. Estos sistemas amortiguan los iones hidrógeno generados como subproductos del metabolismo celular a través de reacciones químicas que implican dióxido de carbono, fosfatos y amonio. Los pulmones y riñones también juegan
Cargado por
Läürä Puitiza AltamiranoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PPTX, PDF, TXT o lee en línea desde Scribd