Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Alcoholes y Fenoles - Laboratorio Química Orgánica II
Cargado por
AyudaFIQ-SMTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Alcoholes y Fenoles - Laboratorio Química Orgánica II
Cargado por
AyudaFIQ-SMCopyright:
Formatos disponibles
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS
(Universidad del Perú, Decana de América)
FACULTAD DE QUÍMICA E
INGENIERÍA QUÍMICA
ESCUELA PROFESIONAL DE
INGENIERÍA QUÍMICA
Química Orgánica II- Laboratorio
INFORME DE LABORATORIO: N°1
“ALCOHOLES Y FENOLES”
PROFESORA: Melissa Rabanal Atalaya
GRUPO: 2
INTEGRANTES:
Chuquinaupa Castillo, Bryan 22070132
Riveros Avila, Jairo 22070042
Quispe Huaman Rodrigo 22070155
Tantalean Sarmiento, Sebastian Jose 22070177
Lima - Perú
2023
UNMSM - Facultad de Química e Ingeniería Química 0
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
Índice
I. RESUMEN............................................................................................................................ 1
II. OBJETIVOS.........................................................................................................................2
III. INTRODUCCIÓN................................................................................................................ 3
IV. PARTE TEÓRICA............................................................................................................... 4
V. PARTE EXPERIMENTAL.................................................................................................... 8
VI. ANÁLISIS DE RESULTADOS..........................................................................................15
VIII. RECOMENDACIONES.................................................................................................. 19
IX. BIBLIOGRAFÍA................................................................................................................ 20
X. CUESTIONARIO............................................................................................................... 21
UNMSM - Facultad de Química e Ingeniería Química 1
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
I. RESUMEN
Esta experiencia involucró la evaluación de las propiedades físicas de los alcoholes y los
fenoles, además de llevar a cabo una diferenciación de alcoholes mediante una serie de
experimentos. En la sección relacionada con los alcoholes, se emplearon tres tipos
distintos: 1-propanol, 2-propanol y alcohol terbutílico. Estos alcoholes fueron sometidos a
diversos análisis para determinar su capacidad de disolución en un solvente apolar (éter de
petróleo) y en un solvente polar (agua). Se observó su reacción con el reactivo de Lucas
(ZnCl₂), lo que provocó la formación de carbocationes en función de su velocidad. También
se llevaron a cabo pruebas de reacción con sodio metálico (Na) para identificar cuál de los
tres alcoholes reaccionaba de manera más rápida. Además, se realizó una observación de
su reacción de oxidación utilizando dicromato de potasio (K2Cr2O7).
Por otro lado, se verificó la solubilidad de los fenoles en agua y en hidróxido de sodio
(NaOH). Se llevó a cabo la reacción del fenol y la resorcina (benceno-1,3-diol) en tubos de
ensayo separados con cloruro de hierro (FeCl3). Un procedimiento similar se aplicó
utilizando agua de bromo (Br₂/H2O). Al analizar todos estos resultados, se procedió a
realizar una discusión y a establecer conclusiones basadas en los hallazgos obtenidos.
UNMSM - Facultad de Química e Ingeniería Química 1
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
II. OBJETIVOS
Objetivos generales
● Conocer las propiedades químicas de los alcoholes y fenoles
● Hacer reacciones de caracterización y diferenciación de alcoholes y fenoles.
● Clasificar a los alcoholes y fenoles
Objetivos particulares
● Verificar la solubilidad de los alcoholes y fenoles
● Aplicar el reactivo de Lucas a los tres tipos de alcoholes
● Hacer la reacción de oxidación de los tres tipos de alcoholes
● Realizar distintos tipos de reacciones con el fenol y observar sus cambios
● Estudiar la utilidad y aplicabilidad de los alcoholes y fenoles.
UNMSM - Facultad de Química e Ingeniería Química 2
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
III. INTRODUCCIÓN
La finalidad de esta práctica de laboratorio es caracterizar a los alcoholes y fenoles
mediante diferentes reacciones, para conocer sus propiedades físicas y químicas, también
se realizará pruebas de solubilidad, pruebas de identificación, entre otros.
Los alcoholes y fenoles se pueden obtener como producto de la sustitución del agua, osea
que uno de los átomos de hidrógeno del carbono es reemplazado por los radicales
orgánicos.
Los alcoholes son utilizados para generar productos industriales y disolventes en industrias
de textiles, colorantes, productos químicos, alimentos, etc. Los fenoles son utilizados en los
explosivos, fertilizantes, pinturas plásticos, caucho, drogas, papel, jabón, fotográficos.
Utilizaremos la prueba de Lucas para poder identificar los tipos de alcoholes mediante la
presencia de turbidez como causa de echar el reactivo a los alcoholes muestras.
El Fenol es sensible a agentes oxidantes. La escisión del átomo de Hidrógeno perteneciente
al grupo Hidroxilo del Fenol, es sucedida por la estabilización por resonancia del radical
feniloxilo resultante. El radical así formado puede continuar oxidándose con facilidad; el
manejo de las condiciones de oxidación y del tipo de agente oxidante empleado, puede
conllevar a la formación de productos tales como dihidroxiBenceno, trioxiBenceno y/o
quinonas. Las propiedades químicas mencionadas hacen al fenol un buen antioxidante, que
actúa como un agente de captura de radicales.
Finalmente es importante conocer estas propiedades e identificarlas en caso del alcohol, ya
que posee una gran variedad de usos y como estudiantes de Ingeniería química eso se
puede aprovechar.
En este informe se redactan los resultados de algunas de las reacciones de caracterización
y diferenciación de alcoholes y fenoles realizados en el laboratorio.
UNMSM - Facultad de Química e Ingeniería Química 3
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
IV. PARTE TEÓRICA
4.1 ALCOHOLES
Los alcoholes tienen uno o más grupos hidroxilo químicos (-OH) unidos covalentemente a
átomos de carbono saturados en su estructura (enlaces simples sólo a átomos adyacentes),
formando un grupo carbonilo (-C-OH). Es un compuesto orgánico específico. El alcohol es
un compuesto orgánico que existe ampliamente en la naturaleza y juega un papel
importante en los organismos vivos, especialmente en la síntesis orgánica.
Fuente: Concepto. https://concepto.de/alcoholes/.
4.1.1 TIPOS DE ALCOHOLES
Los alcoholes pueden clasificarse de acuerdo al número de grupos hidroxilo que
presenten en su estructura:
Alcoholes primarios: El hidroxilo (-OH) se encuentra en un carbono que está conectado a
un solo átomo de carbono adicional. A modo de ilustración:
Fuente: Concepto. https://concepto.de/alcoholes/.
UNMSM - Facultad de Química e Ingeniería Química 4
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
Alcoholes secundarios: El hidroxilo (-OH) se sitúa en un carbono que está enlazado a
otros dos átomos de carbono diferentes. A modo de ilustración:
Fuente: Concepto. https://concepto.de/alcoholes/.
Alcoholes Terciarios: El hidroxilo (-OH) se encuentra en un carbono que está enlazado, a
su vez, con tres átomos de carbono diferentes. A modo de ilustración:
Fuente Concepto. https://concepto.de/alcoholes/.
4.1.2 SOLUBILIDAD DE ALCOHOLES
Los alcoholes pequeños son completamente solubles en agua; mezclar los dos en cualquier
proporción genera una sola solución. Sin embargo, la solubilidad disminuye a medida que
aumenta la longitud de la cadena hidrocarbonada en el alcohol. A cuatro átomos de carbono
y más allá, la disminución de la solubilidad es notable; una sustancia de dos capas puede
aparecer en un tubo de ensayo cuando las dos se mezclan
UNMSM - Facultad de Química e Ingeniería Química 5
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
4.1.3 PRUEBA DE LUCAS
El Test de Lucas es utilizado en alcoholes con el propósito de distinguir entre los alcoholes
primarios, secundarios y terciarios. Este reactivo reemplaza el grupo OH- de un alcohol
terciario con Cl-, generando una reacción positiva que se manifiesta como una turbidez
instantánea. El alcohol secundario requiere aproximadamente de 1 a 3 minutos para
reaccionar, mientras que el alcohol primario no muestra reacción alguna.
4.1.4 PRUEBA CON SODIO METÁLICO
Cuentan con el respaldo de una referencia que indica que los alcóxidos metálicos
originados a partir de metanol y etanol se generan de forma veloz mediante interacciones
con sodio metálico, mientras que los alcoholes secundarios presentan una reactividad
menor que los primarios. En el caso de los alcoholes terciarios, como el t-butanol, su
reacción con sodio ocurre de manera extremadamente pausada, por lo cual se utiliza
potasio, que es más reactivo, para producir el anión t-butóxido.
4.1.5 PRUEBA DE REACCIONES DE OXIDACIÓN
Se logró comprender la manera de identificar la categoría de alcohol utilizando dicromato de
potasio, ya que este reactivo provoca respuestas distintas en los alcoholes primarios y
secundarios, pero no genera reacción alguna con los terciarios. Además, se observó que es
inmiscible con el alcohol primario y, aparentemente, miscible con el secundario.
4.2 FENOLES
Los fenoles constituyen un conjunto de compuestos orgánicos que poseen en su estructura
un grupo funcional hidroxilo enlazado a un radical arilo. En consecuencia, la fórmula general
para un fenol se expresa como Ar - OH. Los fenoles simples se presentan en estado líquido
o sólido, con un aroma característico, demostrando baja solubilidad en agua y alta
solubilidad en solventes orgánicos. Algunos de ellos se utilizan como agentes
desinfectantes, si bien son perjudiciales y generan irritación.
Comparados con el agua y los alcoholes, los fenoles poseen una mayor acidez debido a la
estabilidad que obtiene el ión fenóxido por la resonancia. Dicha resonancia implica la
UNMSM - Facultad de Química e Ingeniería Química 6
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
dispersión de la carga del ión a lo largo de toda la molécula en lugar de concentrarse en un
átomo específico, como se observa en los aniones alcóxido.
FIGURA 5. FENOL
Fuente:https://www.infoagro.com/documentos/images/1369.asp?foto=figura_1__estructura_
quimica_del_fenol
4.2.1 PRUEBA CON CLORURO FÉRRICO
La prueba del cloruro férrico es un método de análisis basado en el color que principalmente
se emplea para identificar fenoles. En esta prueba, se utiliza una solución al 1%. Si la
tonalidad resultante es un amarillo tenue, similar al color del Cl3Fe, la reacción se considera
negativa. Por otro lado, si se observa un cambio de color hacia tonos morados, violetas o
púrpuras, se evidencia la presencia de un fenol. Este fenómeno puede explicarse por la
formación de un complejo entre el hierro y los iones fenóxido que se originan al eliminar un
hidrógeno del grupo hidroxilo debido a los átomos de cloro presentes en la sal de hierro.
Estos complejos son responsables del cambio de color observado.
4.2.2 PRUEBA CON AGUA DE BROMO
La interacción entre el bromo y el fenol representa un proceso de sustitución electrofílica
aromática, en el cual el bromo reemplaza en tres ocasiones en la estructura del anillo
bencénico, generando el compuesto conocido como 2, 4, 6-tribromofenol. Sin embargo, esto
no concuerda con la siguiente observación: "Este compuesto es insoluble en agua, lo que
provoca su precipitación. Esta característica explica la formación de los cristales
amarillentos que se pueden observar en el laboratorio al llevar a cabo esta prueba".
UNMSM - Facultad de Química e Ingeniería Química 7
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
V. PARTE EXPERIMENTAL
Alcoholes
a) Prueba de solubilidad
No se apreció ninguna reacción por parte de los tres tipos de alcoholes con el agua.
Además se observó que todos son solubles en el agua.
Imagen 01: Los 3 tipos de alcoholes son solubles en agua
b) Ensayo de Lucas
Alcoholes primarios (etanol)
Al agregar el reactivo de Lucas a un alcohol primario se observó que no hubo cambios
físicos en el producto. No se aprecia la turbidez.
Imagen 02: Etanol con el reactivo de Lucas
UNMSM - Facultad de Química e Ingeniería Química 8
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
Alcoholes secundarios (2-propanol)
Al agregar el reactivo de Lucas a un alcohol secundario se observó que dentro de 5-10 min
después de agregar el reactivo una turbidez en el producto.
Imagen 03: Formación de turbidez del 2-propanol después de 5 min
Alcoholes terciarios (ter-butilo)
Al agregar el reactivo de Lucas a un alcohol terciario se observó que de manera inmediata
la presencia de una turbidez en el producto después de agregar el reactivo.
Imagen 04: Formación de la turbidez de inmediato en el ter-butílico
UNMSM - Facultad de Química e Ingeniería Química 9
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
c) Con sodio metálico
Alcohol primario (etanol)
Al agregar el sodio metálico al alcohol primario se evidenció una reacción de manera
inmediata y un burbujeo muy rápido.
Alcohol secundario (2-propanol)
Al agregar el sodio metálico al alcohol secundario se evidenció una reacción con velocidad
moderada y un burbujeo rápido.
Alcohol terciario (ter-butilo)
Al agregar el sodio metálico al alcohol terciario se evidenció una reacción lenta.
Imagen 05: Los 3 alcoholes reaccionando de manera distinta con el sodio
d) Reacción de oxidación
Alcoholes primarios (etanol)
UNMSM - Facultad de Química e Ingeniería Química 10
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
Al agregar el dicromato ,que es una sustancia de color naranja, a un alcohol primario se
observó que se produjo una coloración de color azul.
Alcoholes secundarios (2-propanol)
Al agregar el dicromato al alcohol secundario se produjo una poca coloración azul verdosa.
Se colocó en un baño maría donde se aumentó la coloración del producto.
Alcoholes terciarios (ter-butilo)
Al agregar el dicromato al alcohol terciario se observó que no hubo ese cambio de
coloración que tuvo con respecto a los otros dos alcoholes.
Imagen 06: Resultados de la oxidación de los 3 alcoholes
Fenoles
a)Solubilidad
Notamos que el fenol es prácticamente soluble en agua aunque limitadamente debido al
anillo aromático , con respecto al color de la mezcla no varía mucho con respecto al
fenol.En la otra mezcla con el NaOH nos dimos cuenta que el fenol es aún más soluble con
el NaOH que con el agua , esto es debido a que el grupo hidroxilo(-OH) del fenol se
desprotona para formar el ion fenolato(-O) que luego se une al ion sodio para así formar el
Fenolato de Sodio, con respecto al color de la mezcla , tampoco varió mucho y se mantuvo
transparente.
UNMSM - Facultad de Química e Ingeniería Química 11
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
Reacción del fenol mas NaOH
𝐶6𝐻5𝑂𝐻 + 𝑁𝑎𝑂𝐻→ 𝐶6𝐻5𝑂𝑁𝑎 + 𝐻20
Imagen 07: Fenol más H20 Imagen 08: Fenol mas NaOH
b)Reacción con cloruro Férrico
Fenol mas Cloruro Férrico.-
Notamos que la reacción del fenol con cloruro férrico forma un color violeta debido a la
formación de un complejo
Reacción
Imagen 09: Fenol más FeCl2
UNMSM - Facultad de Química e Ingeniería Química 12
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
Fenol más Resorcinol.-
Al mezclar el Fenol mas Resorcinol notamos un cambio de color notorio de transparente a
verdoso , lo cual nos indica la presencia del fenol en la muestra
Imagen 10: Fenol más Resorcinol
c)Reacción con agua de Bromo
Notamos que al agregar Bromo en solución acuosa se forma una solución amarilla , esto es
debido a la estructura química y a las propiedades de absorción de luz que presenta.
Imagen 11: Fenol más agua de bromo
UNMSM - Facultad de Química e Ingeniería Química 13
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
VI. ANÁLISIS DE RESULTADOS
➢ En la prueba de solubilidad del etanol, 2 - propanol y alcohol terbutilico, se pudo
observar que los tres tipos de alcoholes son solubles con el agua, ya que el grupo
hidroxilo que presentan las estructuras, permite que los alcoholes presentan
hidrofilicidad, lo cual eso lo hace miscible con el agua.
➢ En el ensayo del reactivo de lucas se presenció que con el alcohol primario (etanol),
no hubo cambios físicos en el producto, ósea no hubo reacción, dado que este
reactivo es favorecido por el mecanismo Sn1 y se sabe que los alcoholes primarios
reaccionan siguiendo el mecanismo Sn2. Por otro lado con el secundario si se
presentó turbidez (indicador que se dio la reacción) pero de manera lenta, ya que se
pudo apreciar a los 5 - 10 minutos, mientras que con el tert butanol (alcohol terciario)
se dio de manera inmediata.
➢ En la reacción de sodio metálico se vio que con etanol reaccionó de manera
inmediata, eso debido a que la reacción con sodio establece como mecanismo el
Sn2. Por otro lado con los alcoholes terciarios y secundarios se observó reaccionar
de manera más lenta ya que estos presentan obstáculos estéricos, pues tienen
carbonos con grupos alquilo adicionales, lo cual provoca que se ralentice la
reacción.
➢ La reacción de oxidación para el etanol se apreció un cambio de coloración a uno
azul y en él se formó ácido etanoico (ácido carboxílico). Para el caso del 2 -
propanol, se produjo un color azul verdoso en donde se da como producto la
propanona. Respecto con el alcohol terbutilico, no se presentó un cambio de
coloración, tan solo tomo el color naranja del dicromato de potasio, lo cual indica que
no reacciono, ya que para que se dé la reacción necesita de estar en unas
determinadas condiciones.
➢ En la solubilidad de los fenoles se observó que este es soluble tanto con el agua,
como también con el hidróxido de potasio, pero más con este último debido a que el
UNMSM - Facultad de Química e Ingeniería Química 14
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
grupo hidroxilo(-OH) del fenol se desprotona para formar el ion fenolato(-O) que
luego se une al ion sodio para así formar el Fenolato de Sodio y respecto al color de
la mezcla , tampoco varió mucho y se mantuvo transparente.
➢ La reacción de fenol con cloruro férrico dio como producto un complejo, el cual se
determinó por el color violeta que tomó. Respecto al fenol con resorcinol se vio una
coloración verdosa. Por ultimo en la bromación de fenol, la solución se tornó de color
amarilla, debido a la estructura química y propiedades de absorción de la luz que
presente el producto formado.
UNMSM - Facultad de Química e Ingeniería Química 15
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
VII. CONCLUSIONES
● Se comprende la relevancia de los ensayos realizados en este experimento de
laboratorio, ya que los reactivos utilizados demuestran validez, aplicabilidad y precisión
al permitir la distinción precisa de alcoholes primarios, secundarios, terciarios y fenoles
aromáticos.
● Los alcoholes y los fenoles exhiben atributos diferentes a causa de sus respuestas
químicas particulares. Como consecuencia, es viable determinar si se trata de fenoles o
alcoholes mediante el uso de reactivos específicos bajo las condiciones adecuadas.
● Fue evidente que los alcoholes reaccionan de manera distinta en función de si son
primarios, secundarios o terciarios, durante el proceso de oxidación.
● Se verificó que el reactivo de Lucas experimentó una reacción rápida en el alcohol
terciario, seguida del alcohol secundario, que tomó algo más de tiempo, y finalmente en
el alcohol primario, cuya reacción fue la más lenta.
● Se confirmó la capacidad de reacción del sodio metálico con distintos tipos de
alcoholes, lo que da lugar a la formación de alcóxidos de sodio y liberación de
hidrógeno gaseoso. Se observó una reacción instantánea con el alcohol primario,
seguida por el alcohol secundario, que tomó alrededor de un minuto, y finalmente el
alcohol terciario, que requirió más de 5 minutos para reaccionar.
● La reacción entre el fenol y la resorcina con agua de bromo fue confirmada, resultando
en la formación de un precipitado. En el caso del fenol, se obtuvo un precipitado
insoluble, mientras que con la resorcina, el precipitado fue soluble.
● Se confirmó la respuesta de los alcoholes ante el dicromato de potasio en un ambiente
ácido, donde se observó una mayor reactividad en los alcoholes primarios y una menor
reactividad en los alcoholes terciarios. Esta diferencia se atribuye al cambio en el
estado de oxidación del cromo en la reacción.
● Se identificó la disparidad entre alcoholes y fenoles a través de sus propiedades
distintivas y sus reacciones particulares, mediante la ejecución de varios ensayos. Entre
UNMSM - Facultad de Química e Ingeniería Química 16
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
estos, se llevó a cabo la prueba de solubilidad y se empleó el reactivo de cloruro férrico.
En el caso del fenol, la prueba arrojó una coloración morada (indicativo positivo),
mientras que en el alcohol la coloración del reactivo no varió (indicativo negativo).
UNMSM - Facultad de Química e Ingeniería Química 17
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
VIII. RECOMENDACIONES
❖ Se recomienda el uso de pinzas de dimensiones reducidas para dividir el sodio, y es
importante utilizar guantes secos debido a la alta reactividad del sodio metálico.
❖ Al manejar el fenol, es esencial emplear guantes y gafas de protección para prevenir
cualquier contacto con este reactivo, que puede ocasionar quemaduras al entrar en
contacto con la piel o los ojos.
❖ Etiquetar los tubos de ensayo de manera adecuada es fundamental para evitar
confusiones, ya que se emplean numerosos tubos a lo largo del procedimiento.
❖ Realizar una limpieza exhaustiva de los tubos de ensayo y posteriormente enjuagar con
agua destilada es necesario para prevenir reacciones que puedan generar resultados
inexactos.
❖ Se aconseja cortar el sodio metálico en fragmentos pequeños, ya que esto resulta
crucial debido a la prolongada reacción que experimenta con los alcoholes terciarios.
UNMSM - Facultad de Química e Ingeniería Química 18
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
IX. BIBLIOGRAFÍA
"Alcoholes". Autor: Dianelys Ondarse Álvarez. De: Argentina. Para: Concepto.de. Disponible
en: https://concepto.de/alcoholes/. Última edición: 27 de junio de 2023.
AMELIA, E. N. M. ALCOHOLES.
http://ri.uaemex.mx/bitstream/handle/20.500.11799/79678/secme-1022_1.pdf
Propiedades Físicas de Alcoholes. (2022, octubre 30). LibreTexts Español; Libretexts.
https://espanol.libretexts.org/Quimica/Qu%C3%ADmica_Org%C3%A1nica/Mapa%3
A_Qu%C3%ADmica_Org%C3%A1nica_(Wade)/13%3A_Estructura_y_S%C3%ADnt
esis_de_Alcoholes/13.03%3A_Propiedades_F%C3%ADsicas_de_Alcoholes.
Picand, Y., & Dutoit, D. (s/f). reactivo de lucas : definición de reactivo de lucas y sinónimos
de reactivo de lucas (español). sensagent. Recuperado el 27 de agosto de 2023, de
https://diccionario.sensagent.com/reactivo+de+lucas/es-es/
Sebastián, T. R. J., & Cesar, G. V. J. PROPIEDADES FISICAS Y QUIMICAS DE
ALCOHOLES, FENOLES Y ESTERES.
https://d1wqtxts1xzle7.cloudfront.net/60016788/INFORME_7__PROPIEDADES_FISI
CAS_Y_QUIMICAS_DE_ALCOHOLES._FENOLES_Y_ESTERES20190715-121882-
svcwoi-libre.pdf?1563231593=&response-content-disposition=inline%3B+filename%
3DLab_Quimica_Organica_I_Informe_7_Caracte.pdf&Expires=1693548616&Signatu
re=HIRuhG-Pb28DDAfIGi8YkGz0fuQ~WfIqnkMOxkmdZtkGeAPtPDpCN59vKIqZgmu
MF-WKAOHVh067Ci0VeD287sHJVdJzolmZurzadb3V-vIf2qCvflrhhn6P2GPZQ61Uiu
9RRotByLJvuj9duZeHpfLtMup6Lo4~syyS10C552PRov7Apa7nMRgs5ZL~c0CffWZM
nQe9x07adLIujFsGfKIZADJAfUUQxV9yyqS0mldEQR5ALvepyjyN1bEAz7KqXRlCP
WMVPHfj6YnVv6MgtwXZdlQ-u5xAyneHQBuw2Cq0y32Y~zkwC5koWt~qFKAAenYR
mQ6RPTPAO10h7EIsrQ__&Key-Pair-Id=APKAJLOHF5GGSLRBV4ZA
Foto figura 1. Estructura química del fenol. Infoagro. (s. f.-b).
https://www.infoagro.com/documentos/images/1369.asp?foto=figura_1__estructura_
quimica_del_fenol
UNMSM - Facultad de Química e Ingeniería Química 19
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
X. CUESTIONARIO
1.-Escriba todas las reacciones pertinentes.
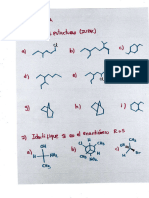
2.-¿Cómo diferencia un alcohol 1rio, 2rio y 3rio.
Los alcoholes primarios, secundarios y terciarios se diferencian en función de la
estructura del carbono al que está unido el grupo hidroxilo (-OH) en la molécula de
alcohol. Aquí tienes una explicación de cada uno: 1. Alcohol primario (1°): En un
alcohol primario, el grupo hidroxilo (-OH) está unido a un carbono que está
conectado a un solo carbono. En otras palabras, el carbono con el grupo hidroxilo
solo tiene un enlace sencillo a otro átomo de carbono. La fórmula general de un
alcohol primario es R-CH2-OH, donde R representa un grupo alquilo. 2. Alcohol
segundo
3.-¿Cómo se mide el grado alcohólico a las personas?
Existen 3 tipos de pruebas de sangre: la prueba del aliento (alcoholímetro), la prueba
de orina y la prueba de sangre (alcoholemia).
●Prueba de Aliento (Alcoholímetro): La persona sopla en un dispositivo llamado
alcoholímetro. Este dispositivo detecta y mide la concentración de alcohol en el
aliento. Finalmente, se calcula una estimación del porcentaje de alcohol en sangre
(BAC). Esta prueba es bastante rápida, sin embargo, los resultados que se obtienen
pueden variar según la persona y otros
factores como el tiempo desde que bebió, el insumo de alimentos con químicos que
también pueden alterar los receptores del dispositivo.
●Prueba de Orina: Se recolecta una muestra de orina y esta es llevada a un
laboratorio para ser analizada.Se calcula una estimación del BAC basado en el nivel
de alcohol contenido en la orina.Esta prueba puede detectar el consumo reciente,
pero tampoco es muy precisa.
UNMSM - Facultad de Química e Ingeniería Química 20
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
●Prueba de Sangre: Se extrae una muestra de sangre a partir de una vena,
posteriormente se analiza en un laboratorio y se determina con precisión el
porcentaje de alcohol en sangre.Esta prueba es más lenta que las demás, pero
posee una alta precisión y es utilizada en situaciones legales y médicas
4- Nombre 2 ejemplos explicativos de industrias en las que se use alcohol.
*Industria de Bebidas Alcohólicas:
Fermentación: El alcohol etílico se produce mediante la fermentación de azúcares
presentes en ingredientes naturales como uvas, cebada, maíz y frutas. En el caso de
la cerveza y el vino, la fermentación convierte los azúcares en alcohol y dióxido de
carbono con la ayuda de levaduras.
Variedad de Bebidas: La industria de bebidas alcohólicas ofrece una amplia gama
de productos que varían en sabor, aroma y concentración de alcohol. Estos incluyen
cerveza, vino, licores, cócteles y licores destilados. Cada tipo de bebida tiene su
propio proceso de producción y perfil de sabor único.
Aspectos Culturales y Sociales: A menudo se asocian con celebraciones, rituales
y momentos sociales. Sin embargo, es importante consumirlas de manera
responsable, ya que el consumo excesivo puede tener efectos negativos en la salud
y el bienestar.
*Industria Farmacéutica:
Extracción de Compuestos Activos: El alcohol es un solvente versátil que puede
disolver una amplia gama de compuestos orgánicos. En la industria farmacéutica, se
utiliza para extraer ingredientes activos de plantas medicinales y otras fuentes
naturales.
Soluciones y Suspensiones: El alcohol se emplea para crear soluciones y
suspensiones estables de medicamentos y productos químicos. Muchas sustancias
activas tienen una mejor solubilidad en alcohol que en agua, lo que permite la
creación de formulaciones más efectivas y de mejor calidad.
UNMSM - Facultad de Química e Ingeniería Química 21
ALCOHOLES Y FENOLES LABORATORIO DE QUÍMICA ORGÁNICA II
Desinfectantes y antisépticos:Las soluciones a base de alcohol, como el alcohol
isopropílico y el alcohol etílico, se usan comúnmente para limpiar y desinfectar
superficies, equipos médicos y la piel antes de procedimientos médicos
5-¿Dónde se encuentran los fenoles en la naturaleza?
Los fenoles, compuestos químicos con propiedades variadas, se encuentran
ampliamente en la naturaleza, presentes en diversas partes de las plantas, como la
corteza, las hojas y las flores. Se hallan en fuentes como plantas medicinales, frutas
y verduras, té, café, productos derivados de plantas como el aceite de oliva y el
vinotinto, así como en productos forestales como la madera y la corteza. Actúan
como antioxidantes y pueden tener efectos beneficiosos para la salud humana, y a
menudo desempeñan un papel en la defensa de las plantas contra patógenos y
herbívoros.
Fuente: Viña, Z (2023). Compuestos fenólicos.
http://sedici.unlp.edu.ar/bitstream/handle/10915/155459/Documento_completo.pdf?sequenc
e=1
UNMSM - Facultad de Química e Ingeniería Química 22
También podría gustarte
- El Mundo de La Cerveza ArtesanalDocumento18 páginasEl Mundo de La Cerveza ArtesanalLucas PérezAún no hay calificaciones
- Alcoholes y Fenoles. Reacciones de Caracterizacion y DiferenciacionDocumento22 páginasAlcoholes y Fenoles. Reacciones de Caracterizacion y DiferenciacionAlexandra Méndez HuertaAún no hay calificaciones
- Documento de Quimica Laboratorio Uae 2022Documento6 páginasDocumento de Quimica Laboratorio Uae 2022Victor SornozaAún no hay calificaciones
- Informe N°1 Alcoholes y FenolesDocumento25 páginasInforme N°1 Alcoholes y FenolesALEJANDRA LUCERO MEJ�A CRUZAún no hay calificaciones
- Sistema UNANIDocumento6 páginasSistema UNANIDelia Gutierrez100% (5)
- Informe Nº3-Propiedades Físicas y Químicas de Los AlcoholesDocumento27 páginasInforme Nº3-Propiedades Físicas y Químicas de Los AlcoholesVIVIANA GARCIAAún no hay calificaciones
- 5to Laboratorio LAS VENGADORASDocumento32 páginas5to Laboratorio LAS VENGADORASRonald Remon CruzAún no hay calificaciones
- Informe - 2 Pruebas de AlcoholesDocumento20 páginasInforme - 2 Pruebas de AlcoholesBRAINERD ROJAS CHAVEZAún no hay calificaciones
- Informe - 2 Pruebas de AlcoholesDocumento20 páginasInforme - 2 Pruebas de AlcoholesBRAINERD ROJAS CHAVEZAún no hay calificaciones
- Informe 6 (7 Alcoholes)Documento7 páginasInforme 6 (7 Alcoholes)Daniel LeviAún no hay calificaciones
- Práctica 2Documento10 páginasPráctica 2José Luis ValenciaAún no hay calificaciones
- Practica 2 Quimica de AlcholesDocumento30 páginasPractica 2 Quimica de AlcholesFreddy DuranAún no hay calificaciones
- Informe 6 (Grupo3)Documento16 páginasInforme 6 (Grupo3)RAMOS OLLACHICA MARYORI JENNIFERAún no hay calificaciones
- Identificación de Alcoholes y Fenoles 4Documento17 páginasIdentificación de Alcoholes y Fenoles 4JULIO CESAR GONZALEZ PACHECOAún no hay calificaciones
- Alcoholes y Fenoles Con CompetenciasDocumento46 páginasAlcoholes y Fenoles Con CompetenciasHaydee Gil MateoAún no hay calificaciones
- Compuestos Carbonílicos y Grupo Carboxílico - Laboratorio Química Orgánica IIDocumento34 páginasCompuestos Carbonílicos y Grupo Carboxílico - Laboratorio Química Orgánica IIAyudaFIQ-SMAún no hay calificaciones
- Practica 6-Quimica OrganicaDocumento25 páginasPractica 6-Quimica OrganicaZHULEM NICKOL AYALA TINEOAún no hay calificaciones
- Informeee 2 1Documento11 páginasInformeee 2 1gabyAún no hay calificaciones
- Hidrocarburos - Laboratorio Química Orgánica 1Documento28 páginasHidrocarburos - Laboratorio Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- INFORME DE LABORATORIO LL PRUEBA DE LUCASDocumento6 páginasINFORME DE LABORATORIO LL PRUEBA DE LUCASINDIRA JOKASTA REINA PARRAGAAún no hay calificaciones
- Informe N°6 Lab. OrganicaDocumento29 páginasInforme N°6 Lab. OrganicaCAICAY OTOYA LUIS EDUARDOAún no hay calificaciones
- 100000b01m-Guia N°3-Labquimi01-Identificacion Cualitativa de Alco.y Fen.Documento14 páginas100000b01m-Guia N°3-Labquimi01-Identificacion Cualitativa de Alco.y Fen.Renato J. AyoraAún no hay calificaciones
- Informe Del AlcoholDocumento7 páginasInforme Del AlcoholCarmen MoriAún no hay calificaciones
- Informe Laboratorio 2 Yenny, Karen y Juan Diego - CN2Documento5 páginasInforme Laboratorio 2 Yenny, Karen y Juan Diego - CN2Mariace GuarinAún no hay calificaciones
- Hidrocarburos CuestionarioDocumento15 páginasHidrocarburos CuestionarioChristianGutierrezSulcaAún no hay calificaciones
- 1 2IV40 - Equipo 1 - OBTENCION DE BENZIDROLDocumento26 páginas1 2IV40 - Equipo 1 - OBTENCION DE BENZIDROLErika SolisAún no hay calificaciones
- Informe #02 Orgánica IIDocumento26 páginasInforme #02 Orgánica IIPIERO EDWARD MERCADO GONZALESAún no hay calificaciones
- Protocolo No.2Documento20 páginasProtocolo No.2Angel QuimAún no hay calificaciones
- Practica 2 Reconocimiento de AlcoholesDocumento6 páginasPractica 2 Reconocimiento de AlcoholesPauü ReinaAún no hay calificaciones
- Informe 6 - HidrocaburosDocumento12 páginasInforme 6 - HidrocaburosJhoana Alexandra Lévano LévanoAún no hay calificaciones
- Química de Los Hidratos de Carbono - Laboratorio Química Orgánica 2Documento23 páginasQuímica de Los Hidratos de Carbono - Laboratorio Química Orgánica 2AyudaFIQ-SMAún no hay calificaciones
- Labo #5 AlcoholesDocumento23 páginasLabo #5 AlcoholesRony Calderon RiveraAún no hay calificaciones
- 3-PROPIEDADES QUÍMICAS DE LOS ALCOHOLES Y FENOLES (Virtual)Documento4 páginas3-PROPIEDADES QUÍMICAS DE LOS ALCOHOLES Y FENOLES (Virtual)Luis Alberto Ramírez HincapiéAún no hay calificaciones
- UntitledDocumento20 páginasUntitledGianfranco PalaciosAún no hay calificaciones
- 1 Alcoholes y FenolesDocumento48 páginas1 Alcoholes y FenolesdiversestoresupplyonlineAún no hay calificaciones
- Informe DESHIDRATACIÓN DE ALCOHOLES..Documento8 páginasInforme DESHIDRATACIÓN DE ALCOHOLES..GIULIANNA NICOLE CHARRIS DI RUGGIEROAún no hay calificaciones
- Guía Práctica 9. Propiedades de Los AlcoholesDocumento4 páginasGuía Práctica 9. Propiedades de Los AlcoholesElena PelaezAún no hay calificaciones
- PRACTICA 4 y 5 DE Q. ORGÁNICA IIDocumento5 páginasPRACTICA 4 y 5 DE Q. ORGÁNICA IIBrayan Contreras JerónimoAún no hay calificaciones
- Obtención de Alcoholes Org. IiDocumento22 páginasObtención de Alcoholes Org. IiJefferson MegoAún no hay calificaciones
- Hid Ro Carb UrosDocumento30 páginasHid Ro Carb UrosPaul Paz CiezaAún no hay calificaciones
- Informe 8 Grupo 3Documento16 páginasInforme 8 Grupo 3RAMOS OLLACHICA MARYORI JENNIFERAún no hay calificaciones
- Informe de Laboratorio 5 - Química 2Documento32 páginasInforme de Laboratorio 5 - Química 2KATHERINE THALIA VILCHEZ VARILLASAún no hay calificaciones
- PRACTICA3Documento4 páginasPRACTICA3Ana CarascoAún no hay calificaciones
- Química Orgánica Introducción 14-05-22Documento26 páginasQuímica Orgánica Introducción 14-05-22Joselyn SimonsAún no hay calificaciones
- Informe de AlcoholesDocumento11 páginasInforme de AlcoholesLarry NelsonAún no hay calificaciones
- INFORME DE LABORATORIO N°2 ACIDOS CARBOXILICOS Quimica Organica-2022-II - Ingeniería QuímicaDocumento24 páginasINFORME DE LABORATORIO N°2 ACIDOS CARBOXILICOS Quimica Organica-2022-II - Ingeniería QuímicaNelson RosalesAún no hay calificaciones
- 11-6 RECONOCIMIENTO DE HIDROCARBUROS y GRUPOS FUNCIONALES IE INDUSTRIALDocumento6 páginas11-6 RECONOCIMIENTO DE HIDROCARBUROS y GRUPOS FUNCIONALES IE INDUSTRIALSantiago Salazar CardonaAún no hay calificaciones
- Trabajo Quimica Eteres Fenoles EpoxidosDocumento66 páginasTrabajo Quimica Eteres Fenoles EpoxidosAngelica Del Aguila ParedesAún no hay calificaciones
- Reactividad de AlcoholesDocumento20 páginasReactividad de AlcoholesWillian MarroquinAún no hay calificaciones
- Informe AlcoholesDocumento12 páginasInforme AlcoholesJavier OrtizAún no hay calificaciones
- Práctica 5 (Virtual) - Propiedades Químicas de Los Alcoholes.Documento4 páginasPráctica 5 (Virtual) - Propiedades Químicas de Los Alcoholes.NataliaOsorioHenaoAún no hay calificaciones
- Introducción AlcoholesDocumento7 páginasIntroducción AlcoholesCharlieTitoValleLeonAún no hay calificaciones
- Práctica 2 - Alcoholes y FenolesDocumento6 páginasPráctica 2 - Alcoholes y FenolesSebastián PinoAún no hay calificaciones
- Informe 2 - Compuestos Carbonílicos y Grupos CarboxilicoDocumento23 páginasInforme 2 - Compuestos Carbonílicos y Grupos Carboxilicopaul bryan arias vidalAún no hay calificaciones
- TALLER Nº2 QUIMICA-okDocumento11 páginasTALLER Nº2 QUIMICA-okCASINO EL CAMPESTREAún no hay calificaciones
- LABORATORION2 IdentificaciondelosgruposfuncionalesDocumento4 páginasLABORATORION2 IdentificaciondelosgruposfuncionalesJefferson Jesús Zapata CamachoAún no hay calificaciones
- Hidrocarburos Organica IDocumento16 páginasHidrocarburos Organica ItanyAún no hay calificaciones
- Universidad Nacional Del Callao Facultad de Ingeniería QuímicaDocumento21 páginasUniversidad Nacional Del Callao Facultad de Ingeniería QuímicaNerit Paucarcaja BuitrónAún no hay calificaciones
- Sexto Informe. Reacciones de Acidos Carboxilicos y DerivadosDocumento9 páginasSexto Informe. Reacciones de Acidos Carboxilicos y DerivadosVíctorMoralesAún no hay calificaciones
- Química de macrocomponentes de alimentosDe EverandQuímica de macrocomponentes de alimentosAún no hay calificaciones
- Sustitutorio Ec. Diferenciales UNMSMDocumento1 páginaSustitutorio Ec. Diferenciales UNMSMAyudaFIQ-SMAún no hay calificaciones
- Evaluacion de Estereoquímica - Química Orgánica 1 UNMSMDocumento3 páginasEvaluacion de Estereoquímica - Química Orgánica 1 UNMSMAyudaFIQ-SMAún no hay calificaciones
- Evaluacion Hidrocarburos Alifáticos - Química Orgánica 1Documento1 páginaEvaluacion Hidrocarburos Alifáticos - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Examen Parcial de Física 1 - UNMSMDocumento1 páginaExamen Parcial de Física 1 - UNMSMAyudaFIQ-SMAún no hay calificaciones
- Examen Final Física 1 - UNMSMDocumento4 páginasExamen Final Física 1 - UNMSMAyudaFIQ-SMAún no hay calificaciones
- Ejercicios Reacciones - Química Orgánica 1Documento2 páginasEjercicios Reacciones - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Ejercicios de Reacciones - Química Orgánica 1Documento1 páginaEjercicios de Reacciones - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Primera Practica - Ecuaciones DiferencialesDocumento1 páginaPrimera Practica - Ecuaciones DiferencialesAyudaFIQ-SMAún no hay calificaciones
- Evaluacion de Alquenos - Química Orgánica 1Documento3 páginasEvaluacion de Alquenos - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Evaluacion de Reactividad de Alcanos - Química Orgánica 1Documento5 páginasEvaluacion de Reactividad de Alcanos - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Examen Parcial Química Inorgánica UNMSMDocumento2 páginasExamen Parcial Química Inorgánica UNMSMAyudaFIQ-SMAún no hay calificaciones
- Examen Sustitutorio Parcial - Ecuaciones DiferencialesDocumento1 páginaExamen Sustitutorio Parcial - Ecuaciones DiferencialesAyudaFIQ-SMAún no hay calificaciones
- Ejercicios Nomenclatura - Estereoisómeros - Química Orgánica 1Documento2 páginasEjercicios Nomenclatura - Estereoisómeros - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Examen Parcial Ecuaciones DiferencialesDocumento1 páginaExamen Parcial Ecuaciones DiferencialesAyudaFIQ-SMAún no hay calificaciones
- Practica de Nomenclatura - Quimica Organica 1Documento2 páginasPractica de Nomenclatura - Quimica Organica 1AyudaFIQ-SMAún no hay calificaciones
- Evaluación Continua #2 - Química Inorgánica (UNMSM)Documento3 páginasEvaluación Continua #2 - Química Inorgánica (UNMSM)AyudaFIQ-SMAún no hay calificaciones
- Evaluacion de Nomenclatura - Quimica Organica 1Documento1 páginaEvaluacion de Nomenclatura - Quimica Organica 1AyudaFIQ-SMAún no hay calificaciones
- Examen Final Química Inorgánica (UNMSM)Documento4 páginasExamen Final Química Inorgánica (UNMSM)AyudaFIQ-SMAún no hay calificaciones
- Practica Aromáticos - Química Orgánica 1Documento2 páginasPractica Aromáticos - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Examen Parcial Química Inorgánica (UNMSM)Documento3 páginasExamen Parcial Química Inorgánica (UNMSM)AyudaFIQ-SMAún no hay calificaciones
- Practica de Reacciones - Química Orgánica 1Documento2 páginasPractica de Reacciones - Química Orgánica 1AyudaFIQ-SMAún no hay calificaciones
- Evaluación Continua #4 - Química Inorgánica (UNMSM)Documento3 páginasEvaluación Continua #4 - Química Inorgánica (UNMSM)AyudaFIQ-SMAún no hay calificaciones
- Boro y Aluminio - Laboratorio Química InorgánicaDocumento25 páginasBoro y Aluminio - Laboratorio Química InorgánicaAyudaFIQ-SMAún no hay calificaciones
- Compuestos Oxigenados de Nitrógeno - Laboratorio Química InorgánicaDocumento26 páginasCompuestos Oxigenados de Nitrógeno - Laboratorio Química InorgánicaAyudaFIQ-SMAún no hay calificaciones
- Oxigeno, Peróxidos, Óxidos y Agua - Laboratorio Química InorgánicaDocumento25 páginasOxigeno, Peróxidos, Óxidos y Agua - Laboratorio Química InorgánicaAyudaFIQ-SMAún no hay calificaciones
- Azufre y Sulfuros - Laboratorio Química InorgánicaDocumento23 páginasAzufre y Sulfuros - Laboratorio Química InorgánicaAyudaFIQ-SMAún no hay calificaciones
- Calor Especifico - Laboratorio Física 2Documento20 páginasCalor Especifico - Laboratorio Física 2AyudaFIQ-SMAún no hay calificaciones
- Carbono y Silicio - Laboratorio Química InorgánicaDocumento21 páginasCarbono y Silicio - Laboratorio Química InorgánicaAyudaFIQ-SMAún no hay calificaciones
- Fosforo, Arsénico, Antimonio, Bismuto - Laboratorio Química InorgánicaDocumento23 páginasFosforo, Arsénico, Antimonio, Bismuto - Laboratorio Química InorgánicaAyudaFIQ-SMAún no hay calificaciones
- Cambio de Fase de La Naftalina - Laboratorio Física 2Documento21 páginasCambio de Fase de La Naftalina - Laboratorio Física 2AyudaFIQ-SMAún no hay calificaciones
- El Razonamiento LógicoDocumento13 páginasEl Razonamiento LógicoLivia Barra DomínguezAún no hay calificaciones
- Cerveza ArtesanalDocumento110 páginasCerveza ArtesanalLuis Enrique Triana LandinezAún no hay calificaciones
- Solemne N°2Documento7 páginasSolemne N°2SEBASTIAN IGNACIO SALDIAS SERRANOAún no hay calificaciones
- IPA West CoastDocumento3 páginasIPA West CoastjoseAún no hay calificaciones
- PP CervezaDocumento4 páginasPP CervezaJuan Carlos FernandezAún no hay calificaciones
- Actividad 3 Analisis OrganizacionalDocumento8 páginasActividad 3 Analisis OrganizacionalLUZ DARY GUEVARA SANDOVALAún no hay calificaciones
- ACERTIJODocumento8 páginasACERTIJORainer DiazAún no hay calificaciones
- Cervecería HondureñaDocumento4 páginasCervecería HondureñaJoel PuertoAún no hay calificaciones
- Laboratorio Bebidas FermentadasDocumento41 páginasLaboratorio Bebidas Fermentadashenga1983100% (2)
- Biotecnología Clásica o Tradicional 1º ParteDocumento5 páginasBiotecnología Clásica o Tradicional 1º ParteKiusver Costa DiazAún no hay calificaciones
- Como Se Juega Beer WarDocumento5 páginasComo Se Juega Beer WarVictor Manuel Lambert OchoaAún no hay calificaciones
- BACKUSDocumento35 páginasBACKUSAnonymous JuF5kl50% (2)
- Evidencia de Producto Informe Procedimiento para El Recibo y Despacho de Objetos.Documento3 páginasEvidencia de Producto Informe Procedimiento para El Recibo y Despacho de Objetos.ernestoAún no hay calificaciones
- SafAle K 97 2Documento1 páginaSafAle K 97 2Juan EcheverriAún no hay calificaciones
- Backus IceDocumento15 páginasBackus IceFranklin Balbin100% (1)
- (CanisLycaon) Tensei Shitara Slime Datta Ken Volumen 04Documento247 páginas(CanisLycaon) Tensei Shitara Slime Datta Ken Volumen 04ozvaldo noeAún no hay calificaciones
- Fortalecimiento de Infraestructura para La Movilizacin y Acopio de Granos y OleaginosasDocumento48 páginasFortalecimiento de Infraestructura para La Movilizacin y Acopio de Granos y OleaginosasCarmen DamianAún no hay calificaciones
- Universidad Tecnológica de El Salvador Facultad de Ciencias Empresariales Escuela de NegociosDocumento2 páginasUniversidad Tecnológica de El Salvador Facultad de Ciencias Empresariales Escuela de NegociosMIGUEL DIAZAún no hay calificaciones
- Clase 1 - Bebidas Fermentadas (Cerveza & Sake) 2021Documento10 páginasClase 1 - Bebidas Fermentadas (Cerveza & Sake) 2021Mauro OliacciAún no hay calificaciones
- Etanol, Fermentados y DestiladosDocumento91 páginasEtanol, Fermentados y DestiladosJuan Pablo Crawford LafargaAún no hay calificaciones
- La Cerveza DiapositivasDocumento14 páginasLa Cerveza DiapositivasOrtega RobertoAún no hay calificaciones
- Tecnologia de Alimentos III PDFDocumento3 páginasTecnologia de Alimentos III PDFhilderAún no hay calificaciones
- Guia Industria de Bebidas DGEEDocumento116 páginasGuia Industria de Bebidas DGEEtomyAún no hay calificaciones
- Unidad6 LibroDocumento93 páginasUnidad6 LibrogercampeAún no hay calificaciones
- Dinámica CervezaDocumento1 páginaDinámica CervezaNatalia ArevaloAún no hay calificaciones
- Caso de Estudio #1 IsenbeckDocumento2 páginasCaso de Estudio #1 IsenbeckSaloAún no hay calificaciones
- Proyecto. 1.2 FODA PORTERDocumento12 páginasProyecto. 1.2 FODA PORTERPaula CatalanAún no hay calificaciones
- Cerveceria San Juan Avance 1 EveDocumento11 páginasCerveceria San Juan Avance 1 Evepablo1716Aún no hay calificaciones