Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Patologias Metabolismo Carbohidratos
Cargado por
Laura MartinezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Patologias Metabolismo Carbohidratos
Cargado por
Laura MartinezCopyright:
Formatos disponibles
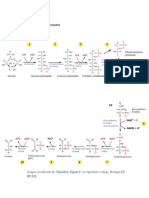
Tomado de: Devlin thomas M.
bioquímica, libro de texto con aplicaciones clínicas
PATOLOGÍAS RELACIONADAS CON EL METABOLISMO
DE CARBOHIDRATOS
LESIÓN HIPÓXICA TISULAR
La lesión hipóxica tisular aguda se ha estudiado en diversos tejidos. La oclusión de una de las arterias
coronarias principales durante un infarto de miocardio produce una gran cantidad de secuelas bioquí-
micas y fisiológicas. Cuando se priva a un tejido de su suministro de oxígeno, la secuencia de la cadena
de transporte electrónico mitocondrial-fosforilación oxidativa queda inhibida dando así lugar a una
disminución de los niveles celulares de ATP y de creatina fosfato. A medida que disminuyen los niveles
celulares de ATP se activa la glucólisis anaerobia, en un intento de mantener las funciones celulares
normales, los niveles de glucógeno se agotan rápidamente y aumentan los niveles de ácido láctico en el
citosol, disminuyendo el pH intracelular. Las células hipóxicas con este déficit energético empiezan a
hincharse, ya que no pueden mantener por más tiempo sus ambientes iónicos intracelulares normales.
Las mitocondrias se hinchan y empiezan a acumular calcio, el cual puede quedar depositado en la matriz
mitocondrial en forma de fosfato cálcico. Las membranas celulares de las células hinchadas se hacen más
permeables, lo que conduce a la pérdida de diversos enzimas solubles, coenzimas y otros constituyentes
celulares, A medida que disminuye el pH intracelular, se dañan las membranas lisosomales, que liberan
diversas proteasas, lipasas, glucosidasas y fosfatasas en la célula. Estas enzimas lisosomales empiezan
una digestión autolítica de los componentes celulares.
Las células que han estado expuestas a cortos períodos de hipoxia pueden recuperarse, sin daño
irreversible, al reperfundirse en un medio que contenga oxígeno. No se conoce con precisión el punto
exacto en el que el daño de la lesión hipóxica se hace irreversible. Este proceso resulta de una gran
importancia práctica en el trasplante de órganos (corazón, riñones e hígado}, que siempre atraviesan
una fase de hipoxia inmediatamente anterior a su implantación.
ACIDOSIS LACTICA
Este problema se caracteriza por la presencia de niveles sanguíneos de lactato elevados, normalmente
superiores a 5 mM, junto con un pH sanguíneo disminuido y concentraciones de bicarbonato más bajas. La
acidosis láctica es la forma de acidosis metabólica más frecuente y puede ser consecuencia de
sobreproducción de lactato, infrautilización de lactato, o de ambas a la vez. Normalmente, la producción
de lactato está equilibrada por la utilización del mismo, con el resultado de que el lactato no se encuentra
normalmente presente en la sangre a concentraciones superiores a 1,2 mM.
Todos los tejidos corporales poseen la capacidad de producir lactato mediante glucólisis anaerobia, si bien
la mayoría de ellos no lo producen en grandes cantidades, debido a que pueden obtener mucho más ATP
mediante oxidación completa del piruvato producido por la glucólisis. Sin embargo, cuando la oxigenación
es inadecuada, todos los tejidos responden con un incremento en la generación de lactato. El descenso en
ATP producido por la reducción de la fosforilación oxidativa permite que aumente la actividad de la 6-
fosfofructo-l-quinasa (FFK-1). Estos tejidos se han de basar en la glucólisis anaerobia para la producción
de ATP, lo que en estas condiciones da lugar a la producción de ácido láctico. Un buen ejemplo de ello es
el ejercicio muscular, que puede agotar el oxígeno tisular y dar así lugar a la sobreproducción de ácido
láctico. Sin embargo, la hipoxia tisular se da en todas las formas de shock, en las convulsiones y en las
enfermedades debidas a fallos circulatorios v pulmonares.
El principal destino del lactato en el cuerpo es, o bien su combustión completa a CO 2 y H2O, o bien su
reconversión en glucosa mediante el proceso de la gluconeogénesis. Ambos requieren oxígeno. La
Docente: Visitación Noy B. MSc Página 1
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
disminución en la disponibilidad de oxígeno incrementa, por tanto, la producción de lactato, a la vez
que disminuye su utilización. Esta última también se puede producir por enfermedades hepáticas, etanol
y otros fármacos. La fenformina, fármaco que durante un tiempo se utilizó para tratar la
hiperglucemia de la diabetes tipo 1 (dependiente de insulina), induce acidosis láctica en ciertos
pacientes.
Normalmente, se administra bicarbonato para intentar controlar la acidosis asociada a la acumulación
de ácido láctico. La clave para un tratamiento con éxito es, sin embargo, encontrar y eliminar la causa
de la superproducción y/o infrautilización de ácido láctico, lo que, muy a menudo, implica la
restauración de la circulación de sangre oxigenada.
INTOLERANCIA HEREDITARIA A LA FRUCTOSA: IHF
Los pacientes con intolerancia hereditaria a la fructosa sufren una deficiencia de la aldolasa hepática
(aldolasa B), responsable de la escisión de la fructosa 1-fosfato en dihidroxiacetona fosfato (DHAP) y
gliceraldehído. El consumo de fructosa por estos pacientes da lugar a la acumulación de fructosa 1-fosfato y
a la desaparición de Pi y ATP del hígado. Las reacciones involucradas son las catalizadas por la fructocinasa y
los enzimas de la fosforilación oxidativa:
Fructosa + ATP → Fructosa 1-P + ADP
ADP + P¡ + "energía proporcionada por la cadena de transferencia electrónica” → ATP
Neto; Pi + fructosa → fructosa 1-P
La inmovilización del Pi en forma de fructosa 1-P impide a las mitocondrias hepáticas la generación de ATP
por la fosforilación oxidativa. Los niveles de ATP caen rápidamente, lo que imposibilita al hígado el
desarrollar sus funciones de trabajo normales. Las células quedan principalmente dañadas porque no
pueden mantener los gradientes iónicos normales por medio de las bombas catiónicas dependientes de
ATP. Las células se hinchan y finalmente pierden su contenido interno por lisis osmótica. Aunque los
pacientes con intolerancia a la fructosa son especialmente sensibles a la fructosa, el hombre en general
posee una capacidad limitada para actuar sobre este azúcar. La capacidad del hígado normal para fosforilar
la fructosa es muy superior a su capacidad para romper la fructosa 1-P. Esto significa que la utilización de la
fructosa por el hígado está controlada de forma muy deficiente, y que el exceso de fructosa podría d e jar al
hígado sin Pi ni ATP. A diferencia de la fructosuria esencial, la IHF se caracteriza por la aparición de una severa
hipoglicemia después de la ingestión de fructosa. La ingestión prolongada de fructosa en los niños puede
conducir a la muerte.
Durante un tiempo, se probó en los hospitales el sustituir la glucosa por fructosa en los pacientes que
debían ser mantenidos por nutrición parenteral. La idea era que la fructosa seria una mejor fuente de
calorías que la glucosa, ya que la utilización de fructosa es relativamente independiente del estatus
respecto a la insulina de un paciente. Pronto se halló que la administración de grandes cantida des de
fructosa mediante nutrición intravenosa daba lugar a una lesión grave del hígado. Se han realizado intentos
similares para sustituir la glucosa por sorbitol y xilitol. Estos azúcares también tienden a agotar el ATP
hepático, por lo que, al igual que la fructosa, no deberían utilizarse en la nutrición parenteral.
FRUCTOSURIA ESENCIAL
La fructosa puede constituir entre el 30 y el 60% de la ingesta total de glúcidos por los mamíferos. Se metaboliza
predominantemente por una vía específica de la fructosa. La primera enzima de esta ruta, la fructoquinasa
(FK), está ausente en la FRUCTOSURIA ESENCIAL. Esta enfermedad constituye una anomalía metabólica asintomática
benigna que parece heredarse de forma autosómica recesiva. Después de la ingesta fructosa, los niveles
sanguíneos y urinarios de fructosa son inusualmente elevados; no obstante, el 90% de la fructosa es finalmente
metabolizada
Docente: Visitación Noy B. MSc Página 2
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
GALACTOSEMIA
Consiste en la incapacidad de transformar la galactosa en glucosa. Las reacciones de la galactosa son de
interés porque están sujetas en los seres humanos a defectos genéticos que dan lugar a la enfermedad
genética galactosemia. Cuando se da este defecto, los individuos son incapaces de metabolizar la galactosa
derivada de la lactosa (azúcar de !a leche) a metabolitos de !a glucosa, lo que provoca a menudo
formación de cataratas, detención de! crecimiento, retraso mental, o incluso la muerte como
consecuencia del deterioro hepático. La perturbación genética se manifiesta en forma de deficiencia
celular ya sea de galactoquinasa (GK), lo que produce una enfermedad relativamente leve caracterizada
por la formación prematura de cataratas, o de galactosa 1-P uridiltransferasa, lo que produce una
enfermedad grave.
La galactosa puede reducirse a galactitol mediante una reacción parecida a la que transforma la glucosa
en sorbitol. El galactitol inicia la formación de cataratas en el cristalino, y puede estar relacionado con
los daños que sufre el sistema nervioso central. La acumulación de galactosa 1-fosfato ocasiona la falla
hepática; los efectos tóxicos de los metabolitos de la galactosa desaparecen cuando se suprime ésta de la
dieta.
ANEMIA HEMOLITICA POR DEFICIENCIA DE PIRUVATO CINASA
La producción de ATP en los eritrocitos maduros depende absolutamente de la actividad glucolítica. El ATP es
necesario para las bombas iónicas, en especial la Na*, K'-ATPasa, que mantienen la forma de disco bicóncavo de los
eritrocitos, una característica que les ayuda a deslizarse a través de los capilares cuando llevan el oxígeno a los
tejidos. Sin ATP, las células se hinchan y se rompen. La anemia debida a la destrucción excesiva de los eritrocitos
se conoce como anemia hemolítica. El déficit de piruvato cinasa (PK) es raro, pero es el defecto genético más
común de la vía glucolítica causante de anemia hemolítica. La mayor parte de los pacientes con déficit de
piruvato cinasa tienen entre un 5 y un 25% de los niveles de piruvato quinasa de los eritrocitos normales, y el
flujo a través de la vía glucolítica está severamente restringido, lo que se traduce en niveles de ATP
marcadamente inferiores.
Se observa el previsible entrecruzamiento de los intermedios de la vía glucolítica, esto es, los intermedios ante-
riores al paso catalizado por la piruvato quinasa se acumulan, mientras que las concentraciones de lactato y
piruvato disminuyen. En los reticulocitos de pacientes con esta enfermedad se observan niveles normales de
ATP. Aunque estos hematíes “inmaduros” son deficitarios en piruvato quinasa, contienen mitocondrias, y
pueden generar ATP por fosforilación oxidativa. La maduración de los reticulocitos a hematíes comporta la
perdida de mitocondrias, con lo que aparece una dependencia completa de la glucólisis para la producción de
ATP. Como la glucólisis es defectuosa, las células maduras se pierden rápidamente de la circulación. La anemia
aparece porque las células no pueden ser reemplazadas de forma suficientemente rápida por la eritropoyesis.
ENVENENAMIENTO POR ARSENICO
La mayoría de las formas del arsénico son tóxicas, pero la forma trivalente (arsenito o AsO 2-) es mucho más
tóxica que la forma pentavalente (arseniato o AsO4-2). Cuando e! arseniato sustituye al Pi, en las reacciones
biológicas se produce menos ATP. El arseniato compite con los centros de fijación de Pi de las enzimas, lo
que da lugar a la formación de esteres de arseniato que son inestables. El arsenito funciona mediante un
mecanismo completamente diferente que implica la formación de un complejo estable con el ácido lipoico
ligado al enzima:
En su mayor parte, el envenenamiento por arsénico se explica por la inhibición de aquellas enzimas que
Docente: Visitación Noy B. MSc Página 3
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
requieren ácido lipoico como coenzima. Entre ellos se cuentan la malato deshidrogenasa, la α-
cetoglutarato deshidrogenasa y la α-cetoácido (de cadena ramificada) deshidrogenasa. El
envenenamiento crónico por arsénico a través de agua de pozo contaminada con pesticidas arsenicales o
a través de los esfuerzos de un asesino, tiene su mejor diagnóstico en la determinación de la
concentración de arsénico en el cabello o en las uñas de la victima. En un individuo normal se
encontrarían unos 0,5 mg de arsénico por kilogramo de cabello. El cabello de una persona expuesta de
manera crónica al arsénico puede tenor hasta 100 veces esta cantidad.
ANEMIA HEMOLITICA POR DEFICIENCIA DE GLUCOSA 6-FOSFATO DESHIDROGENASA
(Deficiencia genética o presencia de variantes genéticas en los eritrocitos)
Cuando se administran algunos fármacos aparentemente inócuos tales como antipalúdicos, antipiréticos o
antibióticos sulfamídicos a pacientes sensibles, puede producirse en éstos una anemia hemolítica aguda
al cabo de 48-96 h. La susceptibilidad a la enfermedad hemolítica inducida por fármacos puede deberse a
un déficit de la actividad G6P deshidrogenasa de los eritrocitos, y fue uno de los primeros indicios de que
existen deficiencias genéticas de este enzima ligadas al sexo. Esta enzima, que cataliza la oxidación de
Glu-6P a 6-fosfogluconato y la reducción de NADP+, es muy importante ya que la vía de las pentosas
fosfato es la principal ruta para la producción de NADPH en el hematíe.
Por ejemplo, los hematíes con carencia relativamente suave, de tipo A, de glucosa 6-fosfato
deshidrogenasa (Glu 6-P-DH) son capaces de oxidar la glucosa a una velocidad normal cuando la
demanda de NADPH es normal. Sin embargo, si se incrementa la tasa de oxidación del NADPH, las células
deficitarias de la enzima no son capaces de aumentar adecuadamente la velocidad de oxidación de la
glucosa ni la de producción de dióxido de carbono. Además, las células que carecen de glucosa 6-fosfato
deshidrogenasa no reducen suficiente NADP+ para mantener el glutatión en su estado reducido. El
glutatión reducido es necesario para la integridad de la membrana eritrocitaria, y por esta razón, los
hematíes que carecen del enzima son más susceptibles a la hemolisis por una amplia gama de
compuestos. Por tanto, la anormalidad básica en la-deficiencia de G6P es la formación de hematíes
maduros que tienen una actividad glucosa 6-íosfato deshidrogenasa disminuida. Los hematíes jóvenes
pueden tener una actividad enzimática significativamente mayor que las células más viejas, debida a
una variedad inestable del enzima. Después de un episodio de hemolisis, los hematíes jóvenes
predominan, y puede no ser posible diagnosticar esta deficiencia genética hasta que la población de
hematíes envejece.
Esta deficiencia enzimática, que no es normalmente detectada hasta la administración de ciertos
fármacos, ilustra la interconexión entre herencia y ambiente en la producción de la enfermedad. Los
defectos en la enzima son sólo una de las diversas anormalidades que pueden afectar la actividad
enzimática, habiendose detectado otras que son independientes de la administración de fármacos.
Existen más de 300 variantes genéticas conocidas de esta, que contiene 516 aminoácidos, que explican
una amplia gama de síntomas. Estas variantes pueden ser distinguidas mediante ciertas diferencias
clínicas, bioquímicas, y moleculares.
ACIDO GLUCURÓNICO E IMPORTANCIA FISIOLÓGICA EN LA FORMACIÓN DE GLUCURÓNIDOS
El significado fisiológico del ácido glucurónico se basa en su capacidad para conjugarse con ciertas sustancias,
endógenas y exógenas, formando así, en una reacción catalizada por la UDP-glucuroniltransferasa, un grupo de
compuestos denominados colectivamente glucurónidos. La conjugación de un compuesto con ácido glucurónico
produce un compuesto fuertemente ácido que es más hidrosoluble a pH fisiológico que el precursor, por lo que
puede alterar su propio metabolismo, transporte o propiedades de excreción. La formación de glucurónidos es
importante en la desintoxicación de fármacos, la excreción de esteroides y el metabolismo de la bilirrubina. Esta
última es el producto mayoritario de degradación metabólica del hemo, grupo prostético de la hemoglobina.
EÍ paso central en la excreción de la bilirrubina es su conjugación con ácido glucurónico por la UDP-
glucuroniltransferasa. El desarrollo de este mecanismo de conjugación tiene lugar de forma gradual y puede
Docente: Visitación Noy B. MSc Página 4
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
tardar desde varios días hasta 2 semanas después del nacimiento para ser totalmente activo en el hombre. La
denominada ictericia fisiológica del recién nacido proviene en la mayor parte de los casos de la incapacidad de
hígado neonatal para formar glucurónido de bilirrubina a una velocidad comparable de producción de bilirrubina.
En una cepa mutante de ratas Wistar (“Gunn”) se ha descubierto un defecto en la síntesis de glucurónidos debido
á una deficiencia de UDP-glucuroniltransferasa, deficiencia que da lugar a una hiperbilirrubinemia hereditaria. En
seres humanos se ha descubierto un defecto similar a la ictericia no hemolítica familiar congénita (síndrome de
Crigler-Najjar). Los pacientes con esta enfermedad tampoco son capaces de conjugar eficientemente compuestos
extraños (xenobióticos) con ácido glucurónico.
PENTOSURIA POR DEFICIENCIA DE XILITOL DESHIDROGENASA
Probablemente, la vía de oxidación del ácido glucurónico no sea esencial para el metabolismo glucídico humano,
ya que los individuos que tienen esta vía bloqueada no sufren efectos. Una variación metabólica, denominada
pentosuria idiopática, proviene de la actividad disminuida de la L-xilulosa reductasa ligada a NADP, la enzima
que cataliza la reducción de la xilulosa a xilitol. De ahí que los individuos afectados excreten grandes cantidades
de pentosa en la orina, especialmente después de la ingestión del ácido glucurónico.
ENFERMEDADES DE ALMACENAMIENTO DE GLUCÓGENO
Existen una serie de enfermedades de almacenamiento del glucógeno bien caracterizadas, todas ellas debidas a
deficiencias heredadas de una o más enzimas implicados en la síntesis y degradación del glucógeno. El hígado es,
normalmente, el tejido más afectado, pero también pueden ser defectuosos los metabolismos del corazón y del
músculo. A continuación se mencionan algunas de ellas:
Enfermedad de von Gierke
La enfermedad de almacenamiento del glucógeno más común, conocida como enfermedad tipo 1 o de von
Gierke, está producida por una deficiencia de la glucosa 6-fosfatasa del hígado, la mucosa intestinal y el riñon,
Así, es posible el diagnóstico mediante biopsia del intestino del intestino delgado. Los pacientes con esta
enfermedad se pueden agrupar en aquellos que carecen de la enzima glucosa-6-fosfatasa (tipo 1a), y los que
carecen de glucosa-6-fosfatasa translocasa (tipo 1b). La anomalía genética en la hidrólisis de glucosa-6-fosfato
aparece sólo en una persona de cada 200000, y se transmite como un carácter autosómico recesivo.
Las manifestaciones clínicas comprenden hipoglucemia en ayuno, acidemia láctica, hiperlipidemia e
hiperuricemia con artritis gotosa, La hipoglucemia en ayuno se explica fácilmente como consecuencia de la
ausencia de glucosa 6-fosfatasa, enzima requerido para obtener glucosa a partir del glucógeno hepático y de la
gluconeogénesis. El hígado de estos pacientes libera algo de glucosa, por acción del enzima desramificante. La
acidemia láctica aparece porque el hígado no puede utilizar de modo efectivo el lactato para la síntesis de
glucosa. Además, en respuesta al glucagón, el hígado produce aún más ácido láctico. Esta hormona debería
desencadenar la liberación de glucosa sin producción de lactato; no obstante, ocurre lo contrario, debido a la
carencia de glucosa 6-fosfatasa. La hiperuricemia proviene del incremento de la degradación de purinas en el
hígado; la hiperlipidemia se debe al aumento en la disponibilidad de ácido láctico para la lipogénesis, y a la
movilización de lípidos del tejido adiposo, provocadas por los elevados niveles de glucagón, que son una
respuesta a la hipoglucemia.
Los síntomas de la enfermedad de von Gierke pueden aliviarse si se administran glúcidos a lo largo del
día, a fin de evitar una hipoglucemia. Durante el sueño, dicha administración puede realizarse mediante la
infusión de glúcidos en el intestino a través de un tubo nasogástrico.
Enfermedad de Pompe
La enfermedad de almacenamiento de glucógeno tipo II o enfermedad de Pompe es producida por la ausencia de
α-1,4-glucosidasa (o maltasa acida), enzima que normalmente se encuentra en los lisosomas. La ausencia de esta
enzima conduce a la acumulación de glucógeno en virtualmente todos los tejidos. Esto puede parecer un poco
sorprendente si no se sabe que los lisosomas captan gránulos de glucógeno y se vuelven defectuosos respecto a
otras funciones cuando carecen de la capacidad necesaria para destruir los gránulos. Dado que las otras rutas
sintéticas y degradativa del metabolismo del glucógeno están intactas, no se aprecian aquí trastornos
metabólicos como los que se observan en la enfermedad de von Gierke. No se conoce la razón de la acumulación
Docente: Visitación Noy B. MSc Página 5
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
de glucógeno extralisosomal. Se produce una cardiomegalia masiva que conduce en una edad temprana a la
muerte por fallo cardíaco.
Enfermedad de Cori
También denominada enfermedad de almacenamiento de glucógeno tipo III, la enfermedad de Cori está
producida por una deficiencia de la enzima desramificante del glucógeno. El glucógeno se acumula, debido a que
sólo las ramas exteriores pueden ser eliminadas de la molécula por la fosforilasa. Aparece hepatomegalia, aunque
ésta disminuye con la edad. Las manifestaciones clínicas son similares, aunque mucho mas benignas, a las de la
enfermedad de von Gierke, debido a que aquí no queda afectada la gluconeogénesis, por lo que la hipoglucemia y
sus complicaciones son mucho menos graves.
Enfermedad de McArdle
También denominada enfermedad de almacenamiento de glucógeno tipo V, la enfermedad de McArdle se debe a
la ausencia de fosforilasa muscular. Los pacientes sufren calambres musculares dolorosos y no pueden realizar
ejercicios vigorosos, probablemente porque los depósitos de glucógeno muscular no están disponibles para e!
músculo en ejercicio. Así, no se produce el incremento normal del lactato plasmático (liberado del músculo)
después del ejercicio. Los músculos se dañan debido probablemente al suministro inadecuado de energía y a la
acumulación de glucógeno. Es frecuente la liberación de proteínas o enzimas musculares (creatina fosfoquinasa,
aldolasa, mioglobina); los elevados niveles de dichas sustancias en la sangre parecen indicar un trastorno
muscular
HIPOGLICEMIA
Hipoglucemia y niños prematuros
Los neonatos prematuros y los que son pequeños respecto a su edad gestacional presentan una mayor
susceptibilidad a la hipoglucemia que los niños de embarazo completo y normales según la edad gestacional.
Diversos factores parecen estar implicados en ello. Los niños, en general, son más susceptibles que los adultos a
la hipoglucemia, simplemente porque tienen una proporción mayor de cerebro con respecto al peso corporal, y el
cerebro utiliza cantidades de glucosa desproporcionadamente mayores que el resto del cuerpo. Los recién
nacidos tienen una capacidad limitada de cetogénesis, debido aparentemente a que está poco desarrollado en
ellos el transporte de ácidos grasos de cadena larga a las mitocondrias hepáticas. Dado que la utilización de
cuerpos cetónicos por el cerebro es directamente proporcional a la concentración de cuerpos cetónicos
circulantes, el recién nacido no puede ahorrar glucosa en cantidad significativa mediante el uso de cuerpos
cetónicos. La consecuencia de ello es que el cerebro del recién nacido depende casi completamente de la
glucosa obtenida por la_glucogénólisis_y gluconeogénesis hepáticas.
La capacidad de síntesis de glucosa hepática a partir del lactato y de la alanina está también limitada en los
recién nacidos. Esto se debe a que la enzima limitante de velocidad, la fosfoenolpiruvato carboxiquinasa
(PEPCK), está presente en concentraciones muy bajas durante las primeras horas que siguen al alumbramiento.
La inducción de la enzima a los niveles requeridos para evitar la hipoglucemia durante el estrés del ayuno
requiere varias horas. Se cree que los recién nacidos prematuros o pequeños con respecto a la edad gestacional
son más susceptibles a la hipoglucemia que los recién nacidos normales, debido a que los depósitos de glucógeno
hepático son en los primeros más pequeños. El ayuno elimina los depósitos de glucógeno más rápidamente,
haciendo que los recién nacidos prematuros dependan más de la gluconeogénesis que los recién nacidos
normales.
Hipoglucemia e intoxicación alcohólica
El consumo de alcohol, especialmente por una persona desnutrida, puede producir hipoglucemia. El mismo efecto
puede tener lugar al beber alcohol después de un ejercicio enérgico. En ambos casos, la hipoglucemia se debe a los
efectos inhibidores del alcohol sobre la gluconeogénesis hepática y, por tanto, tiene lugar en condiciones de carencia
de glucógeno hepático. El problema es debido al NADH producido durante el metabolismo del alcohol. El hígado no
puede simplemente utilizar de manera lo suficientemente rápida los equivalentes de reducción producidos por la
oxidación del etanol para evitar los trastornos metabólicos. Los equivalentes de reducción extra bloquean la
conversión de lactato en glucosa y promueven la conversión de alanina en lactato, lo que da lugar a una
considerable acumulación de lactato en la sangre. Dado que el lactato no tiene a donde ir, puede desarrollarse
acidosis láctica, aunque suele ser de carácter leve.
El alcohol a dosis bajas produce un funcionamiento motor e intelectual debilitado; las dosis elevadas tienen un
Docente: Visitación Noy B. MSc Página 6
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
efecto depresivo que puede conducir a estupor y anestesia. El bajo nivel sanguíneo de azúcar puede contribuir a
estos efectos indeseables del alcohol. Lo que es más, puede parecer que un paciente está sencillamente ebrio,
cuando lo que está en realidad es sufriendo hipoglucemia la cual puede producir daños irreversibles en el sistema
nervioso central. Los niños dependen en gran manera de la gluconeogénesis cuando ayunan, y la ingestión
accidental de alcohol puede producir una hipoglucemia grave
DIABETES MELLITUS
La diabetes mellitus es una enfermedad crónica caracterizada por trastornos en el metabolismo de glúcidos,
grasas y proteínas, clinicamente se reconocen dos tipos: Tipo 1 (llamada de aparición juvenil o dependiente de
insulina) y Tipo 2 (de aparición en la madurez o independiente de insulina).
La prueba de tolerancia oral a la glucosa se utiliza comúnmente para el diagnóstico de la diabetes en
enfermos a quienes el ayuno no les produce hiperglucemía. Consiste en la determinación del nivel de glucosa
sanguínea en el estado de ayuno y a intervalos de 30-60 minutos durante 2 horas o más después de consumir una
comida de 100 gramos de glúcido. En un individuo normal la glucosa sanguínea vuelve a sus niveles normales al
cabo de dos horas de la ingestión de la comida glucídica. En el diabético la glucosa sanguínea alcanza un nivel
más elevado y permanece elevada durante períodos de tiempo más largos, según la gravedad de la enfermedad.
No obstante, hay muchos factores que pueden contribuir a una prueba de tolerancia anormal a la glucosa. El
paciente ha de haber consumido una dieta con alto contenido glucídico durante los 3 días anteriores,
probablemente para permitir la inducción de las enzimas de las rutas utilizadoras de glucosa como, por ejemplo,
glucoquinasa, sintasa de ácidos grasos y acetil CoA carboxilasa. Además, casi cualquier infección (incluso un
resfriado) y el menos bien definido estrés (posiblemente por efectos sobre el sistema nervioso simpático) pueden
dar lugar a anormalidades (transitorias) de la prueba de tolerancia a la glucosa. Debido a los problemas citados,
el diagnóstico sine qua non para la diabetes debería ser la elevación del nivel de glucosa en ayunas.
En el estado diabético disminuye la captación de glucosa por los tejidos sensibles a la insulina, esto es,
músculo y tejido adiposo. La insulina es necesaria para la captación de glucosa por estos tejidos y el diabético o
bien carece de insulina o ha desarrollado "resistencia a la insulina" en estos tejidos. La resistencia a la insulina es
una anomalía del receptor de insulina o en pasos posteriores que mediatizan el efecto metabólico de la insulina.
Las células parenquimáticas del hígado no requieren insulina para la captación de glucosa. Sin embargo, sin
insulina el hígado tiene disminuida la capacidad para extraer glucosa de la sangre. Esto se explica en parte por
una actividad disminuida de la glucoquinasa y la pérdida de actividad de la insulina sobre otras enzimas clave de
la gluconeogénesis y la vía glucolítica.
Diabetes mellitus tipo 1
La diabetes mellitus tipo 1, se denominaba antiguamente dependiente de insulina (IDDM) o diabetes de aparición
juvenil, ya que aparece normalmente en la infancia o en la adolescencia, aunque no se limita a estos pacientes. La
insulina está ausente en esta enfermedad, debido a la ausencia de células β-del páncreas, o que éstas son
defectuosas. Las células β son destruidas por un proceso autoinmune. Cuando no se trata, la enfermedad se
caracteriza por hiperglucemia, hiperlipoproteinemia (quilomicrones y VLDL), y episodios de cetoacidosis severa.
Lejos de ser una enfermedad que genere solamente defectos en el metabolismo glucídico, también produce anomalías
en el metabolismo de las grasas y de las proteínas. La hiperglucemia proviene, en parte, de la incapacidad por parte
de los tejidos dependientes de insulina para captar la glucosa plasmática y, en parte, de la gluconeogénesis hepática
acelerada a partir de aminoácidos provenientes de proteína muscular. La cetoacidosis proviene de la lipólisis
aumentada en el tejido adiposo y de la oxidación acelerada de ácidos grasos en el hígado. La hiperquilomicronemia
es el resultado de la baja actividad lipoproteína lipasa en los capilares del tejido adiposo, un enzima que depende
de la insulina para su síntesis.
Aunque la insulina no cura la diabetes, su utilización altera marcadamente el curso clínico de la enfermedad. La
insulina inyectada promueve la captación de glucosa por los tejidos e inhibe la gluconeogénesis, lipólisis y
proteólisis. El paciente tiene la difícil misión de intentar ajustar la dosis de insulina en función de su dieta y de su
actividad física, el otro determinante importante para la disponibilidad de glucosa por parte del músculo. El
control estricto por parte del paciente requiere la administración de varias inyecciones de insulina cada día y la
comprobación minuciosa de la glucosa sanguínea. Actualmente, se ha comprobado que el control estricto de la
Docente: Visitación Noy B. MSc Página 7
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
glucosa sanguínea reduce las complicaciones microvasculares de la diabetes (nefropatías y retinopatías).
Diabetes mellitus tipo 2
La diabetes mellitus tipo 2, se denominaba antiguamente no dependiente de insulina (NIDDM), que constituye el 80-
90% de los casos diagnosticados de diabetes, se denomina también diabetes de aparición madura, para
diferenciarla de la diabetes dependiente de insulina de aparición juvenil. Normalmente aparece en gente obesa
de mediana edad. La diabetes no dependiente de insulina se caracteriza por hiperglucemia y a menudo
hipertrigliceridemia. No se observa en ella la cetoacidosis característica de la enfermedad dependiente de insulina.
Los niveles elevados de VLDL son probablemente resultado de la síntesis incrementada de triacilgliceroles en el
hígado, estimulada por la hiperglucemia y la hiperinsulinemia.
La insulina se halla presente en cantidades casi normales, o incluso elevadas, en esta forma de enfermedad. La
obesidad aparece a menudo antes del desarrollo de la diabetes independiente de insulina, y parece ser un factor
que contribuye de manera importante a esta última. Los pacientes obesos son a menudo hiperinsulinémicos. Datos
muy recientes atribuyen a los elevados niveles de expresión del factor α de necrosis tumoral (TNF-α) en los
adipocitos la causa de la resistencia. Cuanto mayor es la masa del tejido adiposo, mayor es la producción de TNF-
α, el cual actúa desequilibrando la función del receptor de la insulina. Se ha establecido una relación inversa
entre los niveles de insulina y el número de receptores de insulina. Cuanto más elevado es el nivel basal de
insulina, menor es el número de receptores en las membranas plasmáticas. Además, también se producen
defectos en las células que responden a la insulina en procesos posteriores a la unión al receptor. Un ejemplo de
ello es la capacidad de la insulina para obtener transportadores de glucosa que pasan del interior de la célula a la
membrana plasmática. La consecuencia es que los niveles de insulina permanecen elevados, mientras que los
niveles de glucosa están muy poco controlados debido a la falta de respuesta normal a la insulina. Aunque el
nivel de insulina es aquí alto, no es sin embargo tan alto como el de una persona obesa no diabética. Dicho de
otro modo, existe una deficiencia relativa en el suministro de insulina por las células β. Por lo tanto, esta
enfermedad está causada no sólo por la resistencia a la insulina sino también por un desequilibrio en la función
de las células β, lo que da lugar a una deficiencia relativa de insulina.
La dieta sola puede muy a menudo controlar la enfermedad en el diabético obeso. Si se puede motivar a una
persona a perder peso, los receptores de insulina aumentarán en número y las anomalías posreceptor
mejorarán, lo que, a su vez, comportará un incremento tanto en la tolerancia a la glucosa como en la
sensibilidad tisular a la insulina. El diabético no dependiente de insulina sufre una forma menos grave de la
enfermedad, y no manifiesta una tendencia a desarrollar cetoacidosis, aunque desarrolla las mismas
complicaciones que el diabético insulinodependiente, esto es, neuropatía, retinopatía, enfermedad renal y
enfermedad arterial coronaria.
Hiperglucemia y glucosilación de proteínas
Se sabe que la glucosilación de las enzimas produce cambios en su actividad, solubilidad y susceptibilidad a la
degradación. En el caso de la hemoglobina A, la glucosilación tiene lugar mediante una reacción no enzimática
entre la glucosa y la valina amino terminal de la cadena β. Se forma una base de Schiff entre la glucosa y la valina,
proceso seguido por un reordenamiento de la molécula que da una molécula de 1-desoxifructosa unida a la valina.
La reacción está favorecida por niveles elevados de glucosa, y la proteína resultante, denominada hemoglobina A1c,
es un buen índice para conocer la concentración de glucosa en la sangre de una persona durante las semanas
anteriores. La concentración de esta proteína aumenta de modo sustancial en los eritrocitos de un diabético
incontrolado, y disminuye en aquellos pacientes que controlan la glucosa estrictamente.
Se ha propuesto que la glucosilación de las proteínas puede contribuir a las complicaciones médicas causadas
por la diabetes, por ejemplo enfermedad cardíaca coronaria, retinopatía, nefropatía, cataratas y neuropatía. La
mayor glucosilación de las proteínas del cristalino puede contribuir al desarrollo de cataratas de origen diabético.
El colágeno, la laminina, la vitronectina y otras proteínas de la matriz pueden ser glucosiladas y sufrir alteraciones
en sus propiedades biológicas, tales como el autoensamblaje y la unión de otras moléculas de la matriz.
Las proteínas y lipoproteínas glucosiladas también pueden ser reconocidas por los receptores presentes en los
macrófagos, los cuales están íntimamente implicados en la formación de placas ateroscleróticas. Es posible que
Docente: Visitación Noy B. MSc Página 8
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
estos cambios aceleren la aterosclerosis característica de los diabéticos. El compuesto aminoguanidina inhibe la
formación de los productos de glucosilación y se está comprobando su capacidad de prevenir las complicaciones de
la diabetes.
Complicaciones de la diabetes y ruta de los polioles
Varios desórdenes que pueden compartir una patogénesis común complican la diabetes. El cristalino, nervio
periférico, papilas renales, células de Schwann, glomérulo y, posiblemente, los capilares de la retina
contienen dos enzimas que constituyen la ruta de los polioles. El primero es la aldosa reductasa, una
enzima que requiere NADPH y que reduce la glucosa formando sorbitol, el cual es metabolizado a conti-
nuación por la sorbitol deshidrogenasa, una enzima que requiere NAD + y que oxida el sorbitol a fructosa.
La aldosa reductasa tiene una Km para la glucosa elevada, por lo que esta ruta sólo es cuantitativamente
importante durante la hiperglucemia. Se sabe que en los animales diabéticos el contenido de sorbitol en el
cristalino, nervios y glomérulo es elevado. La acumulación de sorbitol puede dañar estos tejidos al
provocar su hinchazón. Actualmente, se dispone de inhibidores de la reductasa que impiden la acumulación
de sorbitol en estos tejidos retrasando la aparición de dichas complicaciones. Esta es una cuestión muy
controvertida ya que las diferencias entre la potencia de los inhibidores, diseños experimentales, duración
de los ensayos y número de pacientes utilizados ha dado lugar a que los diferentes estudios hayan llevado a
diferentes conclusiones. Por tanto, no podemos todavía recomendar estos fármacos con total seguridad
para la prevención de las complicaciones de la diabetes.
Coma hiperosmolar hiperglucémico
Los pacientes de diabetes de tipo II desarrollan a veces una condición denominada coma hiperosmolar
hiperglucémico. Esto es particularmente habitual en la vejez pero también puede producirse en individuos bajo
estrés metabólico grave sin antecedentes de diabetes. La hiperglucemia, quizá empeorada por la no
administración de insulina o fármacos hipoglucemiantes, infección o la coincidencia de un problema médico como
un ataque al corazón, conduce a la pérdida urinaria de agua, glucosa y electrolitos (sodio, cloruro y potasio). Esta
diuresis osmótica reduce el volumen de sangre circulante, situación que agrava la resistencia a la insulina y la hi-
perglucemia. Además, los pacientes ancianos pueden sentir menos la sensación de sed incorporando menos líquidos.
Al cabo de varios días estos pacientes pueden llegar a ser extremadamente hiperglucémicos (glucosa > 1000
mg/dl), deshidratarse y entrar en coma. En estos pacientes no se desarrolla una cetoacidosis, probablemente
debido a que los niveles de ácidos grasos libres no son siempre elevados o a que las concentraciones de insulina en
la sangre portal son las adecuadas para inhibir la cetogénesis (aunque no lo suficientemente elevadas para inhibir
la giuconeogénesis). La terapia se encamina a reponer el balance de agua y electrolitos y a corregir la
hiperglucemia con insulina. La mortalidad de este síndrome es considerablemente mayor que la de la cetoacidosis
diabética.
MIOPATÍAS MITOCONDRIALES
Se han descrito miopatías que implican defectos en diversas funciones metabólicas del músculo. Clínicamente, los
pacientes con miopatías; sufren debilidad y calambres de los músculos afectados; los niños pequeños tienen
dificultades para alimentarse y para andar a gatas; se produce una gran fatiga a partir de esfuerzos mínimos y
normalmente, se dan síntomas de desgaste muscular. A partir del examen por microscopía electrónica y
caracterización enzimática de material procedente de biopsias musculares, se ha hallado que muchas miopatías
tienen una lesión primaria en la función mitocondrial.
Docente: Visitación Noy B. MSc Página 9
Tomado de: Devlin thomas M. bioquímica, libro de texto con aplicaciones clínicas
Se han descrito deficiencias en las funciones del transporte mitocondrial (p. ej., carnitina palmitoil CoA
transferasa y en componentes de la cadena de transporte electrónico mitocondrial (NADH deshidrogenasa, citocromo
b, citocromo a1a3 o la F1F0-ATPasa). En muchas miopatias mitocondriales se han encontrado grandes inclusiones
paracristalinas dentro de la matriz mitocondrial. No se sabe sí este material cristalino tiene una composición orgánica
o inorgánica. En ciertas miopatías mitocondriales, e! transporte electrónico solo está débilmente acoplado a la
producción de ATP, en otros casos, estos procesos muestran un estrecho acoplamiento normal. Algunos de estos
trastornos están relacionados con defectos de las enzimas codificadas por genes mitocondriales, por lo que se puede
deducir, que provienen de la madre ya que todas, las mitocondrias proceden de las que se encuentran en el
óvulo.
ENVENENAMIENTO POR CIANURO
La inhalación de ácido cianhídrico gaseoso o la ingestión de cianuro potásico produce una rápida y extensa inhibición
de la cadena de transporte electrónico mitocondrial en la etapa de la citocromo oxidasa. El cianuro es uno de los
venenos de actuación más rápida y potente que se conocen. El cianuro se fija al Fe+3 del hemo del citocromo a,a3,
componente del paso final en la cadena de transporte electrónico, e impide que el oxigeno reaccione con el
citocromo a,a3 y sirva como aceptor último de electrones. Cesan la respiración mitocondrial y la generación de energía, y
se produce la muerte rápida de la célula. La muerte debida al envenenamiento por cianuro tiene lugar por asfixia
tisular, muy especialmente del sistema nervioso central.
Si el envenenamiento no ha sido letal, se administran al individuo que ha estado expuesto al cianuro diversos
nitritos que transforman la oxihemoglobina en methemoglobina, lo cual supone solamente convertir el Fe2+ de la
hemoglobina en Fe3+ de la methemoglobina. La methemoglobina (Fe3+) compite con el citocromo a,a3 (Fe3+) por el
cianuro, formando así un complejo methemoglobina-cianuro, La administración de tiosulfato hace que el cianuro
reaccione con la enzima rodanasa formando tiocíanato, compuesto no tóxico.
DEFECTO DE FUMARASA
El defecto de enzimas del ciclo de los ácidos tricarboxílicos es poco frecuente. No obstante, se han
registrado algunos casos en los que hay una deficiencia grave de fumarasa tanto en las mitocondrias como en
el citosol de los tejidos (p. ej. , linfocitos de la sangre). La enfermedad se caracteriza por graves lesiones
neurológicas encefalopatía y distonía que se manifiestan poco después del nacimiento. La orina contiene
niveles anormales de fumarato además de uno o más entre succinato, α-cetoglutarato, citrato y malato.
Ambos enzimas proceden de un único gen y los dos padres presentan niveles medios respecto al normal de
actividad enzimática pero son clínicamente normales, como se corresponde con un trastorno autosómico
recesivo. La primera descripción de u n a mutación en el gen indicó que el glutamato-319 estaba sustituido
por una glutamina.
Docente: Visitación Noy B. MSc Página 10
También podría gustarte
- Exposición Unidad 2.Documento38 páginasExposición Unidad 2.Néstor Santiago Bonilla RomeroAún no hay calificaciones
- Exposicion Segunda UnidadDocumento35 páginasExposicion Segunda UnidadNéstor Santiago Bonilla RomeroAún no hay calificaciones
- Seminario 2 BioquimicaDocumento4 páginasSeminario 2 BioquimicaQoqe Catalán DuránAún no hay calificaciones
- Glucolisis y Oxidacion Del Piruvato-2023Documento23 páginasGlucolisis y Oxidacion Del Piruvato-2023Alexandra Crissel Hidalgo PurizagaAún no hay calificaciones
- Carbohidratos BioenergeticaDocumento27 páginasCarbohidratos BioenergeticaPatricia AZAún no hay calificaciones
- Sindrome de RealimentacionDocumento4 páginasSindrome de RealimentacionRoman LopezAún no hay calificaciones
- Taller Metabolismo - Carbohidratos FinallDocumento15 páginasTaller Metabolismo - Carbohidratos FinallalejandraAún no hay calificaciones
- GluconeogénesisDocumento7 páginasGluconeogénesisroquehernandezmonseAún no hay calificaciones
- Caso Clínico 2. Metabolismo de Los CarbohidratosDocumento7 páginasCaso Clínico 2. Metabolismo de Los CarbohidratosFRannkee100% (3)
- GlucolisisDocumento61 páginasGlucolisisJUAN SEBASTIAN CIFUENTES RUSSIAún no hay calificaciones
- Clase °7 Glucolisis - Regulación de Glucólisis y Destino Del PiruvatoDocumento14 páginasClase °7 Glucolisis - Regulación de Glucólisis y Destino Del PiruvatoAilen TejasAún no hay calificaciones
- AcidosisDocumento11 páginasAcidosisAlondra Gonzalez Aguilar100% (1)
- Caso Clinico Pal 21.1Documento5 páginasCaso Clinico Pal 21.1Yuliana Isabel100% (2)
- GluconeogénesisDocumento38 páginasGluconeogénesisshavo15Aún no hay calificaciones
- Vía de Las PentosasDocumento30 páginasVía de Las PentosasAlexia Fuentes100% (1)
- ENFERMEDADESDocumento4 páginasENFERMEDADESYusuli GonzalezAún no hay calificaciones
- Acidosis LácticaDocumento8 páginasAcidosis LácticaalexisAún no hay calificaciones
- Informe 6 Bioquímica SeminarioDocumento12 páginasInforme 6 Bioquímica SeminarioEmery Sofía C. D. BustamanteAún no hay calificaciones
- Vía de Las PentosasDocumento22 páginasVía de Las Pentosaspedroa8aAún no hay calificaciones
- Trabajos de Metabolismo de Los CarbohidratosDocumento3 páginasTrabajos de Metabolismo de Los CarbohidratosKarol MontañoAún no hay calificaciones
- T-18 Metabolismo de Otras HexoxasDocumento23 páginasT-18 Metabolismo de Otras HexoxasDenis PeraltaAún no hay calificaciones
- Aldosa Reductasa y Protein C en Complicaciones de DM2Documento6 páginasAldosa Reductasa y Protein C en Complicaciones de DM2Omar CanoAún no hay calificaciones
- Taller de MetabolismoDocumento39 páginasTaller de MetabolismoJesús GuzmánAún no hay calificaciones
- Alteraciones Del Metabolismo de La FructosaDocumento9 páginasAlteraciones Del Metabolismo de La FructosaJaimes Rocha OscarAún no hay calificaciones
- HIPERLACTATEMIADocumento3 páginasHIPERLACTATEMIAAna S Tapia50% (2)
- Universidad de Nariño Departamento de Química Taller de Repaso No.2 Metabolismo de Carbohidratos Docente: Juan Carlos Zambrano ArteagaDocumento2 páginasUniversidad de Nariño Departamento de Química Taller de Repaso No.2 Metabolismo de Carbohidratos Docente: Juan Carlos Zambrano ArteagaHarmony CaferestoAún no hay calificaciones
- Glucolisis Equipo 2Documento28 páginasGlucolisis Equipo 2Emmanuel Hernandez GAún no hay calificaciones
- Proteínas, Lípidos y Carbohidratos PDFDocumento7 páginasProteínas, Lípidos y Carbohidratos PDFRoberto OrnanoAún no hay calificaciones
- LactatoDocumento11 páginasLactatoAlejo DiazAún no hay calificaciones
- Trastornos Del Metabolismo Del PotasioDocumento15 páginasTrastornos Del Metabolismo Del Potasiocesar estrellaAún no hay calificaciones
- Metabolismo de Las Hexosas y La GalactosaDocumento20 páginasMetabolismo de Las Hexosas y La GalactosabeberlyAún no hay calificaciones
- La Fructosa y Su MetabolismoDocumento4 páginasLa Fructosa y Su MetabolismoJHENNY BRITHANY YUJRA QUISPEAún no hay calificaciones
- Fructosa y Su Relacion Con La GlucosaDocumento4 páginasFructosa y Su Relacion Con La GlucosaJHENNY BRITHANY YUJRA QUISPEAún no hay calificaciones
- TALLER#3Documento6 páginasTALLER#3Andy MoreiraAún no hay calificaciones
- Glucólisis y La OxidaciónDocumento25 páginasGlucólisis y La OxidaciónBeberly Reyes EspinozaAún no hay calificaciones
- Clase - Metabolismo Fructosa, Etanol, Galactosa USSDocumento6 páginasClase - Metabolismo Fructosa, Etanol, Galactosa USSLohengrinAún no hay calificaciones
- Resumen Metabolismo CarbohidratosDocumento42 páginasResumen Metabolismo CarbohidratosMarienMalavéAún no hay calificaciones
- Clase 3. Glicolisis Ciclo KrebsDocumento71 páginasClase 3. Glicolisis Ciclo KrebsRoxy L.GAún no hay calificaciones
- El Metabolismo de La Fructosa y La Galactosa. Vías de Ingreso de Estos Sustratos en La Glicólisis. Errores Innatos Del Metabolismo A La Fructosa, Galactosa. Otros AzucaresDocumento51 páginasEl Metabolismo de La Fructosa y La Galactosa. Vías de Ingreso de Estos Sustratos en La Glicólisis. Errores Innatos Del Metabolismo A La Fructosa, Galactosa. Otros AzucaresaalarianAún no hay calificaciones
- Bioquimca Guia 3Documento104 páginasBioquimca Guia 3Jannely Nava MejíaAún no hay calificaciones
- Bio Exposición MeDocumento18 páginasBio Exposición MeNATHALI DORIS PE�A TARQUIAún no hay calificaciones
- Fructose MiaDocumento16 páginasFructose MiaFERNANDEZ MIRANDA GIULIANA MISHELLAún no hay calificaciones
- La Vía de Pentosa Fosfato 1Documento9 páginasLa Vía de Pentosa Fosfato 1Nirioky SanchezAún no hay calificaciones
- Importancia Biomédica de Procesos MetabólicosDocumento4 páginasImportancia Biomédica de Procesos MetabólicosRut B Gutierrez BarreraAún no hay calificaciones
- Defectos de La Gluconeogenesis ActualDocumento6 páginasDefectos de La Gluconeogenesis ActualAlexis RosarioAún no hay calificaciones
- Apuntes de GluconeogénesisDocumento6 páginasApuntes de GluconeogénesisIsba Shadai Estrada GarciaAún no hay calificaciones
- GLUCONEOGENESISDocumento3 páginasGLUCONEOGENESISSandra VilloAún no hay calificaciones
- Metabolismo de La GlucosaDocumento15 páginasMetabolismo de La GlucosaDayana EstefaniaAún no hay calificaciones
- S9-Caso Clínico 3Documento16 páginasS9-Caso Clínico 3MariaAún no hay calificaciones
- 2021 Tema 9 Fructosuria VarasDocumento21 páginas2021 Tema 9 Fructosuria VarasLASTRES MENESES JAIR ALEXANDREAún no hay calificaciones
- Proyecto de BioquimicaDocumento13 páginasProyecto de BioquimicaGema ZambranoAún no hay calificaciones
- Metabolismo CarbohidratosDocumento27 páginasMetabolismo CarbohidratosPauAún no hay calificaciones
- Vía de Las Pentosas FosfatoDocumento8 páginasVía de Las Pentosas Fosfatobrenda reynosoAún no hay calificaciones
- Tarea 1. GlucólisisDocumento8 páginasTarea 1. GlucólisisValdovinos KennethAún no hay calificaciones
- 1 - Metabolismo de La Glucosa y PolisacáridosDocumento14 páginas1 - Metabolismo de La Glucosa y PolisacáridosHernán GuietAún no hay calificaciones
- Taller Final BioquimicaDocumento13 páginasTaller Final BioquimicaHector Tulande100% (1)
- Glucolisis y Fermentacion (Cap 9)Documento14 páginasGlucolisis y Fermentacion (Cap 9)Karla Romero2347Aún no hay calificaciones
- Bioquimica FinalDocumento13 páginasBioquimica FinalStefhany MendozaAún no hay calificaciones
- Hipotonía MuscularDocumento3 páginasHipotonía Muscularboti25Aún no hay calificaciones
- Estudio de Las Enfermedades de Las Trompas de Falopio Mediante Resonancia MagnéticaDocumento13 páginasEstudio de Las Enfermedades de Las Trompas de Falopio Mediante Resonancia MagnéticaYessica Patricia Estupiñan SanchezAún no hay calificaciones
- Atlas de Arritmias Cardiacas - Cap 10 HarrisonDocumento13 páginasAtlas de Arritmias Cardiacas - Cap 10 HarrisonLaura MartinezAún no hay calificaciones
- Sistemas de Alerta Precoz en La Hospitalización Pediátrica - ContinuumDocumento3 páginasSistemas de Alerta Precoz en La Hospitalización Pediátrica - ContinuumLaura MartinezAún no hay calificaciones
- Examen Mental UftDocumento36 páginasExamen Mental UftCarolina León ValladaresAún no hay calificaciones
- QUE ES LA BIOETICA Gilbert Hottois Pag 13 A La 26Documento9 páginasQUE ES LA BIOETICA Gilbert Hottois Pag 13 A La 26Laura MartinezAún no hay calificaciones
- The Biospsychosocial Model en EspañolDocumento7 páginasThe Biospsychosocial Model en EspañolLaura MartinezAún no hay calificaciones
- Glosario de PsicopatologiaDocumento8 páginasGlosario de PsicopatologiaLaura MartinezAún no hay calificaciones
- Diabetes Mellitus FisiopatologiaDocumento48 páginasDiabetes Mellitus FisiopatologiaLaura MartinezAún no hay calificaciones
- Sysmex Urianalisis UN-seriesDocumento1 páginaSysmex Urianalisis UN-seriesJorge Luis PSAún no hay calificaciones
- Sistema Salud y Marco 6Documento29 páginasSistema Salud y Marco 6Jorge Sandoval MirandaAún no hay calificaciones
- Guía Clínica de Fracturas Del HúmeroDocumento4 páginasGuía Clínica de Fracturas Del HúmeroCristofer Ernesto Membreño GómezAún no hay calificaciones
- Defensa Interna-Aceite Usado de VehiculoDocumento46 páginasDefensa Interna-Aceite Usado de VehiculoCristhian Castro Antezana100% (1)
- ANOREXIADocumento75 páginasANOREXIANayeli Prado GnzAún no hay calificaciones
- PLACE 1 (Ginecología)Documento17 páginasPLACE 1 (Ginecología)Yara Rubi Lebrija VegaAún no hay calificaciones
- Et Acta Actividad N°11Documento5 páginasEt Acta Actividad N°11Juan Ernesto Garces EpiasAún no hay calificaciones
- Terapia Cognitivo Conductual Tema 5Documento23 páginasTerapia Cognitivo Conductual Tema 5bobsraineyAún no hay calificaciones
- Calendario Escolar 2023: Periodo Escolar 1/2023 Periodo Escolar 2/2023Documento1 páginaCalendario Escolar 2023: Periodo Escolar 1/2023 Periodo Escolar 2/2023patricia martinezAún no hay calificaciones
- Guia DidacticaDocumento37 páginasGuia DidacticaWaynakay RDAún no hay calificaciones
- Triquinosis, Descripción de Un Caso y Prevención VeterinariaDocumento1 páginaTriquinosis, Descripción de Un Caso y Prevención VeterinariariomalodearribaAún no hay calificaciones
- Protocolo de Bioseguridad 2Documento18 páginasProtocolo de Bioseguridad 2luncellaAún no hay calificaciones
- Aspectos Psicosociales de La Edad Adulta IntermediaDocumento14 páginasAspectos Psicosociales de La Edad Adulta IntermediaFrancis RosalesAún no hay calificaciones
- Cuando Tu Hermano o Hermana Tiene CancerDocumento20 páginasCuando Tu Hermano o Hermana Tiene CancerKimberly VargasAún no hay calificaciones
- Ensayo PelículaDocumento5 páginasEnsayo PelículaDayana Rovelo AlboresAún no hay calificaciones
- EpicondilitisDocumento5 páginasEpicondilitisJhonatan Ramos SoriaAún no hay calificaciones
- Clase 5 CBP (Tens)Documento40 páginasClase 5 CBP (Tens)JoaCo CortesAún no hay calificaciones
- Plantilla Proyecto 2020 Jazmin y Roana Fin AdiosDocumento74 páginasPlantilla Proyecto 2020 Jazmin y Roana Fin AdiosLuana MendietaAún no hay calificaciones
- Osteopatia Una Terapia Por Descubrir PDFDocumento203 páginasOsteopatia Una Terapia Por Descubrir PDFpaula100% (1)
- Agentes FisicosDocumento82 páginasAgentes Fisicosniza castilloAún no hay calificaciones
- Cancer BucalDocumento17 páginasCancer BucalD.Estefany MorenoAún no hay calificaciones
- Ensayo de La Película Amar La VidaDocumento3 páginasEnsayo de La Película Amar La VidaElisa OsorioAún no hay calificaciones
- Encuesta Perfil Sociodemografico y Morbilidad Sentida V1Documento6 páginasEncuesta Perfil Sociodemografico y Morbilidad Sentida V1Martha PantojaAún no hay calificaciones
- Genero, Familia y AlternativasDocumento185 páginasGenero, Familia y AlternativasTatiana Rodríguez100% (1)
- Formato de Intervención GrupalDocumento11 páginasFormato de Intervención GrupalDavid Alejandro Duarte100% (1)
- 18º Clase EsquizofreniaDocumento22 páginas18º Clase EsquizofreniaMeli PulgarAún no hay calificaciones
- Tamizaje de Ca de PulmonDocumento11 páginasTamizaje de Ca de PulmonNancy Rocio Briceño ContrerasAún no hay calificaciones
- Examen Parcial - Semana 4 - RA - SEGUNDO BLOQUE-MEDICINA DEL TRABAJO - (GRUPO3) EstefaDocumento12 páginasExamen Parcial - Semana 4 - RA - SEGUNDO BLOQUE-MEDICINA DEL TRABAJO - (GRUPO3) EstefaESTEFANIA FLOREZ CORREAAún no hay calificaciones
- Paralisis Cerebral InfantilDocumento5 páginasParalisis Cerebral Infantilmia rivasAún no hay calificaciones
- Flujograma de Comunicación en Caso Sospechoso Covid - CorprisegDocumento2 páginasFlujograma de Comunicación en Caso Sospechoso Covid - CorprisegMiguel Moran GarciaAún no hay calificaciones