Documentos de Académico
Documentos de Profesional
Documentos de Cultura
M14 Espectro Vibracional Agua
Cargado por
riosmontse580 calificaciones0% encontró este documento útil (0 votos)
14 vistas3 páginasfisicoquimica
Título original
M14_espectro_vibracional_agua
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentofisicoquimica
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
14 vistas3 páginasM14 Espectro Vibracional Agua
Cargado por
riosmontse58fisicoquimica
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
Espectro vibracional del agua
Las moléculas están constituidas por átomos enlazados. Y aunque ni
los átomos son “bolitas” ni los enlaces son “muelles”, se
comportan como si lo fuesen, vibrando continuamente en torno a
posiciones de equilibrio.
Las moléculas se trasladan y rotan y sus átomos vibran. La vibración
es muy compleja, pero la teoría del movimiento oscilatorio ha
permitido deducir que puede considerarse la combinación de varios
movimientos vibratorios muy simples, dependiendo de la complejidad
de la molécula. En el caso de la molécula de H2O son de tres tipos:
La vibraciones de la izquierda y centro de la figura anterior se llaman
de tensión y son de dos tipos, simétrica (νsim ) y asimétrica (νasim). La
de la derecha se llama de flexión (δ). Cada uno de estos movimientos
se denomina modo normal de vibración. La vibración global de la
molécula de agua es una combinación de esos tres modos normales de
vibración, los cuales tienen distinta rapidez o frecuencia. Así, la
frecuencia del modo νsim del H2O es de unos 105 billones de hertzios;
la del modo νasim, de 103 billones de Hz aproximadamente; y la del δ,
de unos 50 billones de Hz..
En general, el número de modos normales de vibración en que se
puede descomponer el movimiento de toda molécula no lineal es3n–6,
siendo n el número de átomos de la molécula. (Si la molécula es lineal,
como el CO2, entonces el número de modos normales es 3n–5.) Estos
modos suelen ser de estos tipos:
Por supuesto, no todos los modos de un tipo (por ejemplo, tensión
simétrica) de todas las moléculas tienen la misma frecuencia; eso
depende de las masas de los átomos y de la fuerza de sus enlaces.
Debido a estos movimientos, cada molécula tiene una cierta energía
de vibración, pero esta energía puede variar absorbiéndose fotones
de la región del infrarrojo. Cuando se absorbe energía la molécula se
dice que pasa a un estado de vibración superior en el que los modos
de vibración no varían, ni sus frecuencias, pero sí la amplitud de la
vibración.
Estados de vibración y espectro IR
La figura siguiente ilustra distintos estados energéticos
correspondientes a cada uno de los modos normales de vibración de
la molécula H2O.
Si se dirige hacia una molécula de agua un fotón cuya energía sea la
diferencia de energía entre dos estados vibracionales de cualquiera
de sus tres modos de vibración, la molécula podrá absorber ese fotón
y, en ese caso, se excitará ese modo de vibración. Si ahora se irradia
una gran colección de moléculas de agua barriendo un intervalo
suficientemente ancho de longitudes de onda en el infrarrojo, se
acabarán excitando secuencialmente los tres modos por absorción de
los correspondientes fotones. Una representación de la absorbancia
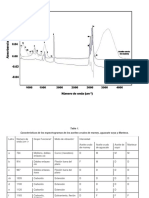
frente a la longitud de onda es el espectro infrarrojo. Cada especie
molecular tiene su espectro infrarrojo característico. En la figura
siguiente se muestra el espectro IR del agua líquida. Pueden
observarse tres bandas correspondientes a sendas transiciones
desde el estado fundamental al excitado para cada uno de sus tres
modos.
En espectroscopía de absorción IR, en el eje de abscisas es
costumbre representar el número de ondas, que es el inverso de la
longitud de onda).
También podría gustarte
- Informe de Mescalina1Documento32 páginasInforme de Mescalina1Jose Lucio Flores SantosAún no hay calificaciones
- Alta FrecuenciaDocumento22 páginasAlta FrecuenciaSebastián Vilches100% (1)
- Espectro IR - Alcoholes YFenolesDocumento4 páginasEspectro IR - Alcoholes YFenolesMayra Scarlet100% (1)
- La Ley Del Siete o Ley de Las OctavasDocumento15 páginasLa Ley Del Siete o Ley de Las Octavassaulinho_daluzAún no hay calificaciones
- Espectroscopia InfrarrojaDocumento9 páginasEspectroscopia InfrarrojaPedroCruzdePiedra100% (1)
- Movimiento Armónico Simple y sus aplicacionesDocumento12 páginasMovimiento Armónico Simple y sus aplicacionesHaskell Enrimar SandovalAún no hay calificaciones
- Espectroscopia InfrarrojaDocumento34 páginasEspectroscopia InfrarrojaSidney Estrada GonzalesAún no hay calificaciones
- Articulo Infrarrojo Con Ejemplo Ir Aceite Soja UsadoDocumento10 páginasArticulo Infrarrojo Con Ejemplo Ir Aceite Soja UsadoJorge EsquerreAún no hay calificaciones
- Capítulo 11.3. Identificación Espectroscópica de Compuestos Orgánicos. Química NM IB (Versión 3,1 2021)Documento22 páginasCapítulo 11.3. Identificación Espectroscópica de Compuestos Orgánicos. Química NM IB (Versión 3,1 2021)Geovanny Cordero GutiérrezAún no hay calificaciones
- Apuntes de InfrarrojoDocumento38 páginasApuntes de InfrarrojoLudving MillanAún no hay calificaciones
- Espectroscopia InfrarrojaDocumento7 páginasEspectroscopia InfrarrojaSilvia VázquezAún no hay calificaciones
- Uso Combinado de Los Métodos Físicos de Análisis en La Determinación de Estructuras OrgánicasDocumento18 páginasUso Combinado de Los Métodos Físicos de Análisis en La Determinación de Estructuras Orgánicasesteffany aguirreAún no hay calificaciones
- Espectroscopia Infrarroja PDFDocumento19 páginasEspectroscopia Infrarroja PDFDamián LMAún no hay calificaciones
- Apuntes de Infrarrojo1Documento38 páginasApuntes de Infrarrojo1Emmanuel Max EspAún no hay calificaciones
- Espectrofotometria Infrarojo PDFDocumento17 páginasEspectrofotometria Infrarojo PDFJosh GiusseppeAún no hay calificaciones
- Espectroscopia InfrarrojoDocumento9 páginasEspectroscopia InfrarrojoJonathan Correa OsorioAún no hay calificaciones
- Espectroscopía Infrarroja (Ir)Documento72 páginasEspectroscopía Infrarroja (Ir)Nataly ChavarriaAún no hay calificaciones
- Oscilador Anarmónico y Vibraciones AnarmónicasDocumento10 páginasOscilador Anarmónico y Vibraciones AnarmónicasDanita GmmAún no hay calificaciones
- Movimiento Armonnico SimpleDocumento8 páginasMovimiento Armonnico SimpleCarlos José GómezAún no hay calificaciones
- Trabajo Espectros VibracionalesrotacionalesDocumento8 páginasTrabajo Espectros VibracionalesrotacionalesALVARO ALEXIS CHOQUEJAHUA TINEOAún no hay calificaciones
- Modulo 4Documento17 páginasModulo 4alejandro chirinosAún no hay calificaciones
- Oscilaciones y ondas: movimientos periódicosDocumento21 páginasOscilaciones y ondas: movimientos periódicosEleanor RamosAún no hay calificaciones
- Guía de QuímicaDocumento52 páginasGuía de QuímicaIrais OrtizAún no hay calificaciones
- Espectroscopia de InfrarrojoDocumento9 páginasEspectroscopia de InfrarrojoEsteban MedinaAún no hay calificaciones
- Vibraciones mecánicas: introducción, osciladores y resonanciaDocumento16 páginasVibraciones mecánicas: introducción, osciladores y resonanciaKyred PlayerAún no hay calificaciones
- 1.3 Movilidad de Los AtomosDocumento6 páginas1.3 Movilidad de Los AtomosKevin AlcarazAún no hay calificaciones
- VibracionesDocumento63 páginasVibracionesStefania Herenandez MotaAún no hay calificaciones
- Análisis Instrumental - ESPECTROFOTOMETRÍADocumento75 páginasAnálisis Instrumental - ESPECTROFOTOMETRÍAHeacker Hacker HackerAún no hay calificaciones
- EspectrofotometriaDocumento33 páginasEspectrofotometrialuceroAún no hay calificaciones
- El Problema de La Radiación de EnergíaDocumento13 páginasEl Problema de La Radiación de EnergíaJosé Luis Flórez MantillaAún no hay calificaciones
- Boceto WordDocumento15 páginasBoceto WordArath Leon ReyAún no hay calificaciones
- Biofisica de Las Membranas ExcitablesDocumento19 páginasBiofisica de Las Membranas ExcitablesYamil Valencia100% (1)
- Ondas estacionarias y resonancia en cuerdas y columnas de aireDocumento10 páginasOndas estacionarias y resonancia en cuerdas y columnas de aireBryan RodríguezAún no hay calificaciones
- EspectroscopíaDocumento5 páginasEspectroscopíareynaHdezAún no hay calificaciones
- De La Física Clásica A La Teoría CuánticaDocumento3 páginasDe La Física Clásica A La Teoría CuánticaCaro Abraham SorianoAún no hay calificaciones
- ONDADocumento5 páginasONDAJUAN MANUEL ROJAS VERAAún no hay calificaciones
- Informe 2 Marco TeoricoDocumento11 páginasInforme 2 Marco TeoricoDany Herrera GuimacAún no hay calificaciones
- Movimiento OcilatorioDocumento25 páginasMovimiento OcilatorioFamilia cristiana unidaAún no hay calificaciones
- Espectroscopia InfrarrojaDocumento8 páginasEspectroscopia InfrarrojaKarlo Josué Sanchez RiveraAún no hay calificaciones
- Tema 5, Espectroscopía InfrarrojaDocumento7 páginasTema 5, Espectroscopía InfrarrojaIan Kenneth Maciel Sandoval BarragánAún no hay calificaciones
- La Mecánica de Fluidos Estudia Las Leyes Del Movimiento de Los Fluidos y Sus Procesos de Interacción Con Los Cuerpos SólidosDocumento3 páginasLa Mecánica de Fluidos Estudia Las Leyes Del Movimiento de Los Fluidos y Sus Procesos de Interacción Con Los Cuerpos SólidosPatricia GimenezAún no hay calificaciones
- Fluorescencia mecanismo luzDocumento3 páginasFluorescencia mecanismo luzRonaldAún no hay calificaciones
- Péndulo SimpleDocumento9 páginasPéndulo SimpleHIBBYS MISHEL ESCORCIA MUNIVEAún no hay calificaciones
- Movimientoarmnicosimple AnexosDocumento9 páginasMovimientoarmnicosimple AnexosYauli H W. YauliAún no hay calificaciones
- Oscilador ArmónicoDocumento9 páginasOscilador ArmónicoLizeth parraAún no hay calificaciones
- Movimiento de proyectilesDocumento21 páginasMovimiento de proyectilesRuben Ñahue RimacheAún no hay calificaciones
- Resumen Video Interferencia de OndasDocumento1 páginaResumen Video Interferencia de Ondasdaniela6retamozoAún no hay calificaciones
- 5 Ondas Estacionarias PDFDocumento26 páginas5 Ondas Estacionarias PDFjuan carlos Quintanilla BerroteranAún no hay calificaciones
- AIF. CONFERENCIA 6. Mét. Ópticos. Absorción Molecular IRDocumento9 páginasAIF. CONFERENCIA 6. Mét. Ópticos. Absorción Molecular IRMagalis LopezAún no hay calificaciones
- Ondas Mecanicas ...Documento27 páginasOndas Mecanicas ...Gino JeanpoolAún no hay calificaciones
- 5 Ondas EstacionariasDocumento26 páginas5 Ondas EstacionariasVale BajoAún no hay calificaciones
- Relación Carga Masa Del ElectrónDocumento5 páginasRelación Carga Masa Del ElectrónNeider BlancoAún no hay calificaciones
- Jeanna Perez - Guía de Estudio Termodinámica 1Documento5 páginasJeanna Perez - Guía de Estudio Termodinámica 1Jeanna PerezAún no hay calificaciones
- Oscilaciones, movimientos amortiguados y resonancia en sistemas mecánicosDocumento13 páginasOscilaciones, movimientos amortiguados y resonancia en sistemas mecánicosXavierAún no hay calificaciones
- Oscilaciones y ondas: conceptos básicosDocumento7 páginasOscilaciones y ondas: conceptos básicosChristian IAún no hay calificaciones
- Practica de Laboratorio de Física 2 HechaDocumento4 páginasPractica de Laboratorio de Física 2 HechaJuan Ramírez DisenAún no hay calificaciones
- 2 - Espectrometría en El InfrarrojoDocumento5 páginas2 - Espectrometría en El InfrarrojoCristhian AlvarezAún no hay calificaciones
- Trabajo de DoraDocumento18 páginasTrabajo de Doraeduard jose cardenas valenciaAún no hay calificaciones
- DF Cuestionario 201969690Documento3 páginasDF Cuestionario 201969690Gabriela CorderoAún no hay calificaciones
- MecánicaFluidosDocumento34 páginasMecánicaFluidosÁlvaro Aronés VillavicencioAún no hay calificaciones
- Resumen de OscilacionesDocumento7 páginasResumen de OscilacionesRaul Cerron GarciaAún no hay calificaciones
- Ondas Estacionarias Lab 2Documento11 páginasOndas Estacionarias Lab 2Alejandra CastañedaAún no hay calificaciones
- Tema 2. Aplicación de Técnicas de Administración de ContrasteDocumento7 páginasTema 2. Aplicación de Técnicas de Administración de Contrasteyungblud harrisonAún no hay calificaciones
- Informe Determinacion de Etanol en La GasolinaDocumento19 páginasInforme Determinacion de Etanol en La GasolinaDaniel KStilloAún no hay calificaciones
- 07 Espectroscopia Infrarroja PDFDocumento82 páginas07 Espectroscopia Infrarroja PDFAndrew TrianaAún no hay calificaciones
- Tema 2 y 3Documento42 páginasTema 2 y 3GlendyAún no hay calificaciones
- Detección de Contaminantes Atmosféricosmediante Espectroscopia InfrarrojaDocumento20 páginasDetección de Contaminantes Atmosféricosmediante Espectroscopia InfrarrojaJuan Humberto Albarracin VargasAún no hay calificaciones
- Espectroscopia de Absosción en El InfrarrojoDocumento5 páginasEspectroscopia de Absosción en El Infrarrojoaaherrera1Aún no hay calificaciones
- HidroxiapatitaDocumento10 páginasHidroxiapatitavitorhupAún no hay calificaciones
- Guia Seminari0s Lab3Documento68 páginasGuia Seminari0s Lab3seAún no hay calificaciones
- Espectroscopia InfrarrojaDocumento9 páginasEspectroscopia InfrarrojaJuan Manuel AcostaAún no hay calificaciones
- Informe - Instrumental - IrDocumento8 páginasInforme - Instrumental - IrAdriana Cangrejo YantenAún no hay calificaciones
- Trabajo FinalDocumento18 páginasTrabajo FinalEnrique Uicab AlcocerAún no hay calificaciones
- Cinéticas de Reacción, Ing. Claudia Hernández AmbrosioDocumento17 páginasCinéticas de Reacción, Ing. Claudia Hernández AmbrosioANAY NALLELY LAPONAún no hay calificaciones
- Cefazolina TextoDocumento16 páginasCefazolina TextoJonathan MedinaAún no hay calificaciones
- Exposicion de EspectrofotometriaDocumento23 páginasExposicion de EspectrofotometriaSherilyn RuizAún no hay calificaciones
- Artículo Científico Revision de La Miel 2022B Kevin JimenezDocumento3 páginasArtículo Científico Revision de La Miel 2022B Kevin JimenezKEVIN OSWALDO JIMENEZ DE ALBAAún no hay calificaciones
- Pre Lab 2 - 174229Documento4 páginasPre Lab 2 - 174229KahimAún no hay calificaciones
- QCE GradoQuimica Apuntes Tema14Documento41 páginasQCE GradoQuimica Apuntes Tema14Aldair Orozco UlloaAún no hay calificaciones
- 1Documento8 páginas1Andres CondeAún no hay calificaciones
- Práctica No. 6. InfrarrojoDocumento5 páginasPráctica No. 6. InfrarrojoNicolas VelásquezAún no hay calificaciones
- 5 (1) - Determinación de Azufre Astm PBVDocumento6 páginas5 (1) - Determinación de Azufre Astm PBVKatAún no hay calificaciones
- Sintesis y Caracterización Acetato de Niquel Tetrahidratado y Hexacloruro de CobreDocumento14 páginasSintesis y Caracterización Acetato de Niquel Tetrahidratado y Hexacloruro de Cobrehardy marquezAún no hay calificaciones
- ANGIE RODELO EspectrosDocumento3 páginasANGIE RODELO EspectrosANGIE PAOLA RODELO PANZAAún no hay calificaciones
- Informe Espectroscopia IR UV VisDocumento4 páginasInforme Espectroscopia IR UV VisHarold PatiñoAún no hay calificaciones
- Trabajo Final de MelinaDocumento36 páginasTrabajo Final de Melinaapi-440481590Aún no hay calificaciones
- Validación de Estructura Molecular de Serotonina y PropiedadesDocumento23 páginasValidación de Estructura Molecular de Serotonina y PropiedadesLouie FigueroaAún no hay calificaciones