Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Bioquímica de La Visión 3er Semestre Medicina
Cargado por
cagudelo430 calificaciones0% encontró este documento útil (0 votos)
4 vistas6 páginasTítulo original
BIOQUÍMICA DE LA VISIÓN 3ER SEMESTRE MEDICINA
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
4 vistas6 páginasBioquímica de La Visión 3er Semestre Medicina
Cargado por
cagudelo43Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 6
BIOQUÍMICA DE LA VISIÓN
La visión supone de la captación de energía lumínica y su transformación en energía
eléctrica, para conducir hasta el cerebro la información recogida en el ojo, y la
interpretación de la misma para generar una percepción de las forma, los colores y los
movimientos del exterior.
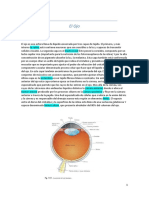
La retina es la encargada de transformarlos estímulos luminoso en impulsos
nerviosos, que luego son transmitidos al cerebro por el nervio óptico para su integración.
Esta está formada por varias capas de células. Las que mas se destacan son las células
fotorreceptoras, estas recogen el estímulo luminoso y establecen uniones sinápticas con
las células bipolares, estas están conectadas con las células ganglionares, cuyos
axones se integran en el nervio óptico y llegan hasta el cerebro. También están las
células horizontales y amacrinas, estas ayudan a controlar la transmisión del
mensaje hasta el cerebro.
También existe un epitelio pigmentado, que su función aunó esta muy clara, pero
se cree que puede contribuir a la calidad de la visión en situaciones donde la
luminosidad es elevada, también participan en el metabolismo del pigmento fotorreceptor
11—cis—retinal. Las células fotorreceptoras se dividen en dos: conos y bastones.
Los conos son mas o menos tres millones en la retina, especializados en la visión a plena
luz. Los bastones son más o menos cien millones en la retina y estos se ocupan de la
visión en condiciones de luz escasa.
Los dos tipos de células presentan características comunes:
•Son alargadas en las que en un estrecho cilio central separa dos partes, los
segmentos externo e interno.
•El segmento interno contiene el núcleo, el retículo endoplásmico y las mayor arte
de orgánicos subcelulares. En su extremo basal, establece uniones sinápticas con
células bipolares.
•El segmento externo es la parte de la célula especializada en la captación del
estímulo luminoso.
•Los bastones en el segmento externo tiene una serie de vesículas aplanadas,
fisicamente separadas de la membrana plasmática, llamadas discos.
•Los conos el segmento externo es más corto y tiene una serie de invaginaciones en la
membrana plasmática denominadas sacos.
En la oscuridad, las células receptores presenta un potencia de membrana de —
40mV. Este es el resulta de la actividad de una ATPasa, dependiente de Na+ y K+ y de
un canal iónico, que se mantiene abierto en ausencia de estímulo luminoso, permitiendo
la entrada de Na+ a favor de gradiente de concentración.
La ATPasa se encuentra en la membrana plasmática del segmento interno y
bombea, contra gradiente, Na+ hacia el exterior y K+ hacia el interior (4Na+ expulsado por
cada K+ introducido). El interior del fotorreceptor es negativo con respecto al exterior. El
canal para el Na+ se encuentra en los segmentos externos y se encuentra abierto
en la oscuridad. Esto permite que el Na+ entre a favor del gradiente electroquímico
generado por la actividad de la ATPasa.
Cuando hay una estipulación luminosa el canal para el Na+ se cierra, pero la activada de
la bomba ATPasa no se afecta, entonces se mantiene la salida de Na+ pero se limita o
anula la entrada del Na+ al fotorreceptor. Esto genera una hiperpolarización de la
membrana del fotorreceptor, que depende del número de fotones absorbidos por la
célula y que puede alcanzar un máximo de unos —60mV. A su vez, el grado de
polarización regula la liberación del neurotransmisor acumulado en los botones sinópticos
de los conos y bastones, el glutamato, que determina la generación de un
impulso que es transmitido, a través de las células bipolares y del nervio óptico, hasta
el cerebro. El canal iónico para el sodio es un canal controlado por ligando ya que los
canales se abren tras la unión de GMPc. En la célula en reposo los niveles de
GMPc son suficientes para mantener el canal abierto, pero cuando hay un estímulo
de luz, los niveles de GMPc bajan entonces se da el cierre del canal provocando la
hiperpolarización de la membrana. También el canal permite en menor medida la
entrada de calcio, esto es importante porque el calcio está implicado en los mecanismos
de adaptación a la luz.
RODOPSINA
Es la que capta el fotón. Esta es la proteína principal de los conos y bastones,
constituyendo un 80% de las proteínas totales de la célula. Se localiza en los
discos y sacos, esta formada por un cadena polipeptídica de 38000 daltons, la
opsina y un grupo prostético, el 11—cis—retinal. Presenta 7 fragmentos con
estructura helicoidal y muy hidrófobos que atraviesan la membrana del disco. Esos
fragmentos están conectado por regiones más hidrófilas en las que se sitúan zonas
de interacción con otros componentes del sistema de transducción de señales. Las
7 regiones hidrófobas helicoidales se disponen en forma de haz,
perpendicularmente a la membrana, dejando en el centro un bolsillo hidrófobo que
contiene el grupo prostético. En la ultima de las regiones hidrófilas hay dos residuos de
cisterna contiguos unidos cada uno a una molécula de ácido palmítico mediante un enlace
tioéster. La unión de estas dos cadenas hidrófobas potencia la asociación de la rodopsina
a la membrana del disco.
El 11—cis—retinal esta unido de forma covalente a la proteína. Las propiedades de
absorción de luz de la proteína se deben a la presencia del grupo prostético. El 11—cis
—retinal tiene un sistema de seis dobles enlaces conjugados que permite la absorción
muy eficaz de luz visible, con un coeficiente molar de 40.000M-1 a 500nm. Este en
la proteína se encuentra en un microentorno específico y establece interacción con
lagunas cadenas laterales de aminoácidos que modifican su distribución electrónica. La
capacidad de la proteína de modificar las propiedades de absorción del cromóforo es la
base de la percepción del color. En los conos, encargados de la percepción del
color, existen tres tipos de pigmento con propiedad de absorción distintas. Estas
tres proteínas contiene 11—cis—retinal como grupo cromóforo y su secuencia de
aminoácido se muy homologa entre sí y es muy parecida a la de la rodopsina de los
bastones. Sin embargo estas diferencias en la estructuras de la proteínas implicadas
en la visión del color hacen que entorno del retinal sea distinto, generando que el
espectro de absorción presente diferencias notables, con máximos de absorción a
longitudes de onda correspondientes a los colores azul, verde y rojo.
METABOLISMO DEL 11—CIS—RETINAL
El 11—cis—retinal y su isómero el todo—trans—retinal se forman mayoritariamente a
partir del β—caroteno (provitamina A) de la dieta.
1. En las células de la mucosa intestinal el β—caroteno es escindido en una reacción de
oxidación canalizada por la 15,15’—dioxigenasa, rindiendo dos moléculas de todo—
trans—retinal.
2. El todo—trans—retinal se reduce a todo—trans—retinol (Vitamina A1), en una
reacción catalizada por la retinol deshidrogenasa dependiente de NADH.
3. El retinol se esterifica con ácidos grasos de cadena larga y se incorpora a los
quilomicrones para su transporte en el hígado, donde es almacenado.
4. En el hígado, los ésteres de retinal se hidrolizan y el retinol libre resultante se combina
con una proteína gigante de retinol (RBP), que permite el transporte por la
sangre, hasta la retina, del cromóforo lipofilico.
5. Los complejos retinol—RBP son reconocidos por receptores específicos de las
células del epitelio pigmentado de la renta, que promueven la entrada en la célula del
retinol.
6. Una vez en la célula, el todo—trans—retinol es esterilizado para su almacenamiento,
o transformado en 11—cis—retinal para su incorporación a la rodopsina. Eso se produce
en dos reacciones consecutivas:
1. De isomerización a 11—cis—retinol catalizada por retinol isomerasa.
2. De oxidación a 11—cis—retinal, catalizada por la retinol deshidrogenada
dependiente de NADH.
Como los mamíferos no pueden producir 11—cis—retinal “de novo”, el déficit de vitamina
A produce anomalías de la visión, debido a una alteración de la capacidad d reformar
rodopsina.
•En las primeras etapas de desarrollo, esta falta de vitamina A provoca
xeroftalmia caracterizada por la formación de una película seca y dura sobre la córnea,
con ceguera nocturna que evoluciona a ceguera total si no se aporta la vitamina
•En los adultos, los primeros síntomas son pérdida de la agudeza visual en condiciones
de penumbra y la ceguera nocturna.
FOTOEXCITACIÓN DE LA RODOPSINA
1. Cuando se absorbe un fotón por la molécula de 11—cis—retinal se produce una
isomerización del grupo prostético que pasa a la forma todo—trans.
2. Esta isomerización produce un cambio considerable en la geometría del grupo
prostético, que a su vez induce una serie de cambios de conformación en casada en
la proteína.
3. Así la rodopsina atraviesa por varios estados meta estables con espectro de
absorción diferentes.
4. E l ú l t i m o d e l o s e s t a d o e s metarrodopsina II, tiene una hemivida de
casi un minuto y es capaz de interactuar con otros componentes del sistema de
transducción de señales para desencadenar la respuesta eléctrica. La esencia del
mecanismo de captación de la luz consiste en que la energía de un fotón se utiliza para
inducir un cambio de conformación en el grupo prostético, que se comunica a la proteína
creando un estado capaz de interaccionar con una cascada de transducción de señales.
CASCADA DE TRASNDUCCIÓN DE SEÑALES
-Activación por la metarrodopsina II de una proteína G específica, la transducina.
-Activación, por la transducina, de la fosfodiesterasa, una enzima capaz de
hidrolizar GMPc. -Cierre de los canales iónicos para el sodio, como consecuencia d
ella caída en la concentración intracelular de GMPc. También hay procesos de
desactivación que permiten la vuelta del sistema al estado basal, previa a la recepción
de un nuevo estímulo.
1. Activación de la transducina: La transducina es una proteína heterotrimétrica
compuesta por tres tipos de subunidades distintas α, β y γ, perteneciente a la familia de
las proteínas G. Esta sociedad a la cara citosólica de la membrana de los discos. Esta
tiene una afinidad muy baja por la rodopsina. Pero después de la excitación de ésta
por la unión de un fotón, los cambios de conformación que conducen a la
metarrodopsina II crean un centro de unión específico y de alta afinidad que
remite la formación de complejos metarrodopsina II—transducina. La disociación y
activación de la transducina es un primer elemento de amplificación de la señal luminosa.
2. Activación de la GMPc fosfodiesterasa, y cierre de los canales iónicos para
el sodio: La subunidad α, liberada por activación de la transducina, interactúa
entonces con una fosfodiesterasa específica de GMPc, provocando una activación
de esta enzima. La fosfodiesterasa es una proteína tetramétrica, compuesta por tres
tipos de subunidades, con una estequiometría αβγ2. La subunidad α de la transducina
podría unirse a las subunidades γ, anulando su capacidad de inhibir la actividad catalítica
de las otras subunidades. En cualquier caso, la enzima activada es capaz de rebajar los
niveles de GMPc total en al célula fotorreceptor hasta un 70% tras la estimulación
luminosa. Esta disminución de la concentración de GMPc es suficiente para inactivar
el canal iónico de sodio. La consecuencia final es la hiperpolarización de la célula
receptora.
3. Mecanismos de desactivación de la cascada: Ocurre como consecuencia de tres
procesos:
1. Inactivación de la metarrodopsina II: Este se puede dividir en dos etapas
1. En la primera se anula la capacidad de la metarrodopsina II de interactuar con la
transducina, con lo que dejan de producirse subunidades α activas.
1. Se produce por la acción combina de dos proteínas la rodopsina cinasa y la
arrestina.
2. La rodopsina cinasa fosforila a expensas de ATP, residuos de serina y
treonina de metarrodopsina II. Estos residuos están situados cerca del sitio de unión
de la transducina y su fosilización dificulta, la capacidad de interacción de las dos
proteínas.
3. La forma fosforilada de metarrodopsina presenta una afinidad muy elevado por la
arrestina, que se une de forma estequiométrica a la metarrodopsina. 4. En el
complejo arrestina—metarrodopsina fosforilada los puntos de integración con al
transducina quedan bloqueados, de forma que la activación de la proteína G
deja de producirse.
2. Se regenera una molécula de rodopsina lista para iniciar un nuevo ciclo de
activación. El mecanismo de reciclaje de la metarrodopsina fosforilada para
regenerar una molécula de rodopsina susceptible de volver a reaccionar frente a un
estímulo luminoso no se conoce totalmente.
1. La fosforilación y la unión de la abestian promueve la liberación del todo—trans—
retinal
2. El cromóforo se reduce rápidamente a todo—trans—retinol, por una retinal
deshidrogenasa existen en el segmento externo de los bastones
3. Es transportado al epitelio pigmentado donde puede convertirse en 11—cis—
retinal, por acción secuencia de la retinol isomerasa y la retinol
deshidrogenasa, quedando dispuesto para su unión a una molécula de opsina.
4. La proteína desprovista del grupo prostético pierde afinidad por la arrestina, el
complejo se disocia, lo que deja accesibles los puntos de fosforilación
permitiendo la acción de la proteína fosfatasa 2A, que hidroliza los grupos
fosfato introducidos por la cinasa. El resultado final de una molécula de opsina
capaz de regenera rodopsina por unión del 11—cis—retinal.
2. Inactivación de la transducina y apertura de los canales para el sodio: La
subunidad α de transducina posee una actividad GTPasa residual que hace que, al cabo
de un tiempo, el GTP unido a la proteína se hidrolice a GDP y fosfato. La subunidad α
queda en forma de GDP—α, que presenta una afinidad elevado por el dímero βγ.
Entonces se da la reconstrucción de la transducina trimérica αβγ inactiva. Puesto que la
fosfodiesterasa dependiente de GMPc solo es activa en presencia de la subunidad
α de transducina, la desaparición de esta determina la inactivación de la fosfodiesterasa,
entonces la degradación de GMPc disminuye, mientras que los mecanismos de su
síntesis siguen funcionando. En consecuencia, la concentración de GMPc aumento, lo
que conlleva a su unión a los canales de soda y la apertura de estos. El sodio entra a la
célula fotorreceptora a favor del gradiente regenerando el potencial de reposo.
Bases bioquímicas de la adaptación a la luz
Este no se encuentra aún totalmente aclarado, pero se sabe que en él interviene una
proteína específica de la célula fotorreceptora, la recoverina, también conocida como
S—modulina (proteína moduladora de la sensibilidad), y que la señal intracelular
que regular el mecanismo de adaptación está relacionado con los niveles de calcio
•Durante la fotorrespuesta, la concentración de Ca+2 citoplasmático libre en los
segmentos externo de los bastones es de 140nM, mientras que en las células
adaptadas a la luz la concertación de calcio aumenta hasta los 300nM.
•La recoverina posee la capacidad de unir cuatro iones calcio por molécula, de forma
cooperativa y con alta afinidad.
•El complejo Ca+2—recoverina es capaz de inhibir la rodopsina cinasa. Variaciones de
la concentración de Ca+2 inducidas por el estado funcional del fotorreceptor, podrían
contribuir la modulación de la hemivida de la forma excitada de rodopsina, y de la
sensibilidad de la fotorrespuesta.
BASES BIOQUÍMICAS DE LAS ALTERACIONES METABOLICOGENETICAS DE LA
VISIÓN
Dentro de las patologías de origen genético se puede destacar:
•Ceguera al color: Provocada por alteraciones de los genes que codifican las distintas
opsinas, y que puede tener distinto grado, desde la ceguera a un color o el daltonismo
(déficit de discriminación entre el rojo y el verde), hasta la visión en blanco y negro.
•Ceguera nocturna estacionaria congénita: Es una enfermedad heredable asociada a
una alteración de la función de los bastones, en ella el paciente presente un fondo
de ojo normal, pero sufre de ceguera nocturna no progresiva, con agudeza visual
reducida y miopía.
•Retinitis pigmentaria: Es un proceso degenerativo y progresivo, que afecta al
epitelio pigmetario. Comienza con una ceguera nocturna y dificultades en la visón
periférica, progresado hasta a ceguera total. Entre las alteración metabólicas de la visión
cabe destacar:
•Síndrome de Bassen-Kornzweing: Debido a un mal funcionamiento del sistema
de absorción de vitaminas liposolubles, que cursa de forma parecida al déficit de
vitamina A (descrito anteriormente). Debe recordarse que algunos estados patológicos
presentan efecto secundarios importantes sobre la visión, como lo es el caso de la
diabetes, que produce un atrofia del sistema microvascular del ojo, con implicación
progresivas y de importancia variables, que pueden acabar en ceguera.
También podría gustarte
- Abon VIHDocumento2 páginasAbon VIHWilmar Michael Zurita Vera100% (3)
- Retículo Endoplasmático (REDocumento9 páginasRetículo Endoplasmático (REJosse RodriguezAún no hay calificaciones
- La FototransducciónDocumento9 páginasLa FototransducciónJerry Carhuatanta SaavedraAún no hay calificaciones
- Fotoquimica de La VisionDocumento18 páginasFotoquimica de La VisionEdna Fernanda Vergara NúñezAún no hay calificaciones
- Ciclo visual: procesamiento de la información lumínicaDocumento27 páginasCiclo visual: procesamiento de la información lumínicaHsieh Lo MingAún no hay calificaciones
- Trabajo de BiologiaDocumento11 páginasTrabajo de Biologialoaizaj12Aún no hay calificaciones
- Química de La VisiónDocumento9 páginasQuímica de La VisiónCarlos Vargas de Montoya100% (2)
- SEMDocumento11 páginasSEMjulissagonzalezzuritaAún no hay calificaciones
- 10.1 - Sist Endome - Reticulo EndoplasmaticoDocumento32 páginas10.1 - Sist Endome - Reticulo Endoplasmaticojanire cabezasAún no hay calificaciones
- Sistema de EndomembranasDocumento50 páginasSistema de EndomembranasAngela AliagaAún no hay calificaciones
- Re, Golgi, Lisosoma, Peroxisoma, MitocondriaDocumento118 páginasRe, Golgi, Lisosoma, Peroxisoma, MitocondriaJosselin Saavedra LópezAún no hay calificaciones
- Transducción de Señales para La VisiónDocumento4 páginasTransducción de Señales para La VisiónCasandra Valo100% (1)
- Guia de Biologia CelularDocumento9 páginasGuia de Biologia CelularMaria Fernanda Hernandez CastañedaAún no hay calificaciones
- Resumen de BiologíaDocumento5 páginasResumen de BiologíaOsvaldo Soto GutiérrezAún no hay calificaciones
- Expo SISTEMA MEMBRANASDocumento28 páginasExpo SISTEMA MEMBRANASVANIA ALEXA COTRINA ESTEVESAún no hay calificaciones
- Captura de Pantalla 2023-09-26 A La(s) 11.32.00 P.M.Documento5 páginasCaptura de Pantalla 2023-09-26 A La(s) 11.32.00 P.M.Darcy FernandezAún no hay calificaciones
- Sistema de Endomembranas 363014 Downloable 1758018Documento9 páginasSistema de Endomembranas 363014 Downloable 1758018Dayana BarahonaAún no hay calificaciones
- Bioquimica Del Mecanismo de La VisionDocumento4 páginasBioquimica Del Mecanismo de La VisionALEXA SORIA GARCIAAún no hay calificaciones
- Resumen MonografíasDocumento17 páginasResumen MonografíasWILIGETAún no hay calificaciones
- Extra 3. Sensibilidad VisualDocumento7 páginasExtra 3. Sensibilidad VisualAlbaAún no hay calificaciones
- Función receptora y nerviosa de la retinaDocumento10 páginasFunción receptora y nerviosa de la retinaJhony PradelaAún no hay calificaciones
- Bioquímica de La RetinaDocumento6 páginasBioquímica de La RetinaAngelina PiñaAún no hay calificaciones
- Ojo 2.2Documento27 páginasOjo 2.2Emily BastosAún no hay calificaciones
- Sistema de EndomembranasDocumento35 páginasSistema de EndomembranasMaria Paula Quintero TamayoAún no hay calificaciones
- Eaxmen de FisioDocumento5 páginasEaxmen de FisioWilmar YPeAún no hay calificaciones
- Túnica Nerviosa o Retina 11Documento34 páginasTúnica Nerviosa o Retina 11henzejuly50% (2)
- Anatomía Funcional de La RetinaDocumento7 páginasAnatomía Funcional de La RetinaJorge Avila100% (2)
- VisiónDocumento17 páginasVisiónDavidAún no hay calificaciones
- Sistema de Membranas Citoplasmaticas o Sistema de EndomembranasDocumento9 páginasSistema de Membranas Citoplasmaticas o Sistema de EndomembranasValentina CelaniAún no hay calificaciones
- Transducción sensorial en la vista, olfato y gustoDocumento19 páginasTransducción sensorial en la vista, olfato y gustoDiego Iván De La CruzAún no hay calificaciones
- Epitelio Pigmentario de La RetinaDocumento4 páginasEpitelio Pigmentario de La RetinaJean Carlos Rivera AlmonteAún no hay calificaciones
- Cuestionario S.N.C. Emperatriz IngaDocumento9 páginasCuestionario S.N.C. Emperatriz IngaEmperatrizIngaHidalgoAún no hay calificaciones
- Fisiologia Del CristalinoDocumento7 páginasFisiologia Del CristalinoOscar Padilla NavarroAún no hay calificaciones
- Reticulo Endoplasmatico RugosoDocumento3 páginasReticulo Endoplasmatico RugosoKrista JuárezAún no hay calificaciones
- OFTALMODocumento25 páginasOFTALMOJhoselyn Melissa Chumbes GarciaAún no hay calificaciones
- El retículo endoplasmático y el aparato de GolgiDocumento58 páginasEl retículo endoplasmático y el aparato de GolgiAroa SilvaAún no hay calificaciones
- Sinapsis ResumenDocumento9 páginasSinapsis ResumenAniretac Neko Seyer50% (4)
- Taller OrgánulosDocumento23 páginasTaller OrgánulosJose TôrrësAún no hay calificaciones
- Tema 13 NeurotrasmisoresDocumento7 páginasTema 13 NeurotrasmisoresFrancisco PabonAún no hay calificaciones
- Modulo III Reticulo Endoplásmicosistema de Endomembranas Con Audio Final 2023Documento29 páginasModulo III Reticulo Endoplásmicosistema de Endomembranas Con Audio Final 2023Madelin BolañosAún no hay calificaciones
- 21 Transduccion SensorialDocumento16 páginas21 Transduccion SensorialFiorela Mamani SuxsoAún no hay calificaciones
- Biologia CelularDocumento19 páginasBiologia Celularmariacmaldonadov12Aún no hay calificaciones
- Retículo Endoplásmico Pi MZVDocumento29 páginasRetículo Endoplásmico Pi MZVCool BoyLVAún no hay calificaciones
- El retículo endoplásmico: estructura y función en la célulaDocumento12 páginasEl retículo endoplásmico: estructura y función en la célulaBelén FernándezAún no hay calificaciones
- Retículo EndoplasmáticoDocumento5 páginasRetículo EndoplasmáticoKarla Peláez GalánAún no hay calificaciones
- Presentacion Retículo EndoplásmicoDocumento46 páginasPresentacion Retículo Endoplásmicobresojiar100% (2)
- Bioquimica FotoreceptoresDocumento36 páginasBioquimica FotoreceptoresVictor ManriquezAún no hay calificaciones
- Organelos IIDocumento8 páginasOrganelos IIantonia muñozAún no hay calificaciones
- MEMBRANA. ExposicionDocumento16 páginasMEMBRANA. ExposicionJuan PabloAún no hay calificaciones
- Tema 6 AcabadoDocumento13 páginasTema 6 AcabadoMagdalena Oñate SerranoAún no hay calificaciones
- Organelos PDFDocumento72 páginasOrganelos PDFVictor CarpioAún no hay calificaciones
- Transducción VisualDocumento2 páginasTransducción Visualandreaaaaar0% (1)
- Citoplasma y citoesqueleto: Taller de refuerzoDocumento7 páginasCitoplasma y citoesqueleto: Taller de refuerzoMARIA LUCIA PIESCHACÓN CHUZCANOAún no hay calificaciones
- La Transmicion NerviosaDocumento7 páginasLa Transmicion Nerviosaeduardo100% (2)
- Clase 10 Fisiologia Del Oido y EquilibrioDocumento96 páginasClase 10 Fisiologia Del Oido y EquilibrioPAOLA LEONOR LOPEZ MARINAún no hay calificaciones
- Sistema EndomembranasDocumento25 páginasSistema EndomembranasGil Ruano100% (1)
- E11 Retà - Culo EndoplasmáTicoDocumento28 páginasE11 Retà - Culo EndoplasmáTicoIago AraújoAún no hay calificaciones
- Retículo EndoplasmáticoDocumento8 páginasRetículo Endoplasmáticocongaconga123Aún no hay calificaciones
- Transporte de ProteinasDocumento9 páginasTransporte de ProteinasGise MathierAún no hay calificaciones
- Retículo EndoplasmáticoDocumento20 páginasRetículo EndoplasmáticoAlba Macipe FeitoAún no hay calificaciones
- Acceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012De EverandAcceso a Universidad para Mayores de 25 años. Biología.: Solucionario Pruebas 2006-2012Aún no hay calificaciones
- taller bioquimica andina 2023Documento5 páginastaller bioquimica andina 2023cagudelo43Aún no hay calificaciones
- RESULTADOS DE LA ENCUESTA DEL SERVICIO DE ENFERMERIADocumento15 páginasRESULTADOS DE LA ENCUESTA DEL SERVICIO DE ENFERMERIAcagudelo43Aún no hay calificaciones
- TALLER DE RECUPERACIÓN FARMACO 2024Documento14 páginasTALLER DE RECUPERACIÓN FARMACO 2024cagudelo43Aún no hay calificaciones
- RELACION DE LA PELICULA DE ENTRE LAS CENIZAS Y LA DECLARACION DEL HELSINKIDocumento2 páginasRELACION DE LA PELICULA DE ENTRE LAS CENIZAS Y LA DECLARACION DEL HELSINKIcagudelo43Aún no hay calificaciones
- Que es la constituciónDocumento4 páginasQue es la constitucióncagudelo43Aún no hay calificaciones
- Conducta de Entrada OptometríaDocumento6 páginasConducta de Entrada Optometríacagudelo43Aún no hay calificaciones
- Enzima CPKDocumento8 páginasEnzima CPKcagudelo43Aún no hay calificaciones
- Analisis de Resultados de Estudio Epi..Documento6 páginasAnalisis de Resultados de Estudio Epi..cagudelo43Aún no hay calificaciones
- EscleritisDocumento4 páginasEscleritiscagudelo43Aún no hay calificaciones
- Propiedades (2) 1Documento3 páginasPropiedades (2) 1Mariano SilveyraAún no hay calificaciones
- Importancia Del Ritmo Biológico Del SueñoDocumento2 páginasImportancia Del Ritmo Biológico Del SueñoMaria CamposAún no hay calificaciones
- Técnicas de coproparasitología para el análisis macroscópico y microscópico de hecesDocumento8 páginasTécnicas de coproparasitología para el análisis macroscópico y microscópico de hecesOmar Vega RuizAún no hay calificaciones
- Calculo ParticipacionDocumento10 páginasCalculo ParticipacionEgresados Inedju0% (1)
- Sistema de Profundización PorcinaDocumento163 páginasSistema de Profundización Porcinaliliana97Aún no hay calificaciones
- Psoriasis: causas, tipos y tratamientoDocumento29 páginasPsoriasis: causas, tipos y tratamientoMercedes PalacioAún no hay calificaciones
- Las Ventajas de Tener Un Huerto en CasaDocumento1 páginaLas Ventajas de Tener Un Huerto en Casainesvictoria100% (1)
- Laboratorio de Bioquimica LecheDocumento5 páginasLaboratorio de Bioquimica LechevictorAún no hay calificaciones
- Evaluación Primer Parcial: Contenidos UnidadDocumento242 páginasEvaluación Primer Parcial: Contenidos UnidadHENRY SANTIAGO CANDO REINOSOAún no hay calificaciones
- Triptico Achotillo Exposicion de CampoDocumento2 páginasTriptico Achotillo Exposicion de CampoMarcos Choez LopezAún no hay calificaciones
- Relación Entre El Ciclo de Muda y La Actividad de Las Enzimas Digestivas y Su Efecto en La Tasa de Alimentación y Crecimiento Juvenil Penaeus Vannamei (Eduardo Cadena, Cesar Molina - ESPOL)Documento13 páginasRelación Entre El Ciclo de Muda y La Actividad de Las Enzimas Digestivas y Su Efecto en La Tasa de Alimentación y Crecimiento Juvenil Penaeus Vannamei (Eduardo Cadena, Cesar Molina - ESPOL)William MonteroAún no hay calificaciones
- Perfil Del Proyecto y Propuesta Tecnica Vivero MunicipalDocumento8 páginasPerfil Del Proyecto y Propuesta Tecnica Vivero MunicipalOscar Eduardo Ortega CutipaAún no hay calificaciones
- SENSOPERCEPCIÓNDocumento26 páginasSENSOPERCEPCIÓNJersiNaviaAún no hay calificaciones
- Sistema reproductor femenino y masculinoDocumento5 páginasSistema reproductor femenino y masculinoManuel HilarioAún no hay calificaciones
- 08 2436 CDocumento90 páginas08 2436 CSaga CastañedaAún no hay calificaciones
- 01 Guía de Lenguaje 1 U0 - Texto Expositivo 3EDocumento6 páginas01 Guía de Lenguaje 1 U0 - Texto Expositivo 3EDavid Rodríguez RAún no hay calificaciones
- Resumen UltrasonidoooDocumento25 páginasResumen UltrasonidoooLuis Espinoza AramburúAún no hay calificaciones
- Catálogo de las briofitas de La LibertadDocumento20 páginasCatálogo de las briofitas de La LibertadSugey Ortiz-SerranoAún no hay calificaciones
- La Alucinación Por Ayahuasca (Jacques Mabit)Documento19 páginasLa Alucinación Por Ayahuasca (Jacques Mabit)drakpoAún no hay calificaciones
- Fagositosos y PinositosisDocumento23 páginasFagositosos y PinositosisAllan PgAún no hay calificaciones
- Robert HookeDocumento2 páginasRobert HookeDaniela Huaman CalcinaAún no hay calificaciones
- Células Del Sistema Inmunitario y Órganos LinfoidesDocumento8 páginasCélulas Del Sistema Inmunitario y Órganos LinfoidesItzel Ramos CruzAún no hay calificaciones
- Lupus Eritematoso Sistémico 2021 CorregidoDocumento108 páginasLupus Eritematoso Sistémico 2021 CorregidoIrmaKIrmaAún no hay calificaciones
- En El Cerebro Estan Las Bases Del AmorDocumento7 páginasEn El Cerebro Estan Las Bases Del AmorJorgeAún no hay calificaciones
- Sopa de LetrasDocumento1 páginaSopa de LetrasNaty AnrrangoAún no hay calificaciones
- Ecto y Endoparasitos en BufalosDocumento11 páginasEcto y Endoparasitos en BufalosthaisAún no hay calificaciones
- Relación Entre Dolor y Crecimiento MuscularDocumento3 páginasRelación Entre Dolor y Crecimiento MuscularJesus DamianAún no hay calificaciones
- Primer Parcial de Anatomia AnatomiaDocumento40 páginasPrimer Parcial de Anatomia AnatomiaMaria De Los Angeles MoraAún no hay calificaciones
- Homo DeusDocumento28 páginasHomo DeusBriones Vásquez50% (2)