Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Bioquimica Resumen H 601512 Downloadable 3597272
Cargado por
Fabián OlivaresTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Bioquimica Resumen H 601512 Downloadable 3597272
Cargado por
Fabián OlivaresCopyright:
Formatos disponibles
Accede a apuntes, guías, libros y más de tu carrera
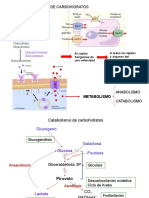
Metabolismo de Carbohidratos
pag.
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
1.Metabolismo de carbohidratos ( Aslhey )
Los carbohidratos están ampliamente distribuidos en vegetales y animales; tienen importantes funciones estructurales
y metabólicas. Los hidratos de carbono y los lípidos son las principales fuentes de energía y se almacenan en el
organismo en forma de glucógeno y triglicéridos. En los vegetales, la glucosa se sintetiza a partir de CO2 y agua por
medio de fotosíntesis, es almacenada como almidón o usada para sintetizar la celulosa de las paredes de las células
vegetales. Los animales pueden sintetizar carbohidratos a partir de aminoácidos, pero casi todos se derivan finalmente
de vegetales. La glucosa es el carbohidrato más importante; casi todo el carbohidrato de la dieta se absorbe hacia el
torrente sanguíneo como glucosa formada mediante hidrólisis del almidón y los disacáridos de la dieta, y otros
azúcares se convierten en glucosa en el hígado, además es el principal combustible metabólico de mamíferos (excepto
de los rumiantes) y un combustible universal del feto
Se define como la interconversión de compuestos químicos en el cuerpo, las vías que siguen moléculas individuales,
sus interrelaciones, y los mecanismos que regulan el flujo de metabolitos a través de las vías:
o Vías anabólicas: Síntesis de compuestos de mayor tamaño y más complejos a partir de precursores
más pequeños
o Vías catabólicas: degradación de moléculas de mayor tamaño
o Vías anfibólicas: Se presentan en las encrucijadas del metabolismo y actúan como enlaces entre las
vías anabólicas y catabólicas.
El metabolismo normal incluye adaptación a periodo de ayuno, inanición, ejercicio, asi como embarazo y lactancia.
El metabolismo anormal puede darse por deficiencia nutricional, deficiencia enzimática, secreción anormal de
hormonas, o las acciones de fármacos y toxinas.
Hay un requerimiento constante de combustibles metabólicos durante todo el día, dado que la actividad física
promedio sólo aumenta la tasa metabólica alrededor de 40 a 50% sobre la tasa metabólica basal, o en reposo. Si la
ingesta de combustibles metabólicos es consistentemente mayor que el gasto de energía, el excedente se almacena,
en su mayor parte como triacilgliceroles en el tejido adiposo, lo que conduce al desarrollo de obesidad.
Es necesario procesar los productos de la digestión de carbohidratos, lípidos y proteínas de la dieta; éstos son
particularmente glucosa, ácidos grasos y glicerol, y aminoácidos, Todos los productos de la digestión se metabolizan
hacia un producto común, la acetil-CoA, que luego se oxida mediante el ciclo del ácido cítrico.
La glucosa es el principal combustible de casi todos los tejidos . Se metaboliza hacia piruvato por la vía de la glucólisis
. Los tejidos aeróbicos metabolizan el piruvato a acetil-CoA, que puede entrar al ciclo del ácido cítrico para su oxidación
completa hacia CO2 y H2O, enlazada a la formación de ATP en el proceso de fosforilación oxidativa
La glucólisis también puede ocurrir de manera anaeróbica cuando el producto terminal es el lactato.
Los aminoácidos son necesarios para efectuar la síntesis de proteína. Algunos deben suministrarse en la dieta (los
aminoácidos esenciales o indispensables), porque no se pueden sintetizar en el organismo. El resto son aminoácidos
no esenciales o dispensables, que provienen de la dieta, pero también pueden formarse a partir de intermediarios
metabólicos mediante transaminación usando el grupo amino de otros aminoácidos.
Los aminoácidos generados por la digestión de proteína de la dieta y la glucosa producida por la digestión de
carbohidratos, se absorben por medio de la vena porta hepática.
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
APORTE CLÍNICO:
En la diabetes mellitus tipo 1 mal controlada, los pacientes llegan a presentar hiperglucemia, en parte como resultado
de falta de insulina para estimular la captación y utilización de glucosa, y porque en ausencia de insulina que
antagonice con las acciones del glucagón hay aumento de la gluconeogénesis a partir de aminoácidos en el hígado. Al
mismo tiempo, la falta de insulina que antagonice las acciones del glucagón ocasiona incremento de la lipólisis en el
tejido adiposo, y los ácidos grasos no esterificados resultantes son sustratos para la cetogénesis en el hígado
En pacientes con caquexia como resultado de la liberación de citocinas en respuesta a tumores, y varios otros estados
patológicos, hay un aumento del índice de catabolismo de proteína tisular, así como incremento considerable del
índice metabólico, de modo que se encuentran en estado de inanición avanzada. De nuevo, la muerte sobreviene
cuando proteínas tisulares esenciales se catabolizan y no son reemplazadas.
2.Historia del Ciclo de Krebs
Recibe su nombre en honor a su descubridor Sir Hans Krebs, quien propuso los elementos clave de esta vía en 1937.
Krebs estaba estudiando el consumo de oxígeno en músculo pectoral de paloma, un tejido con alta tasa de respiración,
y realizó varias observaciones de gran relevancia. En primer lugar, el citrato, el isocitrato y el cis-aconitato estimulaban
la oxidación de piruvato y el consumo de O2, en cantidad desproporcionada. En segundo lugar, empleando malonato,
lograba bloquear la oxidación del piruvato, lo que indicaba su participación en la vía. Además, observó que las células
tratadas con malonato acumulaban citrato, succinato y α-cetoglutarato, lo cual sugería que citrato y α-cetoglutarato
eran precursores del succinato. En tercer lugar, la administración al tejido de piruvato y oxaloacetato provocaba la
acumulación de citrato en el músculo, lo que indicaba que son precursores del citrato. Con base en estas observaciones
experimentales Hans Krebs propuso una ruta cíclica y su secuencia de reacciones.
2.1 Ciclo de Krebs
BAYNES: El ciclo de los ácidos tricarboxílicos (ATC) es una de las vías comunes del metabolismo de todos los
combustibles localizada en la mitocondria.
El ciclo de Krebs aporta una base común para la interconversión de los
combustibles y metabolitos ya que este ciclo participa en la síntesis de la
glucosa a partir de los aminoácidos y lactato durante la inanición y el
ayuno y también interviene en la conversión de hidratos de carbono en
grasa lo que también es una gran fuente de aminoácidos, como aspartato
y glutamato y de succinil-CoA que srive como precursor de las porfirinas
para la síntesis del hemo. El ciclo de Krebs está localizado en la matriz
mitocondrial esta localización del ciclo es importante desde el punto de
vista metabólico. Esto permite que se utilicen intermediarios idénticos con
propósitos diferentes dentro y fuera de la mitocondria. Como sabemos
este ciclo es una continuidad de la glucólisis y el resultado final de la
glucólisis es el piruvato este está en un cruce de caminos en el
metabolismo. Puede ser convertido en un único paso a lactato (lactato
deshidrogenasa), a alanina (alanina aminotransferasa, ALT), a oxalacetato
(piruvato carboxilasa) y a acetil-CoA (complejo piruvato deshidrogenasa).
Aporte clínico: la mayoría de los niños con deficiencia del complejo
piruvato deshidrogenasa debuta en la lactancia con retraso del desarrollo
e hipotonía muscular, generalmente asociado con convulsiones y algunos
lactantes con esta deficiencia tienen malformaciones cerebrales
congénitas.
Las mutaciones en la estirpe germinal de varias enzimas del ciclo de Krebs
son características de distintos subtipos de cáncer. Las mutaciones de las
subunidades de la succinato deshidrogenasa dan lugar a feocromocitomas y paragangliomas. Las mutaciones de la
fumarato hidratasa se asocian a un aumento de la producción de fumarato en los tumores renales, uterinos y cutáneos
que forman parte del llamado síndrome hereditario de leiomiomatosis y carcinoma de células renales.
HARPER: CAP 16: 174 – 180
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
Como ya lo mencionamos este ciclo es parte de una de las rutas metabólicas y este ocurre en casi todos los tejidos,
pero el hígado es el único tejido en el cual todos suceden en un grado significativo. Los pocos defectos genéticos de
las enzimas del ciclo del ácido cítrico que se han informado se relacionan con daño neurológico grave como resultado
de alteración muy considerable de la formación de ATP en el sistema nervioso central.
Las vitaminas desempeñan funciones clave en el ciclo del ácido cítrico
Cuatro de las vitaminas B son esenciales en este ciclo y, por ende, en el metabolismo productor de
energía: la riboflavina, en forma de flavina adenina dinucleótido (FAD), un cofactor para la succinato deshidrogenasa;
niacina, en forma de nicotinamida adenina dinucleótido (NAD), el aceptor de electrón para la isocitrato
deshidrogenasa, a-cetoglutarato deshidrogenasa, y malato deshidrogenasa; tiamina (vitamina B1), como difosfato de
tiamina, la coenzima para la descarboxilación en la reacción de a-cetoglutarato deshidrogenasa, y ácido pantoténico,
como parte de la coenzima A, el cofactor fijo a residuos ácido carboxílicos “activos” como acetil-CoA y succinil-CoA.
El ciclo del ácido cítrico en sí no proporciona una vía para la oxidación completa de esqueletos de carbono de
aminoácidos que dan lugar a intermediarios como a-cetoglutarato, succinil-CoA, fumarato y oxaloacetato, porque esto
da lugar a un incremento de la cantidad de oxaloacetato y así poder continuar con este ciclo.
Conclusión: En el libro de Baynes se observa un gran enfoque en explicar los procesos de cada reacción de las enzimas
y así saber el origen y el final del ciclo de Krebs para así llegar a un nuevo compuesto y seguir con el ciclo y en cómo
podemos ver de manera clínica si estos procesos fallan o no existan una ausencia, en cambio en Harper podemos
observar en cómo reforzar al ciclo de Krebs mediante vitaminas y así evitar las patologías que nos describe Baynes.
3.Historia de Glucolisis
Es un proceso que ha sido estudiado desde la segunda década del siglo XIX, cuando los químicos Louis Pasteur, Eduard
Buchner, Arthur Harden y William Young comenzaron a detallar el mecanismo de la fermentación. Estos estudios
permitieron conocer el desarrollo y distintas formas de reacción en la composición de las moléculas. Los primeros
estudios informales de los procesos glucolíticos fueron iniciados en 1860, cuando Louis Pasteur descubrió que los
microorganismos son los responsables de la fermentación, y en 1897 cuando Eduard Buchner encontró que cierto
extracto celular puede causar fermentación. Descubierta formalmente en 1940 por Otto Meyerhoff y otro tanto años
después por Luis Leloir, aunque todo ello gracias a trabajos previos de finales del siglo.
3.1 Glucolisis
La glucólisis es la vía central del metabolismo de la glucosa en todas las células. La glucosa es el hidrato de carbono
más importante en la Tierra, y el esqueleto y la unidad monomérica de la celulosa y del almidón.
La glucosa ingresa a la célula a través de difusión facilitada, mediada por el trasportados de glucosa GLUT-1. Esta ruta
metabólica comienza con la síntesis de glucosa – 6- fosfato.
La glucolisis solo representa el 5% de los 30-32 ATP que se pueden obtener de la oxidación de glucosa a CO2 Y H2O
por la mitocondria en otros tejidos. La glucolisis no es una vía aislada, sino que representa varios puntos de
ramificación para otras vias metabólicas, como por ejemplo la de las grasas.
• FASE DE IN0VERSION DE LA GLUCOLISIS
1. Glucosa -6-fosfato
El primer paso es la fosforilación de la glucosa a glucosa 6-fosfato, catalizada por la enzima hexocinasa, pero esta
formación es desfavorable, por lo que se gasta 1 molécula de ATP.
2. Fructosa 6-fosfato
La Glc – 6 – p se convierte en fructosa-6-p mediante la fosfoglucosa isomerasa. Luego se invierte una segunda molécula
de ATP para fosforilar la fru-6-P por medio de la Fructoquinasa 1, que requiere ATP para convertirse en Fru-1,6-
Bifosfato
• FASE DE DIVISION DE LA GLUCOLISIS
La Fru-1,6-Bi se divide por la mitad por una reacción catalizada por la aldolasa en dihidroxiacetona fosfato y
gliceraldehido-3-p. Solo el gli-3-P continua el estado de rendimiento, pero es la Triosa fosfata isomerasa cataliza la
interconversion de dihi-3-p a gli-3-p, de manera que las dos mitades de glucosa, se metabolizan hasta lactato.
• FASE DE RENDIMIENTO DE LA GLUCOLISIS
La síntesis de ATP se consigue mediante cinasas que catalizan la fosforilación a nivel del sustrato.
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
Gliceraldehido 3-P deshidrogenasa cataliza una reacción redox formando un compuesto acil fosfato de alta energía
que es 1,3-bisfosfatoglicerato. La coenzima NAD+ es reducida a NADH.
Fosfoglicerato cinasa cataliza 1,3-BPG al ADP formando ATP.
El grupo fosfato restante en el 3-fosfogliceratono tiene suficiente energía para fosforilar ADP, entonces desplzan la
posición C-2 del glicerato, convirtiéndose en 2-fosfoglicerato, catalizado por la enzima Fosfoglicerato MUTASA.
Las reacciones de la glucolisis que generan ATP dan lugar a 2 moléculas de ATP por cada mol de triosa fosfato, o un
total de 4 moles de ATP por cada mol de Fru-1,6-BP. Cuando el ATP se consume y aumenta el ADP, se forma AMP a
través de la reacción de la adenilato cinasa.
Después de ajustar por el ATP invertido en las reacciones de la hexocinasa y PFK-1, el rendimiento neto de energía es
de 2 moles de ATP por cada mol de glucosa convertida en piruvato.
APORTE CLÍNICO
Un niño presentaba ictericia y dolor a la palpación abdominal después de un resfriado intenso. Los análisis de
laboratorio mostraban valores bajos de hematocrito y de hemoglobina; los eritrocitos eran normocromos y con
morfología normal y había una reticulocitosis leve. El valor de la bilirrubina sérica estaba aumentado.
La deficiencia de piruvato cinasa es la más frecuente de las anemias hemolíticas derivadas de la deficiencia en una
enzima glucolítica. Se trata de una enfermedad autosómica recesiva que se encuentra con una frecuencia de 1/10.000
(~1 % de frecuenciagénica) en la población mundial. Ocupa el segundo lugar como causa enzimática de anemia
hemolítica, sólo por detrás de la deficiencia de G6PDH. Estas enfermedades se diagnostican a través de la
determinación de las concentraciones eritrocitarias de enzimas o metabolitos, mediante la demostración de
alteraciones en las actividades enzimáticas o mediante análisis genético. Los defectos enzimáticos en el piruvato cinasa
que han sido caracterizados son la labilidad térmica, el incremento de la Km para el PEP y la disminución de la
activación por Fru-1,6-BP.
4. Gluconeogénesis
BAYNES: Contrario a la glucólisis anaerobia; intervienen enzimas mitocondriales y citosólicas.
Necesaria para mantener la glucemia durante el ayuno y la inanición: Respuesta lenta dependiente de cambios
genéticos. Se convierte en la fuente principal de glucosa en sangre luego de 8 horas a la absorción. Requiere fuente
energética para:
• Biosíntesis
• Formación del esqueleto de la molécula glucosa.
La estructura carbonada se da por:
- Lactato producido en tejido (hematíes y músculo).
- Aminoácidos (de proteínas musculares).
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
- Glicerol (de triglicéridos durante lipólisis del tejido adiposo).
Precursor más importante: Proteína muscular. La grasa se usa para cubrir necesidades energéticas y apoya a la
gluconeogénesis, la mayor parte de aminoácidos se convierten en glucosa; hay aumento de excresión de N en la orina
(úrea).
A PARTIR DEL LACTATO:
Gluconeogénesis hepática; mismas enzimas que se usa para convertir de glucosa a lactato (inversa).
Superación de la irreversibilidad de tres reacciones:
- Glucocinasa (GK)
- Fosfofructocinasa – 1 (PFK-1)
- Piruvato cinasa (PK)
Fosfoglicerato cinasa; cataliza una reacción reversible --> Una fosforilación en el sustrato transfiere un acil fosfato del
1,3-bisfosfoglicerato a un enlace pirofosfato de energía similar en el ATP.
¿Cómo se solventa las tres reacciones irreversibles? El hígado utiliza:
Piruvato carboxilasa (PC) en la mitocondria y fosfoenolpiruvato carboxicinasa (PEPCK) en el citoplasma para
evitar PK.
Fructosa – 1,6 – bisfosfatasa (Fru – 1,6 – Bpasa) para no usar PFK-1.
Glc-6-Pasa para evitar GK.
Proceso:
1. Conversión a fosfoenolpiruvato (PEP): 1. Lactato se convierte en piruvato
mediante lactato deshidrogenasa (LDH). 2. Penetración en mitocondria; donde
se convierte en oxaloacetato por la PC, usando biotina y ATP.
2. Oxaloacetato se reduce a malato por malato deshidrogenasa, sale de la
mitocondria y se vuelve a oxidar a oxaloacetato por malato deshidrogenasa del
citosol.
3. Oxaloacetato citosólico se descarboxila por PEPCK (usa GTP como cosustrato
y produce PEP).
4. Se retrocede desde PEP hasta que alcanza la siguiente reacción irreversible
(PFK-1); enzima que se evita por hidrólisis, catalizada por Fru-1,6-BPasa sin
producción de ATP, reviritiendo la reacción de PFK-1 y produciendo Fru-6-P).
5. La reacción catalizada por GK se evita con hidrólisis de Glc-6-P por la Glc-6-
Pasa, sin producción de ATP.
6. Se libera glucosa en la sangre.
El hígado puede fabricar un kilo de glucosa al día (pacientes diabéticos
hiperglucémicos mal controlados).
Producción normal de C6H12O6 en ausencia de carbohidratos: 200 g/día.
Consumo neto de 4 moles de ATP por cada mol de piruvato convertido a glucosa
(2 ATP en PC y 2 GTP en PEPCK). ATP y GTP son suministrados por oxidación de
ácidos grasos.
A PARTIR DE AMINÓACIDOS Y DEL GLICEROL:
Alanina y glutamina son los más importantes exportados desde el músculo para la gluconeogénesis.
- Alanina se convierte en piruvato mediante alanina transaminasa (ALT).
- Aspartato se convierte en oxaloacetato por aspartato transaminasa (AST).
- Glutamato se convierte en a-cetoglutarato por glutamato deshidrogenasa.
Algunos se convierten en intermediarios del ciclo de los ATC, los grupos amino de estos aminoácidos se convierten en
úrea, mediante el ciclo de la urea (en los hepatocitos) y sesxcreta en la orina.
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
El glicerol, proveniente del tejido adiposo, entra en la gluconeogénesis a través de las triosas fosfato.
- Glicerol captado por el hígado y fosforilado por glicerol cinasa.
- Actúa glicerol-3-fosfato deshidrogenasa; glicerol entra en la vía como dihidroxiacetona fosfato.
- Solo el componente glicerol de las grasas puede convertirse en glucosa. La incorporación del glicerol a la
glucosa necesita 2 moles ATP por cada mol de glucosa producida.
C6H12O6 NO SE SINTETIZA A PARTIR DE ÁCIDOS GRASOS
Debido a la forma en que se metabolizan. Los ácidos grasos se descomponen en acetil-CoA, que luego se utiliza en el
ciclo de los ácidos tricarboxílicos (ATC) para producir energía. Sin embargo, durante este proceso se eliminan dos
moléculas de CO2, lo que resulta en la pérdida de los dos carbonos del acetil-CoA para la gluconeogénesis. Por lo tanto,
el acetil-CoA y los ácidos grasos de cadena par no pueden ser utilizados como sustratos netos para la gluconeogénesis.
Sin embargo, los ácidos grasos de cadena impar y de cadena ramificada, que generan propionil-CoA, pueden ser
precursores menores para la gluconeogénesis. El propionil-CoA se convierte en metilmalonil-CoA, que a su vez se
transforma en succinil-CoA mediante reacciones enzimáticas. El succinil-CoA se convierte en malato, sale de la
mitocondria y se oxida a oxaloacetato. Luego, a través de la PEPCK, los tres carbonos del propionato se conservan en
el PEP (fosfoenolpiruvato) y se utilizan para la síntesis de glucosa.
Regulación de la gluconeogénesis:
La regulación de la gluconeogénesis involucra la contrarregulación de la glucólisis y la
gluconeogénesis a través de la fructosa 2,6-bisfosfato (Fru-2,6-BP). El glucagón y la insulina
son las principales hormonas que controlan este proceso. La Fru-2,6-BP regula las enzimas
PFK-1 y Fru-1,6-BPasa de manera alostérica. La Fru-2,6-BP activa la PFK-1 y inhibe la Fru-
1,6-BPasa, contrarrestando las dos vías opuestas. La síntesis de Fru-2,6-BP es regulada por
la enzima bifuncional PFK-2/Fru-2,6-BPasa. Bajo la influencia del glucagón, esta enzima
muestra actividad Fru-2,6-BPasa, disminuyendo la concentración de Fru-2,6-BP y
promoviendo la gluconeogénesis.
La insulina, al entrar la glucosa al hígado después de una comida, desfosforila la PFK-2/Fru-
2,6-BPasa, activando su actividad PFK-2. Esto aumenta la concentración de Fru-2,6-BP, lo
que activa la PFK-1 e inhibe la Fru-1,6-BPasa. Como resultado, se inhibe la gluconeogénesis
y la glucosa se incorpora al glucógeno o se dirige hacia la glucólisis para la lipogénesis.
En la mitocondria, el acetil-CoA regula la gluconeogénesis. El aumento de acetil-CoA, debido a la entrada de ácidos
grasos estimulada por el glucagón, inhibe la piruvato deshidrogenasa (PDH) y activa la carboxilasa piruvato (PC). Esto
favorece el uso del piruvato para la gluconeogénesis en el hígado.
En el músculo, durante el ayuno, la baja concentración de insulina limita la utilización de glucosa en el metabolismo
energético. Además, el acetil-CoA inhibe la PDH. El metabolismo activo de las grasas y las altas concentraciones de
acetil-CoA en el músculo promueven la producción de lactato a partir del piruvato. El ciclo de Cori y el reciclaje de
piruvato a glucosa permiten que el esqueleto carbonado de la glucosa regrese al hígado, preservando así la proteína
muscular.
CONVERSIÓN DE LA FRUCTOSA Y LA GALACTOSA EN GLUCOSA
La fructosa se metaboliza principalmente en el hígado, ingresando a la glucólisis en forma de triosas fosfato, sin pasar
por la enzima reguladora PFK-1. Después de consumir alimentos ricos en fructosa, como jugos de frutas, bebidas
isotónicas o jarabe de maíz, grandes cantidades de piruvato pueden ingresar a la mitocondria para ser utilizadas en el
metabolismo energético o en la síntesis de grasas. Durante la gluconeogénesis, la fructosa puede convertirse en
glucosa y suministrar una fuente adecuada de glucosa en la sangre.
De manera similar, la galactosa se convierte eficientemente en glucosa, ya que la Glc-1-P derivada de la galactosa-1-
fosfato se isomeriza fácilmente a Glc-6-P mediante la enzima fosfoglucomutasa. Tanto la fructosa como la galactosa
son buenas fuentes de glucosa, independientemente de la glucogenólisis y la gluconeogénesis.
CONCLUSIÓN:
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
El almacenamiento y metabolismo del glucógeno en el organismo están finamente regulados por una serie de
mecanismos alostéricos y hormonales. El hígado almacena glucógeno para mantener la estabilidad de la glucosa en la
sangre a corto plazo, mientras que el músculo lo utiliza como fuente de energía durante el ejercicio intenso.
En el hígado, el equilibrio entre la degradación y la síntesis del glucógeno está regulado por las concentraciones de
glucagón e insulina en la sangre. Bajo la influencia del glucagón, el glucógeno se degrada para liberar glucosa y
mantener los niveles adecuados de glucosa en la sangre durante el ayuno o el sueño. Por otro lado, la insulina
promueve la síntesis de glucógeno y la captación de glucosa en el músculo y tejido adiposo después de las comidas.
La adrenalina también desencadena la degradación del glucógeno en el hígado y el músculo, aumentando la
disponibilidad de glucosa en la sangre en situaciones de estrés o actividad física intensa.
La gluconeogénesis, que ocurre principalmente en el hígado, es esencial para mantener los niveles de glucosa en la
sangre durante el ayuno prolongado. Utiliza sustratos como lactato, aminoácidos y glicerol, y obtiene energía del
metabolismo de ácidos grasos. La enzima PFK-1 es un punto clave de control en la gluconeogénesis y su actividad está
regulada por el efecto alostérico del Fru-2,6-BP.
La síntesis de Fru-2,6-BP, un regulador importante de la gluconeogénesis, está controlada por la enzima bifuncional
PFK-2/Fru-2,6-BPasa, cuya actividad cinasa y fosfatasa se ven influenciadas por la fosforilación y desfosforilación, que
a su vez son reguladas por las hormonas insulina y glucagón.
APORTE CLÍNICO:
CASO: Una niña nacida de una madre joven desnutrida presentó signos de hipoglucemia poco después del nacimiento.
La niña estaba delgada, débil y mostraba signos de distrés. Su nivel de glucosa en sangre fue de 3,5 mmol/l (63 mg/dl)
al nacer y disminuyó rápidamente a 1,5 mmol/l (27 mg/dl) después de una hora, lo que la llevó a entrar en coma. Su
condición mejoró significativamente con la administración de una solución de glucosa y una dieta rica en
carbohidratos. Durante las siguientes dos semanas, su estado de salud mejoró gradualmente antes de recibir el alta
médica.
ANÁLISIS: El desarrollo fetal depende de la obtención de glucosa a través de la circulación placentaria. Sin embargo,
después del nacimiento, el bebé debe depender de la movilización del glucógeno hepático y de la gluconeogénesis
para mantener niveles adecuados de glucosa en sangre. En este caso, debido al estado de desnutrición de la madre,
la niña nació con escasas reservas de glucógeno hepático, lo que la hizo incapaz de mantener la glucemia adecuada
después del parto, resultando en hipoglucemia y una respuesta de estrés. Después de sobrevivir a la hipoglucemia
transitoria, es probable que la niña aún careciera de suficiente masa muscular para proporcionar los aminoácidos
necesarios para la gluconeogénesis. La administración de glucosa seguida de una dieta rica en carbohidratos pudo
corregir estos déficits, pero es posible que no haya corregido el daño más grave causado por la desnutrición durante
el desarrollo fetal prolongado.
HARPER: CAP 19: 198 – 207
Proceso de síntesis de glucosa a partir de precursores que no son carbohidratos, como lactato, aminoácidos
gluconeogénicos, glicerol y propionato. Los principales tejidos gluconeogénicos son los riñones y el hígado. La energía
necesaria para este proceso es proporcionada por la oxidación de los ácidos grasos.
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
De las reacciones del glucolisis, la mayoría son reversibles por lo
que se realizan a la inversa de la glucolisis, sin embargo, en el caso
de las reacciones irreversibles se presentan ciertos cambios en
comparación a la glucolisis:
• Piruvato y fosfoenolpiruvato: Para revertir la reacción
catalizada por la enzima piruvato quinasa en la glucolisis, se
necesita de dos reacciones endotérmicas:
• 1. La carboxilación de piruvato a oxalacetato gracias a la
enzima piruvato carboxilasa y a su cofactor la biotina (inversión
de 1ATP). Este oxalacetato se convierte en malato y se traslada
hacia el citosol, en donde se convierte nuevamente en
oxalacetato
• 2. La formación de fosfoenol piruvato a partir del oxalacetato,
gracias a la enzima foenolpiruvato carboxicinasa (usa 1 GTP)
• Fructosa 1,6-bisfosfato y fructosa 6-fosfato: La conversión de
la fructuosa 1,6 bisfosfato a fructuosa 6 fosfato se logra por la
enzima fructosa 1,6-bisfosfatasa.
• Glucosa 6-fosfato y glucosa: La conversión de glucosa 6-
fosfato a glucosa, gracias a la enzima glucosa 6-fosfatasa. Esta
enzima solo se presenta en hígado y riñones.
• Glucosa 1-fosfato y glucógeno: Una fosforilasa cataliza la
conversión de glucógeno a glucosa 1-fosfato, que después se
convierte en glucosa 6-fosfato gracias a la fosfoglucomutasa.
Ciclo de Cori o ciclo del ácido láctico: Es la transformación del
lactato (producido por glucolisis en el musculo estriado y
eritrocitos) en glucosa (a nivel del hígado y riñones)
Regulación de la actividad de enzimas vinculadas con el metabolismo de carbohidratos:
Inducción y represión de las enzimas clave: Existe una serie de cambios en la actividad enzimática que ocurre en el
hígado, dependiendo del estado metabólico, por ejemplo, cundo existe gran fluidez de glucosa las enzimas que se
utilizan durante el glucolisis son activas y las enzimas relacionadas con la gluconeogénesis presentan una actividad
baja.
Modificación covalente por medio de fosforilación reversible: Hormonas como el glucagón y la epinefrina
causan la disminución de la glucosa en sangre, y, por tanto, estimulan la gluconeogénesis a nivel hepático.
Modificación alostérica: La enzima piruvato carboxilasa usada en la glucolisis necesita de un activador alostérico que
es el acetil-Coa. La activación e inhibición de piruvato deshidrogenasa por la acetil-CoA explica la relación entre la
oxidación de ácidos grasos y la estimulación de la gluconeogénesis
Mecanismos para la regulación de glucosa en sangre: La gluconeogénesis es importante ya que una baja repentina
de los niveles de glucosa en sangre puede causar convulsiones ya que el cerebro depende de la glucosa. Es por ello
por los niveles de glucosa en sangre son controlados sobre todo por hormonas como: insulina producida a nivel de las
células beta de los islotes pancreáticos como respuesta a la hiperglucemia, esta produce una disminución de los niveles
de glucosa en sangre al incrementar su transporte hacia el tejido adiposo y muscular; o el glucagón que se libera por
las células alfa de los islotes pancreáticos como respuesta de la hipoglucemia, este aumenta la glucogénesis a partir
de aminoácidos o lactato. También existen otras hormonas como la hormona de crecimiento, la hormona
adrenocorticotrópica, los glucocorticoides, citocinas, epinefrina.
APORTE CLÍNICO
Cuando se supera el umbral renal para la glucosa se produce glucosuria: En condiciones normales los riñones
reabsorben por completo la glucosa que se filtró a nivel del glomérulo, pero cuando las concentraciones de la glucosa
en sangre se elevan de 10 mmol/L (hiperglucemia) el filtrado glomerular puede contener más glucosa que la que se
puede resorber, lo que provoca glucosuria.
La hipoglucemia puede aparecer durante el embarazo y en el recién nacido: El feto consume niveles de glucosa altos
durante la gestación, lo que genera el riesgo de hipoglucemia materna o fetal sobre todo si los intervalos entre comidas
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
son prolongados. Los lactantes prematuros y con peso bajo al nacer también son susceptibles a la hipoglucemia porque
tienen poco tejido adiposo para que proporcione ácidos grasos libres, mismo que actúan como fuente de energía para
la gluconeogénesis
Medir la tolerancia a la glucosa permite determinar la capacidad del cuerpo para utilizarla: La tolerancia a la glucosa
es la capacidad de regular sus niveles de concentración en sangre después de la administración de una dosis de prueba.
En la diabetes mellitus la tolerancia es baja ya que la secreción de insulina también los es. Por ello se administra insulina
misma que disminuye la concentración sanguínea de glucosa, y aumenta su utilización y almacenamiento como
glucógeno.
Conclusión: La gluconeogénesis es la formación de glucosa a partir de elementos que nos son carbohidratos. Ocurre a
nivel de hígado y los riñones, y al ser lo contrario al glucolisis el proceso es similar, a excepción de las reacciones
irreversibles en donde deben usarse enzimas adicionales. La gluconeogénesis es importante para mantener los niveles
normales de glucosa en sangre durante periodos de ayuno.
5.Cadena transportadora de electrones y fosforilación oxidativa
BAYNES: La producción de energía a partir de los ácidos grasos tiene lugar exclusivamente en la mitocondria, las
mitocondrias tienen como principal función la oxidación de los combustibles metabólicos y la conservación de la
energía libre mediante la síntesis de ATP.
Las principales coenzimas de oxidorreducción (redox) que participan en la transducción de la energía desde los
combustibles al ATP son: nicotinamida-adenina-dinucleótido (NAD+), flavina-adeninadinucleótido (FAD) y flavina-
mononucleótido (FMN)
• El NAD+ acepta un ion hidruro (H-), formado por un protón y dos electrones
• El FAD y el FMN aceptan dos electrones y dos protones
La energía libre de la oxidación de NADH y FADH2 se utiliza en el sistema de transporte electrónico para bombear
protones hacia el espacio intermembranoso. La energía producida cuando estos protones vuelven a entrar en la matriz
mitocondrial se utiliza para sintetizar ATP.
El Sistema Mitocondrial De Transporte De Electrones
Se localiza en la membrana mitocondrial interna, formado por varios complejos de proteínas grandes y por dos
pequeños componentes independientes, la ubiquinona y el citocromo c.
Los protones son bombeados desde la matriz hasta el espacio intermembranoso por los complejos I, III y IV, Por cada
par de electrones transportado por los complejos I, III o IV, cada complejo bombea protones para la síntesis de un mol
de ATP/complejo.
• A partir de NADH, se sintetizan aproximadamente 2,5 moles de ATP
• A partir de las flavoproteínas que contienen FADH2 produce unos 1,5 moles de ATP
Hay cuatro flavoproteínas en la cadena de transporte de electrones: el complejo I, que contiene FMN, y otras tres, que
contienen FAD.
Complejo I: NADH-Q reductasa o NADHdeshidrogenasa:
Es una flavoproteína que contiene FMN, oxida el NADH mitocondrial y junto al FMN y complejos FeS, transfiere
electrones a la ubiquinona, así puede bombear cuatro protones desde la matriz .
Complejo III: citocromo c reductasa
El complejo III acepta electrones desde la ubiquinona y bombea 4 protones, dos de la ubiquinona totalmente reducida
y dos desde la matriz.
Complejo IV: citocromo c oxidasa
Oxida el citocromo c móvil y transporta electrones a través de los citocromos a y a3; finalmente, reduce el oxígeno a
agua en una reacción de transferencia de cuatro electrones. Bombea protones hacia el exterior de las mitocondrias,
con lo que se sintetiza 1 mol de ATP por cada par de electrones transferidos al oxígeno.
Hipótesis Quimiosmótica
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
Las mitocondrias producen ATP utilizando la energía libre procedente del gradiente de protones generado durante la
oxidación de NADH y FADH2, esta energía es la fuerza motriz de protones, un gradiente electroquímico creado por el
gradiente de concentración de protones y una diferencia de carga a través de la membrana mitocondrial interna.
Relaciones P:0
La relación P :0 puede calcularse a partir de los moles de ADP utilizados para sintetizar ATP y los átomos de oxígeno
captados por las mitocondrias
• Si se convierten 2 mmol de ADP en ATP y se captan 0,5 mmol de oxígeno, la relación P:0 es de 2,0.
• la relación P:O en la oxidación de los metabolitos que producen NADH es de ~ 2 ,5
• La relación P:O para los que producen FADH2 es de ~ 1,5.
La energía restante disponible de la oxidación de NADH y FADH2 se libera en forma de calor.
Una pequeña actividad física, con consumo de ATP y formación de ADP y Pi, abre los canales de la ATPasa, descargando
el gradiente de protones y activando la cadena de transporte de electrones y el consumo de combustible y oxígeno.
Desacoplantes
Transportan de nuevo los protones al interior de las mitocondrias y hacen desaparecer el gradiente de protones sin
intervención de la ATP sintasa y estimulan la respiración.
Los desacoplantes suelen ser compuestos hidrofóbicos y bases o ácidos débiles, con un pKa cercano al pH 7.
Inhibidores Del Metabolismo Oxidativo: Estos inhiben de modo selectivo los complejos I, III o IV, interrumpiendo el
flujo de electrones a lo largo de la cadena respiratoria.
• La rotenona inhibe el complejo I (NADH-O reductasa): un insecticida de uso
común, y algunos barbitúricos (p. ej., amital), causa la reducción de todos los
componentes previos al punto de inhibición, dado que no pueden ser
oxidados, mientras que después del punto de inhibición se oxidan por
completo.
• La antimicina A inhibe el complejo III (OH2-citocromo c reductasa): impide la
transmisión al citocromo c de electrones procedentes del complejo I o bien de
flavoproteínas que contengan FADH2
• El cianuro y el monóxido de carbono inhiben el complejo IV: Los
componentes que preceden al complejo IV se reducen, el oxígeno no puede
reducirse, ninguno de los complejos es capaz de bombear protones y no se
sintetiza ATP.
Regulación De La Fosforilación Oxidativa
Control respiratorio: cuando se añade ADP a mitocondrias aisladas, el ADP estimula
la respiración y la síntesis de ATP. Una vez el ADP ha sido convertido completamente
en ATP, la respiración recupera su frecuencia inicial.
Modificación covalente y efectores alostéricos (ATP-ADP): En respuesta a la acción
hormonal el complejo IV es fosforilado por la proteína cinasa dependiente del AMPc
(PKA) y desfosforilado por una proteína fosfatasa estimulada por Ca2. Esto permite la
regulación alostérica por el ATP (relación ATP/ADP).
Poro de transición de permeabilidad mitocondrial (PTPM)
localizado en la membrana mitocondrial interna, sólo se abrirá cuando las células se recuperan por perfusión después
de un período de isquemia como la lesión por reperfusión isquémica (LRI). En respuesta a la LRI se produce una cascada
de reacciones que finalizan en la apoptosis y necrosis celular, causando la muerte de la célula.
Fármacos, como la ciclosporina A, inhiben la apertura del PTPM y pueden proteger a las células de la necrosis o la
apoptosis tras la administración de un trombolítico.
HARPER: CAP 13: 140 - 148
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
Los organismos aerobios captan una gran cantidad de energía libre, este proceso en su mayor parte va a ocurrir en la
mitocondria.
La matriz mitocondrial ser encuentra rodeada por dos membranas:
- Membrana externa: es permeable a casi todos los metabolitos
Encontramos la presencia de enzimas: Acetil-CoA sintetasa y glicerolfosfato aciltransferasa
- Membrana interna: tiene permeabilidad selectiva
Cuenta con el fosfolípido cardiolipina, junto con las enzimas de la cadena respiratoria, ATP sintasa y diversos
transportadores de membrana
El espacio intermembrana: Cuenta con enzimas como adenilil cinasa y la creatina cinasa
En la mitocondria toda la energía liberada en la oxidación de carbohidratos, ácidos grasos y aminoácidos se encuentra
dentro mitocondrias como -H o electrones
Los complejos de la cadena respiratoria, y la maquinaria para la fosforilación oxidativa, se encuentran en las
mitocondrias, esta cadena reúne y transporta equivalentes reductores como -H o electrones y los dirige a su reacción
final con el oxígeno para formar agua. La fosforilación oxidativa atrapa la energía libre en forma de fosfato de alta
energía.
Lo electrones de la cadena respiratoria fluyen desde NAD1/NADH hacia
O2/2H2O a través de tres complejos:
1. Complejo I, NADH-Q oxidorreductasa: transfieren electrones
desde NADH hacia la coenzima Q
2. Complejo III, Q-citocromo c oxidorreductasa: Pasa los
electrones hacia el Citocromo c, y citocromo c oxidasa
(Complejo IV),
3. El Citocromo c, y citocromo c oxidasa (Complejo IV), completa
la cadena, pasa los electrones hacia O2 y hace que se reduzca a H2O.
Algunas sustancias pasan electrones hacia Q por medio del cuarto complejo, la succinato-Q reductasa (complejo II).
El flujo de electrones por los complejos I, III y IV provoca el bombeo de protones desde la matriz por la membrana
mitocondrial interna hacia el espacio intermembrana.
Q acepta electrones mediante los complejos I y II:
• Complejo I o NADH-Q oxidorreductasa: es una proteína grande, en forma de L, cataliza la transferencia de
electrones desde NADH hacia Q y la transferencia de cuatro H+ hacia la membrana
• Complejo II (succinato-Q reductasa): forma FADH2 durante la conversión de succinato en fumarato en el ciclo
del ácido cítrico, y los electrones pasan por medio de varios centros Fe-S hacia Q.
El ciclo Q acopla la transferencia de electrones al transporte de protones en el complejo III:
• complejo III (Q-citocromo c oxidorreductasa): Los electrones se pasan desde QH2 hacia el citocromo c por
medio del complejo III:
Este proceso incluye citocromos C1, bL y bH+, y un Fe-S Rieske, elementos que componen el ciclo Q. Q puede existir
en tres formas, la quinona oxidada, el quinol reducido o la semiquinona
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
El oxígeno molecular se reduce hacia agua por medio del complejo IV:
• Complejo IV (citocromo c oxidasa): oxida el citocromo c reducido, con la reducción concomitante de O2 hacia
dos moléculas de agua:
La transferencia de cuatro electrones desde el citocromo c hacia O2 comprende dos grupos hem, a y a3, y Cu. Estos
electrones viajan a un centro Cu, luego hacia hem a, hem a3 y finalmente a O2. De los ocho H1 eliminados de la matriz,
cuatro forman dos moléculas de agua, y cuatro son bombeadas al espacio intermembrana.
El transporte de electrones mediante la cadena respiratoria crea un gradiente de protón que impulsa la síntesis de
ATP
La Teoría Quimiosmótica propuesta por Peter Mitchell en 1961, postula que la fuerza motriz de protón causada por la
diferencia de potencial electroquímico impulsa el mecanismo de síntesis de ATP.
La fuerza motriz que posee un protón impulsa al ATP sintasa
ubicada en la membrana interna, a formar ATP cuando cuenta
con la presencia de Pi + ADP. Varias subunidades de la proteína
se ubican alrededor de un eje F1, que contiene el mecanismo de
fosforilación, a su vez. F1 está fijo a la proteína F0, que abarca
toda la membrana y forma un canal de protones, causando que
F0 rote e impulse la producción de ATP en el complejo F1.
Esto ocurre debido a un mecanismo de cambio de unión, donde
una de las subunidades de F1 se une a ATP, luego a una que libera
ATP y se une a ADP y Pi, para que pueda formarse el siguiente
ATP.
El ATP resultante se denomina la moneda de energía de la célula,
porque pasa energía libre necesaria para los procesos que
requieren energía.
En las reacciones de Fosforilación Oxidativa en el ámbito de la cadena respiratoria, como en el Ciclo del ácido cítrico,
se captan dos fosfatos de alta energía más por mol de glucosa durante la conversión de succinil CoA en succinato, por
cada mol de sustrato oxidado por los complejos I, III y IV se forman 2.5 mol de ATP por cada 0.5 mol de O2 consumido.
La disponibilidad de ADP puede controlar el índice de respiración de las mitocondrias. Cuando se realiza trabajo, el
ATP se convierte en ADP, lo que permite que ocurra más respiración y reabastecer las reservas de ATP. La energía libre
restante que no se capta como fosfato de alta energía se libera como calor
Sistemas de difusión de intercambio
Están presentes en la membrana para intercambio de aniones contra iones OH- y cationes
contra iones H+.
La membrana mitocondrial interna es permeable a moléculas pequeñas no cargadas,
como oxígeno, agua, CO2, NH3 y ácidos monocarboxílicos, como 3-hidroxibutírico,
acetoacético y acético.
El piruvato utiliza un acarreador especial, que utiliza el gradiente de H+ desde afuera hacia
dentro de la mitocondria.
Los aniones dicarboxilato y tricarboxilato y los aminoácidos requieren sistemas transportadores específicos para
facilitar su paso a través de la membrana. El transporte de ∝-cetoglutarato exige un intercambio con malato.
El transportador de nucleótido adenina permite el intercambio de ATP y ADP, permite que el ATP salga de las
mitocondrias hacia los sitios de utilización extramitocondrial y el ADP regrese para la producción de ATP dentro de la
mitocondria.
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
NADH, normalmente no puede ingresar a la mitocondria. Sin embargo, en condiciones aeróbicas, se cree que el NADH
extramitocondrial se oxida en las mitocondrias a través de la cadena respiratoria. La transferencia de NADH a través
de la membrana mitocondrial requiere de deshidrogenasas específicas a cada lado de la membrana. Existe el
transbordador de glicerofosfato un mecanismo de transferencia utilizando el transbordador de glicerofosfato, que
está presente en algunos tejidos como el cerebro, pero es deficiente en el musculo cardiaco.
Además, el transbordador malato, es un sistema más complejo debido a que la membrana mitocondrial no permite el
paso directo del oxaloacetato, por lo que este debe reaccionar con el glutamato y formar aspartato y ∝-cetoglutarato
mediante transaminación antes de ser transportado a través de la membrana y convertirse nuevamente en
oxaloacetato en el citosol.
El transbordador de creatina fosfato facilita el transporte de fosfato de alta energía desde mitocondrias
El transbordador de creatina fosfato actúa como un sistema dinámico para transferir fosfato de alta energía desde las
mitocondrias a los tejidos activos como el corazón y el musculo estriado, proporcionando una importante fuente de
energía para la producción de ATP.
APORTE CLÍNICO
MIOPATÍA MITOCONDRIAL MORTAL INFANTIL CON DISFUNCIÓN RENAL: Comprende el decremento grave o falta de
casi todas las oxidorreductasas de la cadena respiratoria, debido a deficiencia de NADH-Q oxidorreductasa (complejo
I) o citocromo oxidasa (complejo IV). Está involucrada en la enfermedad de Alzheimer y la diabetes mellitus.
Descargado por Fabián Olivares (daimaku320@gmail.com)
Encuentra más documentos en www.udocz.com
También podría gustarte
- Rejuvenecer Con El Plasma Sanguíneo De Los JóvenesDe EverandRejuvenecer Con El Plasma Sanguíneo De Los JóvenesCalificación: 5 de 5 estrellas5/5 (1)
- Metabolismo de Los Carbohidratos ExpoDocumento35 páginasMetabolismo de Los Carbohidratos ExpoJoelTevesMendoza100% (2)
- La Ciencia Del Metabolismo: Metabolismo sin rodeosDe EverandLa Ciencia Del Metabolismo: Metabolismo sin rodeosCalificación: 5 de 5 estrellas5/5 (1)
- Fosforilacion OxidativaDocumento32 páginasFosforilacion OxidativaKariEspinozaAún no hay calificaciones
- Integracion MetabolicaDocumento21 páginasIntegracion Metabolicajuan100% (2)
- Cadena Respiratoria Fosforilacion OxidatDocumento95 páginasCadena Respiratoria Fosforilacion OxidatMiguel Soni CasillasAún no hay calificaciones
- Metabolitos de Una Quimica Sanguinea.Documento39 páginasMetabolitos de Una Quimica Sanguinea.audreyAún no hay calificaciones
- Infografía Lipogénesis Vs LipólisisDocumento14 páginasInfografía Lipogénesis Vs Lipólisismariana opolka100% (2)
- Caso Clínico 2. Metabolismo de Los CarbohidratosDocumento7 páginasCaso Clínico 2. Metabolismo de Los CarbohidratosFRannkee100% (3)
- Metabolismo de Los Glúcidos - Bioquimica de Laguna y PiñaDocumento6 páginasMetabolismo de Los Glúcidos - Bioquimica de Laguna y PiñaMonserrat LopezAún no hay calificaciones
- Casos ClínicosDocumento15 páginasCasos ClínicosJosé ÁvilaAún no hay calificaciones
- CARBOHIDRATOS UNIFICADOoDocumento11 páginasCARBOHIDRATOS UNIFICADOoJesus Smaikel Teran MuenalaAún no hay calificaciones
- Gluconeogénesis y Control de La Glucosa SanguíneaDocumento16 páginasGluconeogénesis y Control de La Glucosa SanguíneaYan Yeberson Chamba ContrerasAún no hay calificaciones
- Tema 16Documento7 páginasTema 16IvanaAún no hay calificaciones
- PARTE 2 Metabolismos - ABIDocumento66 páginasPARTE 2 Metabolismos - ABInm5611645Aún no hay calificaciones
- Convergencia de Las Rutas MetabólicasDocumento9 páginasConvergencia de Las Rutas MetabólicasHelen AlcivarAún no hay calificaciones
- Anabolismo de CarbohidratosDocumento8 páginasAnabolismo de CarbohidratosIrene VidalAún no hay calificaciones
- Metabolismo y Equilibrio EnergeticoDocumento31 páginasMetabolismo y Equilibrio Energeticoshirley andradeAún no hay calificaciones
- Metabolismo de Principales Alimentos 2023Documento17 páginasMetabolismo de Principales Alimentos 2023Arnoldo Jose Candanedo JaramilloAún no hay calificaciones
- Ruta MetabólicaDocumento20 páginasRuta MetabólicaAna Milena Riascos GrajalesAún no hay calificaciones
- Folleto de Carbohidratos1Documento22 páginasFolleto de Carbohidratos1EstivenAún no hay calificaciones
- Determinacion de Colesterol en Sangre - Docx ReporteDocumento7 páginasDeterminacion de Colesterol en Sangre - Docx Reportejuan cruzAún no hay calificaciones
- PIA - Hepatocito Con Compuestos Nitrogenados CompletoDocumento14 páginasPIA - Hepatocito Con Compuestos Nitrogenados CompletoReyna RobledoAún no hay calificaciones
- Integración y Regulación Metabólica - Resumen Qca IIDocumento15 páginasIntegración y Regulación Metabólica - Resumen Qca IIVEROAún no hay calificaciones
- Clase 3. Glicolisis Ciclo KrebsDocumento71 páginasClase 3. Glicolisis Ciclo KrebsRoxy L.GAún no hay calificaciones
- Clase 12-Nutricion, Metabolismo, Ciclo Del Acido Citrico, Glucolisis 2018Documento52 páginasClase 12-Nutricion, Metabolismo, Ciclo Del Acido Citrico, Glucolisis 2018Natalia0% (1)
- Glucólisis de Una Célula CancerosaDocumento6 páginasGlucólisis de Una Célula CancerosaCarolina Supo OrihuelaAún no hay calificaciones
- 16 2B 07 06 MetabolismoDocumento3 páginas16 2B 07 06 MetabolismoJosmel yañezAún no hay calificaciones
- Metabolismo de Los Carbohidratos, Lípidos, Proteínas y PorfirinasDocumento7 páginasMetabolismo de Los Carbohidratos, Lípidos, Proteínas y Porfirinasana_clu_diaAún no hay calificaciones
- Iefi NutriciónDocumento14 páginasIefi NutriciónAgustina DaricoAún no hay calificaciones
- Cuestionario BQMDocumento4 páginasCuestionario BQMBeatriz G.Aún no hay calificaciones
- Bioquimica, Ensayo Metabolismo de Carbohidratos.Documento5 páginasBioquimica, Ensayo Metabolismo de Carbohidratos.DennisLandaetaAún no hay calificaciones
- DriveDocumento16 páginasDriveLau Rafael Flores RiveraAún no hay calificaciones
- BiomoleculasDocumento20 páginasBiomoleculasJazmin VeraAún no hay calificaciones
- Ensayo PropeDocumento14 páginasEnsayo PropeFenanda mar redondoAún no hay calificaciones
- Vision General Del MetabolismoDocumento20 páginasVision General Del Metabolismooscaralferez96Aún no hay calificaciones
- Metabolismo de Los Carbohidratos, Lípidos y ProteínasDocumento4 páginasMetabolismo de Los Carbohidratos, Lípidos y ProteínasCarlos M Garcia LaraAún no hay calificaciones
- Metabolismo Actividades - DiazDocumento14 páginasMetabolismo Actividades - Diazaildy27bascaraAún no hay calificaciones
- Universidad Privada de Tacna: Facultad de Ciencias de La SaludDocumento16 páginasUniversidad Privada de Tacna: Facultad de Ciencias de La Saludgg2022073533Aún no hay calificaciones
- Bioqumica Clinica Digital Una Pagina Segunda EdicionDocumento370 páginasBioqumica Clinica Digital Una Pagina Segunda Edicionemily032015Aún no hay calificaciones
- TALLER - No. - 1 - de - BIOQUIMICA - 2021 - 2 - DEFDocumento28 páginasTALLER - No. - 1 - de - BIOQUIMICA - 2021 - 2 - DEFlaura pardoAún no hay calificaciones
- Kelly Gabriel Orellana Ramos RESUMEN 202244223.Documento6 páginasKelly Gabriel Orellana Ramos RESUMEN 202244223.Ana Lucía MéndezAún no hay calificaciones
- Clase 09-OD Y FBDocumento23 páginasClase 09-OD Y FBHERNAN EDUARDO VASCO OSORIOAún no hay calificaciones
- Biosisntesis de CarbohidratosDocumento5 páginasBiosisntesis de Carbohidratostiburcio floresAún no hay calificaciones
- Bioqimica AntologiaDocumento9 páginasBioqimica AntologiaIsrael Dzul LopezAún no hay calificaciones
- CB Carbohidratos ResidPeru 11Documento9 páginasCB Carbohidratos ResidPeru 11Alex Cárdenas ValdiviesoAún no hay calificaciones
- Metabilismo de Proteinas, Lipidos y CarbohidratosDocumento4 páginasMetabilismo de Proteinas, Lipidos y CarbohidratosDenis MontesAún no hay calificaciones
- Capítulo 20 DevlinDocumento22 páginasCapítulo 20 DevlinAngel OnceAún no hay calificaciones
- GLUCONEOGENESISDocumento16 páginasGLUCONEOGENESISSusanaAún no hay calificaciones
- Metabolismo de Los CarbohidratosDocumento5 páginasMetabolismo de Los CarbohidratosSarai BocelAún no hay calificaciones
- Metabolismo de Chis 2018 IIDocumento53 páginasMetabolismo de Chis 2018 IIMarita SiadénAún no hay calificaciones
- Taller Segundo CorteDocumento8 páginasTaller Segundo CorteGustavo AdolfoAún no hay calificaciones
- METABOLISMO GlucidosDocumento5 páginasMETABOLISMO GlucidosMaría Pykasu Delgado ValenzuelaAún no hay calificaciones
- Bio Qui MicaDocumento21 páginasBio Qui Micalefef81847Aún no hay calificaciones
- Regulación Del Metabolismo de La Glucosa Desde Una Perspectiva Hepática.Documento6 páginasRegulación Del Metabolismo de La Glucosa Desde Una Perspectiva Hepática.andreaAún no hay calificaciones
- CarboDocumento12 páginasCarboLina QuinteroAún no hay calificaciones
- Metabolismo de Los CarbohidratosDocumento38 páginasMetabolismo de Los CarbohidratosAlexandra Crissel Hidalgo PurizagaAún no hay calificaciones
- Funcion Hepatica PDFDocumento5 páginasFuncion Hepatica PDFAnggeline espinozaAún no hay calificaciones
- Clase 5 Metabolismo de Carbohidratos - IDocumento26 páginasClase 5 Metabolismo de Carbohidratos - IKRISTELL ELENA PEREZ MONJAAún no hay calificaciones
- Aporte - Trabajo Colaborativo - Bioquímica - 2016-2Documento8 páginasAporte - Trabajo Colaborativo - Bioquímica - 2016-2Jeffe Yepes GarcíaAún no hay calificaciones
- Los Carbohidratos en El MetabolismoDocumento13 páginasLos Carbohidratos en El MetabolismoLuis BasilioAún no hay calificaciones
- PRACTICA 07. Inhibidores de La Cadena de OxidorreducciónDocumento3 páginasPRACTICA 07. Inhibidores de La Cadena de OxidorreducciónDorisYsabelMejiaAún no hay calificaciones
- Bioquimica Resumen H 601512 Downloadable 3597272Documento14 páginasBioquimica Resumen H 601512 Downloadable 3597272Fabián OlivaresAún no hay calificaciones
- 7.1. Clasificación FungicidasDocumento5 páginas7.1. Clasificación FungicidasJosue Velasquez RamosAún no hay calificaciones
- Tema 2 Conversión EnergéticaDocumento48 páginasTema 2 Conversión Energéticamarcosh777Aún no hay calificaciones
- Cadena de Transporte de Electrones 2021Documento118 páginasCadena de Transporte de Electrones 2021Heidy HerreraAún no hay calificaciones
- CAPÍTULO 13. La Cadena Respiratoria y Fosforilación Oxidativa.Documento11 páginasCAPÍTULO 13. La Cadena Respiratoria y Fosforilación Oxidativa.YunierValderramaAún no hay calificaciones
- 04 Premedicina Metabolsimo+y+Respiración+CelularDocumento8 páginas04 Premedicina Metabolsimo+y+Respiración+Celulargeorgepiste1Aún no hay calificaciones
- Fosforilación Oxidativa y FotosintesisDocumento30 páginasFosforilación Oxidativa y FotosintesisSofia CbaAún no hay calificaciones
- Celula BioenergeticaDocumento19 páginasCelula BioenergeticaGreciAún no hay calificaciones
- Unidad2-2 2022Documento30 páginasUnidad2-2 2022antonio reyesAún no hay calificaciones
- Cadena Transportadora de ElectronesDocumento13 páginasCadena Transportadora de Electronesagustin zarate cruz100% (1)
- Krebs 1Documento41 páginasKrebs 1Valentin RodriguezAún no hay calificaciones
- Capítulo 13 (Harper) - Cadena Respiratoria y Fosforilación OxidativaDocumento10 páginasCapítulo 13 (Harper) - Cadena Respiratoria y Fosforilación OxidativaMichell SchecterAún no hay calificaciones
- Laboratorio N°4 - Citocromo OxidasaDocumento5 páginasLaboratorio N°4 - Citocromo OxidasaAndrea MongeAún no hay calificaciones
- FV Tema 4Documento11 páginasFV Tema 4Alba GracianoAún no hay calificaciones
- Fuerza Proton MotrizDocumento5 páginasFuerza Proton MotrizFabiana Cardozo FluorAún no hay calificaciones
- Mmitocondrialcelulaneural PDFDocumento167 páginasMmitocondrialcelulaneural PDFeli eliasAún no hay calificaciones
- Cadena de Transporte Electrónico y Fosforilación Oxidativa-2020Documento69 páginasCadena de Transporte Electrónico y Fosforilación Oxidativa-2020SusanaAún no hay calificaciones
- Practica 4. Bombeo de Protones Por Levaduras: Efecto de Inhibidores y Desacoplantes.Documento17 páginasPractica 4. Bombeo de Protones Por Levaduras: Efecto de Inhibidores y Desacoplantes.Dianis RangelAún no hay calificaciones
- Juan Toscano Fuentes, Describir La Biosíntesis de DesoxirribonucleótidosDocumento6 páginasJuan Toscano Fuentes, Describir La Biosíntesis de DesoxirribonucleótidosJUAN TOSCANOAún no hay calificaciones
- En Qué Consiste La Fosforilación Oxidativa Trabajo de BoquinarDocumento18 páginasEn Qué Consiste La Fosforilación Oxidativa Trabajo de BoquinarLoad Ulises Retete RiveraAún no hay calificaciones
- Naftoquinona PDFDocumento13 páginasNaftoquinona PDFGABY PATRICIAAún no hay calificaciones
- Seminario 13 - Cadena de Transporte de Electrones. Fosforilación Oxidativa - 2019Documento24 páginasSeminario 13 - Cadena de Transporte de Electrones. Fosforilación Oxidativa - 2019Nati Di NucciAún no hay calificaciones
- Cadena Respiratoria y Fosforilación OxidativaDocumento6 páginasCadena Respiratoria y Fosforilación OxidativahenryAún no hay calificaciones
- Fosforilacion Oxidativa y Cadena RespiratoriaDocumento19 páginasFosforilacion Oxidativa y Cadena RespiratoriaerikaAún no hay calificaciones
- ACAPELA 25 SC Hoja Informativa - ActzadoDocumento1 páginaACAPELA 25 SC Hoja Informativa - ActzadoJhon CristhianAún no hay calificaciones
- Tesis MitocondriasDocumento219 páginasTesis MitocondriasAngieAún no hay calificaciones
- Cadena de Transporte ElectrónicoDocumento11 páginasCadena de Transporte ElectrónicoIsabelAún no hay calificaciones