Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Dengue - Manifestaciones Clinicas y Chagas Parasitologia Ciclo de Vida
Cargado por
edwin patiñoDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Dengue - Manifestaciones Clinicas y Chagas Parasitologia Ciclo de Vida
Cargado por
edwin patiñoCopyright:
Formatos disponibles
DENGUE
MANIFESTACIONES CLINICAS
Etapas de la enfermedad
a) Etapa febril
Es de duración variable, 4 a 7 días; es el período de viremia en el cual existe una alta posibilidad de
transmisión de la enfermedad si la persona es picada por un mosquito vector.
Presentación clínica
Además de fiebre puede existir dolor muscular y articular, cefalea, dolor retro-orbitario, astenia, exantema
predominantemente máculo-papular con o sin prurito (50% de los casos), discreto dolor abdominal, náuseas,
vómitos. En un porcentaje significativo de pacientes existe diarrea, en general pastosa y de baja frecuencia.
En esta etapa es característica la postración vinculada a estos síntomas.
Exámenes complementarios etapa febril
Hemograma: en general se presenta con leucopenia con linfocitosis relativa y trombocitopenia. El hemograma
es un examen indispensable en todos los casos.
Hepatograma: puede ocurrir un incremento de transaminasas.
Proteína C reactiva (PCR) no elevada o en valores bajos, el aumento muy marcado de la PCR orienta a un
diagnóstico diferencial de infección bacteriana.
El resto de la analítica dependerá de la presentación clínica: azoemia, creatininemia, ionograma, gasometría,
glicemia, albuminemia, crasis.
Los estudios de imágenes (radiografía de tórax, ecografía) son útiles para evaluar la presencia de líquido libre
en la cavidad abdominal o en las serosas (pericardio, pleura) antes de que sean clínicamente evidentes y para
evaluación de diagnósticos diferenciales.
Una característica distintiva de esta infección, crucial en el manejo clínico, es que en el período durante el cual
se produce la caída de la fiebre y hasta 48 horas después es el momento en que con mayor frecuencia los
pacientes pueden presentar complicaciones, ya que la extravasación de plasma se hace más intensa y es
capaz de conducir al shock por dengue(9).
Signos de alarma(10-14)
Derivado del manejo clínico y la experiencia acumulada en la atención a estos pacientes se han identificado
signos que son buenos predictores de mala evolución y que conocemos como signos de alarma; la presencia
de estos determina que el equipo de salud debe brindar una atención con controles estrechos con el paciente
hospitalizado para lograr la recuperación.
El empeoramiento es precedido por uno o más signos clínicos de alarma: estos signos deben ser
monitorizados y reconocidos por el equipo de salud, pacientes y familiares(13,14):
Dolor abdominal intenso y sostenido.
Vómitos persistentes.
Derrame seroso (en peritoneo, pleura o pericardio).
Hipotensión postural o lipotimia.
Sangrado de mucosas.
Cambio en el estado mental del paciente: somnolencia o irritabilidad.
Hepatomegalia (> 2 cm).
Incremento brusco del hematocrito concomitante con rápida disminución del recuento de plaquetas (signo
tardío).
Identificar los signos de alarma permite iniciar precozmente la reposición de líquidos por vía intravenosa y
prevenir el shock con la consecuente disminución de la mortalidad.
Luego de la etapa aguda la mayoría de los pacientes mejorarán, mientras que algunos de ellos pasarán a una
etapa crítica sintomática(9,13,14).
b) Etapa crítica
Es donde se produce la extravasación de plasma que puede llevar al shock hipovolémico; todos los esfuerzos
deben estar dirigidos a la prevención de esta situación clínica dado que una vez instalada puede ser
irreversible.
Presentación clínica
Generalmente el shock es de rápida instalación y corta duración (horas), pudiendo llevar a la muerte del
paciente en un lapso de 24 a 48 horas o a una recuperación rápida con la terapia apropiada.
Sin embargo, también puede ser prolongado o recurrente. En estos casos la hipoperfusión mantenida llevará
a la disfunción multiorgánica, con acidosis metabólica y coagulación intravascular diseminada que puede
determinar hemorragias graves o masivas que empeoren el shock. En los pacientes con hemorragias masivas
que comprometen el aparato digestivo frecuentemente se encuentra el antecedente de gastritis, úlcera péptica
y consumo de antiinflamatorios no esteroideos (AINES) o anticoagulantes, así como otras comorbilidades(14).
Entre las complicaciones graves también se encuentran neumonitis, distrés respiratorio, afectación cardíaca
grave con insuficiencia cardíaca y miocarditis, hepatitis y encefalitis. La insuficiencia renal aguda empeora el
pronóstico.
Se deben reconocer signos precoces de shock, vigilando la presión arterial diferencial de 20 mmHg o menos
(la presión diferencial se calcula restando la presión sistólica menos la diastólica) y otros signos de
inestabilidad hemodinámica tales como taquicardia, frialdad y enlentecimiento del llenado capilar.
Sin diagnóstico precoz y tratamiento óptimo esta etapa puede tener una alta mortalidad.
El aumento del hematocrito, según algunos expertos, no es un signo precoz, por lo que no debe esperarse
para iniciar la reposición hidroelectrolítica.
CHAGAS PARASITOLOGIA Y CICLO DE VIDA
El parásito
T cruzi es miembro de la familia Trypanosomatidae en el orden Kinetoplastida y pertenece a una
sección especial llamada Stercoraria. Las formas infecciosas de T cruzi están contenidas en las
heces de los insectos vectores y logran entrar en sus huéspedes mamíferos a través de la
contaminación. Este mecanismo de transmisión contrasta con el de las dos subespecies de
tripanosomas africanos que causan enfermedades humanas, Trypanosoma brucei
gambiense y Trypanosoma brucei rhodesiense , que se transmiten a través de la saliva de sus
vectores, y con el mecanismo por el cual el tripanosoma no patógeno que se encuentra en las
Américas , Trypanosoma rangeli , se transmite a sus huéspedes mamíferos.
Al igual que con otros parásitos que infectan tanto a mamíferos como a insectos, el ciclo de vida
de T cruzi es complejo
El ciclo de vida de T cruzi consta de 3 formas principales de desarrollo. Los epimastigotes son una
forma extracelular y no infecciosa del parásito que se encuentra en el intestino medio de los
insectos vectores, donde se multiplican por fisión binaria. A medida que los epimastigotes
(representados en la primera imagen a continuación) se desplazan hacia el intestino posterior, se
diferencian en tripomastigotes metacíclicos (representados en la segunda imagen a continuación),
que son formas que no se dividen, resistentes al complemento de los mamíferos y que tienen la
capacidad de infectar células de mamíferos. Entran en las células locales a través de roturas en la
piel, las membranas mucosas o las conjuntivas y se transforman en la tercera forma morfológica,
los amastigotes. Los amastigotes se multiplican intracelularmente hasta que la célula huésped se
ve abrumada, momento en el que se transforman en tripomastigotes en el torrente sanguíneo.
A medida que las células huésped se rompen, los tripomastigotes se liberan en los vasos linfáticos
y el torrente sanguíneo, a través de los cuales se propagan a sitios distantes e invaden nuevas
células huésped. Ver imagen a continuación.
Este proceso continúa de forma asíncrona durante la vida del host. Se pueden ingerir pequeñas
cantidades de tripomastigotes en comidas de sangre tomadas por triatominos no infectados. Los
tripomastigotes luego se transforman en epimastigotes en el intestino medio de estos insectos,
completando así el ciclo.
También podría gustarte
- Vasculitis CutaneaDocumento35 páginasVasculitis CutaneaJuanCarlosSayersAún no hay calificaciones
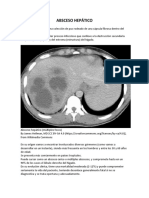
- Absceso HepáticoDocumento7 páginasAbsceso HepáticoDr. Francisco ZapataAún no hay calificaciones
- Tos Ferina, Tos Convulsiva, CoquelucheDocumento35 páginasTos Ferina, Tos Convulsiva, CoquelucheFelipe DìazAún no hay calificaciones
- Enfermedades MetaxenicasDocumento28 páginasEnfermedades MetaxenicasMaria83% (6)
- Revista Salud Jalisco No 2 Pantalla 2Documento84 páginasRevista Salud Jalisco No 2 Pantalla 2laloerwAún no hay calificaciones
- Presentacion Final DengueDocumento48 páginasPresentacion Final DengueSamuel CarranzaAún no hay calificaciones
- Caso Clínico de Dengue Clásico 244Documento27 páginasCaso Clínico de Dengue Clásico 244Victor Medina100% (1)
- Cadena Epid. DengueDocumento8 páginasCadena Epid. DengueSilvia De LéonAún no hay calificaciones
- Encuesta Sobre DengueDocumento1 páginaEncuesta Sobre DengueAngie Espinoza0% (1)
- Fisiopatología Dengue-1Documento10 páginasFisiopatología Dengue-1jxvila-esAún no hay calificaciones
- Fiebre HemorragicaDocumento15 páginasFiebre HemorragicaMaría Gabriela LópezAún no hay calificaciones
- Dengue PTTDocumento37 páginasDengue PTTmelvinAún no hay calificaciones
- Salmonelosis y ShigelosisDocumento6 páginasSalmonelosis y ShigelosisAlexander Atoche MendozaAún no hay calificaciones
- Josue Garcia - Pancreatitis AgudaDocumento10 páginasJosue Garcia - Pancreatitis AgudaJosué Andrés García GonzalesAún no hay calificaciones
- Enfermedades Soc 1Documento37 páginasEnfermedades Soc 1Marcela RodriguezAún no hay calificaciones
- Resumen Sindrome PurpuricoDocumento6 páginasResumen Sindrome PurpuricoJosé Gajardo ForrayAún no hay calificaciones
- Sindrome de Guillain-BarreDocumento7 páginasSindrome de Guillain-BarreamarilisAún no hay calificaciones
- Salmonelosis Rodrigo Escobedo NuñezDocumento2 páginasSalmonelosis Rodrigo Escobedo NuñezRodrigoEscobedoAún no hay calificaciones
- HepatitisDocumento37 páginasHepatitisEstrella Adriana SicardiAún no hay calificaciones
- ApendicitisDocumento5 páginasApendicitisRamiro GuerreroAún no hay calificaciones
- Pancreatitis Aguda - ClinicalKeyDocumento25 páginasPancreatitis Aguda - ClinicalKeyMedipackAún no hay calificaciones
- Articulo Digestivo Foro CoDocumento6 páginasArticulo Digestivo Foro CoKatalina Acevedo DiazAún no hay calificaciones
- Pancreatitis AgudaDocumento3 páginasPancreatitis AgudaCynthia LucasAún no hay calificaciones
- Exposición SeminarioDocumento8 páginasExposición SeminarioJosé Barreda AnguloAún no hay calificaciones
- Síndrome NefríticoDocumento7 páginasSíndrome NefríticoLaura MorilloAún no hay calificaciones
- Leptospirosis y Paludismo y Fiebre TifoideaDocumento15 páginasLeptospirosis y Paludismo y Fiebre TifoideaAna AlvarezAún no hay calificaciones
- Clase #6-PancreatitisDocumento44 páginasClase #6-PancreatitisEdwin Daniel Bayes De La CruzAún no hay calificaciones
- Enfermedad de Crohn-Caso ClínicoDocumento5 páginasEnfermedad de Crohn-Caso ClínicoMaricela Martínez San JuanAún no hay calificaciones
- Enf de ChagasDocumento23 páginasEnf de ChagasEloy VillavicencioAún no hay calificaciones
- Absceso HepaticoDocumento6 páginasAbsceso HepaticoEstudiantes de Medicina Unison 2017Aún no hay calificaciones
- Absceso Hepatico Amebiano y PiogenoDocumento22 páginasAbsceso Hepatico Amebiano y PiogenoGabriel Alejandro Ardila ContrerasAún no hay calificaciones
- Pancreatitis AgudaDocumento14 páginasPancreatitis AgudaOscar RgAún no hay calificaciones
- 11 HepatitisDocumento14 páginas11 HepatitisSaraAún no hay calificaciones
- Infecciones en EmbarazadaDocumento29 páginasInfecciones en EmbarazadaArturo ContrerasAún no hay calificaciones
- AMEBIASISDocumento5 páginasAMEBIASISWilber Ramirez AguilarAún no hay calificaciones
- Glomerulonefritis Post-EstreptocóccicaDocumento5 páginasGlomerulonefritis Post-EstreptocóccicaDainer Estrada MejiasAún no hay calificaciones
- Infome ChagasDocumento12 páginasInfome ChagasAndrellys EstradaAún no hay calificaciones
- Hepatitis InfantilDocumento43 páginasHepatitis InfantilRosa Campos CumpaAún no hay calificaciones
- Enfermedad de Chagas - Edvan Santos Da HoraDocumento4 páginasEnfermedad de Chagas - Edvan Santos Da HoraEdvan HoraAún no hay calificaciones
- SDI - GUIA - DENGUE Páginas 6 31Documento26 páginasSDI - GUIA - DENGUE Páginas 6 31Rusbel BaezAún no hay calificaciones
- Guillain BarreDocumento5 páginasGuillain BarreNathally gonzalezAún no hay calificaciones
- Apendicitis Aguda y PeritonitisDocumento14 páginasApendicitis Aguda y PeritonitisNathalia Restrepo CoralAún no hay calificaciones
- DENGUEDocumento23 páginasDENGUELiesth YaninaAún no hay calificaciones
- Dengue Docx Jpdlod, DDJGVDocumento14 páginasDengue Docx Jpdlod, DDJGVAndreCarol03Aún no hay calificaciones
- Púrpuras PediatriaDocumento23 páginasPúrpuras PediatriaMaEsp29Aún no hay calificaciones
- DengueDocumento2 páginasDengueMiguelina TejadaAún no hay calificaciones
- PAE Terminado de HDADocumento19 páginasPAE Terminado de HDALaurita Callo Dayli TaurielAún no hay calificaciones
- Apendice, Colecistitis, Ulcera Peptica PerforadaDocumento85 páginasApendice, Colecistitis, Ulcera Peptica PerforadaManuel Onésimo De La Cruz PeñaAún no hay calificaciones
- DENGUEDocumento20 páginasDENGUEMICAELA TOLABA GALLARDOAún no hay calificaciones
- Guía DengueDocumento40 páginasGuía DengueDerlis ValdezAún no hay calificaciones
- SX Inflamatorio SistémicoDocumento3 páginasSX Inflamatorio SistémicoTomás RodríguezAún no hay calificaciones
- Salmonelosis Ciclo VitalDocumento54 páginasSalmonelosis Ciclo VitalMery de AguilarAún no hay calificaciones
- Patologia DengueDocumento29 páginasPatologia DengueGina DiazAún no hay calificaciones
- Leptospirosis ResumenDocumento3 páginasLeptospirosis ResumenRaquelAún no hay calificaciones
- Explicacion de ApendicitisDocumento8 páginasExplicacion de ApendicitisNeorlidis Maria Vasquez HernandezAún no hay calificaciones
- Dengue ImssDocumento7 páginasDengue ImssMario Amilcar Ramirez CardonaAún no hay calificaciones
- sp3 ExtraordinarioDocumento44 páginassp3 ExtraordinarioCarlosAún no hay calificaciones
- Atencion de Enfermeria en Papcientes Criticos en Procesos CardiovascularesDocumento4 páginasAtencion de Enfermeria en Papcientes Criticos en Procesos CardiovascularesOdalys AlvidrezAún no hay calificaciones
- Aborto SepticoDocumento31 páginasAborto SepticoYulimarAún no hay calificaciones
- APENDICITIS PlaceDocumento17 páginasAPENDICITIS PlaceLiz VelezAún no hay calificaciones
- DengueDocumento4 páginasDengueGUSTAVO EUSTACIO VALDELAMAR RUIZ ESTUDIANTEAún no hay calificaciones
- DENGUEDocumento13 páginasDENGUEBarbara SwanstonAún no hay calificaciones
- Tema 4 Pancreatitis OficialDocumento6 páginasTema 4 Pancreatitis OficialElizabeth angelica Gallegos vacaAún no hay calificaciones
- Disnea M. InternaDocumento25 páginasDisnea M. Internaedwin patiño100% (1)
- PreventivoDocumento2 páginasPreventivoedwin patiñoAún no hay calificaciones
- AudioDocumento4 páginasAudioedwin patiñoAún no hay calificaciones
- Examen OftalmologicoDocumento22 páginasExamen Oftalmologicoedwin patiñoAún no hay calificaciones
- Como Medida RepelenteDocumento2 páginasComo Medida RepelenteDanielgame767Aún no hay calificaciones
- Virus Del DengueDocumento3 páginasVirus Del DengueNain Oliva LozanoAún no hay calificaciones
- Folleto Fiebre AmarillaDocumento1 páginaFolleto Fiebre AmarillaJey Hc100% (1)
- Ministerio de SaludDocumento54 páginasMinisterio de Saludthe house englishAún no hay calificaciones
- Teoría Lenguaje Semana 7 Textos y OrtografíaDocumento6 páginasTeoría Lenguaje Semana 7 Textos y OrtografíaLucia JhoselynAún no hay calificaciones
- Guía de Práctica Clínica-DengueDocumento52 páginasGuía de Práctica Clínica-DengueAllisson NuñezAún no hay calificaciones
- DengueDocumento3 páginasDengueJENNIFER ZULEJG MOYORGA VASQUEZAún no hay calificaciones
- Cuestionario PpsDocumento2 páginasCuestionario PpsVALERIA CRISTINA SOSSA CESPEDESAún no hay calificaciones
- Teo 15Documento7 páginasTeo 15MelanyAún no hay calificaciones
- Tamaño de Gota 2009Documento10 páginasTamaño de Gota 2009Segio ReyAún no hay calificaciones
- PREGUNTASDocumento29 páginasPREGUNTASSolange naomi Parra avilaAún no hay calificaciones
- Fichas Adicionales RV 4S LLDPVKWDocumento34 páginasFichas Adicionales RV 4S LLDPVKWMarco Montalban SayagoAún no hay calificaciones
- Informe pc2 IntegradoraDocumento13 páginasInforme pc2 IntegradoraRosa AsencioAún no hay calificaciones
- Pla Del Concurso InterescolarDocumento13 páginasPla Del Concurso InterescolarloloAún no hay calificaciones
- VirusDocumento47 páginasVirusMario RojasAún no hay calificaciones
- Medicina Tropical 2do ParcialDocumento15 páginasMedicina Tropical 2do ParcialYeinmys VillasmilAún no hay calificaciones
- Reparación Directa Greys DefinitivaDocumento42 páginasReparación Directa Greys DefinitivaJorge Mario Sepulveda OspinoAún no hay calificaciones
- 06 SegataDocumento23 páginas06 SegatagreededuAún no hay calificaciones
- Dengue PDFDocumento135 páginasDengue PDFAlejandro MendozaAún no hay calificaciones
- A EJEMPLO DE TABLA GRAFICA Y ANALISIS. May. 2020Documento17 páginasA EJEMPLO DE TABLA GRAFICA Y ANALISIS. May. 2020Elshema Hernandez MenchacaAún no hay calificaciones
- SolucionarioGUÍA PRÁCTICA #01 - 2022 - 1Documento16 páginasSolucionarioGUÍA PRÁCTICA #01 - 2022 - 1Brayann palaciosAún no hay calificaciones
- Temario de Medicina Social - 2Documento22 páginasTemario de Medicina Social - 2Vale URAún no hay calificaciones
- Informe Semanal VirologiaDocumento26 páginasInforme Semanal VirologiaPaola Vega GuerraAún no hay calificaciones
- Dengue JCDM2020Documento32 páginasDengue JCDM2020Juan Carlos Diaz MongeAún no hay calificaciones
- Rotulos Agentes BiologicosDocumento6 páginasRotulos Agentes BiologicosCamila PizarroAún no hay calificaciones
- Guia de MgiDocumento13 páginasGuia de MgiOscarAún no hay calificaciones