Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe 7
Cargado por
SolAngel Eulate RamosTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe 7
Cargado por
SolAngel Eulate RamosCopyright:
Formatos disponibles
OBJETIVOS GENERALES
Establecer la forma de la curva de titulación pH vs Volumen de titulante, al titular un
ácido fuerte (Ácido Clorhídrico) con una base fuerte (Hidróxido de sodio).
Realizar la comparación de la forma de la curva obtenida a partir de cálculo teórico con
la forma de la curva obtenida de forma experimental con la ayuda de la aplicación
OBJETIVOS ESPECIFICOS
Preparar soluciones acidas y básicas.
Elegir el indicar adecuado para la titulación.
Aplicar el método de volumetría para cuantificar concentraciones.
Determinar el pH en cada intervalo de neutralización.
MARCO TEORICO
pH :
El pH es una medida que indica la acidez o la alacalinidad del agua. Se define como la
concentración de iones de hidrógeno en el agua. La escala del pH es logarítmica con valores de 0 a
14.
pOH :
El pOH (o potencial OH) es una medida de la basicidad o alcalinidad de una disolución. También se
emplea el pH = - log [H3O+] para medir la concentración de iones hidronio [H3O+].
La Titulación
La titulación es un procedimiento cuantitativo analítico de la química. Con la titulacion
puede determinar la concentración desconocida en un líquido añadiéndole reactivos de un
contenido conocido. La titulación es un procedimiento relativamente sencillo que no
requiere un despliegue de aparatos técnicos para determinar la concentración de
sustancias conocidas disueltas. Los instrumentos esenciales para la titulacion son una
bureta y un vaso de precipitados. La bureta contiene una solución volumétrica de la cual
se conoce la concentración de la sustancia. En el vaso de precipitados se encuentra la
solución con la concentración desconocida y un indicador para la detección del parámetro.
Después de mezclar la solución volumétrica y la solución con la muestra en el vaso de
precipitados es posible, en base al conocimiento del desarrollo químico de reacción y el
consumo de la solución volumétrica, calcular la concentración de la solución con la
muestra. Los diferentes procedimientos de titulación se pueden separar según los tipos de
reacción químicos
Titulación ácido-base:
El fundamento de la titulación ácido-base es la reacción de neutralización entre ácidos y
base. Como solución volumétrica se selecciona un ácido o base como complemento a la
solución de prueba. Mediante la titulación se consigue una neutralización entre iones
H3O+- y OH-. Si se alcanza el valor pH 7 la solución es neutra; añadiendo más solución
volumétrica la solución de prueba se volverá más ácido o básico. Si se registra en una
curva el desarrollo del valor pH a través de todo el desarrollo de la reacción, es posible
determinar la cantidad a raíz del punto de equivalencia (valor pH 7).
Indicadores
Un indicador químico (también conocido como indicador ácido-
base) es una sustancia que evidencia un cambio observable
(normalmente, un cambio de color) cuando se produce un cambio
en el pH de una solución acuosa. Algunos ejemplos son la
fenolftaleína, el rojo de metilo o el naranja de xileno.
Curvas de neutralizacion
MATERIALES
Item Materiales Caracteristicas Cantidad
1 Tubos de ensayo 12
2 Gradiila 1
3 Piseta 1
4 Espatula 1
5 Propipetas 2
6 Pinza de 3 dedos 1
7 Varilla de vidrio 1
8 Pipeta aforada 1
9 Pipeta 2
10 Bureta 25 ml 1
11 Matraz aforado 250 ml 1
12 Matraz aforado 500 ml 2
13 Matraz 3
erlenmeyer
14 Cepillo 100 ml 1
15 Vasos 250 ml 4
precipitados
16 Vasos 2
precipitados
17 Vidrio reloj 1
18 Soporte universal 1
19 Probeta 1
REACTIVOS
Con Papel Indicador
Solucion pH
H2O (destilada ) 5
H2O (grifo ) 6
NaOH 13
HCl 0
CH3COOH 3
DATOS EXPERIMENTALES
Curvas de neutralizacion Titulante : NaOH
pH ml añadidos pH ml añadidos
0,78 O 1,77 25
0,83 5 8,39 29,2
1 10 9,11 1 gota
1,14 15 11,78 5
1,36 20 12,06 5
Curvas de neutralizacion Titulante : HCl
pH ml añadidos pH ml añadidos
12,67 O 2,23 30
12,59 5 1,68 35
12,53 10 1,50 40
12,41 15 1,38 45
12,16 20 1,27 50
11,66 25
Indicadores Universales
Naranja de metilo Fenolftaleina Rojo de metilo
Acido Basico Acido Basico Acido Basico
H2O Naranja Incoloro Naranja
(destilada ) bajo
HCl Rojo Incoloro Fucsia
anaranjado
NaOH Naranja Violeta Amarillo
claro
CH3COOH Rojo Incoloro Rosado
glacial
Amoniaco Amarillo Violeta Amarillo
CH3COOH Rosa Incoloro Rosa
normal fuerte
CONCLUSIONES
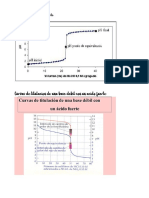
Una curva de neutralización es aquella en la que se representa el pH frente al volumen de reactivo
(ácido o base), añadidos.
En el laboratorio “Curvas de Neutralizacion”, se determinó que al titular un ácido fuerte (Ácido
Clorhídrico) con una base fuerte (Hidróxido de sodio), la forma de la curva es una S.
En la determinación teórica del pH se obtuvieron resultados que indican que a medida que se
incrementa el volumen del hidróxido de sodio, el pH del ácido clorhídrico, también
se
incrementa.
En la determinación experimental de pH se obtuvieron resultados que muestran a un
incremento de el pH del ácido clorhídrico conforme se incrementa el volumen del hidróxido de
sodio. Además, se observó que, a partir del volumen de 20 ml de NaOH, se presenta un súbito
incremento de pH del ácido clorhíreacción
También podría gustarte
- Calle Ticona Leonel Freddy (Informe 7)Documento13 páginasCalle Ticona Leonel Freddy (Informe 7)Ariana GrandeAún no hay calificaciones
- Indicadores de PH y Curvas de Neutralizacion Informe Umsa Ingenieria I-2018Documento9 páginasIndicadores de PH y Curvas de Neutralizacion Informe Umsa Ingenieria I-2018FERDEZ T0% (1)
- Informe de Lab PH y PohDocumento11 páginasInforme de Lab PH y Poharnaldo simon sirpa laricoAún no hay calificaciones
- Diagrama de ProcesosDocumento10 páginasDiagrama de ProcesosluisAún no hay calificaciones
- PDF Indicadores de PH y Curvas de Neutralizacion Informe Umsa Ingenieria I 2018Documento5 páginasPDF Indicadores de PH y Curvas de Neutralizacion Informe Umsa Ingenieria I 2018Julius Wilkerson RobertAún no hay calificaciones
- Titulación pHDocumento6 páginasTitulación pHMelanie Daniela Castillo AguilarAún no hay calificaciones
- pH y curvas de neutralizaciónDocumento12 páginaspH y curvas de neutralizaciónRUBEN VELASQUEZ CALLEAún no hay calificaciones
- Cómo medir el pH y construir curvas de neutralizaciónDocumento8 páginasCómo medir el pH y construir curvas de neutralizaciónReyna Mamani Quispe50% (2)
- QMC-212 P66Documento10 páginasQMC-212 P66Ayelen VediaAún no hay calificaciones
- 7 INDICADORES PH Y CURVAS DE NEUTRALIZACIÓN JosiDocumento17 páginas7 INDICADORES PH Y CURVAS DE NEUTRALIZACIÓN JosiDamaris Martina AndradeAún no hay calificaciones
- Curvas de neutralización y determinación de pHDocumento5 páginasCurvas de neutralización y determinación de pHdraggusAún no hay calificaciones
- Indicadores de PH y Curva de NeutralizaciónDocumento8 páginasIndicadores de PH y Curva de NeutralizaciónAlex EfcAún no hay calificaciones
- PDF PH y Curva de NeutralizacionDocumento17 páginasPDF PH y Curva de NeutralizacionJulius Wilkerson RobertAún no hay calificaciones
- Quimica Lab 7Documento10 páginasQuimica Lab 7Cristian IbañezAún no hay calificaciones
- PH y Curva de NeutralizacionDocumento17 páginasPH y Curva de NeutralizacionHelen Andrea Ramos ZuazoAún no hay calificaciones
- PRÁCTICA 1 PH y Soluciones AmortiguadorasDocumento18 páginasPRÁCTICA 1 PH y Soluciones AmortiguadorasAlexander Zevallos100% (1)
- Determinación de PH y Poh en Diferentes MuestrasDocumento7 páginasDeterminación de PH y Poh en Diferentes MuestrasMalu HernandezAún no hay calificaciones
- P10. Medidas de PHDocumento5 páginasP10. Medidas de PHMariajose FuentesAún no hay calificaciones
- Informe BioquimicaDocumento9 páginasInforme BioquimicaLAURA JULIANA ALEMAN VARGASAún no hay calificaciones
- Laboratorio de Quimica 10Documento21 páginasLaboratorio de Quimica 10juan carlosAún no hay calificaciones
- QuimicaaaDocumento5 páginasQuimicaaanoemigq22Aún no hay calificaciones
- Imforme de Quimica N7 TerminadaDocumento12 páginasImforme de Quimica N7 TerminadaJhimmy CondoriAún no hay calificaciones
- Soluciones Acidas - Basicas y NeutrasDocumento9 páginasSoluciones Acidas - Basicas y NeutrasErika Yoli ArevaloAún no hay calificaciones
- Práctica # 4 (Recuperado)Documento23 páginasPráctica # 4 (Recuperado)GUILLERMO ADOLFO ZAPATA TABORDAAún no hay calificaciones
- PH y Curva de NeutralizacionDocumento17 páginasPH y Curva de NeutralizacionBrian LH100% (11)
- Quimica-Semana 07 MD3N5Documento14 páginasQuimica-Semana 07 MD3N5Piero TorresAún no hay calificaciones
- AmortiguadoresDocumento6 páginasAmortiguadoresalexis VilcherresAún no hay calificaciones
- Practica2 - Medicion PHDocumento5 páginasPractica2 - Medicion PHNicolHernandezNarvaezAún no hay calificaciones
- Bermeo - A - Laboratorio Quimica - 4 - B1-P2 - 2019 - 2Documento9 páginasBermeo - A - Laboratorio Quimica - 4 - B1-P2 - 2019 - 2Aldair BermeoAún no hay calificaciones
- Práctica5 LasResucitadasDocumento17 páginasPráctica5 LasResucitadasESMERALDA ZAMORA MARTINEZAún no hay calificaciones
- Informe de Laboratorio N°1Documento12 páginasInforme de Laboratorio N°1Cele IrrazabalAún no hay calificaciones
- Laboratorio 2 EstandarizacionDocumento5 páginasLaboratorio 2 EstandarizacionGiovanny LuceroAún no hay calificaciones
- PRACTICA #11 - MEDIDA DE PH BBDocumento11 páginasPRACTICA #11 - MEDIDA DE PH BBIsabel Apaza CruzAún no hay calificaciones
- 6 DISOLUCIONES parte 1Documento21 páginas6 DISOLUCIONES parte 1espinoza.13757922Aún no hay calificaciones
- PRACTICA 2. Estandarización de HCL y NaOH.Documento4 páginasPRACTICA 2. Estandarización de HCL y NaOH.Sofia Paredes OrtizAún no hay calificaciones
- Gutiérrez González - Práctica 1. Titulación Ácido-BaseDocumento5 páginasGutiérrez González - Práctica 1. Titulación Ácido-BaseEljua NalejandroAún no hay calificaciones
- Soluciones amortiguadoras, buffer o tampones: preparación y comprobación del poder amortiguadorDocumento3 páginasSoluciones amortiguadoras, buffer o tampones: preparación y comprobación del poder amortiguadorWanda Polet Salvatierra Paz0% (3)
- Informe Curvas de NeutralizacionDocumento11 páginasInforme Curvas de NeutralizacionSOYSUCODEPIÑAAún no hay calificaciones
- Práctica de Laboratorio No.9 Entificación y Caracterización de Alcoholes y FenolesDocumento9 páginasPráctica de Laboratorio No.9 Entificación y Caracterización de Alcoholes y FenolesMels PothyAún no hay calificaciones
- Laboratorio de PHDocumento5 páginasLaboratorio de PHEduar Daniel Rodriguez PerezAún no hay calificaciones
- Reporte de Practica 4Documento9 páginasReporte de Practica 4MARGARITA SALAS MARTINEZAún no hay calificaciones
- Informe 07Documento20 páginasInforme 07Nicol Litsi Jimenez AguilarAún no hay calificaciones
- Laboratorio 2Documento6 páginasLaboratorio 2VALERIA TABORDA CARVAJALAún no hay calificaciones
- Soluciones IndicadorasDocumento2 páginasSoluciones Indicadoraslauraten10Aún no hay calificaciones
- Bioquímica de amortiguadoresDocumento9 páginasBioquímica de amortiguadoresAldo MartínezAún no hay calificaciones
- # 12 IndicadoresDocumento9 páginas# 12 IndicadoresAntony TorrezAún no hay calificaciones
- Informe Lab Quimica 6Documento6 páginasInforme Lab Quimica 6jhonatanAún no hay calificaciones
- Libro Com de TextosdDocumento5 páginasLibro Com de Textosdberthavelasquez90Aún no hay calificaciones
- Informe Práctico #1 - Determinación de La Acidez de Un Zumo de Pomelo-2Documento6 páginasInforme Práctico #1 - Determinación de La Acidez de Un Zumo de Pomelo-2Alexandra Rodríguez PereraAún no hay calificaciones
- LaB AQ Guía # 4 Determinación de Acido Acetilsalicilico en Aspirina y Determinación de La Acidez en Un VinoDocumento4 páginasLaB AQ Guía # 4 Determinación de Acido Acetilsalicilico en Aspirina y Determinación de La Acidez en Un VinoLola FernandaAún no hay calificaciones
- GUIA 10. MEDIDA DE PH ALGUNOS ACIDOS, BASES Y SALESDocumento6 páginasGUIA 10. MEDIDA DE PH ALGUNOS ACIDOS, BASES Y SALES凯瑟雷耶斯Aún no hay calificaciones
- PRACTICA 13. MEDICION DE PH, pOH y TITULACION ACIDO BASEDocumento6 páginasPRACTICA 13. MEDICION DE PH, pOH y TITULACION ACIDO BASEBenjamín HTAún no hay calificaciones
- pract1titulaciónDocumento8 páginaspract1titulaciónferogachuzAún no hay calificaciones
- Determinación del pH de sustancias ácidas y básicasDocumento15 páginasDeterminación del pH de sustancias ácidas y básicasCamila EsRaAún no hay calificaciones
- 8678642b9b02ec40118fe8c638fc433bDocumento44 páginas8678642b9b02ec40118fe8c638fc433bMarylin AlvarezAún no hay calificaciones
- QuímicaDocumento12 páginasQuímicaLeider VargasAún no hay calificaciones
- Analitica LaboratorioDocumento13 páginasAnalitica Laboratorioandres ardilaAún no hay calificaciones
- Informe Disoluciones Infomes de QuimicaDocumento17 páginasInforme Disoluciones Infomes de QuimicaJhulisa Torrez Condori100% (1)
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Grafica Base Fuerte 2Documento4 páginasGrafica Base Fuerte 2SolAngel Eulate RamosAún no hay calificaciones
- Cuestionario de Reacciones QuimcasDocumento6 páginasCuestionario de Reacciones QuimcasSolAngel Eulate RamosAún no hay calificaciones
- Procedimiento de ViscocidadDocumento1 páginaProcedimiento de ViscocidadSolAngel Eulate RamosAún no hay calificaciones
- Preinforme 8Documento13 páginasPreinforme 8SolAngel Eulate RamosAún no hay calificaciones
- Determinar viscosidad y tensión superficial de líquidosDocumento1 páginaDeterminar viscosidad y tensión superficial de líquidosSolAngel Eulate RamosAún no hay calificaciones
- Flujograma Estado Gaseoso PDF2Documento1 páginaFlujograma Estado Gaseoso PDF2SolAngel Eulate RamosAún no hay calificaciones