Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Practica #07
Cargado por
mmmmmmmmmmmmmmDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Practica #07
Cargado por
mmmmmmmmmmmmmmCopyright:
Formatos disponibles
DEPARTAMENTO ACADÉMICO DE QUÍMICA-UNSAAC
LABORATORIO DE QUIMICA ORGANICA II
ESCUELA PROFESIONAL DE QUÍMICA
PRACTICA No 07 OBTENCIÓN DE ALCOHOL BENCILÍLICO Y ACIDO
BENZOICO
MA 09-11/VI 09-11
1. OBJETIVO
Obtener alcohol bencílico y acido benzoico mediante la reacción de Cannizzarro
2. INTRODUCCION
Liebig en 1835 descubre que el benzaldehído en presencia de hidróxido se oxidaba a
acido benzoico. Observando que se obtenía con 50 % de rendimiento, pero su error fue el
no percatarse que se formaba un segundo producto en la reacción. En 1853 Cannizzarro
se percata que en realidad la reacción era un oxido-reducción en el que la mitad del
benzaldehído se convertía en acido benzoico y la otra mitad se reducía a alcohol bencílico.
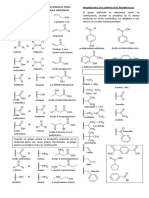
REACCION
La reacción de Cannizzarro tiene lugar cuando se da la adición nucleofílica del -OH a un
aldehído formando así el intermedio tetraédrico, en este intermediario el grupo saliente
va a ser el ion hidruro, provocando una oxidacion. Otra molécula de aldehído capta el ion
hidruro en otra reacción de adición nucleofílica, provocando una reducción,
MECANISMO DE REACCIÓN.
Adición del ión hidróxido al carbonilo.
Jefe de prácticas: Quim. Wilber Huahuasoncco Condori 2019-II
DEPARTAMENTO ACADÉMICO DE QUÍMICA-UNSAAC
LABORATORIO DE QUIMICA ORGANICA II
ESCUELA PROFESIONAL DE QUÍMICA
Transferencia de hidruro
Equilibrio: Acido – base
3. MATERIALES Y REACTIVOS
Erlenmeyer Benzaldehído
Embudos Hidróxido de sodio
Vasos precipitados Sulfato de sodio anhidro
Embudo de separación Éter
Pipetas Agua destilada
4. PROCEDIMIENTO EXPERIMENTAL
Colocar a un Erlenmeyer 1g de NaOH seguido de 4.8 ml de agua.
Agitar el Erlenmeyer hasta que todo el NaOH se disuelva, la reacción es
exotérmica, dejar enfriar la disolución hasta la temperatura ambiente,
Añadir a la disolución 1.6 ml de benzaldehído, agitar hasta la obtención de una
emulsión permanente, dejar en reposo.
La mezcla resultante constituida por benzoato de potasio disolver con un poco de
agua (si se diluye demasiado con agua es difícil extraer todo el alcohol bencílico).
Verter la mezcla en un embudo de separación, lavar con 5 ml de éter y adicionar
este al embudo de separación. Agitar el embudo para asegurar una extracción
eficiente del alcohol bencílico por el éter.
Jefe de prácticas: Quim. Wilber Huahuasoncco Condori 2019-II
DEPARTAMENTO ACADÉMICO DE QUÍMICA-UNSAAC
LABORATORIO DE QUIMICA ORGANICA II
ESCUELA PROFESIONAL DE QUÍMICA
Dejar reposar el embudo por 5 minutos y separar a la fase acuosa (inferior) en un
vaso de precipitado y la fase etérea (superior) en otro vaso de precipitado.
Regresar la fase acuosa al embudo de separación y volver a extraer con otros 5 ml
de éter, repetir la operación de separación de las dos fases y mezclar los dos
extractos etéreos. Guardar la solución acuosa para la separación del ácido
benzoico.
Para la obtención del alcohol bencílico añadir 2 g de sulfato de sodio anhidro a la
solución etérea, decantar y eliminar éter. Medir el volumen del alcohol bencílico
obtenido con una pipeta, calcular el rendimiento.
Para la obtención del ácido benzoico. Poner la solución acuosa en una mezcla de
10 ml de HCl (C) y 20 g de hielo frapé con agitación.
Filtrar el precipitado en un embudo Buchner, lavando con agua fría.
Secar el ácido benzoico y luego obtener el porcentaje de rendimiento.
CUESTIONARIO
1. Desarrollar el flujograma de la síntesis del ácido benzoico y alcohol bencílico
2. Desarrollar los cálculos correspondientes para el porcentaje de rendimiento,
explicar el resultado.
3. ¿Cuáles son los usos y aplicaciones del producto obtenido?
Jefe de prácticas: Quim. Wilber Huahuasoncco Condori 2019-II
También podría gustarte
- Unidad 06 - SolucionarioDocumento9 páginasUnidad 06 - SolucionarioCristo Gil Montesdeoca75% (4)
- Informe Lab 2Documento13 páginasInforme Lab 2IliMeza100% (1)
- Obtencion de Acetato de Isobutilo Mediante La Sintesis de FischerDocumento4 páginasObtencion de Acetato de Isobutilo Mediante La Sintesis de FischerJONNATHAN DAVID VALBUENA DIAZAún no hay calificaciones
- Práctica 2 Condensación AldólicaDocumento3 páginasPráctica 2 Condensación AldólicaAndrea C. López100% (1)
- Grupo 5 Informe 9 Laboratorio Química Orgánica II.Documento16 páginasGrupo 5 Informe 9 Laboratorio Química Orgánica II.Lisaen HuertaAún no hay calificaciones
- Práctica 4Documento4 páginasPráctica 4LUIS ANGEL MONTIEL LEYVAAún no hay calificaciones
- Reaccioncanizaro 2021Documento24 páginasReaccioncanizaro 2021Quimico SalgueroAún no hay calificaciones
- Síntesis Del Ácido CinámicoDocumento8 páginasSíntesis Del Ácido Cinámicokiara Natsumy Velasquez CordovaAún no hay calificaciones
- Reaccion de Canizaro 1Documento13 páginasReaccion de Canizaro 1KarenAún no hay calificaciones
- PRACTICA Nro 3 REACCIÓN DE CANNIZZARODocumento12 páginasPRACTICA Nro 3 REACCIÓN DE CANNIZZARONALENY MORAYMA RUIZ CRUZAún no hay calificaciones
- Reaccion de CannizaroDocumento12 páginasReaccion de CannizaroRosa VasquezAún no hay calificaciones
- Organica CanizadoDocumento17 páginasOrganica CanizadoCristhyan Willy Raa TorresAún no hay calificaciones
- Diagrama Prac 3Documento3 páginasDiagrama Prac 3A.Aún no hay calificaciones
- L8 Informe G54Documento18 páginasL8 Informe G54Mackenzie Aguilar SanzAún no hay calificaciones
- Universidad de Cartagena Facultad de Ingenieria QuimicaDocumento9 páginasUniversidad de Cartagena Facultad de Ingenieria QuimicaJuan Sebastian MoralesAún no hay calificaciones
- Informe 9Documento16 páginasInforme 9Darwin Tapia IzaguirreAún no hay calificaciones
- Practica-Reaccion de CannizzaroDocumento13 páginasPractica-Reaccion de CannizzaroRodolfo CamargoAún no hay calificaciones
- Reporte Práctica 2-Síntesis de Al - Bencílico y Ac - BenzóicoDocumento11 páginasReporte Práctica 2-Síntesis de Al - Bencílico y Ac - BenzóicoAndy AldamaAún no hay calificaciones
- Sintesis de Ester de BananoDocumento11 páginasSintesis de Ester de BananoDayanne ZeladaAún no hay calificaciones
- Práctica No. 2 Orgánica IVDocumento3 páginasPráctica No. 2 Orgánica IVEmilio BurgosAún no hay calificaciones
- Aldehidos y Cetonas (Primera Parte)Documento9 páginasAldehidos y Cetonas (Primera Parte)0XROBERTX0Aún no hay calificaciones
- Experimento 6 A Y BDocumento10 páginasExperimento 6 A Y BLiliapple AvilaAún no hay calificaciones
- 9no Informe Reaccion de Cannizaro TerminadoDocumento19 páginas9no Informe Reaccion de Cannizaro TerminadoRandy100% (1)
- Informe de Practica 10 Reactividad de Acidos CarboxilicosDocumento12 páginasInforme de Practica 10 Reactividad de Acidos CarboxilicosCesar Castillo GuerreroAún no hay calificaciones
- Práctica 3 Sisntesis de Alcohol BencilicoDocumento2 páginasPráctica 3 Sisntesis de Alcohol BencilicoJason Téllez AndradeAún no hay calificaciones
- Manual de Quimica Oranica 2Documento56 páginasManual de Quimica Oranica 2tsukinogaara100% (11)
- Reacciones Con Cloruro de ButiriloDocumento4 páginasReacciones Con Cloruro de ButiriloJuan Pablo Gallego CardonaAún no hay calificaciones
- Inf SFMPDocumento3 páginasInf SFMPVerónica CarolinaAún no hay calificaciones
- Laboratorio Quimica Organica II Practica#2Documento5 páginasLaboratorio Quimica Organica II Practica#2Robin Fernando Zambrano Trivi�oAún no hay calificaciones
- Reporte Práctica 2-Síntesis de Al - Bencílico y Ac - BenzóicoDocumento12 páginasReporte Práctica 2-Síntesis de Al - Bencílico y Ac - BenzóicoAndy AldamaAún no hay calificaciones
- Practica 2 Organica CorregidaDocumento2 páginasPractica 2 Organica CorregidaEndelyon ReiAún no hay calificaciones
- Sintesis de Ácido 2,4-DihidroxibenzoicoDocumento5 páginasSintesis de Ácido 2,4-DihidroxibenzoicoLuis Tamayo0% (1)
- Síntesis de CannizzaroDocumento8 páginasSíntesis de CannizzaroAbraham MartinezAún no hay calificaciones
- Práctica # 5 Propiedades Químicas de Ácidos Carboxílicos y DerivadosDocumento4 páginasPráctica # 5 Propiedades Químicas de Ácidos Carboxílicos y DerivadosVerónicaAún no hay calificaciones
- Lab. Q.orgánica II I.QDocumento17 páginasLab. Q.orgánica II I.QDanielAún no hay calificaciones
- Sintesis Del Ácido Benzoico - PracDocumento3 páginasSintesis Del Ácido Benzoico - PraclungataAún no hay calificaciones
- Reacciones CannizaroDocumento11 páginasReacciones CannizaroGuisela Quispe Velez100% (1)
- Practica 1. 0x-RdDocumento5 páginasPractica 1. 0x-RdrositorrealbaAún no hay calificaciones
- Práctica 8Documento18 páginasPráctica 8Fernanda PérezAún no hay calificaciones
- Organica PracticasDocumento46 páginasOrganica PracticasDenisse QuintanaAún no hay calificaciones
- Práctica # 7 Ácidos Carboxílicos y Ésteres RDocumento10 páginasPráctica # 7 Ácidos Carboxílicos y Ésteres RJoel Ccansaya FernándezAún no hay calificaciones
- Práctica 05 - INAF-204 - Alcoholes y FenolesDocumento5 páginasPráctica 05 - INAF-204 - Alcoholes y FenolesReyner BautistaAún no hay calificaciones
- TP 32 Sintesis de 1-BromobutanoDocumento3 páginasTP 32 Sintesis de 1-BromobutanoIgnacio TaulerAún no hay calificaciones
- INFORME SaponificacionDocumento6 páginasINFORME SaponificacionmestraaguasAún no hay calificaciones
- PRACTICA N°1 Sintesis de La AzlactonaDocumento12 páginasPRACTICA N°1 Sintesis de La AzlactonaRricardoo Ubillus Ruiz100% (1)
- Sintesis Del Ácido AdipicoDocumento9 páginasSintesis Del Ácido AdipicoDiego Luna VeraAún no hay calificaciones
- Reacciones de Acidos Carboxilicos y Sus DerivadosDocumento7 páginasReacciones de Acidos Carboxilicos y Sus DerivadosJose murciaAún no hay calificaciones
- Exposicion Acidos Carb-1Documento25 páginasExposicion Acidos Carb-1FERNANDO JOSE OSORIO ROSARIOAún no hay calificaciones
- Informe de Laboratorio de Química Organica II: Síntesis Del Benzoato de MetiloDocumento7 páginasInforme de Laboratorio de Química Organica II: Síntesis Del Benzoato de MetiloCarolina Sánchez67% (3)
- Practica 3 BioorganDocumento6 páginasPractica 3 BioorganIrene FarmerAún no hay calificaciones
- PG Reporte#2Documento10 páginasPG Reporte#2Isaias PerdomoAún no hay calificaciones
- Practica 2Documento9 páginasPractica 2Mayra BarajasAún no hay calificaciones
- CanizzaroDocumento4 páginasCanizzaroDavis BernardoAún no hay calificaciones
- PrácticaDocumento4 páginasPrácticaDiego CalderaAún no hay calificaciones
- Informe 5 Org Jueves AmDocumento7 páginasInforme 5 Org Jueves Amvictor carbonellAún no hay calificaciones
- Practicas de Lab. Q.Orgánica II I.QDocumento34 páginasPracticas de Lab. Q.Orgánica II I.QAndrés Cortés TorresAún no hay calificaciones
- Practicas de Lab Q. A.Documento23 páginasPracticas de Lab Q. A.Ciro CornejoAún no hay calificaciones
- El Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásDe EverandEl Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásAún no hay calificaciones
- Cócteles Para Principiantes: Aprende a Preparar Tragos de Ron, Vodka, Tequila, Brandy, Whisky y másDe EverandCócteles Para Principiantes: Aprende a Preparar Tragos de Ron, Vodka, Tequila, Brandy, Whisky y másAún no hay calificaciones
- Resultados: Hgcl2 + 2ki Hgi2 + 2Kcl Hgi2 + 2ki K2 (Hgi4)Documento1 páginaResultados: Hgcl2 + 2ki Hgi2 + 2Kcl Hgi2 + 2ki K2 (Hgi4)mmmmmmmmmmmmmmAún no hay calificaciones
- Rubrica para Examen de QuimicaDocumento2 páginasRubrica para Examen de QuimicammmmmmmmmmmmmmAún no hay calificaciones
- Laboratorio EstadisticaDocumento11 páginasLaboratorio EstadisticammmmmmmmmmmmmmAún no hay calificaciones
- Labo TicsDocumento6 páginasLabo TicsmmmmmmmmmmmmmmAún no hay calificaciones
- Rubrica para Examen de QuimicaDocumento2 páginasRubrica para Examen de Quimicammmmmmmmmmmmmm100% (1)
- Investigacion en Estadistica. Contaminacion Del AguaDocumento5 páginasInvestigacion en Estadistica. Contaminacion Del AguammmmmmmmmmmmmmAún no hay calificaciones
- Guia Numero 8Documento3 páginasGuia Numero 8mmmmmmmmmmmmmmAún no hay calificaciones
- Labo TicsDocumento6 páginasLabo TicsmmmmmmmmmmmmmmAún no hay calificaciones
- Resultados: Hgcl2 + 2ki Hgi2 + 2Kcl Hgi2 + 2ki K2 (Hgi4)Documento1 páginaResultados: Hgcl2 + 2ki Hgi2 + 2Kcl Hgi2 + 2ki K2 (Hgi4)mmmmmmmmmmmmmmAún no hay calificaciones
- Practica #04Documento3 páginasPractica #04mmmmmmmmmmmmmmAún no hay calificaciones
- Labo TicsDocumento6 páginasLabo TicsmmmmmmmmmmmmmmAún no hay calificaciones
- Practica16 PDFDocumento12 páginasPractica16 PDFHorianita TrujilloAún no hay calificaciones
- Guía Grupo A-001-AlumnoDocumento8 páginasGuía Grupo A-001-AlumnommmmmmmmmmmmmmAún no hay calificaciones
- Practica #07Documento3 páginasPractica #07mmmmmmmmmmmmmmAún no hay calificaciones
- Practica #06Documento2 páginasPractica #06mmmmmmmmmmmmmm100% (1)
- Campéonato Fisico-Quimico-2Documento2 páginasCampéonato Fisico-Quimico-2mmmmmmmmmmmmmmAún no hay calificaciones
- Practica 12Documento6 páginasPractica 12Eduardo CalzadaAún no hay calificaciones
- TPN10Documento6 páginasTPN10Andreia Villarroel Do NascimentoAún no hay calificaciones
- MMMMDocumento2 páginasMMMMmmmmmmmmmmmmmmAún no hay calificaciones
- Práctica N 9 PDFDocumento1 páginaPráctica N 9 PDFmmmmmmmmmmmmmmAún no hay calificaciones
- Guia Practica #1Documento10 páginasGuia Practica #1mmmmmmmmmmmmmmAún no hay calificaciones
- Práctica N 5Documento2 páginasPráctica N 5mmmmmmmmmmmmmmAún no hay calificaciones
- Práctica #11 Síntesis Del Alumbre de Aluminio y Potasio: MaterialesDocumento1 páginaPráctica #11 Síntesis Del Alumbre de Aluminio y Potasio: MaterialesmmmmmmmmmmmmmmAún no hay calificaciones
- Práctica #11 Síntesis Del Alumbre de Aluminio y Potasio: MaterialesDocumento1 páginaPráctica #11 Síntesis Del Alumbre de Aluminio y Potasio: MaterialesmmmmmmmmmmmmmmAún no hay calificaciones
- Practica de Inor 10Documento4 páginasPractica de Inor 10mmmmmmmmmmmmmmAún no hay calificaciones
- Práctica N 7 PDFDocumento2 páginasPráctica N 7 PDFmmmmmmmmmmmmmmAún no hay calificaciones
- Práctica N4Documento2 páginasPráctica N4Wimpy MagnateAún no hay calificaciones
- Práctica N 5Documento2 páginasPráctica N 5mmmmmmmmmmmmmmAún no hay calificaciones
- Práctica #11 Síntesis Del Alumbre de Aluminio y Potasio: MaterialesDocumento1 páginaPráctica #11 Síntesis Del Alumbre de Aluminio y Potasio: MaterialesmmmmmmmmmmmmmmAún no hay calificaciones
- Trabajo Práctico N°6 - CaramelizacionDocumento10 páginasTrabajo Práctico N°6 - CaramelizacionRegina Gisela De CunhaAún no hay calificaciones
- Identificación y Comparación de Secuencias de Adn Utilizando Expresiones RegularesDocumento4 páginasIdentificación y Comparación de Secuencias de Adn Utilizando Expresiones RegularesYeimy QuevedoAún no hay calificaciones
- Informe Practica 1 de Laboratorio QuimicaDocumento9 páginasInforme Practica 1 de Laboratorio QuimicaKaren ArtunduagaAún no hay calificaciones
- P7 Cuestionar1oDocumento2 páginasP7 Cuestionar1oVeronica Leydi Quispe CondoriAún no hay calificaciones
- AlquinosDocumento1 páginaAlquinosNatalia Carrera cruzAún no hay calificaciones
- TeoriaDocumento18 páginasTeoriaLUIS ANGEL ROBLESAún no hay calificaciones
- Sintesis de AspirinaDocumento21 páginasSintesis de Aspirinavar 32Aún no hay calificaciones
- Nomeclatura InorganicaDocumento2 páginasNomeclatura InorganicaIoyo SamaAún no hay calificaciones
- Informe de Organia 1Documento6 páginasInforme de Organia 1Pamela Páez100% (1)
- Prioridades de Grupos Funcionales Prioridades y Grupos para La Nomenclatura en Química Orgánica PDFDocumento1 páginaPrioridades de Grupos Funcionales Prioridades y Grupos para La Nomenclatura en Química Orgánica PDFCamila Jimenez Bejarano0% (1)
- Mapa de Extraccion de Pectina UnachDocumento2 páginasMapa de Extraccion de Pectina UnachMirian Yuliza Rubio CiezaAún no hay calificaciones
- T9-Lipolisis Impotante PDFDocumento20 páginasT9-Lipolisis Impotante PDFkaren2795Aún no hay calificaciones
- Resumen Primer Parcial Biología 54Documento9 páginasResumen Primer Parcial Biología 54Macarena LuacesAún no hay calificaciones
- 5.-Moleculas OrganicasDocumento45 páginas5.-Moleculas OrganicasFigueroa CristianAún no hay calificaciones
- Propuesta de Un Metodo de Analisis Quimico de Compuestos Nitrogenados para La Deteccion de Urea en Cocuy de PencaDocumento53 páginasPropuesta de Un Metodo de Analisis Quimico de Compuestos Nitrogenados para La Deteccion de Urea en Cocuy de PencaNeyaly BecerraAún no hay calificaciones
- Manual Agua Potable PVCDocumento172 páginasManual Agua Potable PVCAlfa J.A.100% (1)
- Exposicion Sobre La UreaDocumento9 páginasExposicion Sobre La UreaErik CondoriAún no hay calificaciones
- Practica 1 Identificacion de Aldehidos y CetonasDocumento8 páginasPractica 1 Identificacion de Aldehidos y CetonasCRISTIAN ELEAZAR HURTADO ANTICONAAún no hay calificaciones
- Practica02 Identificación Cualitativa de Aminoácidos AzufradosDocumento5 páginasPractica02 Identificación Cualitativa de Aminoácidos AzufradosAdrian CoxAún no hay calificaciones
- Práctica No. 16Documento5 páginasPráctica No. 16Andrés Felipe Serrano Barrios0% (1)
- Metabolismo Glucidos, Lipidos y ProteínasDocumento76 páginasMetabolismo Glucidos, Lipidos y ProteínasMauro BarriosAún no hay calificaciones
- Trabajo Final de Tratamiento de Gas NaturalDocumento47 páginasTrabajo Final de Tratamiento de Gas NaturalItcelita BigabrielAún no hay calificaciones
- Biosíntesis de Aminoácidos ResumenDocumento3 páginasBiosíntesis de Aminoácidos ResumenAntonio SolisAún no hay calificaciones
- Examen de Alcanos y AlquenosDocumento2 páginasExamen de Alcanos y AlquenosEmi CdrAún no hay calificaciones
- Licencia Ambiental PDFDocumento10 páginasLicencia Ambiental PDFJohan FloresAún no hay calificaciones
- Ciclo Del AzufreDocumento17 páginasCiclo Del AzufremariaAún no hay calificaciones
- Isomería-2 PDFDocumento129 páginasIsomería-2 PDFPamela AboytesAún no hay calificaciones
- Mineralizacion Del EsmalteDocumento1 páginaMineralizacion Del Esmaltenaye sosaAún no hay calificaciones
- Empresas Prestadoras de Servicio para El ReciclajeDocumento20 páginasEmpresas Prestadoras de Servicio para El ReciclajeRamón Fernando PadillaAún no hay calificaciones