Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Equilibrio L - V
Cargado por
Takeshi Tanohuye TanohuyeTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Equilibrio L - V
Cargado por
Takeshi Tanohuye TanohuyeCopyright:
Formatos disponibles
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
EQUILIBRIO VAPOR - LQUIDO DE
SOLUCIONES
Si los dos componentes lquidos son completamente miscibles, es
decir que se disolvern en todas las proporciones para formar una
solucin homognea, se tendr una sola fase lquida.
El estudio del equilibrio vapor - lquido de soluciones hace referencia
a las condiciones de equilibrio entre un lquido y el vapor en contacto
con este lquido.
Siendo el nmero de fases presentes en el equilibrio igual a dos (1
fase lquida y 1 fase vapor).
Para poder interpretar el equilibrio vapor - lquido de soluciones,
resulta conveniente aplicar el principio conocido como "Regla de las
Fases". Esta se puede expresar por la siguiente relacin:
F
donde :
C - P + 2
C = nmero de componentes del sistema
P = nmero de fases presentes en el equilibrio
F = nmero de grados de libertad
Una fase puede definirse como cualquier porcin homognea de un
sistema limitado por una superficie y que pueda separarse de las
otras porciones.
El nmero de grados de libertad se define como el nmero de
variables independientes (temperatura, presin y concentraciones)
que tienen que fijarse para definir por completo el sistema.
Aplicando la Regla de Fases para el caso de MEZCLAS BINARIAS:
El nmero de componentes es igual a dos, donde A representa al
componente ms voltil mientras que B representa al componente
menos voltil.
Entonces el nmero de grados de libertad ser:
F = 2 - 2 + 2 = 2 grados de libertad.
Esto indica que para un sistema binario, donde los componentes en
fase lquida son completamente miscibles, deben fijarse dos variables
para definir completamente el sistema.
Si se fija la presin y la concentracin en una de las fases, queda
determinada la temperatura y la concentracin en la otra fase. Si se
fija la presin y la temperatura, quedan determinadas ambas
concentraciones.
Aplicando la Regla de las fases para el caso de una MEZCLA
MULTICOMPONENTE, constituida por n componentes, y bajo la
suposicin de que los lquidos son completamente miscibles:
Nmero de componentes = n
Nmero de fases
= 2
Luego el nmero de grados de libertad ser:
F = n - 2 + 2 = n grados de libertad
- 1 -
UNIVERSIDAD NACIONAL DEL CALLAO
FACULTAD DE INGENIERA QUMICA
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
Si se fija la presin o la temperatura, ser necesario fijar (n-1)
concentraciones para definir completamente el sistema.
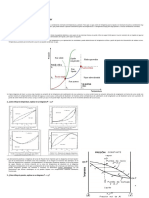
Estos datos se pueden representar en un DIAGRAMA
TEMPERATURA - COMPOSICION, representando la temperatura de
equilibrio (T) versus la composicin, expresada en fraccin molar, en
las fases lquida (x) y vapor (y).
DIAGRAMAS DE FASES
Para las mezclas binarias es posible representar grficamente el
equilibrio entre las fases vapor - lquido, relacionando las variables
temperatura, presin y concentracin; lo que requiere de un diagrama
tridimensional.
Presin constante
T vs y
T vs x
x , y
La curva superior resulta de representar la temperatura vs la
composicin en fase vapor y corresponde a la Curva de los Puntos de
Roco, en la cual la mezcla se encuentra como vapor saturado.
Resulta ms conveniente fijar una de las variables (generalmente
temperatura o presin), de modo que la relacin entre las dos
restantes se puede representar en un diagrama plano.
La curva inferior resulta de representar la temperatura vs la
composicin en fase lquida y corresponde a la Curva de los Puntos de
Burbuja, en la cual la mezcla se encuentra como lquido saturado en
su punto de ebullicin.
En la destilacin,
es ms frecuente fijar la presin que la
temperatura, resultando de gran utilidad los datos de equilibrio a
presin constante.
La zona comprendida entre las dos curvas, corresponde a la Regin de
las dos fases.
-2-
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
Los datos de equilibrio a presin constante, tambin permiten la
construccin del DIAGRAMA DE DISTRIBUCIN DIAGRAMA
x-y, que es la representacin de la composicin del vapor (y
y) frente a
la composicin del lquido (x
x).
Temperatura constante
P vs x
1.0
y
0.9
P vs y
0.8
0.7
0.6
0.5
x , y
0.4
0.3
0.2
0.1
0.0
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
Si la temperatura se mantiene constante, los datos de equilibrio se
representan en un DIAGRAMA PRESION COMPOSICIN.
Entre los sistemas de inters para la destilacin se pueden distinguir
los siguientes:
Sistemas del Tipo I: Son sistemas que se caracterizan por presentar
un punto de ebullicin variable y donde la presin total que ejerce la
fase vapor es intermedia entre la presin de vapor de los componentes
puros.
La curva superior resulta de representar la presin vs la composicin
en fase lquida y corresponde a la Curva de los Puntos de Burbuja,
en la cual la mezcla se encuentra como lquido saturado.
Presin constante
Temperatura constante
La curva inferior resulta de representar la presin vs la composicin
en fase vapor y corresponde a la Curva de los Puntos de Roco, en la
cual la mezcla se encuentra como vapor saturado.
La zona comprendida entre las dos curvas, corresponde a la Regin de
las dos fases.
x , y
- 3 -
x , y
UNIVERSIDAD NACIONAL DEL CALLAO
FACULTAD DE INGENIERA QUMICA
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
Ejemplos: benceno - tolueno , metanol - agua , tetracloruro de
carbono - ciclohexano , tetracloruro de carbono - tolueno.
mximo de ebullicin, y donde la presin total que ejerce la fase vapor
presenta un valor mnimo.
Sistemas del Tipo
II: Son sistemas que se caracterizan por
presentar un punto de ebullicin constante, que a la vez es un punto
mnimo de ebullicin, y donde la presin total que ejerce la fase
vapor presenta un valor mximo.
Presin constante
Presin constante
Temperatura constante
Temperatura constante
x , y
x , y
Sistema
etanol -agua
hexano - etanol
benceno - etanol
acetona - disulfuro de carbono
metanol - cloroformo
Sistema
alcohol benclico - p cresol
cido frmico - agua
cido ntrico - agua
acetona - cloroformo
cido clorhdrico - agua
x , y
moles % A
89.43
66.8
55.2
39.0
35.0
T C
78.15
58.68
68.24
39.25
53.50
PT mm Hg
760
760
760
760
760
x , y
moles % A
62.0
56.7
37.8
34.5
11.1
T C
207.0
107.1
129.5
64.5
110.0
PT mm Hg
760
760
735
760
760
Para mezclas multicomponentes resulta difcil representar las
relaciones de equilibrio vapor - lquido, salvo el caso de sistemas de
tres componentes donde es posible utilizar diagramas triangulares.
Los clculos de las temperaturas de roco y de burbuja para mezclas
multicomponentes se determinan mediante iteraciones, a diferencia de
las mezclas binarias donde se obtienen directamente de los diagramas
de fases.
Sistemas del Tipo III: Son sistemas que se caracterizan por
presentar un punto de ebullicin constante, que a la vez es un punto
-4-
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
RELACIONES DE EQUILIBRIO VAPOR LQUIDO
Una manera adecuada de representar la relacin de equilibrio entre
una fase vapor y una fase lquida, es en trminos del valor K, definido
por la siguiente relacin:
K
yi
= ---xi
Para las soluciones ideales, el equilibrio vapor - lquido se puede
calcular fcilmente, ya que stas siguen la Ley de Raoult, y si son
aplicables las Leyes de los Gases Ideales, los nicos datos necesarios
son las presiones de vapor.
Fase lquida
Fase vapor
comportamiento ideal
comportamiento ideal
Ley de Raoult
Ley de Dalton
notndose que el valor K (Constante de equilibrio) es una relacin
entre la fraccin molar del componente i en la fase vapor y la
fraccin molar del mismo componente i en la fase lquida, cuando
ambas fases se encuentran en equilibrio a determinadas condiciones
de temperatura y de presin.
La Ley de Raoult seala que la presin parcial de equilibrio, a una
temperatura determinada, es igual al producto de su presin de vapor
como lquido puro por su fraccin molar en el lquido.
Por otro lado, tambin es de suma utilidad emplear el factor de
separacin , denominado volatilidad relativa, que relaciona las
concentraciones de dos componentes i y j entre las fases
vapor y lquida, cuando stas se encuentran en equilibrio a una
determinada condicin de temperatura y presin.
La Ley de Dalton seala que a temperatura constante, la presin
ejercida por una mezcla de gases en un volumen definido es igual a la
suma de las presiones individuales que cada gas ejercera, si ocupase
slo el volumen total.
iJ
pi = Pi . xi
yi / xi
= -------yJ / xJ
En el caso de una mezcla binaria, el componente i es el
componente ms voltil y el componente j es el componente
menos voltil; mientras que en el caso de una mezcla
multicomponente el componente i es un componente cualquiera
y el componente j es el componente de referencia.
PT =
i = 1
pi
Definiendo la fraccin molar del componente i en la fase vapor
como:
pi
Pi . xi
yi = ---- = --------PT
PT
- 5 -
UNIVERSIDAD NACIONAL DEL CALLAO
FACULTAD DE INGENIERA QUMICA
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
Luego la constante K de equilibrio ser igual a:
y la volatilidad relativa:
iL . Pi
ij = -------j L . PJ
Pi
Ki = ----PT
y la volatilidad relativa:
Para evaluar los coeficientes de actividad de lquidos se han
desarrollado ecuaciones basadas en la de Gibbs - Dunhem, que es una
consecuencia de las leyes primera y segunda de la termodinmica.
Pi
i j = ----Pj
Para la correlacin de los coeficientes de actividad en fase lquida de
mezclas binarias se han desarrollado ecuaciones como las de Van Laar,
Margules, Scatchard Hamer, Wilson, NRTL, UNIQUAC. En la
prctica la ecuacin de Van Laar es ampliamente utilizada debido a su
flexibilidad, sencillez y capacidad para ajustar bien muchos sistemas.
Para el caso de soluciones que no obedecen la Ley de Raoult, deber
incluirse un factor de correccin conocido como el coeficiente de
actividad para lquidos, de modo tal que:
pi = iL . Pi . xi
Para el caso de mezclas binarias, se tienen ecuaciones como la de Van
Laar, con algunas excepciones como cuando los datos abarcan lmites
amplios de temperatura. La ecuacin de Van Laar presenta la siguiente
forma:
Suponiendo que la fase vapor obedece la Ley de los gases ideales, se
tiene:
iL . Pi . xi
yi = ------------PT
log LA =
Luego la constante K de equilibrio ser igual a:
iL . Pi
Ki = -------PT
CA
-----------------------CA . x A
1 + -------CB . x B
log LB =
CB
----------------------CB . xB
1 + --------CA . x A
donde CA y CB son las constantes binarias para los coeficientes de
actividad.
-6-
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
DATOS DE EQUILIBRIO VAPOR - LQUIDO A
PRESIN CONSTANTE
Si la fase vapor no obedece las leyes de los gases ideales, lo que
ocurre sobre todo si se trabaja a altas presiones, se debe tener en
cuenta el concepto de fugacidad ( f ).
La fugacidad es la presin actuante, es decir la verdadera presin
que ejerce el gas a las condiciones de masa, volumen y temperatura
determinadas.
f
= ---p
Cuando se requieren datos de equilibrio vapor lquido para sistemas
binarios a presin constante, estos datos pueden obtenerse de tablas.
Sin embargo, se pueden generar los datos de equilibrio aplicando las
diversas leyes que gobiernan el equilibrio, dependiendo del
comportamiento del sistema con respecto a la idealidad, resultando
relativamente sencillo los clculos de equilibrio vapor lquido para
sistemas ideales y con mayor complicacin para sistemas reales.
MEZCLAS BINARIAS
(Soluciones ideales)
a) Presiones de vapor
Ley de Raoult:
pA = PA . xA
pB = PB . xB
Ley de Dalton:
PT =
= PB . ( 1 - xA )
pA + pB
Relacionando ambas leyes:
PT PB
xA = --------PA PB
Por otro lado se sabe:
- 7 -
yA = PA / PT
UNIVERSIDAD NACIONAL DEL CALLAO
FACULTAD DE INGENIERA QUMICA
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
xA + xB =
yA = PA . xA / PT
El procedimiento para generar los datos de equilibrio consiste en:
TA
TB
KB . xB
= 1
KA . xA
KB . ( 1 -
xA ) =
yA = KA . xA
Dentro de este rango de temperaturas, tomar unos 8 - 10
valores intermedios.
El procedimiento para generar los datos de equilibrio consiste en:
Determinar las temperaturas de ebullicin de los componentes
A y B, como sustancias puras, a la presin total especificada.
Para cada valor de temperatura, se calcula la presin de vapor
de los componentes A y B, y luego las composiciones de las
fases lquido y vapor (xA e yA).
Temperatura de ebullicin de A
Temperatura de ebullicin de B
b) Constantes de equilibrio
TA
TB
Dentro de este rango de temperaturas, tomar 8 -10 valores
intermedios.
Por definicin:
yA
yB
KA = ---KB = ---xA
xB
Por otro lado se sabe:
y A + yB =
1 - KB
xA = -------KA - KB
Determinar las temperaturas de ebullicin de los componentes
A y B, como sustancias puras, a la presin total especificada.
Temperatura de ebullicin de A
Temperatura de ebullicin de B
KA . xA
Para cada valor de temperatura, se calcula la constante de
equilibrio K de los componentes A y B, y luego las composiciones
de las fases lquido y vapor. (xA e yA)
1
c) Volatilidad relativa
-8-
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
Si para un sistema binario la volatilidad relativa es una constante,
independiente de la temperatura, se puede generar una expresin
que correlaciona las concentraciones de equilibrio.
1.0
y
yA / xA
= ---------yB / xB
Por definicin:
0.9
0.8
0.7
Se sabe que:
yB = 1 - yA ,
xB = 1 - xA
0.6
0.5
Sustituyendo y despejando:
0.4
yA / xA
0.3
= --------------------
0.2
(1 - yA) / ( 1 xA)
0.1
. xA
yA = ------------1 + ( - 1) xA
0.0
0.0
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
Se generan los datos de equilibrio utilizando el valor de y
dando valores a xA entre 0 y 1 paras obtener las composiciones
del vapor (yA) en equilibrio con el lquido
- 9 -
UNIVERSIDAD NACIONAL DEL CALLAO
FACULTAD DE INGENIERA QUMICA
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
Volatilidad relativa y KJ
MEZCLAS MULTICOMPONENTES (Soluciones ideales)
3. Calcular la composicin del vapor en equilibrio con la fase lquida.
CLCULO DEL PUNTO DE BURBUJA
4. La temperatura asumida ser la temperatura de burbuja si:
Datos:
Composicin de la mezcla lquida
Presin total
yi = 1
i = 1
Objetivo:
Calcular la composicin del vapor en equilibrio con la
fase lquida y la temperatura de burbuja
n
1. Asumir la temperatura de burbuja
Aproximacin
1.0005 >
yi > 0.9995
i = 1
Como primer valor de temperatura, asumir la temperatura de
ebullicin del componente de referencia. Se utiliza el siguiente
criterio para su seleccin:
Calcular el peso molecular promedio del lquido y ubicar el par
de componentes cuyos pesos moleculares contengan el valor
promedio.
Mtodo de Iteracin directa
Se realiza el primer clculo del punto de roco y con los resultados
se calcula la fraccin molar corregida para el componente de
referencia.
De este par, seleccionar como componente de referencia al
componente ms voltil.
2. Evaluar, a la temperatura asumida, la relacin de equilibrio lquido
vapor adecuada
yr = yr / yi
i = 1
Presin de vapor
Constante de equilibrio K
- 10 -
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
Con este valor de la fraccin molar corregida, se calcula el nuevo
valor de la relacin de equilibrio vapor lquido para el
componente de referencia.
Kr calculado
= yr / xr
Pr
= ( yr / xr ) . PT
ir
calculado
calculado
yr
CLCULO DEL PUNTO DE ROCO
Datos:
Composicin del vapor
Presin total
Objetivo:
Calcular la composicin del lquido en equilibrio con la
fase vapor y la temperatura de roco
/ (KJ . xr )
1. Asumir la temperatura de roco
Finalmente con este valor calculado se obtiene el nuevo valor de
temperatura.
Como primer valor de temperatura, asumir la temperatura de
ebullicin del componente de referencia. Se utiliza el siguiente
criterio para su seleccin:
Calcular el peso molecular promedio del vapor y ubicar el par de
componentes cuyos pesos moleculares contengan el valor
promedio.
De este par, seleccionar como componente de referencia al
componente menos voltil.
2. Evaluar, a la temperatura asumida, la relacin de equilibrio lquido
vapor adecuada:
Presin de vapor
Constante de equilibrio K
Volatilidad relativa y KJ
3. Calcular la composicin del lquido en equilibrio con la fase vapor.
- 11 -
UNIVERSIDAD NACIONAL DEL CALLAO
FACULTAD DE INGENIERA QUMICA
TRANSFERENCIA DE MASA II
Ing. Carlos Angeles Queirolo
4. La temperatura asumida ser la temperatura de roco si
Kr
calculado
Pr
n
i r
xi = 1
calculado
calculado
= yr / xr
= ( yr / xr ) . PT
=
yr
/ (KJ . xr )
i = 1
Finalmente con este valor calculado se obtiene el nuevo valor de
temperatura.
Aproximacin
1.0005 >
xi > 0.9995
i = 1
Mtodo de Iteracin directa
Se realiza el primer clculo del punto de roco y con los
resultados se calcula la fraccin molar corregida para el
componente de referencia.
n
xr = xr / xi
i = 1
Con este valor de la fraccin molar corregida, se calcula el nuevo
valor de la relacin de equilibrio vapor lquido para el
componente de referencia.
- 12 -
Universidad Nacional del Callao
Facultad de Ingeniera Qumica
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- 3 Equilibrio L VDocumento120 páginas3 Equilibrio L VGIANCARLOAún no hay calificaciones
- Ley de Dalton y HenryDocumento62 páginasLey de Dalton y HenryLaura ReyesAún no hay calificaciones
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Punto de Rocio y BurbujaDocumento23 páginasPunto de Rocio y Burbujamanutws71% (7)
- Ley de Raoult ModificadaDocumento8 páginasLey de Raoult ModificadaMilagrosCabanillasInfantesAún no hay calificaciones
- Equilibrio Líquido-Vapor Benceno-Tolueno (ELV B-TDocumento10 páginasEquilibrio Líquido-Vapor Benceno-Tolueno (ELV B-TMiguel Jiménez FloresAún no hay calificaciones
- Supere El NoDocumento18 páginasSupere El Nobrayan sepulveda100% (1)
- Termo III (Práctica 3)Documento33 páginasTermo III (Práctica 3)Jesus Vazquez60% (5)
- Equilibrio Liquido-VaporDocumento10 páginasEquilibrio Liquido-VaporMiguelAún no hay calificaciones
- Taller Desarrollo Competencias Quimica IDocumento32 páginasTaller Desarrollo Competencias Quimica ICarlos Andres Paredes Perdomo69% (16)
- Tabla de Presión de Vapor de Agua Líquida y HieloDocumento2 páginasTabla de Presión de Vapor de Agua Líquida y HieloMeiser B. Gamboa100% (1)
- Actividades 4Documento7 páginasActividades 4AngelAlejandroCabreraCarrillo0% (4)
- Espectrofluorímetros: componentes y fuentes de luzDocumento11 páginasEspectrofluorímetros: componentes y fuentes de luzFabian Vizcarra100% (1)
- Informe 2-Mezcla MulticomponentesDocumento19 páginasInforme 2-Mezcla MulticomponentesSalustria Cabezas SánchezAún no hay calificaciones
- Informe de Gas Natural 2Documento20 páginasInforme de Gas Natural 2Salustria Cabezas SánchezAún no hay calificaciones
- Equilibrio vapor-líquido etanol-aguaDocumento26 páginasEquilibrio vapor-líquido etanol-aguaHildreth JadiraAún no hay calificaciones
- Lecciones de RepasoDocumento18 páginasLecciones de RepasoRicardoAún no hay calificaciones
- Informe de DestilacionDocumento44 páginasInforme de DestilacionReina PinedoAún no hay calificaciones
- Procesos de Separacion T2Documento10 páginasProcesos de Separacion T2davidAún no hay calificaciones
- Ecuacion de Clauis y ClapeyronDocumento7 páginasEcuacion de Clauis y ClapeyronjuanAún no hay calificaciones
- Equilibrio líquido-vapor en mezclas binariasDocumento11 páginasEquilibrio líquido-vapor en mezclas binariasRoberto GoncalvesAún no hay calificaciones
- Copia de Práctica 3 y 4 - EH 2015Documento26 páginasCopia de Práctica 3 y 4 - EH 2015angelriosvazquez08Aún no hay calificaciones
- Cap12 Termodinamica 2Documento9 páginasCap12 Termodinamica 2Sofia Mac RodriAún no hay calificaciones
- Informe de Laboratorio #04Documento20 páginasInforme de Laboratorio #04ruttAún no hay calificaciones
- Informe Equilibrio Liquido Vapor. 89Documento18 páginasInforme Equilibrio Liquido Vapor. 89Rony Martin Alegria RodriguezAún no hay calificaciones
- Wuolah-Capítulo 6Documento5 páginasWuolah-Capítulo 6ksaweryjpcAún no hay calificaciones
- Equilibrio Liquido VaporDocumento8 páginasEquilibrio Liquido VaporARNOLD BRAVO RAMIREZAún no hay calificaciones
- Diferencia Entre Gas y VaporDocumento8 páginasDiferencia Entre Gas y VaporJosé TorrezAún no hay calificaciones
- Tutorial Termodinamica I Sustancias Puras Trabajo (2021)Documento28 páginasTutorial Termodinamica I Sustancias Puras Trabajo (2021)Cristofer J Prieto SantanaAún no hay calificaciones
- Lectura Interesante Diagramas de FaseDocumento16 páginasLectura Interesante Diagramas de FaseTatiana BarbosaAún no hay calificaciones
- Informe T BurbujaDocumento14 páginasInforme T BurbujaRicardo Felipe Cortes CruzAún no hay calificaciones
- Simulacion Tema 3Documento31 páginasSimulacion Tema 3ingemax1Aún no hay calificaciones
- Informe Labo IIDocumento18 páginasInforme Labo IIDilam Diaz RamirezAún no hay calificaciones
- Equilbrio de FasesDocumento4 páginasEquilbrio de FasesRosalba González MéndezAún no hay calificaciones
- Operacion UnitariaDocumento5 páginasOperacion UnitarialioAún no hay calificaciones
- Equilibrio Vapor LiquidoDocumento13 páginasEquilibrio Vapor LiquidoERCI100% (1)
- Marco Teorico TxyDocumento4 páginasMarco Teorico TxyCraven HorrorsAún no hay calificaciones
- Aqui Editar111Documento14 páginasAqui Editar111SHsaavedraAún no hay calificaciones
- Practica 4Documento22 páginasPractica 4adrielAún no hay calificaciones
- Equilibrio de fases en mezclas multicomponentesDocumento21 páginasEquilibrio de fases en mezclas multicomponentesMari SalasAún no hay calificaciones
- Equilibrio vapor-líquido solucionesDocumento11 páginasEquilibrio vapor-líquido solucionesEdwin Cirilo ChaucaAún no hay calificaciones
- 2 Equilibrio Líquido - VaporDocumento11 páginas2 Equilibrio Líquido - VaporMeliza Bravo CastilloAún no hay calificaciones
- Objetivo GeneralDocumento11 páginasObjetivo GeneralAdal SandovalAún no hay calificaciones
- Tarea 2 - p2Documento2 páginasTarea 2 - p2jose daniel TrujilloAún no hay calificaciones
- PRACTICA 7 ELABORACIÓN DE DIAGRAMA T-X-YDocumento5 páginasPRACTICA 7 ELABORACIÓN DE DIAGRAMA T-X-YIrvingAún no hay calificaciones
- Equilibrio Liquido VaporDocumento6 páginasEquilibrio Liquido VaporAlexChacónAún no hay calificaciones
- Laboratorio Integral II P7Documento6 páginasLaboratorio Integral II P7Yozlin Medel ReyesAún no hay calificaciones
- Equilibrio de Mezaclas Multi ComponentesDocumento31 páginasEquilibrio de Mezaclas Multi ComponentesMario Ramiro Humerez Diaz100% (2)
- Ley de Raoult y soluciones idealesDocumento6 páginasLey de Raoult y soluciones idealesluis alonso fernandez alvirdeAún no hay calificaciones
- DIAGRAMAS DE FASES T-X Y P-XDocumento14 páginasDIAGRAMAS DE FASES T-X Y P-XChäz XdAún no hay calificaciones
- Termo Pract 1Documento20 páginasTermo Pract 1Luis Alfonso LHAún no hay calificaciones
- Lab Op3 Parte 1Documento16 páginasLab Op3 Parte 1Jorge EliasAún no hay calificaciones
- ANEXO 4 Cuest de La Ley de RoultDocumento5 páginasANEXO 4 Cuest de La Ley de Roultluis alonso fernandez alvirdeAún no hay calificaciones
- Tema 4Documento21 páginasTema 4Elio barrios ibarraAún no hay calificaciones
- Practica #2 Lineas de EquilibrioDocumento15 páginasPractica #2 Lineas de EquilibrioErikaCorderoLópezAún no hay calificaciones
- Comportamiento de FasesDocumento69 páginasComportamiento de FasesPrivée Audiopro100% (7)
- Practica 1 de Termodinamica de FasesDocumento18 páginasPractica 1 de Termodinamica de FasesAlberto Arteaga100% (1)
- Tema 4Documento24 páginasTema 4Aro RogerAún no hay calificaciones
- EQUILIBRIO DE MEZCLAS MULTICOMPONENTE Y SIMULACIÓNDocumento28 páginasEQUILIBRIO DE MEZCLAS MULTICOMPONENTE Y SIMULACIÓNDylan Gonzales MuñozAún no hay calificaciones
- Sistema binario paradiclorobenceno-naftalenoDocumento71 páginasSistema binario paradiclorobenceno-naftalenoMalu AisneAún no hay calificaciones
- Informe de FaseDocumento24 páginasInforme de FaseLlocclla Ccasani GloriaAún no hay calificaciones
- AzeotroposDocumento13 páginasAzeotroposMaggyBalcazarAún no hay calificaciones
- Informe Práctica #3 Punto de BurbujaDocumento5 páginasInforme Práctica #3 Punto de BurbujaDiego Nicolas ManceraAún no hay calificaciones
- Regla de La PalancaDocumento8 páginasRegla de La PalancaFrancisco Javier CanoAún no hay calificaciones
- Reflexión Gerencia Del TiempoDocumento1 páginaReflexión Gerencia Del TiempoTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Estructura de Informe de InvestigaciónDocumento5 páginasEstructura de Informe de InvestigaciónTakeshi Tanohuye TanohuyeAún no hay calificaciones
- La Importancia de La Inteligencia Emocional en El TrabajoDocumento3 páginasLa Importancia de La Inteligencia Emocional en El TrabajoTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Kdo 98394Documento15 páginasKdo 98394Takeshi Tanohuye TanohuyeAún no hay calificaciones
- Obtenga El SiDocumento18 páginasObtenga El SiHaner González PulidoAún no hay calificaciones
- Seminario Seguridad Basada en El LiderazgoDocumento4 páginasSeminario Seguridad Basada en El LiderazgoTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Articulo Eficiencia en CalderasDocumento12 páginasArticulo Eficiencia en CalderasFelipe Flores TarqueAún no hay calificaciones
- MSDS Fundente 3DDocumento8 páginasMSDS Fundente 3DTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Evaluación de trazabilidad y ensayos interlaboratorioDocumento4 páginasEvaluación de trazabilidad y ensayos interlaboratorioTakeshi Tanohuye TanohuyeAún no hay calificaciones
- 894210Documento1 página894210Takeshi Tanohuye TanohuyeAún no hay calificaciones
- Master en Project ManagementDocumento2 páginasMaster en Project ManagementTakeshi Tanohuye TanohuyeAún no hay calificaciones
- ALS Santiago Laboratorio Central de Servicios A La Minera Servicios Analticos de Cobre y OroDocumento4 páginasALS Santiago Laboratorio Central de Servicios A La Minera Servicios Analticos de Cobre y OroFrancisco Droguett MorenoAún no hay calificaciones
- Formato de Trámite AcadémicoDocumento2 páginasFormato de Trámite AcadémicoFranciscoPalominoAún no hay calificaciones
- Conclusion EsDocumento1 páginaConclusion EsTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Material EsDocumento1 páginaMaterial Esalbert4455Aún no hay calificaciones
- Conclusion PlantasDocumento1 páginaConclusion PlantasTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Práctica de investigación sobre representación finita del grupo trenzaDocumento5 páginasPráctica de investigación sobre representación finita del grupo trenzaTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Floculacion Con YucaDocumento8 páginasFloculacion Con YucaMario Antonio Anaya RaymundoAún no hay calificaciones
- Proyecto Minero #TiaMaria: Absolviendo Preguntas, Despejando Dudas y Eliminando TemoresDocumento16 páginasProyecto Minero #TiaMaria: Absolviendo Preguntas, Despejando Dudas y Eliminando TemoresMiguel Ampudia BellingAún no hay calificaciones
- Cas 041 2015 Esp 1 GN Ing GFGNDocumento3 páginasCas 041 2015 Esp 1 GN Ing GFGNTakeshi Tanohuye TanohuyeAún no hay calificaciones
- InformaciónDocumento1 páginaInformaciónGerzon GarcíaAún no hay calificaciones
- Manual Del Carbon ActivadoDocumento89 páginasManual Del Carbon ActivadoAlejandro Moreno Oscanoa75% (4)
- Instalación Update 23 juegoDocumento1 páginaInstalación Update 23 juegoTakeshi Tanohuye TanohuyeAún no hay calificaciones
- Plan de Manejo de Residuos Solidos y Declaracion 2014 - Rev 2Documento21 páginasPlan de Manejo de Residuos Solidos y Declaracion 2014 - Rev 2Takeshi Tanohuye TanohuyeAún no hay calificaciones
- Cap 1Documento10 páginasCap 1Julio TiradoAún no hay calificaciones
- Pautas 9001 y 14001Documento1 páginaPautas 9001 y 14001Takeshi Tanohuye TanohuyeAún no hay calificaciones
- Diplomado Iso 14001Documento8 páginasDiplomado Iso 14001Takeshi Tanohuye TanohuyeAún no hay calificaciones
- Rotaciones de La Lista Dos de MayoDocumento9 páginasRotaciones de La Lista Dos de MayoTakeshi Tanohuye TanohuyeAún no hay calificaciones
- PASIVACIONDocumento11 páginasPASIVACIONFlavioCesarChirmeSisaAún no hay calificaciones
- Sol Quinta Evaluacion - Campos Cardenas Julio - IqDocumento10 páginasSol Quinta Evaluacion - Campos Cardenas Julio - IqJulio Campos CardenasAún no hay calificaciones
- Clase 3. AguaDocumento16 páginasClase 3. AguaAmbar Elizabeth BajañaAún no hay calificaciones
- ENRIQUE ALDAIR VILCAS OCHOA - Trabajo Previo Práctica Presencial Indicadores Ácido-BaseDocumento5 páginasENRIQUE ALDAIR VILCAS OCHOA - Trabajo Previo Práctica Presencial Indicadores Ácido-BaseCARLOS ALBERTO SANCHEZ RUIZAún no hay calificaciones
- Problemas de La 1 Ley de La Termodinamica PDFDocumento12 páginasProblemas de La 1 Ley de La Termodinamica PDFnaleny ruiz cruzAún no hay calificaciones
- Practica 6Documento10 páginasPractica 6Payan Gastelum AbrilAún no hay calificaciones
- Análisis de la calibración de un espectrofotómetro UV-VIS mediante rutinas de diagnósticoDocumento15 páginasAnálisis de la calibración de un espectrofotómetro UV-VIS mediante rutinas de diagnósticoLuis Aguirre 13Aún no hay calificaciones
- Guión Química II-2014Documento17 páginasGuión Química II-2014Cesar BravoAún no hay calificaciones
- Química Reacciones químicasDocumento5 páginasQuímica Reacciones químicasPerseo RellAún no hay calificaciones
- Características Del Petróleo (PRG-410)Documento14 páginasCaracterísticas Del Petróleo (PRG-410)Luis Fernando UrionaAún no hay calificaciones
- Test 4 Solucionario FlorDocumento18 páginasTest 4 Solucionario Florjordanzr10Aún no hay calificaciones
- p5 Cambiadores de Calor en Serie-1Documento13 páginasp5 Cambiadores de Calor en Serie-1Miguel GómezAún no hay calificaciones
- Taller No.6A Alquenos Eliminaciones Sept.2021)Documento9 páginasTaller No.6A Alquenos Eliminaciones Sept.2021)ALEJANDRA MARULANDA GALLEGOAún no hay calificaciones
- Clase+7+ Ejercicios+maquina+de+carnotDocumento3 páginasClase+7+ Ejercicios+maquina+de+carnotAndrea Angarita HernándezAún no hay calificaciones
- EJERCICIOSDocumento2 páginasEJERCICIOSMONICA MARGARETH HUARACA TANTANEAún no hay calificaciones
- Descripcion de Proceso de PropilvenDocumento8 páginasDescripcion de Proceso de PropilvenPedro Jose Amaya Osorio100% (1)
- 2 RTD Ipi 2023Documento62 páginas2 RTD Ipi 2023Jorge AntiveroAún no hay calificaciones
- Análisis de soluciones sólidas hierro-carburo de hierro mediante el método de la palancaDocumento7 páginasAnálisis de soluciones sólidas hierro-carburo de hierro mediante el método de la palancaKadir MuñozAún no hay calificaciones
- ANALISIS DE ENERGIA DE SISTEMAS CERRADOS No.1Documento11 páginasANALISIS DE ENERGIA DE SISTEMAS CERRADOS No.1Carolina SaavedraAún no hay calificaciones
- Semana 08. Cinetica Química, Electroquímica, TermoquímicaDocumento4 páginasSemana 08. Cinetica Química, Electroquímica, TermoquímicaGabrielita RengoAún no hay calificaciones
- Aniones y CationesDocumento2 páginasAniones y CationesJuecito69Aún no hay calificaciones
- Capi. 7 y 8 Fisica Estadistica 2017Documento66 páginasCapi. 7 y 8 Fisica Estadistica 2017dayannaAún no hay calificaciones
- Termorregulación CorporalDocumento12 páginasTermorregulación CorporalSILVIA ROSARIO CHALCO MENDOZAAún no hay calificaciones
- Teorías del enlace covalenteDocumento13 páginasTeorías del enlace covalenteロサレスアヤラ キンAún no hay calificaciones
- Cardona - Los Enzimas. Introducción A La Enzimología.Documento9 páginasCardona - Los Enzimas. Introducción A La Enzimología.Danher EscalanteAún no hay calificaciones
- Reporte Practica #5 Determinación de La Masa Molar de Un Líquido Volátil Por El Método de Las Presiones ParcialesDocumento3 páginasReporte Practica #5 Determinación de La Masa Molar de Un Líquido Volátil Por El Método de Las Presiones ParcialesFelipeMarinAún no hay calificaciones
- AMINASDocumento5 páginasAMINASCAROLINA SALOMÓN ALEJANDROAún no hay calificaciones