Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Teorías del enlace covalente
Cargado por
ロサレスアヤラ キンTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Teorías del enlace covalente
Cargado por
ロサレスアヤラ キンCopyright:
Formatos disponibles
Enlace en el cual se comparte un par de electrones o ms de uno entre dos tomos.
El par de electrones compartidos se representa como una sola lnea y cada electrn del par compartido es atrado por los ncleos de ambos tomos. Esta atraccin mantiene unidos los tomos.
ENLACE COVALENTE
TEORAS PARA EXPLICAR EL ENLACE COVALENTE Y SUS ALCANCES
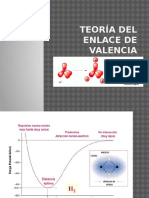
TEORIA DEL ENLACE DE VALENCIA En esta teora dos orbitales atmicas semicompletas de dos tomos (una de cada tomo) se consideran interpenetrndose para formar uno o ms enlaces covalentes entre dichos tomos, de tal manera que el par electrnico ocupe ambos orbitales. A esta interpenetracin de orbitales tomicas se le llama orbitales enlazantes.
H TEORIA DEL ENLACE DE VALENCIA H2 H Cl
Regin traslape de
Cl
Cl
1s
3p
3p
3p
TEORIA DE LOS ORBITALES MOLECULARES
En esta teora los orbitales atmicos de tomos diferentes se combinan para formar nuevos niveles de energa (orbitales moleculares) para toda la molcula. El nmero de orbitales moleculares formados iguala el nmero de orbitales atmicos que se combinan. Los electrones ocupan los orbitales moleculares de las molculas del mismo modo que ocupan los orbitales atmicos de los tomos; es decir, en su estado fundamental, una molcula tiene sus orbitales moleculares de menor energa ocupados. Algunos orbitales moleculares son enlazantes, mientras que otros son antienlazantes.
nodo
1s H
1s H H2 orbital de enlace 1s
LA FORMA DE LAS MOLCULAS
Cuando se escribe la estructura de Lewis para el agua parece que los tomos se disponen en lnea recta. ..
Sin embargo, experimentalmente se determina que la forma de la molcula no es lineal. La molcula es angular, como se muestra en la figura.
H: O : H ..
O
d2
H
d1
Se entiende por forma molecular la figura geomtrica obtenida al unir los ncleos de los tomos enlazados mediante lneas rectas. Estas lneas rectas representan los enlaces ANGULOS DE ENLACE son los ngulos formados por las lneas que unen los ncleos de los tomos de la molcula LONGITUD DE ENLACE es la distancia entre los ncleos de los tomos que participan en el enlace.
POLARIDAD DE LOS ENLACES Los pares de electrones que se comparten entre dos tomos distintos por lo regular no se comparten equitativamente. El concepto de polaridad del enlace es til para describir la proporcin en que los electrones se comparten. Un enlace covalente no polar es quel en el que los electrones se comparten equitativamente entre dos tomos, debido a que ambos tienen electronegatividades iguales.
En un enlace covalente polar uno de los tomos ejerce una atraccin mayor sobre los electrones de enlace que el otro. Si la diferencia de electronegatividades es muy grande, se forma un enlace inico.
.. Na : F : ..
+1
-1
Los smbolos + y - indican las cargas parciales positiva y negativa, respectivamente
ENLACES MULTIPLES El hecho de compartir un par de electrones constituye un solo enlace covalente, al que comnmente se le llama enlace sencillo. H:H H-H En muchas molculas, los tomos completan un octeto compartiendo ms de un par de electrones entre ellos. Cuando dos pares de electrones unen a dos tomos el enlace se llama doble enlace. O::C::O O=C=O Cuando tres pares de electrones se comparten entre dos tomos se forma un enlace triple. N:::N N=N Por regla general, la distancia entre los tomos enlazados disminuye al aumentar el nmero de pares de electrones compartidos.
GEOMETRAS MOLECULARES La geometra molecular es la distribucin tridimensional de los tomos de una molcula. La geometra de una molcula influye en sus propiedades fsicas y qumicas, como el punto de fusin, el punto de ebullicin, la densidad y el tipo de reacciones en que puede participar. MODELO DE LA REPULSIN DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA (RPECV) Hay un procedimiento que permite predecir la geometra de las molcula y iones, si se conoce el nmero de electrones que rodean al tomo central, segn la estructura de Lewis. El fundamento de este enfoque es que los pares de electrones de la capa de valencia de un tomo se repelen entre s. Esta es la TEORIA DE LA REPULSION DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA Se puede predecir la geometra de las molculas (e iones) de manera sistemtica. Para lograrlo es conveniente dividir las molculas en dos categoras, dependiendo de la presencia o ausencia de pares electrnicos libres en el tomo central.
La secuencia para predecir geometras moleculares es la siguiente
a) Se dibuja la estructura de Lewis, siguiendo las consideraciones que se estudiraron anteriormente.
b) Se cuenta el nmero de pares de electrones de enlace y no enlazantes alrededor del tomo central y se colocan de forma que minimicen las repulsiones: (ver tabla)
c) La geometra molecular final vendr determinada en funcin de la importancia de la repulsin entre los pares de electrones de enlace y de no enlace.
GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES
NUMERO DE GRUPOS DE ELECTRONES GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE PARES SOLITARIOS
NOTACION RPECV GEOMETRIA MOLECULAR
ANGULOS DE ENLACE IDEALES
EJEMPLO
GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES
NUMERO DE GRUPOS DE ELECTRONES GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE PARES SOLITARIOS
NOTACION RPECV GEOMETRIA MOLECULAR
ANGULOS DE ENLACE IDEALES
EJEMPLO
GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES
NUMERO DE GRUPOS DE ELECTRONES GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE PARES SOLITARIOS
NOTACION RPECV GEOMETRIA MOLECULAR
ANGULOS DE ENLACE IDEALES
EJEMPLO
GEOMETRIA MOLECULAR EN FUNCION DE LA GEOMETRIA DE LOS GRUPOS DE ELECTRONES
NUMERO DE GRUPOS DE ELECTRONES GEOMETRIA DE LOS GRUPOS DE ELECTRONES NUMERO DE PARES SOLITARIOS
NOTACION RPECV GEOMETRIA MOLECULAR
ANGULOS DE ENLACE IDEALES
EJEMPLO
También podría gustarte
- Hibridación de Orbitales AtómicosDocumento30 páginasHibridación de Orbitales AtómicosMonica BortAún no hay calificaciones
- Tema 2 Orbitales MolecularesDocumento14 páginasTema 2 Orbitales MolecularesIsmael Angel NietoAún no hay calificaciones
- Uniones IónicasDocumento4 páginasUniones Iónicaslujul100% (1)
- UNIONES QUÍMICAS Nomenclatura y FormuleoDocumento19 páginasUNIONES QUÍMICAS Nomenclatura y Formuleolilip100% (3)
- Manual de Prácticas LQI-V 2014Documento96 páginasManual de Prácticas LQI-V 2014Rodrigo Chico Merino100% (1)
- QG F TEMA 8 2017 Procesos RedoxDocumento59 páginasQG F TEMA 8 2017 Procesos Redoxarmando fuentesAún no hay calificaciones
- Escrito ReflexivoDocumento12 páginasEscrito ReflexivoJovanna MtzAún no hay calificaciones
- FE - Tema 4. Espectroscopia Electronica Parte 2 PDFDocumento87 páginasFE - Tema 4. Espectroscopia Electronica Parte 2 PDFALAN URIEL RODRIGUEZ CASTROAún no hay calificaciones
- Obtención de pigmentos de algas y cianobacterias mediante métodos físicos y químicosDocumento10 páginasObtención de pigmentos de algas y cianobacterias mediante métodos físicos y químicosJoseAún no hay calificaciones
- Espectografo de Masas e InfrarojoDocumento4 páginasEspectografo de Masas e Infrarojonestor sanchezAún no hay calificaciones
- Electrodos Indicadores de Membrana o Electrodos Selectivos de IonesDocumento1 páginaElectrodos Indicadores de Membrana o Electrodos Selectivos de IonesRonalStivenEspañaAún no hay calificaciones
- Requisitos de La DocumentaciónDocumento22 páginasRequisitos de La DocumentaciónLuis Andres Chavez LopezAún no hay calificaciones
- SEArDocumento40 páginasSEArHugo AlemánAún no hay calificaciones
- Potenciales de ElectrodoDocumento21 páginasPotenciales de ElectrodoArturo EsquivelAún no hay calificaciones
- Reacciones PDFDocumento91 páginasReacciones PDFJavier CastilloAún no hay calificaciones
- Problemas de Estequiometría CompletoDocumento56 páginasProblemas de Estequiometría CompletoFrancisco CastroAún no hay calificaciones
- Qca Bioinorganica 2014Documento25 páginasQca Bioinorganica 2014Juan José100% (1)
- Obtención de AlcanosDocumento2 páginasObtención de Alcanosjuan lopezAún no hay calificaciones
- Practica ElectroquimicaDocumento19 páginasPractica ElectroquimicaKarito HernándezAún no hay calificaciones
- Curva de solubilidad HCCl3-CH3COOH-H2ODocumento14 páginasCurva de solubilidad HCCl3-CH3COOH-H2OSteevenRafaelPinargoteAún no hay calificaciones
- BalanceMateriaDocumento8 páginasBalanceMateriaROCIO TORRESAún no hay calificaciones
- DIFUSIONDocumento43 páginasDIFUSIONGabriela G. ChAún no hay calificaciones
- Mecanismos de ReacciónDocumento4 páginasMecanismos de ReacciónFaustoAún no hay calificaciones
- Obtencion e Identificacion de HidrocarburosDocumento31 páginasObtencion e Identificacion de HidrocarburosJuniorRomero67% (3)
- DiagramaFasesAleacionesDocumento28 páginasDiagramaFasesAleacionesabrahamAún no hay calificaciones
- Electroquimica AvanzDocumento79 páginasElectroquimica AvanzLEONOR100% (1)
- Propiedades Periódicas de Los Elementos QuímicosDocumento15 páginasPropiedades Periódicas de Los Elementos Químicosdéborah_rosalesAún no hay calificaciones
- Coulumbimetria y VoltamperometriaDocumento2 páginasCoulumbimetria y VoltamperometriaJ Alfredo Cruz MtzAún no hay calificaciones
- Propiedades ColigativasDocumento17 páginasPropiedades ColigativasKaren Lizzeth Ortega ZamarripaAún no hay calificaciones
- La Hibridación Consiste en Una Mezcla de Orbitales Puros en Un Estado Excitado para Formar Orbitales Hibridos Equivalentes Con Orientaciones Determinadas en El EspacioDocumento7 páginasLa Hibridación Consiste en Una Mezcla de Orbitales Puros en Un Estado Excitado para Formar Orbitales Hibridos Equivalentes Con Orientaciones Determinadas en El EspacioYamil ValenciaAún no hay calificaciones
- Beneficios de La Aplicación de Un Campo Eléctrico A Un Biorreactor de MembranaDocumento7 páginasBeneficios de La Aplicación de Un Campo Eléctrico A Un Biorreactor de Membranaanon_999497818Aún no hay calificaciones
- Rev - Manual Lab - Qoarevisado - 222Documento55 páginasRev - Manual Lab - Qoarevisado - 222Arturo Álvarez PérezAún no hay calificaciones
- Produccion de Cloruro de ViniloDocumento16 páginasProduccion de Cloruro de ViniloDiamante Hernandez MeridaAún no hay calificaciones
- Heterogeneous Catalysis: The Basis and ApplicationsDocumento34 páginasHeterogeneous Catalysis: The Basis and ApplicationsMar PGAún no hay calificaciones
- Materia, Estructura y PeriodicidadDocumento28 páginasMateria, Estructura y PeriodicidadAndrea RoblesAún no hay calificaciones
- Temp pptx-1569100278Documento14 páginasTemp pptx-1569100278Paloma MartinezAún no hay calificaciones
- CromatografíaDocumento14 páginasCromatografíaKaren Ledezma BautistaAún no hay calificaciones
- Procesos Termoquímicos de BiomasaDocumento10 páginasProcesos Termoquímicos de BiomasaNéstor CamarilloAún no hay calificaciones
- Consulta Numero 4 - QuimicaDocumento24 páginasConsulta Numero 4 - QuimicaSantiago Valencia GAún no hay calificaciones
- Clase Enlace Quimico ACTUALDocumento73 páginasClase Enlace Quimico ACTUALDanielLeMuzzAún no hay calificaciones
- Metodos EspectrofotometricosDocumento23 páginasMetodos EspectrofotometricosArmando ValenciaAún no hay calificaciones
- Diferencias Finitas, Ejemplo BásicoDocumento4 páginasDiferencias Finitas, Ejemplo BásicoJosé Fdo Duran PerezAún no hay calificaciones
- AnalisisDocumento76 páginasAnalisisNereida Yesica Olortigue HuamanAún no hay calificaciones
- TP PolímerosDocumento20 páginasTP PolímerosZoe AbrilAún no hay calificaciones
- Alquinos Capitulo 7Documento25 páginasAlquinos Capitulo 7Elizabeth Eizaga LagunaAún no hay calificaciones
- Formación Del SmogDocumento49 páginasFormación Del SmogElvis Rogers Pakita50% (2)
- Sílabo de Fisicoquímica I-2018Documento6 páginasSílabo de Fisicoquímica I-2018Fatima Leiva ChiribogaAún no hay calificaciones
- La PerovskitaDocumento15 páginasLa PerovskitaDayana CanoAún no hay calificaciones
- Informe Determinacion de Un Compuesto OrganicoDocumento6 páginasInforme Determinacion de Un Compuesto OrganicoFlookyAún no hay calificaciones
- Leyes Fundamentales de La QuímicaDocumento4 páginasLeyes Fundamentales de La QuímicaMarian12orAún no hay calificaciones
- ECOBALANCES Y BALANCES DE MATERIA Y ENERGÍA HERRAMIENTAS PARA LA PMLDocumento35 páginasECOBALANCES Y BALANCES DE MATERIA Y ENERGÍA HERRAMIENTAS PARA LA PMLLaura Paola Fonseca PuertoAún no hay calificaciones
- Regla de FasesDocumento16 páginasRegla de Faseskenyi8Aún no hay calificaciones
- La nanotecnología: El mundo de las máquinas a escala nanométricaDe EverandLa nanotecnología: El mundo de las máquinas a escala nanométricaAún no hay calificaciones
- Termodinámica clásica. Protocolos experimentales sobre primera y segunda leyes, y sobre potenciales selectosDe EverandTermodinámica clásica. Protocolos experimentales sobre primera y segunda leyes, y sobre potenciales selectosAún no hay calificaciones
- Teorías del enlace químico: orbitales moleculares, repulsión de pares y hibridaciónDocumento9 páginasTeorías del enlace químico: orbitales moleculares, repulsión de pares y hibridaciónmara alvarezAún no hay calificaciones
- TEORÍAS DEL ENLACE COVALENTEDocumento5 páginasTEORÍAS DEL ENLACE COVALENTEDavid Manrique TamayoAún no hay calificaciones
- Enlace covalente: compartición de electronesDocumento31 páginasEnlace covalente: compartición de electronesceo_quercusAún no hay calificaciones
- 7 Unidad VII. QMA-103Documento10 páginas7 Unidad VII. QMA-103Omar SantosAún no hay calificaciones
- Programas Analíticos Mecatrónica UAMZM-UASLP (6semestre) (VoBoSecretaríaAcadémica)Documento45 páginasProgramas Analíticos Mecatrónica UAMZM-UASLP (6semestre) (VoBoSecretaríaAcadémica)ロサレスアヤラ キンAún no hay calificaciones
- Simulacion PerturbacionDocumento4 páginasSimulacion Perturbacionロサレスアヤラ キンAún no hay calificaciones
- SISTEMADQUISICIONDocumento0 páginasSISTEMADQUISICIONanviozzyAún no hay calificaciones
- Matemáticas AvanzadasDocumento6 páginasMatemáticas Avanzadasロサレスアヤラ キンAún no hay calificaciones
- Guía completa de circuitos digitales TTLDocumento30 páginasGuía completa de circuitos digitales TTLGerardo Ramirez RiofrioAún no hay calificaciones
- Probabilidad y EstadísticaDocumento9 páginasProbabilidad y Estadísticaロサレスアヤラ キンAún no hay calificaciones
- Diseño Contruccion y Prueba de Un FSAE. GeneralDocumento155 páginasDiseño Contruccion y Prueba de Un FSAE. GeneralOswaldo BorjasAún no hay calificaciones
- Electrónica Digital IIDocumento9 páginasElectrónica Digital IIロサレスアヤラ キンAún no hay calificaciones
- Diseño Contruccion y Prueba de Un FSAE. GeneralDocumento155 páginasDiseño Contruccion y Prueba de Un FSAE. GeneralOswaldo BorjasAún no hay calificaciones
- GokartDocumento165 páginasGokartHenry Morales100% (2)
- Enlace MetlicoDocumento16 páginasEnlace Metlicoロサレスアヤラ キンAún no hay calificaciones
- AutoCAD-MouseDocumento8 páginasAutoCAD-Mouseb04825128Aún no hay calificaciones
- Leyes de Los ExponentesDocumento14 páginasLeyes de Los Exponentesロサレスアヤラ キンAún no hay calificaciones
- Usos e Impacto Economico y Ambiental de Compuestos y ElementosDocumento19 páginasUsos e Impacto Economico y Ambiental de Compuestos y ElementosElena Arellano Guillén100% (2)
- Enlace MetlicoDocumento16 páginasEnlace Metlicoロサレスアヤラ キンAún no hay calificaciones
- Biologia 2Documento16 páginasBiologia 2ロサレスアヤラ キンAún no hay calificaciones
- Compuestos InorganicosDocumento23 páginasCompuestos Inorganicosロサレスアヤラ キンAún no hay calificaciones
- Compuestos PDFDocumento19 páginasCompuestos PDFjunito2085Aún no hay calificaciones
- Física IiDocumento56 páginasFísica Iiロサレスアヤラ キンAún no hay calificaciones
- Desarrollo de Los Cuerpos GeometricosDocumento65 páginasDesarrollo de Los Cuerpos Geometricosロサレスアヤラ キンAún no hay calificaciones
- Numeros Reales y Sus PropiedadesDocumento20 páginasNumeros Reales y Sus Propiedadesロサレスアヤラ キンAún no hay calificaciones
- Exámen Febrero 1S 2020Documento5 páginasExámen Febrero 1S 2020Marco García GarcíaAún no hay calificaciones
- Tema 2. Capitulo IV. Orbitales Moleculares. 2014Documento27 páginasTema 2. Capitulo IV. Orbitales Moleculares. 2014JorgeMartinAún no hay calificaciones
- Guia de El Carbono y Sus CompuestosDocumento12 páginasGuia de El Carbono y Sus CompuestosAdrianaCarbonellAún no hay calificaciones
- Naproxeno AnteDocumento31 páginasNaproxeno AnteMarco GaonaAún no hay calificaciones
- Febrero23 1 Semana SolDocumento9 páginasFebrero23 1 Semana SolMiriam100% (1)
- Desarrollo Del Transporte Eeuu y JapónDocumento40 páginasDesarrollo Del Transporte Eeuu y JapónErick Alejandro Costa AimacañaAún no hay calificaciones
- Estructura Atomica y Molecular PDFDocumento229 páginasEstructura Atomica y Molecular PDFPabloAún no hay calificaciones
- Clase 2 HibridacionDocumento16 páginasClase 2 HibridacionJuan Otero MAún no hay calificaciones
- Antología Química Orgánica PDFDocumento220 páginasAntología Química Orgánica PDFRulas CoriaAún no hay calificaciones
- Apuntes Enlace PDFDocumento46 páginasApuntes Enlace PDFFrancisco IglesiasAún no hay calificaciones
- Química Organometálica Facultad de Química UNAMDocumento256 páginasQuímica Organometálica Facultad de Química UNAMHidekel LópezAún no hay calificaciones
- CTM Clase 11-2019-2Documento37 páginasCTM Clase 11-2019-2Julio GiraldoAún no hay calificaciones
- Química Del Carbono: 6°año Ciencias NaturalesDocumento206 páginasQuímica Del Carbono: 6°año Ciencias NaturalesFRANCISCO LOPEZ VILACLARAAún no hay calificaciones
- MO orbitales diatómicas homonuclearesDocumento56 páginasMO orbitales diatómicas homonuclearesCristopher CanoAún no hay calificaciones
- Espectroscopia Visible Cuestionario Desarrollado AbrahamDocumento3 páginasEspectroscopia Visible Cuestionario Desarrollado AbrahamAbraham S. Aro100% (1)
- Anexo 2 - Tarea 3Documento22 páginasAnexo 2 - Tarea 3andres felipe contrerasAún no hay calificaciones
- Enlace Quimico Prop 1Documento62 páginasEnlace Quimico Prop 1Quimi-ciencias SismayGAún no hay calificaciones
- Resueltos Serie 3Documento27 páginasResueltos Serie 3aleinAún no hay calificaciones
- Laboratorio Analisis Organico PDFDocumento9 páginasLaboratorio Analisis Organico PDFCaroline Carreon MuñoaAún no hay calificaciones
- Cómo Explica La TOM El Tipo de Orden de Enlace y La Longitud de EnlaceDocumento2 páginasCómo Explica La TOM El Tipo de Orden de Enlace y La Longitud de EnlaceFernanda DíazAún no hay calificaciones
- Actividad Tercer Parcial QIDocumento8 páginasActividad Tercer Parcial QILuis Mario Benson FloresAún no hay calificaciones
- La Teoría Del Orbital MolecularDocumento8 páginasLa Teoría Del Orbital MolecularJoel AzaelAún no hay calificaciones
- Informe Química Inorgánica - Átomos y Moléculas (HyperChem)Documento10 páginasInforme Química Inorgánica - Átomos y Moléculas (HyperChem)Ana Schafir100% (1)
- Laboratorio #4 Quimica 2Documento10 páginasLaboratorio #4 Quimica 2BrianAún no hay calificaciones
- Espectros moleculares UV-Vis y fluorescenciaDocumento34 páginasEspectros moleculares UV-Vis y fluorescenciaLucio Montero SalinasAún no hay calificaciones
- Química orgánica: Propiedades del átomo de carbonoDocumento47 páginasQuímica orgánica: Propiedades del átomo de carbonoFabian FloresAún no hay calificaciones
- Química Sus Ramas Modelo Atomico de Rutheford y BohrDocumento21 páginasQuímica Sus Ramas Modelo Atomico de Rutheford y BohrdjesusunefaAún no hay calificaciones
- T.O.M. (Teoria)Documento3 páginasT.O.M. (Teoria)Jorge MillánAún no hay calificaciones
- Apuntes Quimica HeterociclicaDocumento260 páginasApuntes Quimica Heterociclicamaga930100% (1)
- Síntesis, Caracterización y Acetilación Del FerrocenoDocumento7 páginasSíntesis, Caracterización y Acetilación Del FerrocenoJuan Alejandro Guerrero Teran100% (1)