Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Reporte Hemoglobina
Cargado por
KALIN19 GAMING0 calificaciones0% encontró este documento útil (0 votos)
33 vistas5 páginasgrrgf
Título original
reporte hemoglobina (1)
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PPTX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentogrrgf
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
33 vistas5 páginasReporte Hemoglobina
Cargado por
KALIN19 GAMINGgrrgf
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPTX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 5
Hemoglobina Fecha: 06|feb|2023
Nombre: Karla Leonor
Jiménez Tamayo
Semestre y grupo: 4to E
Actividad No. 10
Se denomina hemoglobina a la proteína Nombre del tema: Reporte
presente en el torrente sanguíneo que documental ( Hemoglobina)
Actividad No. 10
permite que el oxígeno sea llevado desde
los órganos del sistema respiratorio hasta
todas las regiones y tejidos. Es posible Es posible diferenciar entre distintos
identificar la hemoglobina como una tipos de hemoglobina. La
heteroproteína ya que, de acuerdo a los hemoglobina de tipo A, también
expertos, se trata de una proteína conocida como hemoglobina normal
conjugada (donde es posible apreciar una o de adulto, está compuesta por un
parte proteica bautizada como globina par de globinas alfa y 2 globinas
con una parte no proteica que se conoce beta. La hemoglobina A representa
como grupo prostético). La hemoglobina cerca del 97% de la hemoglobina en
está compuesta por una proteína una persona adulta. La hemoglobina
denominada globina y un compuesto A2 (2 globinas alfa y la misma
denominado hemo. El hemo está cantidad de globinas delta), por su
compuesto por hierro y un pigmento parte, supone menos del 2,5% de la
denominado porfirina, que le da a su hemoglobina tras el nacimiento
sangre el color rojo.
Al perder oxígeno, en cambio, la
hemoglobina se vuelve rojo.
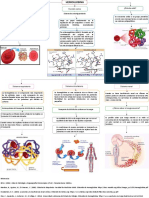
Estructura
oscuro, que es el color que caracteriza a la La hemoglobina es una proteína con
sangre de las venas. estructura cuaternaria, es decir, esta
constituidapor cuatro cadenas
Dos pares de cadenas polipeptídicas polipeptídicas (fig. 1): dos α y dos
componen la hemoglobina y cada una de β (hemoglobina adulta- HbA); dos
ellas está unida a un grupo hemo. Los α y dos δ (forma
átomos de hierro de estos conjuntos les minoritaria de hemoglobina
permiten enlazarse, de manera fácil de adulta- HbA2- normal 2%); dos α y
revertir, a una molécula de O2. Al quedar dos γ
unida con oxígeno, la hemoglobina recibe (hemoglobina fetal- HbF). En el feto
el nombre de hemoglobina oxigenada u humano, en un principio, no se
oxihemoglobina. En cambio, si pierde sintetizan cadenas alfa ni
oxígeno, se habla de hemoglobina
reducida.
beta, sino zeta (ζ ) y épsilon (ξ) (Hb en su estado funcional. El átomo de
Gower I). Al final del primer trimestre hierro se encuentra en estado de
la subunidades α han reemplazado a oxidación ferroso (+2) y puede
las subunidades ζ (Hb Gower II) y las formar
5 o 6 enlaces de
subunidades γ a los péptidos ξ. Por coordinación
dependiendo de la unión del oxigeno
esto, la HbF tiene la composición a la Hb (oxiHb, desoxiHb). Cuatro de
α2γ2. estos enlaces se producen con los
Las subunidades β comienzan su nitrógenos pirrólicos de la porfirina en
síntesis en el tercer trimestre y no un plano horizontal. El quinto enlace
reemplazan a γ en su totalidad hasta de coordinación se realiza con el
algunas semanas después del nitrógeno imidazol de una
nacimiento. Las cadenas del histidinadenominada
polipeptídicas alfa contienen proximal. Finalmente,
histidina el sexto enlace
aminoácidos, las no alfa 146 (β, γ, δ)
141 del átomo ferroso es con el O2,
ydifieren en la secuencia de que además está unido a un segundo
aminoácidos. Se conoce desde hace imidazol de una histidina denominada
décadas la estructura primaria de las histidina distal. Tanto el quinto como
cuatro cadenas de Hb normales. La el sexto enlace se encuentran en un
estructura secundaria es muy similar: plano perpendicular al plano del anillo
cada una exhibe 8 segmentos de porfirina. La parte porfirínica del
helicoidales designados con las letras Hem se sitúa dentro de una bolsa
A a la H. Entre ellos se encuentran hidrofóbica que se forma en cada una
7segmentos no helicoidales. de las cadenas polipeptídicas.
Cada
cadena α esta en contacto con las
cadenas β, sin embargo, existen pocas
interacciones entre las dos cadenas α
o entre las dos cadenas β entre si.
Las cuatro cadenas polipeptídicas de la
Hb contienen cada una un
grupo prostético, el
Hem, un tetrapirrol cíclico (fig. 2),
que les
proporciona el color rojo a los hematíes.
Un
grupo prostético es una porción no
polipeptídica que forma parte de una
proteína
Tipos originarl el hecho de no consumir
o hierro, presencia
Existen muchos tipos diferentes de suficiente la
de en los intestinos,
hemoglobina (Hb). Los más comunes hemorragias
parásitos lascausadas por úlceras en el
son HbA, HbA2, HbE, HbF, HbS, HbC, estómago o por un exceso de
HbH y HgbM. Los adultos sanos menstruación, entre otros factores. Un
tienen niveles significativos de HbA y motivo que excede la voluntad de una
HbA2. persona es una cirugía, dado que en
este tipo de intervenciones se pierde
Diversas patologías también generan
mucha sangre. Algunos de los
diferentes tipos de hemoglobina
síntomas
presentes en estos casos con
oalteraciones en las cantidades
debilidad y la falta de energías para
la
normales. La hemoglobina S está
realizar tareascomunes poco
presente en algunos tipos de anemia,
y exigentes, la
mientras que la hemoglobina
taquicardia e
insuficiencias inclus
glucosilada aumenta con la diabetes.
cardíacas. o
Se conoce como efecto Bohr
Hemoglobina Para establecer
al fenómeno mediante el
la
cantidad de hemoglobina presente en
cual la
hemoglobina pulmonar se oxigena, con
la sangre de una persona y así poder
la consiguiente expulsión de oxígeno
detectar si sufre de alguna de las
presente en los tejidos, debido al pCO2
posibles formas de anemia, se realiza el
y el pH. Los músculos, que como
análisis pertinente, que puede incluirse
tipos
otros de tejido
en una extracción rutinaria. Si bien no
rápidamente, metabolizan cuando
se necesita ningún tipo de preparación
producen considerables se volúmenes
contraende
previa al examen, resulta indispensable
iones de de carbono e
indicar al profesional de turno si se ha
hidrógeno. La hemoglobina se ha
dióxido
recibido una transfusión en
adaptado para conseguir
el
transcurso de los tres meses anteriores
enviar donde más se lo necesite, y ha
oxígeno el
o si se ha consumido nicotina minutos
aprendido a actuar frente a
antes, dado que cualquiera de estas
acumulaciones de los dos compuestos
las
situaciones puede alterar el nivel de
recién mencionados.
hemoglobina.
Cuando disminuye la
Una de las causas más comunes de un cantidad
hemoglobina depresenta
pH, unalaatracción
bajo nivel de hemoglobina en la sangre menor al oxígeno, por lo cual si se
es una dieta deficiente, poco nutritiva; encuentra con una zona en la que se
sin embargo, también pueden esté produciendo este descenso,
reacciona liberándolo.
Hemoglobina La hemoglobina es un compuesto
normal: químico constituido por un núcleo de
La hemoglobina (Hb) es una hierro transportado por la sangre
proteína globular con una masa dentro de los glóbulos rojos, fijando
molecular de el
oxígeno en los pulmones
64.4 kDa.4 transportándose por la sangre hacia
y
Más del 95% de la hemoglobina del los tejidos y células. Al volver a los
adulto y de los niños mayores de 7 pulmones, la hemoglobina actúa
meses es HbA cuya estructura es α2 como transporte de dióxido de
β2. Los adultos normales también carbono y de protones.
tienen un 2-3% de HbA2, α2 δ2. La
Hb fetal (HbF), es el componente
principal de la Hb del recién nacido,
α2 γ2 fija mucho
oxígeno el más fuerte para
competir por el O2 con la
HbA materna. Las
hemoglobinas
Gower I, Gower II y Portland son
embrionarias y sólo aparecen durante
el primer trimestre de gestación. La
Hb Gower II es la más importante y
alcanza entre el 50% y 60% de toda la
Hb embrionaria. Al parecer las
cadenas polipeptídicas epsilon (ε) y
zeta (z) se sintetizan en el saco
vitelino.1
Hemoglobina anormal:
La causa más común de las
hemoglobinopatías es la mutación
puntual, es decir, la sustitución de un
nucleótido de ADN por otro, lo que
modifica el código genético y puede
inducir un cambio en un aminoácido
de la globina resultante.1
En la actualidad se conocen más de
600 hemoglobinopatías, aunque no
todas producen problemas clínicos.3
Bibliografía
1. de hemoglobina
Definición Definición.de. [citado el 6
[Internet].
de marzo de 2023]. Disponible en:
https://definicion.de/hemoglobina/
2.default - Stanford
Medicine Children’s Health
[Internet].
Stanfordchildrens.org. [citado el 6 de
marzo de2023]. Disponible en:
https://www.stanfordchildrens.org/es/
topic/default?id=hemoglobin-167-
hemoglobin_ES
3.Investigación RS. Hemoglobina,
estructura y trastornos,
revisión bibliográfica [Internet]. 𝖣
RSI - Revista Sanitaria de
Investigación. 2021 [citado el 6 de
marzo de 2023]. Disponible en:
https://revistasanitariadeinvestigacion.
com/hemoglobina-estructura-y-
trastornos-revision-bibliografica/
4.Brandan N, de Profesora Titular.
Cátedra de NPTC. Aguirre, María
Victoria Victoria Profesora Adjunta.
Cátedra de Profesora Adjunta. Cátedra
de [Internet]. Moodle.org. [citado el 6
de marzo de 2023]. Disponible en:
https://docs.moodle.org/all/es/images
_es/5/5b/Hemoglobina.pdf
También podría gustarte
- Determinacion de Hemoglobina Expo Miguel PC TerminadoDocumento33 páginasDeterminacion de Hemoglobina Expo Miguel PC TerminadowilliamAún no hay calificaciones
- Mierda FeaDocumento5 páginasMierda FeaAndres BohorquezAún no hay calificaciones
- Hematología Equipo 4 - 20240318 - 131201 - 0000Documento23 páginasHematología Equipo 4 - 20240318 - 131201 - 0000carmen23052001Aún no hay calificaciones
- HemoglobinaDocumento6 páginasHemoglobinamairaAún no hay calificaciones
- Seminario BioquimicaDocumento41 páginasSeminario BioquimicaEdersson ReyesAún no hay calificaciones
- Practica 2 HemoglobinaDocumento11 páginasPractica 2 HemoglobinaErika QuimbitaAún no hay calificaciones
- Lab 8 Manual 2018Documento7 páginasLab 8 Manual 2018Montserrat PérezAún no hay calificaciones
- Estructura y Función de La HemoglobinaDocumento16 páginasEstructura y Función de La HemoglobinaMiguel Marroquín79% (58)
- HemoglobinaDocumento35 páginasHemoglobinaAlexandra Londoño SanchezAún no hay calificaciones
- Hemoglobina y Eritropoyetina - UcvDocumento17 páginasHemoglobina y Eritropoyetina - UcvMale TGAún no hay calificaciones
- HemoglobinaDocumento352 páginasHemoglobinaFrecia CQAún no hay calificaciones
- ORGANIGRAMA2Documento15 páginasORGANIGRAMA2ESLY100% (2)
- HEMOGLOBINADocumento22 páginasHEMOGLOBINAapi-3720763100% (1)
- Estructura y Función de La HemoglobinaDocumento15 páginasEstructura y Función de La HemoglobinaIsabella CatañoAún no hay calificaciones
- Cuestionario HemoglobinaDocumento3 páginasCuestionario HemoglobinaZamora Ortiz Marco PoloAún no hay calificaciones
- Metabolismo de Hemoglobina (DV)Documento9 páginasMetabolismo de Hemoglobina (DV)Dary Deivy Varela AracheAún no hay calificaciones
- Hemoglobin ADocumento9 páginasHemoglobin A1230109Aún no hay calificaciones
- Investigacion #2Documento4 páginasInvestigacion #2jose cordova barahonaAún no hay calificaciones
- Informe Bioquimica HemoglobinaDocumento19 páginasInforme Bioquimica HemoglobinaMAPSI SASAún no hay calificaciones
- Monografia de Bioquimica HemoglobinaDocumento28 páginasMonografia de Bioquimica HemoglobinaVictor Hugo Calsina Luque50% (2)
- Mioglobina y HemoglobinaDocumento44 páginasMioglobina y HemoglobinaNelson Rodrigo Quispe VargasAún no hay calificaciones
- HemoglobinaDocumento5 páginasHemoglobinaJosue Toledo FuentesAún no hay calificaciones
- Transporte de Gases Por La SangreDocumento6 páginasTransporte de Gases Por La SangreilmediciAún no hay calificaciones
- CLASE 3, Grupo 1A, Bioquimica 1Documento32 páginasCLASE 3, Grupo 1A, Bioquimica 1Fran GuzmanAún no hay calificaciones
- HEMOGLOBINADocumento4 páginasHEMOGLOBINAKAROL DANIELA GALINDO CRUZAún no hay calificaciones
- Practica 8 A.B.Documento5 páginasPractica 8 A.B.KIRSA BARBARA TACO ROQUEAún no hay calificaciones
- Hemoglobina PDFDocumento9 páginasHemoglobina PDFJavi R. HatemAún no hay calificaciones
- Apunte Hemoglobina 2022Documento19 páginasApunte Hemoglobina 2022brendaAún no hay calificaciones
- HEMOGLOBINADocumento5 páginasHEMOGLOBINASORIANO QUIROZ LIZBETH DEL CARMENAún no hay calificaciones
- Monografia Anemia 3Documento16 páginasMonografia Anemia 3ARACELY YAJAIRA ZAMUDIO VALERIANOAún no hay calificaciones
- Intervencion de Hemoglobina FetalDocumento3 páginasIntervencion de Hemoglobina FetalpaoxtorrexAún no hay calificaciones
- Metabolismo de La Hemoglobina Berlin Regalado 2018-0134Documento14 páginasMetabolismo de La Hemoglobina Berlin Regalado 2018-0134Berlin RegaladoAún no hay calificaciones
- HemoglobinaDocumento21 páginasHemoglobinaEsperanza De JesusAún no hay calificaciones
- 4.hemoglobina TeoríaDocumento17 páginas4.hemoglobina TeoríaJasna ZovakAún no hay calificaciones
- HEMOGLOBINADocumento1 páginaHEMOGLOBINAMary García100% (1)
- 3a. Clase - HemoglobinaDocumento37 páginas3a. Clase - HemoglobinaIngrid HuayhuaAún no hay calificaciones
- Semana 6Documento9 páginasSemana 6Emilie RossiAún no hay calificaciones
- Anemias HemoliticasDocumento63 páginasAnemias HemoliticasAura maria Lopez argüelloAún no hay calificaciones
- Fisología de La SangreDocumento3 páginasFisología de La SangreIgnacia GaeteAún no hay calificaciones
- Hemoglobinaa TallerDocumento13 páginasHemoglobinaa TallerCARLOS GREGORIO PADILLA PAJOYAún no hay calificaciones
- Albumina 2Documento25 páginasAlbumina 2Aurora Dannae Véliz GonzálezAún no hay calificaciones
- Hemoglobina para AnexarDocumento16 páginasHemoglobina para AnexarAldair HernándezAún no hay calificaciones
- Módulo 01 - HemoglobinaDocumento7 páginasMódulo 01 - HemoglobinaVirginiaAún no hay calificaciones
- Trabajo de HG Bioquimica TDocumento3 páginasTrabajo de HG Bioquimica THarold ZeballosAún no hay calificaciones
- Hemoglobina y MioglobinaDocumento35 páginasHemoglobina y Mioglobinatupapirico1645Aún no hay calificaciones
- Concentracion de HEMOGLOBina en SangrwDocumento10 páginasConcentracion de HEMOGLOBina en SangrwOrbe JosueAún no hay calificaciones
- Hemoglobin A 3Documento32 páginasHemoglobin A 3Mirelli Duran100% (1)
- Hemoglobina para AnexarDocumento16 páginasHemoglobina para AnexarAldair HernándezAún no hay calificaciones
- Bioquimica de La SangreDocumento5 páginasBioquimica de La SangreHolman AndersonAún no hay calificaciones
- HemoglobinaDocumento21 páginasHemoglobinaE EAún no hay calificaciones
- Bilirrubina 2023Documento12 páginasBilirrubina 2023Federico Juarez VozzaAún no hay calificaciones
- Repaso. Fisiologia de La Sangre. HemoglobinaDocumento5 páginasRepaso. Fisiologia de La Sangre. HemoglobinaMarisel LorenaAún no hay calificaciones
- HematologíaDocumento41 páginasHematologíaMariangel JimenezAún no hay calificaciones
- TranscribirDocumento5 páginasTranscribirWilma Marisol Torrez TiconaAún no hay calificaciones
- Hemoglobina y Transporte de GasesaDocumento30 páginasHemoglobina y Transporte de GasesaIveth LPAún no hay calificaciones
- Feminine Routine Timeline InfographicDocumento3 páginasFeminine Routine Timeline InfographicMelanyAún no hay calificaciones
- Tema #8 Hemoglobina e Índices ErtrocitariosDocumento16 páginasTema #8 Hemoglobina e Índices ErtrocitariosHeredia Vargas RodrigoAún no hay calificaciones
- Trabajo Práctico Sobre El Análisis de Hemoglobina en SangreDocumento7 páginasTrabajo Práctico Sobre El Análisis de Hemoglobina en SangreJael CarboneAún no hay calificaciones
- HEMOGLOBINADocumento57 páginasHEMOGLOBINArebeca moreliAún no hay calificaciones
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017De EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Aún no hay calificaciones
- BDSM Divina Insumisa PDFDocumento302 páginasBDSM Divina Insumisa PDFindra rosario0% (1)
- Existencialismo LatinoamericanoDocumento4 páginasExistencialismo LatinoamericanoFrancisco Fernando FrigeriAún no hay calificaciones
- Tarea 9,1 QuimicaDocumento8 páginasTarea 9,1 QuimicaJouZyAún no hay calificaciones
- Armado Luminaria Semi PPPDDDFFFDocumento1 páginaArmado Luminaria Semi PPPDDDFFFAnderson ChamorroAún no hay calificaciones
- Baldeon Jara PDFDocumento172 páginasBaldeon Jara PDFBETO EL CABROAún no hay calificaciones
- Actividad 1. Taller Teorico - Practico Sobre La Libertad de Culto y de Religion (Ajustado)Documento5 páginasActividad 1. Taller Teorico - Practico Sobre La Libertad de Culto y de Religion (Ajustado)Componente DocenteAún no hay calificaciones
- Estudio de Tiempos y MovimientosDocumento154 páginasEstudio de Tiempos y MovimientosOmarin Chávez CortezAún no hay calificaciones
- Subestaciones Eléctricas GilDocumento155 páginasSubestaciones Eléctricas Gilmoisesp_12100% (1)
- Laura Ges - Marketing de Afiliados para PrincipiantesDocumento38 páginasLaura Ges - Marketing de Afiliados para PrincipiantesrouyenAún no hay calificaciones
- La Prehistoria de La Sal La FactoriaDocumento34 páginasLa Prehistoria de La Sal La FactoriavdiazpardoAún no hay calificaciones
- Práctica 1 - Cifrado César A ConsolaDocumento4 páginasPráctica 1 - Cifrado César A Consolaroberto.martinez8198Aún no hay calificaciones
- El DescuentoDocumento7 páginasEl DescuentoMaria MartínAún no hay calificaciones
- Recomendaciones - Riesgo Público AXA COLPATRIADocumento3 páginasRecomendaciones - Riesgo Público AXA COLPATRIAJudith OliverosAún no hay calificaciones
- Documento 3. Estándares Basicos de Competencias..Documento184 páginasDocumento 3. Estándares Basicos de Competencias..diegoAún no hay calificaciones
- ACR Plus en Las Fallas Recurrentes de Un Motor - Ventilador Edgar Fuenmayor 2020Documento28 páginasACR Plus en Las Fallas Recurrentes de Un Motor - Ventilador Edgar Fuenmayor 2020Elvis DiazAún no hay calificaciones
- Competencia PerfectaDocumento25 páginasCompetencia PerfectaMarycielo Ortiz HidalgoAún no hay calificaciones
- Macroeconomia Fase 4 ColaborativoDocumento15 páginasMacroeconomia Fase 4 ColaborativonicolAún no hay calificaciones
- Modelo de Von NeumannDocumento4 páginasModelo de Von NeumannSmith RojasAún no hay calificaciones
- 7.equipos de Sonido y MultimediaDocumento54 páginas7.equipos de Sonido y MultimediaJose Ignacio Sanchez ArenasAún no hay calificaciones
- Alcance 06Documento2 páginasAlcance 06Ale CvAún no hay calificaciones
- Santa Maria EufrasiaDocumento6 páginasSanta Maria EufrasiaJackelynFlor1999Aún no hay calificaciones
- Manual Compresor KaeserDocumento122 páginasManual Compresor KaeserDavid G. Abad D'Orozco100% (2)
- Problemas MRUDocumento4 páginasProblemas MRUsegundomedioAún no hay calificaciones
- Planificación Estrategica Dirección de Educación PúblicaDocumento14 páginasPlanificación Estrategica Dirección de Educación PúblicaAny OsorioAún no hay calificaciones
- Pepitas de OroDocumento3 páginasPepitas de OroMaríaJoséAún no hay calificaciones
- CRUCIGRAMA DE LA HISTORIA - COMUNICACIÓN-convertido - docxRESUELTODocumento2 páginasCRUCIGRAMA DE LA HISTORIA - COMUNICACIÓN-convertido - docxRESUELTODayana SuárezAún no hay calificaciones
- Análisis de Objeto Técnico Del Cepillo DentalDocumento9 páginasAnálisis de Objeto Técnico Del Cepillo DentalIng. Gerardo Sánchez Nájera77% (13)
- Caso 01. Negocios InternacionalesDocumento2 páginasCaso 01. Negocios InternacionalesDaniela Midori Álvarez BringasAún no hay calificaciones
- Diseño de Circuitos Neumáticos y ElectroneumáticosDocumento42 páginasDiseño de Circuitos Neumáticos y ElectroneumáticosJuanjo MarengoAún no hay calificaciones
- Sesión 03 Proteínas y Ácidos NucleicosDocumento2 páginasSesión 03 Proteínas y Ácidos NucleicosCarmen ValeraAún no hay calificaciones