0% encontró este documento útil (0 votos)
41 vistas9 páginasDiabetes
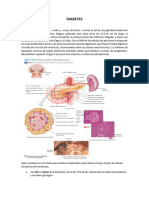
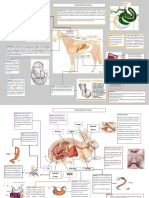
El documento habla sobre la diabetes. Explica que el páncreas secreta las hormonas insulina y glucagón, las cuales regulan los niveles de glucosa en la sangre. La insulina los reduce al ayudar a ingresar la glucosa a las células, mientras que el glucagón los aumenta. Una alteración en la producción de estas hormonas puede generar diabetes, la cual se caracteriza por hiperglicemia. Existen criterios para diagnosticar la diabetes como niveles altos de glucosa en ayunas o después de una prueba oral de glucosa
Cargado por
Alem GoróDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
41 vistas9 páginasDiabetes
El documento habla sobre la diabetes. Explica que el páncreas secreta las hormonas insulina y glucagón, las cuales regulan los niveles de glucosa en la sangre. La insulina los reduce al ayudar a ingresar la glucosa a las células, mientras que el glucagón los aumenta. Una alteración en la producción de estas hormonas puede generar diabetes, la cual se caracteriza por hiperglicemia. Existen criterios para diagnosticar la diabetes como niveles altos de glucosa en ayunas o después de una prueba oral de glucosa
Cargado por
Alem GoróDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd