Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Relación Estructura Química y Actividad Biológica23-2
Cargado por
Andrea CosíoTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Relación Estructura Química y Actividad Biológica23-2
Cargado por
Andrea CosíoCopyright:
Formatos disponibles
Farmacología General, Ejercicio Relación estructura química- actividad biológica 1
Relación estructura química y actividad biológica
1. Barbitúricos
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 2
Clasificación
Todos los barbitúricos son similares farmacológicamente y difieren sólo en la velocidad de comienzo y duración
de su acción (tabla 1).
Acción ultracorta Acción corta(+) (2-3 Acción media (3-6 Acción prolongada (6-12
(menos de 3 horas) horas) horas) horas)
Dosis tóxica: entre 5 y 10
Dosis tóxica:1 gr. Dosis tóxica: 3 gr. Dosis tóxica:2-3 gr.
gramos
• Barbital. Dosis tóxica 10
• Ciclobarbital • Amobarbital gramos
• Metohexital
• Pentobarbital • Aprobarbital • Fenobarbital. Dosis
• Tiopental
• Secobarbital (*) • Butabarbital (*) tóxica 5 gramos
• Mefobarbital
Muy liposolubles.
Distribución rápida
Liposolubilidad Liposolubilidad
por el SNC y Poco liposolubles
intermedia intermedia
posterior al resto de
tejidos Uso: Anticonvulsivantes
Uso: Hipnosedantes Uso: Hipnosedantes
Uso: Anestésicos
Tabla 1. Clasificación de los barbitúricos. Varias cadenas laterales influyen en la liposolubilidad, potencia y la
tasa de eliminación. La potencia de cada fármaco es función de la constante de ionización y del grado de
liposolubilidad. A mayor liposolubilidad (conlleva un predominio de metabolización hepática) mayor potencia y
a pH plasmático más bajo mayor entrada de la forma ionizada en el cerebro. Los barbitúricos de acción rápida
se manifiestan clínicamente a los 15-30 minutos, con un pico máximo a las 2-4 horas. Los de acción media y
prolongada pueden tardar entre 1-2 horas, con un pico a las 6-18 horas.
Farmacocinética
El ácido barbitúrico y sus derivados, son ácidos débiles, se obtienen por la combinación de urea y ácido
malónico. El compuesto carece de actividad depresora central, pero la presencia de grupos alquilo o arilo en la
posición 5 da lugar a otros compuestos con actividades sedantes e hipnóticas. Todos ellos se absorben
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 3
rápidamente en el tubo digestivo, excepto los de acción ultracorta. Su velocidad de absorción depende del pH
gástrico (a presencia de alimentos en el estómago disminuye la velocidad de absorción) e intestinal, del pKa del
barbitúrico (es alcalino, entre 7.2 y 8.5.) y del grado de solubilidad. Por la gran liposolubilidad de su forma no
ionizada atraviesan bien las membranas biológicas. Aparecen niveles en sangre y los primeros síntomas unos
30 minutos después de la ingestión y se alcanza su pico y efecto máximo a las 4 horas. La unión a proteínas
plasmáticas es alta, igual o superior al 50%, para los de acción ultracorta y corta. No está bien establecida para
los de acción media, y para los de acción prolongada es igual o inferior al 50%.
El volumen de distribución aparente (Vd) oscila entre 0,6 l/kg para el fenobarbital y 2,6 l/kg para el tiopental. El
tiempo de semivida (t1/2) se afecta por las dosis tóxicas, debido a la inducción enzimática producida. La
eliminación depende del grado de liposolubilidad. Los de acción corta (muy liposolubles) se metabolizan en el
hígado induciendo al sistema microsomal P450 (oxidación) y la conjugación mediante glucoronización, antes
de ser excretados por el riñón. Los de acción prolongada como el fenobarbital (poco liposolubles) son excretados
por la orina sin grandes modificaciones, incrementándose su eliminación con la alcalinización urinaria.
Tipos de barbitúricos
Amobarbital
Comúnmente conocido como “amital sódico” o “pentotal sódico”, este barbitúrico es el que se ganó la reputación
de ser el suero de verdad. Si bien en realidad no obliga a las personas a decir la verdad, el amobarbital
puede desacelerar el sistema nervioso central de modo que la concentración se vuelve más difícil. La
teoría era que alguien hacía una pregunta mientras que, bajo la influencia de amobarbital, sería menos probable
que pensara en una respuesta falsa, lo que requiere más atención que simplemente decir la verdad.
Butalbital
Este barbitúrico de acción corta se usa con frecuencia para tratar los dolores de cabeza por migraña, a
menudo en combinación con paracetamol, aspirina y cafeína. También se ha usado como sedante y
anestésico.
Fenobarbital
Este barbitúrico se utilizó para tratar las convulsiones en niños, debido a su función anticonvulsiva. También se
ha usado para tratar la ansiedad, la abstinencia de drogas (particularmente de otros barbitúricos) y como una
ayuda para dormir.
Secobarbital
Comercializado en EE. UU. Como Seconal a partir de 1934, este fármaco se recetó durante muchos años para
combatir el insomnio. Es la droga más usada en suicidios asistidos por médicos en ese país.
Pentobarbital
Utilizado como anestésico en animales, este medicamento utilizó en el pasado para tratar ataques y
convulsiones. También tiene la dudosa distinción de ser una de las drogas preferidas para las ejecuciones de
presos en los Estados Unidos.
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 4
2. Sulfas
Relación estructura-actividad
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 5
¿Qué se modifica de la zona farmacofórica que hace que se cambie el efecto farmacológico?
Antibacterianos
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 6
La síntesis de un gran número de análogos de sulfonamida llevó a las siguientes conclusiones:
• El grupo amino en la posición para es esencial para la actividad y no debe ser sustituido, siendo por tanto
R1=H. La única excepción es cuando R1=acilo (amidas). Las amidas por sí mismas son inactivas pero pueden
ser metabolizadas en el organismo para dar lugar al compuesto activo. Las amidas, por tanto, pueden ser
usadas como profármacos de sulfonamidas.
• El anillo aromático y el grupo funcional sulfonamida son indispensables.
• El anillo aromático debe estar sustituido únicamente en posición para.
• El nitrógeno de la sulfonamida debe ser primario o secundario.
• R2 es la única posición posible que puede variar en las sulfonamidas.
Análogos de sulfonamidas R2 suele variar incorporando una gran variedad de heterociclos o estructuras
aromáticas, que afectan a la medida en la que el fármaco se une a las proteínas plasmáticas. Esto a cambio
controla los niveles sanguíneos y la vida media del fármaco. Por lo tanto, un fármaco que se une fuertemente a
proteínas plasmáticas será liberado lentamente en el torrente sanguíneo y por lo tanto permanecerá más tiempo
en él. Modificando R2 se puede variar también la solubilidad de las sulfonamidas. Es por ello que variaciones
en R2 afectan más a su farmacocinética que a su mecanismo de acción.
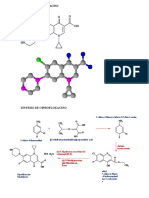
3. Quinolonas
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 7
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 8
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 9
4. Naproxeno
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 10
Derivados
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 11
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 12
5. Talidomida
COMPUESTOS QUIRALES
https://www.textoscientificos.com/quimica/quirales
La química orgánica, se basa en la relación entre estructura molecular y propiedades.
La estereoquímica (del griego stereos, sólido) es la parte de la química que se ocupa del de las estructuras en
tres dimensiones. Estudia la disposición espacial de los átomos que componen las distintas moléculas y como
afecta esta disposición a las propiedades y reactividad de dichas moléculas.
Un aspecto de la estereoquímica es la estereoisomería. Los isómeros son compuestos diferentes que tienen la
misma fórmula molecular. Es decir poseen la misma proporción de átomos que los conforman, pero presentan
estructuras moleculares diferentes.
La clase particular de isómeros que sólo se diferencian por la orientación espacial de sus átomos (pero que son
iguales entre sí en cuanto a qué átomos están unidos a cuáles otros) se llama estereoisómeros.
La existencia de tales isómeros nos proporciona una de nuestras medios más importantes para la exploración
de mecanismos de reacciones químicas; muy a menudo, se selecciona una de estos isómeros para un estudio,
no porque sea diferente de los compuestos ordinarios en su química tridimensional, sino porque puede revelar
lo que las sustancias corrientes ocultan y, nuevamente, a pesar de su gran semejanza, un isómero de tal pareja
puede servir de alimento nutriente, como antibiótico o como un poderoso estimulante cardiaco, mientras que el
otro puede ser inútil.
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 13
Actividad óptica, Luz polarizada
La luz posee ciertas propiedades que se comprenden mejor si se considera como un fenómeno ondulatorio,
cuyas vibraciones son perpendiculares a la dirección de su desplazamiento. Hay un número infinito de planos
que pasan por la línea de propagación y la luz ordinaria vibra en todos estos planos. Consideremos que se está
mirando de frente una linterna, todas ellas perpendiculares a una línea entre nuestros ojos y el papel (linterna).
La luz polarizada en un plano es luz cuyas vibraciones ocurren en uno solo de sus planos posibles. La luz
ordinaria se convierte en polarizada haciéndola pasar a través de una lente hecha del material conocido como
Polaroid o, más tradicional, por trozos de calcita (una forma cristalina particular del CaCO3), dispuestos de
forma que constituyen lo que se conoce como un prisma de Nicol.
Una sustancia ópticamente activa es la que rota el plano de la luz polarizada. Cuando se hace pasar luz
polarizada, vibrando en un plano determinado, por una sustancia ópticamente activa, emerge vibrando en un
plano diferente. Esta propiedad es medida por medio de un polarímetro.
Enantiomería
La actividad óptica fue descubierta en 1815 por el físico Jean-Baptiste Biot.
En 1848, el químico Louis Pasteur mientras estaba realizando un trabajo sobre sales del ácido tartárico, observó
que, el tartrato de sodio y amonio, ópticamente inactivo, existía como una mezcla de dos clases diferentes de
cristales que eran imágenes especulares entre sí. Separó la mezcla cuidadosamente en dos montones uno de
cristales derechos y el otro de izquierdos.
La mezcla original era ópticamente inactiva; sin embargo, cada grupo de cristales por separado era ópticamente
activo. Además, las rotaciones específicas de ambas soluciones eran iguales, pero de signo contrario; es decir,
una solución rotaba la luz polarizada en un plano hacia la derecha y, la otra, un número igual de grados hacia
la izquierda. En todas las demás propiedades, ambas sustancias eran idénticas.
Moléculas Quirales
Los isómeros que son imágenes especulares (una es la imagen en el espejo de la otra) se llaman enantiómeros.
Estas moléculas no son superponibles con sus imágenes especulares; es decir, son quirales.
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 14
Los enantiómeros tienen propiedades físicas idénticas, excepto por la dirección en la que desvían la luz
polarizada. Un ejemplo, son los 2-metil-1-butanoles, éstos tienen idénticos puntos de fusión y ebullición,
densidades, etc. pero uno rota la luz polarizada en un plano a la derecha, y el otro, a la izquierda.
Las propiedades químicas de los enantiómeros también son idénticas, excepto cuando se hacen reaccionar con
compuestos ópticamente activos. Si se comparan las velocidades de reacción de los dos enantiómeros estas
son iguales; sin embargo, muchas veces los productos que se forman no son idénticos, sino que son
enantiómeros entre sí.
Fármacos Quirales
Las moléculas quirales tienen un sin fin de aplicaciones, principalmente dentro de la bioquímica. En la industria
farmacéutica la mayoría de los medicamentos se basan en este tipo de moléculas, donde la mayoría de las
medicinas se componen de mezclas racémicas, es decir mezclas de enantiómeros en igual proporción.
Por otro lado esto puede llegar a ser un problema ya que mientras que un enantiómero puede tener un efecto
benéfico en el organismo, la otra forma enantiomérica puede ser dañina o simplemente no causar efecto alguno.
Debido a este problema la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) ha propuesto
y exigido a todos los fabricantes de medicamentos realizar investigaciones sobre las propiedades de cada
enantiómero a ser usados en las drogas que existen en el mercado. De esta forma solo se podrán comerciar
medicamentos que contengan un solo enantiómero con lo que se desea reducir los efectos secundarios
causados por los medicamentos.
Un ejemplo se puede observar en la dexenfluramina (1), es un medicamento anti-obesidad el cual fue aprobado
en 1996 que presenta varia ventajas en comparación a la mezcla racémica de la cual proviene entre ellas la
reducción de los efectos secundarios.
Anteriormente la mayoría de los fármacos sintéticos no eran quirales, sin embargo las que se derivan de
productos naturales los son por ejemplo la penicilina. Considerando que en la producción de medicamentos se
busca la mayor efectividad posible es necesario aplicar procesos más complejos. Una prueba de esto sería el
hecho de que actualmente se requieren más de doce pasos para la síntesis de un medicamento a base de
compuestos orgánicos, mientras que años atrás seis eran suficientes.
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 15
Los medicamentos, constituidos de un sólo isómero actúan de una manera mucho más específica en
comparación a las mezcla racémicas de la que provienen. Además, los avances tecnológicos contribuyen a que
la separación de enantiómeros sea una opción factible
Hay principalmente tres opciones para la obtención de enantiómeros simple:
Obtención a partir de fuentes naturales
El primero y el más simple consiste en obtener los enantiómeros a partir de fuentes naturales, ya sea de
microorganismos, plantas o animales. Un ejemplo es el Taxol, que es una droga anti - cáncer y que se obtiene
de un árbol. La complejidad estructural de ésta molécula hace que la síntesis química sea impráctica para la
fabricación de medicamentos a nivel industrial. Sin embargo, es posible unir una cadena sintética que contenga
el agente activo del Taxol a otro compuesto más abundante en la fuente de la que se obtiene, en este caso al
Baccatin III.
Taxol
Obtención a partir de mezclas racémicas
Las mezclas racémicas son fáciles de hacer y existen muchas maneras de separarlas en enantiómeros. La
resolución clásica utiliza un ácido o base quiral que forma una sal con la mezcla racémica.
Naproxeno
Muchos medicamentos son hechos de ésta forma. El Naproxeno, por ejemplo, se obtiene usando una
alcaliglucamina como agente de resolución.
Los dos métodos presentados anteriormente requieren cantidades estequiométricas de otro agente, pero el
método de resolución se puede realizar directamente por medio de métodos físicos.
Otras separaciones físicas similares pueden ser realizadas por sistemas de extracción o de membranas, en las
que una fase contiene la muestra racémica y la otra contiene un selector quiral, el cual extrae uno de los
enantiómeros.
Las resolución puede ser efectuada mediante la conversión de uno de los dos enantiómeros en otro compuesto,
este proceso se conoce como resolución cinética. En este tipo de resoluciones generalmente se utilizan
reagentes quirales o catalizadores, aunque en el caso de medicamentos esto no es muy funcional.
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 16
Métodos asimétricos
La forma más usual de síntesis asimétrica se hace tomando un sustrato planar (sin elementos quirales y se
transforma vía asimétrica en un compuesto quiral. Esto tiene la ventaja de que todo el material puede ser
transformado directamente al enantiómero requerido.
Un ejemplo de este método es la hidrogenación asimétrica utilizada con Difosfito de Rodio como catalizador
para elaborar el Levodopa que es un medicamento utilizado para tratar el mal de Parkinson.
Levodopa
La mayoría de las reacciones asimétricas son reducciones, oxidaciones o otro tipo de reacciones en las que se
forman enlaces, ya sea por medios catalíticos o estequiométricos.
La fabricación de medicamentos a base de un sólo enantiómero constituye un avance muy importante en lo que
a salud respecta. En un futuro cercano todos los medicamentos serán producidos de ésta forma. Más aún esta
filosofía se extenderá a otras áreas de la química igualmente importantes como la producción de herbicidas,
por ejemplo.
LA QUIRALIDAD EN LOS MEDICAMENTOS
Introducción:
Etanol (C2H5OH) y éter dimetílico (CH3OCH3) son isómeros: compuestos diferentes que tienen la misma formula
molecular; en este caso: C2H6O.
Se denominan isómeros constitucionales a aquellos isómeros que difieren en el orden de conectividad de sus
átomos, es decir, tienen diferente estructura. Por ejemplo:
(Fórmula molecular: C3H8O)
Los estereoisómeros son isómeros que difieren sólo en el arreglo espacial de sus átomos. No son
constitucionales porque sus átomos están conectados en el mismo orden; sólo difieren en la orientación de
éstos en el espacio.
Se dividen en dos categorías generales:
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 17
Enantiómeros, que son estereoisómeros cuyas moléculas son imágenes de espejo entre sí, pero éstas no
pueden ser sobrepuestas una en la otra por lo que no coinciden en todas sus partes.
Diasterómeros, que son estereoisómeros que no son imágenes de espejo entre sí.
Un ejemplo claro de lo que son enantiómeros son las manos: la mano derecha es la imagen de espejo de la
mano izquierda:
Al tratar de sobreponer una en la otra (en el mismo plano) observamos que no es posible lograr que ambas
coincidan en todas sus partes. Por eso son dos manos y no la misma repetida dos veces:
Un objeto que no se puede sobreponer a su imágen de espejo se denomina quiral. Si el objeto y su imágen de
espejo pueden hacerse coincidir e todas sus partes, entonces ese objeto es aquiral (no quiral).
La quiralidad en los objetos se debe a que éstos carecen de un plano o un punto de simetría (son asimétricos).
Esta característica es la responsable de que las imágenes de espejo no sean idénticas ni puedan sobreponerse
una en la otra.
Los enantiómeros ocurren en aquellas moléculas que son quirales.
Un distintivo estructural que podrían poseer las moléculas quirales es el siguiente: un carbono tetrahedal que
enlaza cuatro átomos o grupos diferentes entre sí. Este carbono recibe el nombre de carbono
asimétrico o carbono quiral o carbono estereogénico. Una molécula que posea un sólo carbono quiral existe
como un par de enantiómeros; si posee más de un carbono quiral, entonces podría existir en varios pares de
enantiómeros, que serían disterómeros entre sí.
La configuración es el arreglo u orientación espacial de los átomos enlazados al carbono quiral. Esta
configuración se determina aplicando las reglas de secuencia de Cahn, Ingold y Prelog y se denomina con las
letras R o S. De esa forma se puede distinguir entre los dos enantiómeros.Por ejemplo:
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 18
La mezcla en partes iguales de dos enantiómeros se conoce como mezcla racémica o racemato.
Los enantiómeros tienen las mismas propiedades físicas, excepto por la dirección de rotación de luz
polarizada en un plano (rotación específica): uno gira ese plano hacia la derecha, se denomina dextrorotatorio,
y se designa (+), el otro, levorotatorio, gira el plano hacia la izquierda y se designa (-). La rotación específica y
la configuración son propiedades independientes entre sí.
En cuanto a propiedades químicas, los enantiómeros sólo difieren en la rapidez con que reaccionan con un
compuesto quiral.
Medicamentos Quirales:
Muchos de los medicamentos son quirales y se expenden como mezclas racémicas o como un sólo
enantiómero. En la actualidad, hay una gran tendencia en la industria de los medicamentos de producir lo que
se conoce como "canjes racémicos" (racemic switches): drogas quirales ya aprobadas como racematos, pero
que se están re-desarrollando como un sólo enantiómero. La idea detrás de estos "canjes racémicos" se basa
en lo siguiente: los enantiómeros exhiben comportamientos distintos cuando se someten a un ambiente quiral.
Por ejemplo, el cuerpo humano es un ambiente quiral, por lo que debe producirse una diferenciación entre los
enantiómeros. Esta discriminación entre enantiómeros - o reconocimiento quiral- depende del grado de
interacción que exhibe cada enantiómero con el lugar de enlace quiral del cuerpo. Por ejemplo, en la siguiente
figura el reconocimiento quiral descansa en la ausencia de la conección D-D conjuntamente con las otras dos
interacciones.
También, el reconocimiento quiral puede incluir interacciones con ciertas estructuras aquirales que poseen
lados o ligandos estereoquimicamente no equivalentes (heterotópicos). Por ejemplo, etanol es aquiral, pero
los hidrógenos denominados HR y HS son heterotópicos. Estos se denominan enantiotópicos si el remplazo de
uno u otro con un ligando diferente da el uno o el otro de un par de enantiómeros (el R o el S). El carbono se
denomina proquiral porque el remplazo de uno de esos dos hidrógenos lo convierte en un carbono quiral o
estereogénico. El hidrógeno HR es, entonces, pro-R , y el HS es pro-S:
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 19
En la catálisis enzimática oxidativa de etanol para formar acetaldehído, sólo se elimina el H R. En este caso, el
reconocimiento quiral depende de la enzima que discrimina entre los dos hidrógenos:
Por otro lado, las moléculas planas pueden poseer lados o caras estereoquimicamente no equivalentes (caras
heterotópicas). Por ejemplo, el ataque de HCN al acetaldehído puede ocurrir por cualquiera de sus dos caras
heterotópicas. Esto produce la mezcla racémica de la cianohidrina de acetaldehído.
Si se usa un catalítico quiral especial que favorezca el ataque a una cara sobre la otra, la discriminación
conduciría a la formación de uno de los dos enantiómeros.
Unicidad de los enantiómeros:
Se conoce que los medicamentos se unen en lugares específicos por medio de unos enlaces tridimensionales
caraterísticos, de la misma manera que una llave se ajusta en lugares específicos en una cerradura para abrirla.
El medicamento adecuado es la "llave" que puede ajustarse a "cerradura" receptora para generar la respuesta
biológica deseada. En algunas instancias, dos "llaves" con pocas diferencias entre ellas pueden encajar en la
misma cerradura, pero sólo una de ellas puede "abrir la puerta".
Frecuentemente los medicamentos racémicos contienen la actividad terapéutica en uno de los dos
enantiómeros. Este es el que se pega al receptor y desencadena la respuesta adecuada; este es el agonista.
El antagonista, se ajusta al mismo receptor pero no provoca la respuesta deseada, aunque podría tener otra
actividad terapéutica, o efectos indeseables o simplemente ser farmacologicamente inerte.Así, por ejemplo:
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 20
Propanolol es un agente antiarrítmico: reduce el ritmo cardíaco así como las fuerzas contráctiles del corazón.
Se ha demostrado que sólo el S-(-)-propanolol es efectivo para el tratamiento de angina. De hecho, es 100
veces más potente que el isómero R-(+):
Ibuprofén: es un fármao antiinflamatorio no-esteroidal (NSAID, por sus siglas en inglés) que presenta actividad
terapéutica sólo en el isómero S-(+). Los estudios sugieren que este isómero alcanza los niveles terapéuticos
en la sangre en unos 12 minutos, comparado con los 30 minutos que tarda el racemato. El isómero R-(-) se
convierte ezimáticamente en el S-(+).
Metadona: el isómero R(+), conocido como levadona, usualmente se prescribe para tratar casos de daño severo
en el hígado. La mezcla racémica se usa para el tratamiento de pacientes en el programa de desintoxicación
de drogas adictivas.
Anfetamina: tanto la mezcla racémica como el isómero S(+), conocido como dexedrina, se prescriben como
supresores del apetito. La dexedrina es de 3 a 4 veces más potente que el isómero R-(-).
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 21
L-Dopa: se prescribe para tratar le mal de Parkinson. Originalmente se administraba la mezcla racémica, la
cual adolecía de serios efectos secundarios, como la granulocitopenia (reducción de glóbulos
blancos).Actualmente se mercadea como el isómero S-(-), que no presenta los problemas del racemato. De
aquí que los efectos negativos se pueden atribuir al isómero R-(+).
L-Metildopa: sólo el isómero S-(-) es efectivo para tratar la hipertensión. El isómero R-(+) contribuye a serios
efectos secundarios.
Naproxén: sólo el isómero S-(-) es seguro para el consumo humano como antiinflamatorio (NSAID) ya que el
R es una toxina del hígado. Como dato interesante, el medicamento es la sal de sodio (Naproxén sodio) que
es levorotatoria. El ácido libre, su precursor, es dextrorotatorio. Sin embargo, tanto la sal como el ácido tiene
la misma configuración: S.
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
Farmacología General, Ejercicio Relación estructura química- actividad biológica 22
Algunos medicamentos quirales poseen actividad terapéutica diferente en cada enantiómero, es decir, se
prescriben para tratar diferentes condiciones. Por ejemplo:
Tiroxina: S-(-) tiroxina es una hormona natural de la tiroides que se usa para el tratamiento de esa glándula.
La R-(+) tiroxina se prescribe para reducir los niveles de colesterol seroso.
Propoxifeno: los enantiómeros se venden con diferente propósito: dextropropoxifeno como analgésico y
levopropoxifeno como antitusivo.
MenFC Ma. Eugenia R. Posada Galarza Documento de trabajo
También podría gustarte
- Infografía RMNDocumento1 páginaInfografía RMNEliana Rocio Moya Bare�oAún no hay calificaciones
- Rea AntibioticosDocumento4 páginasRea AntibioticosNiinosk Páiz100% (1)
- Ósmosis y difusión a través de membranas biológicasDocumento5 páginasÓsmosis y difusión a través de membranas biológicasElizabeth Ramírez NietoAún no hay calificaciones
- Bpa - 5 OkDocumento44 páginasBpa - 5 Okjudederrycash555Aún no hay calificaciones
- Guía de Evaluación de Medicamentos HerbolariosDocumento38 páginasGuía de Evaluación de Medicamentos HerbolariosÁngel MagdalenoAún no hay calificaciones
- Manual Quimica OrganicaDocumento62 páginasManual Quimica OrganicaBrenda SottileAún no hay calificaciones
- Proceso FarmacocinéticoDocumento16 páginasProceso FarmacocinéticoCorina Edith Guerra TutivenAún no hay calificaciones
- Interpretacion Espectros RMN 1HDocumento27 páginasInterpretacion Espectros RMN 1HOtilia Acha de la CruzAún no hay calificaciones
- Realizar pruebas bioquímicas bacteriasDocumento3 páginasRealizar pruebas bioquímicas bacteriasSaraliAún no hay calificaciones
- Informe No 6Documento6 páginasInforme No 6LV HeribertoAún no hay calificaciones
- IbuprofenoDocumento6 páginasIbuprofenoMarcelo Muñoz VegaAún no hay calificaciones
- Pruebas Bioquimicas Secundarias Actualizado XDDocumento5 páginasPruebas Bioquimicas Secundarias Actualizado XDAngel FloresAún no hay calificaciones
- Trabajo de Farmacologia CiprofloxacinoDocumento7 páginasTrabajo de Farmacologia CiprofloxacinoNorma Núñez RojasAún no hay calificaciones
- Previo 2 Manejo, Sexado, Marcado, Distribución y Vias de Administración en Animales de LaboratorioDocumento6 páginasPrevio 2 Manejo, Sexado, Marcado, Distribución y Vias de Administración en Animales de LaboratorioWaldo Moreno DanielAún no hay calificaciones
- Respuesta Innata - InmunologiaDocumento57 páginasRespuesta Innata - InmunologiaJessica CarriónAún no hay calificaciones
- Tema 8: Módulo 2. EspectrosDocumento52 páginasTema 8: Módulo 2. EspectrosAriana NoeliaAún no hay calificaciones
- ANTECEDENTES PRACTICA 1. LQO III. Valdez-FernandoDocumento7 páginasANTECEDENTES PRACTICA 1. LQO III. Valdez-FernandoFernando ValdezAún no hay calificaciones
- Guia Laboratorio Sfmp-I-2 1Documento127 páginasGuia Laboratorio Sfmp-I-2 1Yamilet MenfozaAún no hay calificaciones
- Monografia Nitrofurazona (3415)Documento17 páginasMonografia Nitrofurazona (3415)SusanaRamírezAparicio100% (1)
- Ejercicios RMN 1H y 13C: Guía prácticaDocumento29 páginasEjercicios RMN 1H y 13C: Guía prácticaHanns GomezAún no hay calificaciones
- Previo 4 Farmacologia GeneralDocumento6 páginasPrevio 4 Farmacologia GeneralletyssAún no hay calificaciones
- Informe Final Medios de Cultivo Ambientes y SuperficiesDocumento18 páginasInforme Final Medios de Cultivo Ambientes y SuperficiesDaniela Basto CastroAún no hay calificaciones
- Soluciones parenterales: equipos 4 y 5Documento66 páginasSoluciones parenterales: equipos 4 y 5LEON MOYA MARIA ALINARYAún no hay calificaciones
- INMUNOFARMACOLOGÍADocumento57 páginasINMUNOFARMACOLOGÍAanhyelyAún no hay calificaciones
- Pruebas microbiológicas para identificación bacterianaDocumento6 páginasPruebas microbiológicas para identificación bacterianaAna Karen Patiño SimbrónAún no hay calificaciones
- Normas de Seguridad en El LaboratorioDocumento4 páginasNormas de Seguridad en El LaboratorioCarolinaFernandezAún no hay calificaciones
- Ramírez Morales Tarea RAMDocumento7 páginasRamírez Morales Tarea RAMErick RMAún no hay calificaciones
- Practica 9 CarbohidratosDocumento4 páginasPractica 9 CarbohidratosRuben GonzálezAún no hay calificaciones
- Practica 5. Parte 2Documento3 páginasPractica 5. Parte 2Zyanya TapiaAún no hay calificaciones
- Cuestionario Previo Analitica Practica 6Documento3 páginasCuestionario Previo Analitica Practica 6Sandra PlumaAún no hay calificaciones
- Características de Un BioterioDocumento3 páginasCaracterísticas de Un BioterioMartin Galicia CortesAún no hay calificaciones
- Aldehidos y CetonasDocumento10 páginasAldehidos y CetonasFaniAún no hay calificaciones
- Actividad enzimática PPO pera pH óptimo 7 Km 11.23Documento7 páginasActividad enzimática PPO pera pH óptimo 7 Km 11.23Daniel Esteban Leal TrivinhoAún no hay calificaciones
- Técnicas de SembradoDocumento9 páginasTécnicas de SembradoNoe JonatanAún no hay calificaciones
- Tema 19Documento12 páginasTema 19SonsolesAún no hay calificaciones
- Buenas Practicas de DispensaciónDocumento20 páginasBuenas Practicas de DispensaciónfakiplAún no hay calificaciones
- Biofarmacia Programa DocenteDocumento14 páginasBiofarmacia Programa DocenteProf. Víctor M. VitoriaAún no hay calificaciones
- Formato Reporte - 2022-IDocumento8 páginasFormato Reporte - 2022-IRodolfo TovarAún no hay calificaciones
- Análisis ClínicoDocumento14 páginasAnálisis ClínicoHans Ayllon ChambergoAún no hay calificaciones
- Bitácoras 12 y 13Documento12 páginasBitácoras 12 y 13Athenas A.PAún no hay calificaciones
- Reporte - Práctica 1. Posología.Documento17 páginasReporte - Práctica 1. Posología.Ariadna Janeth Cruz CuandonAún no hay calificaciones
- Técnica de MicrocultivoDocumento3 páginasTécnica de Microcultivocistian david gaona mateusAún no hay calificaciones
- Fitoquimica 4 Ruta de PoliacetatosDocumento19 páginasFitoquimica 4 Ruta de PoliacetatosHospicios RafaAún no hay calificaciones
- Quimica OrganicaDocumento111 páginasQuimica OrganicaMarisol Jasso BautistaAún no hay calificaciones
- Ácido Bencílico 1Documento4 páginasÁcido Bencílico 1Sarai VargasAún no hay calificaciones
- Farmacologia 3Documento34 páginasFarmacologia 3Shirley Ulloa100% (1)
- Semana 1 Introduccion A La Biof-Fcocin. BF - FKDocumento30 páginasSemana 1 Introduccion A La Biof-Fcocin. BF - FKricardo100% (1)
- Q.farmaceutica Ucam Tema 1Documento135 páginasQ.farmaceutica Ucam Tema 1Ismael YCAún no hay calificaciones
- Sintesis de Propranolol PDFDocumento14 páginasSintesis de Propranolol PDFMartín PaucarAún no hay calificaciones
- Citocromo p450 2018-2Documento29 páginasCitocromo p450 2018-2PAULA NIETOAún no hay calificaciones
- MANUAL DE GENETICA PMC ELEAZAR SERRANO PDFDocumento37 páginasMANUAL DE GENETICA PMC ELEAZAR SERRANO PDFJhonatan Santos Martínez0% (1)
- Introduccion A La InmunologíaDocumento13 páginasIntroduccion A La Inmunología.:("*"BLacK BuLLeT"*"):.100% (1)
- BIOQUIMICA Previo 10Documento2 páginasBIOQUIMICA Previo 10Fernando Sanchez FuerteAún no hay calificaciones
- NitrofurantoinaDocumento4 páginasNitrofurantoinaSo MI100% (1)
- Natural Ez A Quim I Cade Lasd RogasDocumento8 páginasNatural Ez A Quim I Cade Lasd Rogasdiego fernando lobo moncadaAún no hay calificaciones
- Farmacos Como Mezclas RacemicasDocumento43 páginasFarmacos Como Mezclas RacemicasIrvin Ramirez SalazarAún no hay calificaciones
- CLASE 2 - Conceptos Generales 2022Documento33 páginasCLASE 2 - Conceptos Generales 2022Andres peñaAún no hay calificaciones
- Factores respuesta farmacológicaDocumento4 páginasFactores respuesta farmacológicakaren perez100% (1)
- Lorazepam rCABDocumento3 páginasLorazepam rCABMarcela OlarteAún no hay calificaciones
- FARMACOLOGÍA EXPOSICIÓN DE YADIRA ANDRADE PÉREZ 3er Cuatrimestre EnfermeríaDocumento38 páginasFARMACOLOGÍA EXPOSICIÓN DE YADIRA ANDRADE PÉREZ 3er Cuatrimestre EnfermeríaYadi Andrade PerezAún no hay calificaciones
- FHyC_RP#5Documento14 páginasFHyC_RP#5Andrea CosíoAún no hay calificaciones
- _Equipo#3_AndreaGloria_P8Documento3 páginas_Equipo#3_AndreaGloria_P8Andrea CosíoAún no hay calificaciones
- P3 Gloria Cosío Andrea Eq1Documento4 páginasP3 Gloria Cosío Andrea Eq1Andrea CosíoAún no hay calificaciones
- Equipo#3_Andrea Gloria_P5Documento3 páginasEquipo#3_Andrea Gloria_P5Andrea CosíoAún no hay calificaciones
- 1.1 Margen de Seguridad de Los Fármacos. EjercicioDocumento4 páginas1.1 Margen de Seguridad de Los Fármacos. EjercicioAndrea CosíoAún no hay calificaciones
- Eq1 P1 GLORIA COSIO ANDREADocumento5 páginasEq1 P1 GLORIA COSIO ANDREAAndrea CosíoAún no hay calificaciones
- Crucigrama Prop de FármacosEjercicioFarmacología - Gral21-2 - AlumnosDocumento3 páginasCrucigrama Prop de FármacosEjercicioFarmacología - Gral21-2 - AlumnosAndrea CosíoAún no hay calificaciones
- Reporte - 1.pdf (1) FARMADocumento22 páginasReporte - 1.pdf (1) FARMAAndrea CosíoAún no hay calificaciones
- Bicentennial ManDocumento3 páginasBicentennial ManAndrea CosíoAún no hay calificaciones
- Práctica No.1 SolubilidadDocumento17 páginasPráctica No.1 SolubilidadAndrea CosíoAún no hay calificaciones
- Tarea FG IntroducciónDocumento1 páginaTarea FG IntroducciónAndrea CosíoAún no hay calificaciones
- Eq1 P1 GLORIA COSIO ANDREADocumento5 páginasEq1 P1 GLORIA COSIO ANDREAAndrea CosíoAún no hay calificaciones
- Reporte Identificación de Compuesto OrgánicoDocumento6 páginasReporte Identificación de Compuesto OrgánicoAndrea CosíoAún no hay calificaciones
- Docsity Posologia de Farmacos en Ratas WistarDocumento21 páginasDocsity Posologia de Farmacos en Ratas WistarAndrea CosíoAún no hay calificaciones
- Relación Estructura Química y Actividad Biológica23-2Documento22 páginasRelación Estructura Química y Actividad Biológica23-2Andrea CosíoAún no hay calificaciones
- Previo 2Documento10 páginasPrevio 2Andrea CosíoAún no hay calificaciones
- Eq1 - P2 - Gloria Cosio AndreaDocumento7 páginasEq1 - P2 - Gloria Cosio AndreaAndrea CosíoAún no hay calificaciones
- RecristalizaciónDocumento12 páginasRecristalizaciónAndrea CosíoAún no hay calificaciones
- P3 Gloria Cosio AndreaDocumento5 páginasP3 Gloria Cosio AndreaAndrea CosíoAún no hay calificaciones
- Reporte de ExtracciónDocumento12 páginasReporte de ExtracciónAndrea CosíoAún no hay calificaciones
- Previo 2Documento10 páginasPrevio 2Andrea CosíoAún no hay calificaciones
- Previo#1 - Anatomía y FisiologiaDocumento25 páginasPrevio#1 - Anatomía y FisiologiaAndrea CosíoAún no hay calificaciones
- P4 Gloria Cosio AndreaDocumento13 páginasP4 Gloria Cosio AndreaAndrea CosíoAún no hay calificaciones
- Previo 2Documento10 páginasPrevio 2Andrea CosíoAún no hay calificaciones
- Reporte de ExtracciónDocumento12 páginasReporte de ExtracciónAndrea CosíoAún no hay calificaciones
- Punto de FusiónDocumento6 páginasPunto de FusiónAndrea CosíoAún no hay calificaciones
- Ejercicios GranulometriaDocumento5 páginasEjercicios GranulometriaAnonymous OsyZ4eLAún no hay calificaciones
- RecristalizaciónDocumento12 páginasRecristalizaciónAndrea CosíoAún no hay calificaciones
- Punto de FusiónDocumento6 páginasPunto de FusiónAndrea CosíoAún no hay calificaciones
- Analisis Instrumental II ExpoDocumento36 páginasAnalisis Instrumental II ExpoNüzhet TrejoAún no hay calificaciones
- Manual Sistesis de Compuestos HeterociclicosDocumento61 páginasManual Sistesis de Compuestos HeterociclicosJose Antonio Martinez MorenoAún no hay calificaciones
- 06 - 2996 Crema y Shampoo de Aceite de ZapuyulDocumento89 páginas06 - 2996 Crema y Shampoo de Aceite de ZapuyulNicolle Hernández0% (1)
- Interacción de Energía Radiante Con La MateriaDocumento2 páginasInteracción de Energía Radiante Con La MateriaRoxana100% (1)
- Determinacion de Azucares Por PolarimetriaDocumento22 páginasDeterminacion de Azucares Por Polarimetriafacundo AlvarezAún no hay calificaciones
- Anexo 5 Rotacion Optica ESDocumento3 páginasAnexo 5 Rotacion Optica ESCristhian RangelAún no hay calificaciones
- Refractometria en Bebida Aoholica-Polarimetria en AzucarDocumento8 páginasRefractometria en Bebida Aoholica-Polarimetria en AzucarJuanjo RamAún no hay calificaciones
- Fisica BiologicaDocumento18 páginasFisica BiologicaMacarena BaigorriaAún no hay calificaciones
- Hidratos de Carbono en Los Alimentos (HC 1)Documento12 páginasHidratos de Carbono en Los Alimentos (HC 1)Sergio Guzman KunstmannAún no hay calificaciones
- POLARIMETRIADocumento20 páginasPOLARIMETRIAJhoselin Haro SebastianAún no hay calificaciones
- Análisis de AlimentosDocumento27 páginasAnálisis de AlimentosZY AlexAún no hay calificaciones
- Presentación de EsteroquímicaDocumento45 páginasPresentación de EsteroquímicahalicesAún no hay calificaciones
- CLORURO DE TRANS-DICLOROBIS(ETILENDIAMIN)COBALTODocumento8 páginasCLORURO DE TRANS-DICLOROBIS(ETILENDIAMIN)COBALTOIoskani EstradaAún no hay calificaciones
- Isomeria Capitulo 3Documento46 páginasIsomeria Capitulo 3Elizabeth Eizaga Laguna0% (1)
- Teórico ESTEREOISOMERÍA 2016Documento46 páginasTeórico ESTEREOISOMERÍA 2016Andrés Forero MaestreAún no hay calificaciones
- Articulo Inversión de Sacarosa Final PDFDocumento11 páginasArticulo Inversión de Sacarosa Final PDFLourdes ArdónAún no hay calificaciones
- 6.reporte Glucosa en Suero OralDocumento3 páginas6.reporte Glucosa en Suero OralKarLaa DôminGuezAún no hay calificaciones
- PolarímetriaDocumento19 páginasPolarímetriaLiz Mamani0% (1)
- Polarimetría: Estudio de la rotación de la luz polarizadaDocumento35 páginasPolarimetría: Estudio de la rotación de la luz polarizadaJuanCamiloPelaezLopezAún no hay calificaciones
- La Turbidimetría y La Nefelometría Son Técnicas Analíticas Basadas en La Dispersión de La Luz Por Partículas en Suspensión en El Seno de Una DisoluciónDocumento5 páginasLa Turbidimetría y La Nefelometría Son Técnicas Analíticas Basadas en La Dispersión de La Luz Por Partículas en Suspensión en El Seno de Una DisoluciónYrvin Narro LucanoAún no hay calificaciones
- EstereoquímicaDocumento17 páginasEstereoquímicarmarin_90Aún no hay calificaciones
- Carbonizacion Del AzucarDocumento4 páginasCarbonizacion Del Azucarestuardo92Aún no hay calificaciones
- Pre - Informe1reacDocumento10 páginasPre - Informe1reacAdriana RosasAún no hay calificaciones
- Clase 2Documento30 páginasClase 2Devra GomezAún no hay calificaciones
- POLARÍMETRODocumento3 páginasPOLARÍMETROJESSYAún no hay calificaciones
- Quimica Organica I 05 EstereoquimicaDocumento88 páginasQuimica Organica I 05 EstereoquimicaAlex Ramos maqueraAún no hay calificaciones
- Polarimetría: análisis óptico de sustancias quiralesDocumento20 páginasPolarimetría: análisis óptico de sustancias quiralesMichelleAún no hay calificaciones
- Conf. No.5 ESTEREOQUIMICADocumento58 páginasConf. No.5 ESTEREOQUIMICAJeny Serrano0% (1)
- Polarimetria y RefractometriaDocumento26 páginasPolarimetria y RefractometriaDaniel Carrillo OrtizAún no hay calificaciones