Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cuantificación Por Espectrofotometría en El Uv-Visible
Cargado por
DANIEL VICTOR TRIGOSO LOSTAUNAUTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Cuantificación Por Espectrofotometría en El Uv-Visible
Cargado por
DANIEL VICTOR TRIGOSO LOSTAUNAUCopyright:
Formatos disponibles
TAREA GRUPAL: ESPECTROFOTOMETRÍA
Lee esta práctica, escucha los videos con los links que están al final y agénciate de
más información para contestar las siguientes preguntas del cuestionario.
CUANTIFICACIÓN DE HIERRO POR ESPECTROFOTOMETRÍA EN EL UV-VISIBLE
I. CAPACIDADES
1. Conoce y opera el espectrofotómetro UV – visible
2. Maneja los términos absorbancia, transmitancia y la ley de Lambert y Beer.
3. Prepara disoluciones y maneja la curva de calibración para cuantificación de
Hierro.
II. FUNDAMENTO TEÓRICO
Las técnicas espectroscópicas o espectrofotométricas se basan en la utilización de
energía luminosa de cierta longitud de onda para identificar y cuantificar analito de
una muestra. Es común clasificar estas técnicas atendiendo a la región del espectro
electromagnético que utilizan, y así por ejemplo se tiene la espectroscopía de rayos X
(usa longitudes de onda que van de 100 pm a 10 nm), la espectroscopía en el
ultravioleta (de 180 a 380 nm), espectroscopía en el visible (de 380 a 780 nm) y
espectroscopía de infrarrojo (de 0.78 a 50 µm) (Harris, 2001). Las radiaciones
ultravioleta y visible (UV-Visible) se usan ampliamente con fines analíticos y ambas
pueden ser medidas con los espectrofotómetros comunes.
Cuando un analito en disolución capaz de absorber luz se coloca en la celda de un
espectrofotómetro y se le hace incidir luz de cierta longitud de onda (monocromática o
de un solo color), parte de la luz incidente es absorbida por el analito y otra parte
atraviesa y llega al fototubo del equipo que la detecta y mide (Verde y col., 1999).
Estas propiedades se conocen como absorbancia y transmitancia y se definen como se
indica a continuación.
Figura 1. Fenómenos de absorbancia y transmitancia. Parte de la luz monocromática
que incide en la celda es absorbida por el analito en disolución y otra parte es
transmitida.
Si Po es la energía radiante incidente y P la energía radiante transmitida, la
transmitancia, definida como la fracción de la energía radiante que pasa a través de la
muestra (disolución conteniendo al analito), se expresa como:
T = P/Po, o bien T%= (P/Po)100
Mientras que la absorbancia, definida como la fracción de la energía radiante que es
absorbida por la muestra y que está relacionada logarítmicamente con la
transmitancia, se expresa como:
A = -log T = log (Po /P)
La ley de Lambert y Beer, indica cuantitativamente como la absorbancia depende de la
concentración de las moléculas absorbentes y de la longitud del trayecto, paso óptico
o recorrido de la luz en la celda. Cuanto mayor sea la concentración de las moléculas
absorbentes mayor será la absorbancia pues habrá más moléculas por unidad de
volumen absorbiendo, e igualmente entre mayor sea la longitud del paso óptico,
mayor será la absorbancia pues existirán más moléculas en el trayecto recorrido por la
luz (Skoog y col., 2008). La ley de Lambert y Beer dice por lo tanto, que la absorbancia
es directamente proporcional a la concentración de la especie absorbente (c) y a la
longitud del paso óptico (b) y se expresa como:
A = εbc
En donde:
ε = constante de proporcionalidad llamada absortividad molar en M -1 cm -1
b = longitud de paso óptico en cm
c = concentración de la especie absorbente en M
Nótese que A es adimensional.
La ley de Lambert y Beer sólo se cumple con radiación monocromática y en
disoluciones diluidas (10 -2-10 -6 M) debido a que en disoluciones concentradas las
moléculas de soluto interaccionan entre sí y cambian sus propiedades, entre ellas, la
absortividad (Harris, 2001). Bajo estas condiciones, un gran número de compuestos
siguen la ley de Beer, pero algunos no muestran una relación lineal entre absorbancia y
concentración. Para saber el intervalo de concentraciones en el que un compuesto
sigue una relación lineal con la absorbancia (ley de Lambert y Beer), se elabora una
curva de calibración midiendo las absorbancias de disoluciones del analito de
concentraciones conocidas.
III. MATERIALES Y REACTIVOS
Balanza analítica
Espectrofotómetro Genesys o Biomate
2 celdas de acrílico o de vidrio óptico
Papel seda
1 matraz volumétrico de 50 mL
2 matraces volumétricos de 500 mL
1 pipeta graduada de 1 mL
1 pipeta graduada de 5 mL
2 pipetas graduadas de 10 mL
4 vasos de precipitados de 100 mL
1 espátula
1 Bombilla de succión
Disolución de ácido clorhídrico (HCl) 0.05 M, 500 mL
Disolución de cloruro férrico (FeCl3) 1 X 10-4 M en HCl 0.05 M, 500 mL
Tiocianato de amonio (NH4SCN) 0.5 M, 50 mL
Disolución problema de cloruro férrico. Concentración aproximada: 5 x 10 -5 M
IV.PROCEDIMIENTO
Preparación de Disoluciones
Prepare las disoluciones de ácido clorhídrico (HCl) 0.05 M (en campana de extracción),
cloruro férrico (FeCl3) 1 X 10-4 M y tiocianato de amonio (NH4SCN) 0.5 M. Antes de
proceder a su preparación verifique con su profesor los cálculos y forma de
preparación.
Determinación del Espectro de Absorción del Complejo Tiocianato de Hierro (III)
Coloque en un tubo de ensayo 5 mL de la disolución de cloruro férrico, 0.3 mL de la
disolución de tiocianato de amonio, 4.7 mL de agua destilada, tape y agite por
inversión. Transfiera a una celda y lea la absorbancia en el modo barrido de 400 a 550
nm a intervalos de 5 nm. Ajuste la absorbancia con un blanco preparado con 0.3 mL de
la disolución de tiocianato de amonio y 9.7 mL de agua destilada.
Elaboración de la Curva de Calibración del Complejo Tiocianato de Hierro (III)
Prepare la siguiente serie de tubos:
Tubo Disolución de FeCl3 1 X 10-4 M Disolución de NH4SCN 0.5 M Agua destilada
(mL) (mL) (mL)
1 1 0.3 8.7
2 2 0.3 7.7
3 3 0.3 6.7
4 5 0.3 4.7
5 7 0.3 2.7
6 9 0.3 0.7
7 0 0.3 9.7
Mezcle por inversión y lea inmediatamente la absorbancia a la longitud de onda de
máxima absorbancia (λMax) encontrada en su espectro de absorción. Ajuste la
absorbancia con el blanco (tubo 7).
Determinación de la Concentración de Fe3+ en la Disolución Problema
Coloque en un tubo de ensayo 5 mL de la disolución problema de cloruro férrico, 0.3
mL de la disolución de tiocianato de amonio, 4.7 mL de agua destilada, tape y agite por
inversión. Transfiera a una celda y lea la absorbancia a la longitud de onda de máxima
absorbancia (λMax) encontrada en su espectro de absorción. Ajuste la absorbancia con
el blanco preparado con 0.3 mL de la disolución de tiocianato de amonio y 9.7 mL de
agua destilada.
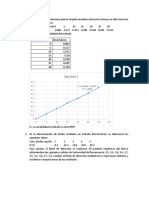
V. CÁLCULOS Y RESULTADOS
Determinación del Espectro de Absorción del Complejo Tiocianato de Fierro (III)
Con los resultados construya una gráfica de absorbancia contra longitud de onda y
determine la longitud de onda de máxima absorbancia para el complejo rojo de
tiocianato de fierro (III). Muestre a su profesor la longitud de onda seleccionada antes
de continuar con la elaboración de la curva de calibración y la cuantificación de hierro
en su muestra problema.
Elaboración de la Curva de Calibración del Complejo Tiocianato de Fierro (III)
Construya una gráfica de absorbancia contra concentración molar de Fe 3+. Compruebe
en que intervalo hay linealidad y por lo tanto, la ley de Beer se cumple. Obtenga la
ecuación de la recta y el coeficiente de correlación (R 2) para ver que tan bien se ajustan
sus datos a la línea recta.
Determinación de la concentración de Fe3+ en la Disolución Problema
Obtenga la media de sus tres determinaciones de absorbancia y la desviación estándar.
Con la ecuación de la recta obtenida en el punto anterior, encuentre la concentración
de FeCl3 de su muestra problema. Solicite a su profesor la concentración real de su
muestra problema y reporte la exactitud y la precisión de su determinación.
www.youtube.com/watch?v=G-C5a0lpoc0&ab_channel=MelquiadesBarraganCondori
www.youtube.com/watch?v=gmEzzEse5IA&ab_channel=NORLEYMORETO
VI. CUESTIONARIO
Desarrollar el siguiente cuestionario de definiciones; leer la práctica y videos
proporcionados e investigar en textos los siguientes términos y dar dos ejemplos
de cada término y haga un es quema o dibujo que ilustre su uso de cada uno.
1. Absorbancia
2. Transmitancia
3. Luz mono cromática
4. Analito
5. Ley de Lambert y Beer
6. Longitud de paso óptico
7. Curva de calibración
8. Espectro de Absorción
9. Espectrofotometría
10. Espectrofotometría UV-Visible
11. Longitud de onda en espectrofotometría de rayos X
12. Longitud de onda en espectrofotometría ultravioleta
13. Longitud de onda en espectrofotometría de infrarrojo
14. Longitud de onda en espectrofotometría en el UV-Visible
15. Absortividad
16. Espectro electromagnético
17. Coeficiente de correlación
18. Celda o cubeta de muestra
19. Barrido espectral
20. Absorbancia corregida
VII. BIBLIOGRAFÍA
Harris Daniel C., 2001. Análisis Químico Cuantitativo. 2ª edición. Editorial
Reverté, S.A. México.
Skoog Douglas A., West Donald M., Holler F. James, Crouch Stanley R. 2008.
Fundamentos de Química Analítica. 8ª edición.
Thomson Learning, México.
Verde Calvo José Ramón, Escamilla Hurtado Ma. de Lourdes, Reyes Dorantes
Alberto y Malpica Sánchez Frida. Manual de Prácticas de Química Analítica II. 1ª
edición. Universidad Autónoma Metropolitana-Iztapalapa, México.
También podría gustarte
- Guia Practica 6 Quimica AnaliticaDocumento5 páginasGuia Practica 6 Quimica AnaliticaVALERIA MAYETT GARCIAAún no hay calificaciones
- Plantilla Práctica 1Documento13 páginasPlantilla Práctica 1María DelgadoAún no hay calificaciones
- PolarimetríaDocumento14 páginasPolarimetríaAnaMonicaTorres67% (3)
- Medición tensión superficial por elevación capilarDocumento7 páginasMedición tensión superficial por elevación capilarJorge ToroAún no hay calificaciones
- Ficha de seguridad glicerinaDocumento2 páginasFicha de seguridad glicerinajohan bustacaraAún no hay calificaciones
- Laboratorio N°5Documento9 páginasLaboratorio N°5Anonymous zxZIsSmCt100% (1)
- Aminoácidos y péptidos: estructura, clasificación y propiedadesDocumento14 páginasAminoácidos y péptidos: estructura, clasificación y propiedadesFrancisco Alejandro Torres GarciaAún no hay calificaciones
- Titulación Potenciometrica de AminoacidosDocumento17 páginasTitulación Potenciometrica de AminoacidosKendrys RuizAún no hay calificaciones
- Analítica Práctica 12. Determinación Turbidimétrica de SulfatosDocumento11 páginasAnalítica Práctica 12. Determinación Turbidimétrica de SulfatosJose Alfonso Barreto E.Aún no hay calificaciones
- Validación de hierro en aguaDocumento5 páginasValidación de hierro en aguaJhoam S CorreaAún no hay calificaciones
- PotenciometriaDocumento7 páginasPotenciometriaLyseth Karina Gómez RoseroAún no hay calificaciones
- Informe 5Documento4 páginasInforme 5LEIDY CORDERO PÉREZAún no hay calificaciones
- Practica Isomerizacion PDFDocumento3 páginasPractica Isomerizacion PDFunifiqt2013Aún no hay calificaciones
- Informe N°7Documento8 páginasInforme N°7Richard AluchoAún no hay calificaciones
- Toxicodinámica de La RadiaciónDocumento10 páginasToxicodinámica de La RadiaciónJessica ViverosAún no hay calificaciones
- Fraccionamiento de tejidos y caracterización de biomoléculasDocumento5 páginasFraccionamiento de tejidos y caracterización de biomoléculasMychys DyazzAún no hay calificaciones
- GUÍA 7 de LABORATORIO - Enzimas MitocondrialesDocumento9 páginasGUÍA 7 de LABORATORIO - Enzimas MitocondrialesAlejandro ReyAún no hay calificaciones
- Determinación GravimétricaDocumento3 páginasDeterminación GravimétricaSara CatañoAún no hay calificaciones
- PRACTICA 11creatininaDocumento2 páginasPRACTICA 11creatininaGERARDO SILVESTRE MELENDEZ MACALOPUAún no hay calificaciones
- Laboratorio Nº5 Equilibrio Quimico IPQ Naysu - Ventura - PoccohuancaDocumento19 páginasLaboratorio Nº5 Equilibrio Quimico IPQ Naysu - Ventura - PoccohuancaNAYSU VENTURA POCCOHUANCAAún no hay calificaciones
- Análisis de plata y berilio mediante absorción atómica y fluorometríaDocumento2 páginasAnálisis de plata y berilio mediante absorción atómica y fluorometríaNatasha VargasAún no hay calificaciones
- Volumetrias 051808 1 PDFDocumento71 páginasVolumetrias 051808 1 PDFJhonatan Rimache ArotomaAún no hay calificaciones
- Análisis de Las Propiedades Químicas de Los Aldehídos y CetonasDocumento9 páginasAnálisis de Las Propiedades Químicas de Los Aldehídos y CetonasJUAN DAVID LÓPEZ LÓPEZAún no hay calificaciones
- Taller Membranas BiológicasDocumento5 páginasTaller Membranas Biológicasluisa velasquezAún no hay calificaciones
- Informe ArgentometriaDocumento5 páginasInforme ArgentometriaPaola JosefaAún no hay calificaciones
- Informe Determinación Espectrofotométrica de Hierro en Un Alimento Por Adición de EstándaresDocumento4 páginasInforme Determinación Espectrofotométrica de Hierro en Un Alimento Por Adición de EstándaresCamilo DussanAún no hay calificaciones
- Problemario 2 Capítulo 7 y 12Documento3 páginasProblemario 2 Capítulo 7 y 12Karim 'SolizAún no hay calificaciones
- Equilibrio Quimico 8Documento5 páginasEquilibrio Quimico 8SOLEDADAún no hay calificaciones
- Problemas de soluciones ácidas y básicas para Análisis FarmacéuticoDocumento68 páginasProblemas de soluciones ácidas y básicas para Análisis FarmacéuticoEstefany GuerreroAún no hay calificaciones
- Ejercicios Deber 2Documento5 páginasEjercicios Deber 2PAUL JHERSON CARCAHUSTO TUMBILLOAún no hay calificaciones
- Fluidos Taller2Documento2 páginasFluidos Taller2NICOLAS SIERRA PEREZAún no hay calificaciones
- GUIA Método de Caso - Cinética EnzimaticaDocumento2 páginasGUIA Método de Caso - Cinética EnzimaticaHeredy100% (1)
- Proceso de Extracción Del Omeprazol FinalDocumento12 páginasProceso de Extracción Del Omeprazol FinalJuan DavidAún no hay calificaciones
- Práctica5Labster Equilibrio YeseniaFloresGlzDocumento31 páginasPráctica5Labster Equilibrio YeseniaFloresGlzYesenia FloresAún no hay calificaciones
- Practica 3Documento5 páginasPractica 3Alma Martinez ZacahulaAún no hay calificaciones
- Tarea - Métodos de DerivatizaciónDocumento4 páginasTarea - Métodos de DerivatizaciónAngela ValenciaAún no hay calificaciones
- Introduccion Al Laboratorio de Quimica AnaliticaDocumento11 páginasIntroduccion Al Laboratorio de Quimica Analiticaunknown__userAún no hay calificaciones
- Ejercicios VOLUMETRIADocumento4 páginasEjercicios VOLUMETRIANALENY MORAYMA RUIZ CRUZAún no hay calificaciones
- Titulación potenciométrica de haluros usando Ag+ para determinar KCl y KIDocumento7 páginasTitulación potenciométrica de haluros usando Ag+ para determinar KCl y KICamilo DiazAún no hay calificaciones
- HPLC Del IbuprofenoDocumento18 páginasHPLC Del IbuprofenoCinthya JazminAún no hay calificaciones
- REFRACTOMETRIADocumento20 páginasREFRACTOMETRIAJuanLuisZarzaAún no hay calificaciones
- Práctica 3 Disminución de La Acidez Del Jugo de Limón Por Cromatografía de Intercambio IónicoDocumento5 páginasPráctica 3 Disminución de La Acidez Del Jugo de Limón Por Cromatografía de Intercambio IónicoMARISOL GOMEZ ROBLESAún no hay calificaciones
- Determinación Volumétrica de Haluros Por Formación de PrecipitadosDocumento6 páginasDeterminación Volumétrica de Haluros Por Formación de PrecipitadosJorly Torres100% (1)
- Informe Bioquimica 3. Cuantificación de CaseinaDocumento5 páginasInforme Bioquimica 3. Cuantificación de CaseinaANA MARIA ROMERO ARIASAún no hay calificaciones
- Determinacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerDocumento11 páginasDeterminacion Del Peso Molecular de Un Vapor Condensable Por Los Metodos de Dumas y de Victor MeyerSEBASTIAN ALZATE ALZATEAún no hay calificaciones
- Deberes 3 - Contraste Hipótesis-Y Anova (Recuperado)Documento16 páginasDeberes 3 - Contraste Hipótesis-Y Anova (Recuperado)SthefiiEnriquezAún no hay calificaciones
- Volumetría Redox II - Titulaciones Con Permanganato Mediante Potenciometría PDFDocumento2 páginasVolumetría Redox II - Titulaciones Con Permanganato Mediante Potenciometría PDFMardabAún no hay calificaciones
- PolarimetríaDocumento3 páginasPolarimetríaJoshua Isaias MartinezAún no hay calificaciones
- Importancia de La Química AnalíticaDocumento6 páginasImportancia de La Química AnalíticaChuy1594Aún no hay calificaciones
- Laboratorio N°6Documento4 páginasLaboratorio N°6Andrea SanchezAún no hay calificaciones
- Marchas AnaliticasDocumento20 páginasMarchas AnaliticasPerlaZavaletaAún no hay calificaciones
- Universidad Autónoma de Chihuahua: Anova de Un FactorDocumento15 páginasUniversidad Autónoma de Chihuahua: Anova de Un FactorKAREN HERNANDEZ MARTINEZAún no hay calificaciones
- Informe Valoracion Potenciometrica Acido-BaseDocumento16 páginasInforme Valoracion Potenciometrica Acido-BasePaola Valverde100% (1)
- Taller 10 PH Acidos Poliproticos-2Documento2 páginasTaller 10 PH Acidos Poliproticos-2Andzhiita SaampeerAún no hay calificaciones
- Informe Quimica Analitica #1Documento2 páginasInforme Quimica Analitica #1Mateo MartinezAún no hay calificaciones
- Cuantificación Colorimétrica de ConcentraciónDocumento9 páginasCuantificación Colorimétrica de ConcentraciónZeld BarrientosAún no hay calificaciones
- LAB 8 MESA 3 XD FinalDocumento9 páginasLAB 8 MESA 3 XD FinalRico Cacho PortuánoAún no hay calificaciones
- Práctica #4 de EspectrofotometríaDocumento5 páginasPráctica #4 de EspectrofotometríaKarolayn TeránAún no hay calificaciones
- Informe N°1 InstrumentacionDocumento14 páginasInforme N°1 InstrumentacionAldoCabreraFernandezAún no hay calificaciones
- Práctica 7 EyCDocumento3 páginasPráctica 7 EyCikutotsukiAún no hay calificaciones
- La PalabraDocumento37 páginasLa PalabraDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Tildación GeneralDocumento29 páginasTildación GeneralDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Palabras de Escritura Junta-SeparadaDocumento79 páginasPalabras de Escritura Junta-SeparadaDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Cuantificación Por Espectrofotometría en El Uv-Visible - Grupo 4BDocumento19 páginasCuantificación Por Espectrofotometría en El Uv-Visible - Grupo 4BDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Seminario #2 - BotánicaDocumento26 páginasSeminario #2 - BotánicaDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- TAREA - DE FUNCIONES DE BASE DE DATOS - 2 - Daniel TrigosoDocumento5 páginasTAREA - DE FUNCIONES DE BASE DE DATOS - 2 - Daniel TrigosoDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Caratula de Info 2 BOTANICADocumento2 páginasCaratula de Info 2 BOTANICADANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- La PalabraDocumento37 páginasLa PalabraDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Practica Funciones de Repaso - AlumnoDocumento14 páginasPractica Funciones de Repaso - AlumnoDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- ROA 15, Botánica GeneralDocumento3 páginasROA 15, Botánica GeneralDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Practica Funciones Logicas - SIDocumento5 páginasPractica Funciones Logicas - SIMaiquer Julio Angelo PedrazaAún no hay calificaciones
- Semana 1 - Funciones y DerivadasDocumento21 páginasSemana 1 - Funciones y DerivadasDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Practica Calificada 1 - AlumDocumento2 páginasPractica Calificada 1 - AlumDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Caratula de Info 2 BOTANICADocumento2 páginasCaratula de Info 2 BOTANICADANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Practica 5 Semana 6 Daniel TrigosoDocumento4 páginasPractica 5 Semana 6 Daniel TrigosoDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Semana 4 - Práctica DirigidaDocumento10 páginasSemana 4 - Práctica DirigidaDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Semana 4 - Retroalimentación de IntegralesDocumento3 páginasSemana 4 - Retroalimentación de IntegralesDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Semana 1 - Práctica Funciones y DerivadasDocumento7 páginasSemana 1 - Práctica Funciones y DerivadasDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Semana 2 - Taller de AntiderivadasDocumento8 páginasSemana 2 - Taller de AntiderivadasDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Semana 3 - Taller de Métodos de IntegraciónDocumento9 páginasSemana 3 - Taller de Métodos de IntegraciónDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Presentacion 2.volumetria Acido - BaseDocumento22 páginasPresentacion 2.volumetria Acido - BaseDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Cien 436 1805 Inag M 20220908200908Documento8 páginasCien 436 1805 Inag M 20220908200908DANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Semana 2 - Integrales IndefinidasDocumento7 páginasSemana 2 - Integrales IndefinidasDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Semana 3 - Métodos de IntegraciónDocumento15 páginasSemana 3 - Métodos de IntegraciónDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- PRESENTACION 3. Volumetría Por PrecipitaciónDocumento34 páginasPRESENTACION 3. Volumetría Por PrecipitaciónDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Practica de Aula N°2 Volumetría Acido BaseDocumento2 páginasPractica de Aula N°2 Volumetría Acido BaseDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Presentacion 1. Calculos Basicos en Quimica AnaliticaDocumento25 páginasPresentacion 1. Calculos Basicos en Quimica AnaliticaDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Practica de Aula N°1 Calculos Basicos en Quimica AnaliticaDocumento2 páginasPractica de Aula N°1 Calculos Basicos en Quimica AnaliticaDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Practica #3 Volumetria Por PrecipitaciónDocumento1 páginaPractica #3 Volumetria Por PrecipitaciónDANIEL VICTOR TRIGOSO LOSTAUNAUAún no hay calificaciones
- Física Nuclear y de Partículas apuntesDocumento238 páginasFísica Nuclear y de Partículas apuntesjuanjo romero0% (1)
- Informe Tecnico N03 - Analisis InstrumentalDocumento11 páginasInforme Tecnico N03 - Analisis Instrumentalalessandra nuñez santiagoAún no hay calificaciones
- Diseño de Canales: Hidráulica, Estructura y EstabilidadDocumento19 páginasDiseño de Canales: Hidráulica, Estructura y EstabilidadFrancisco Alban Benites0% (1)
- Nanopartículas Biomiméticas para El Teragnóstico de AterosclerosisDocumento5 páginasNanopartículas Biomiméticas para El Teragnóstico de AterosclerosisAngel M. VelascoAún no hay calificaciones
- Torres de Enfrto 2019Documento30 páginasTorres de Enfrto 2019Liliana LiraAún no hay calificaciones
- Desarrollo Psicomotor Del Niño: Etapa de 0 A 12 MesesDocumento42 páginasDesarrollo Psicomotor Del Niño: Etapa de 0 A 12 MesesmileAún no hay calificaciones
- Caso-Clínico ImagenologiaDocumento9 páginasCaso-Clínico ImagenologiaValeria GalecioAún no hay calificaciones
- 03 - Flexión en BarrasDocumento57 páginas03 - Flexión en BarrasSebastian IbarraAún no hay calificaciones
- Métodos en economía, positiva vs normativa, discrepancias y enseñanzaDocumento12 páginasMétodos en economía, positiva vs normativa, discrepancias y enseñanzaRiding&MoreAún no hay calificaciones
- Estudio e intervención de anillos metálicos prehispánicosDocumento26 páginasEstudio e intervención de anillos metálicos prehispánicosLuis MGamboaAún no hay calificaciones
- Modulo 1 Manual de TrabajoDocumento32 páginasModulo 1 Manual de TrabajoYissel TavarezAún no hay calificaciones
- Presupuesto Base Cero: Metodología y AplicacionesDocumento8 páginasPresupuesto Base Cero: Metodología y AplicacionesSinFronterasAgenciasAún no hay calificaciones
- Ciclos de Refrigeración y RefrigerantesDocumento8 páginasCiclos de Refrigeración y RefrigerantesCarlos ArancibiaAún no hay calificaciones
- WhatmanDocumento39 páginasWhatmansilvamayenAún no hay calificaciones
- Clásicos a filósofosDocumento5 páginasClásicos a filósofosNayib SoñethAún no hay calificaciones
- Guia de Aprendizaje AA2 PDFDocumento8 páginasGuia de Aprendizaje AA2 PDFOlga Stella Morales RendonAún no hay calificaciones
- Caratulas Segundo Basico - nnx3QHDocumento2 páginasCaratulas Segundo Basico - nnx3QHmister wowaAún no hay calificaciones
- El ColorDocumento20 páginasEl ColorPedro Trujillo67% (3)
- REPRESENTACION DE LOS SINTOMAS CARACTERISTICOS DE Los MEDICAMENTOS (PDFDrive)Documento66 páginasREPRESENTACION DE LOS SINTOMAS CARACTERISTICOS DE Los MEDICAMENTOS (PDFDrive)Mauricio RuizAún no hay calificaciones
- Una Mirada Filológica A La Obra Del Extranjero Albert CamusDocumento4 páginasUna Mirada Filológica A La Obra Del Extranjero Albert CamusJesús B. SánchezAún no hay calificaciones
- G11 Trabajocolaborativo FTDocumento18 páginasG11 Trabajocolaborativo FTSofia2012Aún no hay calificaciones
- Tipón Tarea Nº7Documento12 páginasTipón Tarea Nº7angel efrainAún no hay calificaciones
- Formulación y nomenclatura de compuestos inorgánicosDocumento54 páginasFormulación y nomenclatura de compuestos inorgánicosYalitza Álvarez BarazarteAún no hay calificaciones
- Glosario aprendizaje términos psicologíaDocumento2 páginasGlosario aprendizaje términos psicologíaNath NegmenAún no hay calificaciones
- Material de Apoyo Revisado para Realizar Un Trabajo MonográficoDocumento4 páginasMaterial de Apoyo Revisado para Realizar Un Trabajo MonográficoJose Ricardo PachecoAún no hay calificaciones
- Psicologia 10Documento3 páginasPsicologia 10alma andinoAún no hay calificaciones
- UF5 - 20200302 - SS - Procedimiento para Montaje de Viga Cabezal PDFDocumento9 páginasUF5 - 20200302 - SS - Procedimiento para Montaje de Viga Cabezal PDFGial TidiAún no hay calificaciones
- Informe de TopografíaDocumento61 páginasInforme de TopografíaJimmy Carlos Paico PascoAún no hay calificaciones
- Libro PACCRCSMO CONANP 2013Documento109 páginasLibro PACCRCSMO CONANP 2013Alejandro DuranAún no hay calificaciones
- 6.2 AUTOevalua REUMato ENAM ComentaDocumento22 páginas6.2 AUTOevalua REUMato ENAM ComentaAna Cecilia MantillaAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Desastres y emergencias. Prevención, mitigación y preparaciónDe EverandDesastres y emergencias. Prevención, mitigación y preparaciónCalificación: 4 de 5 estrellas4/5 (5)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Borges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonDe EverandBorges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonCalificación: 5 de 5 estrellas5/5 (4)
- Cómo hacer aviones de papel y otros objetos voladoresDe EverandCómo hacer aviones de papel y otros objetos voladoresAún no hay calificaciones
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Notas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesDe EverandNotas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesAún no hay calificaciones
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Trucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasDe EverandTrucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- El cerebro del niño explicado a los padresDe EverandEl cerebro del niño explicado a los padresCalificación: 4.5 de 5 estrellas4.5/5 (147)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)