Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Guia Practica 6 Quimica Analitica
Cargado por
VALERIA MAYETT GARCIATítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Guia Practica 6 Quimica Analitica
Cargado por
VALERIA MAYETT GARCIACopyright:
Formatos disponibles
PRACTICA 6.
LABORATORIO QUIMICA ANALITICA
CUANTIFICACIÓN DE HIERRO POR ESPECTROFOTOMETRÍA EN EL VISIBLE
Introducción
La espectrofotometría UV-visible es una técnica analítica que permite determinar la concentración
de un compuesto en solución y se basa en que las moléculas absorben las radiaciones
electromagnéticas y a su vez la cantidad de luz absorbida depende de forma lineal de la
concentración. Para hacer este tipo de medidas se emplea un espectrofotómetro, en el que se
puede seleccionar la longitud de onda de la luz que pasa por una solución y medir la cantidad de
luz absorbida por la misma.
Las longitudes de onda de las radiaciones que una molécula puede absorber y la eficiencia con la
que se absorben dependen de la estructura atómica y de las condiciones del medio (pH,
temperatura, fuerza iónica, constante dieléctrica), por lo que esta técnica constituye un valioso
instrumento para la determinación y caracterización de biomoléculas.
En espectrofotometría de absorbancia se utilizan las regiones del ultravioleta (UV cercano, de 195-
400 nm) y el visible (400-780 nm). En la región visible apreciamos el color visible de una solución y
que corresponde a las longitudes de onda de luz que transmite, no que absorbe, el color que
absorbe es el complementario del color que transmite. Por lo tanto, para realizar mediciones de
absorción es necesario utilizar la longitud de onda en la que absorbe luz la solución coloreada.
El FeCl3 no absorbe en la región del visible es por eso que se combina con el NH4SCN, los iones
tiocianato, SCN- reaccionan con los iones hierro (III), Fe -3, dando lugar al ion [Fe(SCN) 6]3- de color
rojo; el equilibrio dinámico que se establece entre los tres iones esta dado por:
Fe3+(ac) + 6SCN-(ac) ↔ [Fe(SCN)6]3-(ac)
Amarillo claro Transparente Rojo
La intensidad del color rojo nos indica, de manera cualitativa, la cantidad del ion [Fe(SCN)6]3- en la
mezcla en equilibrio.
Objetivo
El alumno determinará el espectro de absorción, elaborará la curva patrón de un analito y usará
esta información para cuantificar una muestra problema del mismo analito.
Materiales y reactivos
1 pipeta graduada de 1 mL
1 pipeta graduada de 5 mL
2 pipetas graduadas de 10 mL
12 tubos de ensayo con tapones de rosca
1 gradilla para tubos de ensayo
4 vasos de precipitados de 100 mL
1 propipeta
1 agitador de vidrio
1 piseta con agua destilada
Cálculos teóricos
150 mL de HCl 0.05 M
g = M*PM*V
g = (0.05 M)(36.458 g/mol)(0.15 L)
g = 0.273 g
ΡHCl = 1.18 g/mL; pureza 37% p/p
100 g de disolución – 37 g HCl
% p/v = (% p/p)( ΡHCl)
% p/v = (37g/g)(1.18g/mL)
% p/v =43.66 g/mL
43.66 g HCl – 100 mL disolución
0.273 g HCl – X
X = 0.626 mL de HCl
150 mL de FeCl3 0.0001 M
g = M*PM*V
g = (0.0001 mol/L)(162.2 g/mol)(0.15 L)
g = 0.0024 g de FeCl3
disolver en los 150 mL de HCl 0.05 M
25 mL de NH4SCN 0.5 M
g = M*PM*V
g = (0.5 mol/L)(76.122 g/mol)(0.025 L)
g = 0.9515 g de NH4SCN
Diagrama de método.
Preparación de Disoluciones
Determinación del Espectro de Absorción del Complejo Tiocianato de Hierro (III)
Elaboración de la Curva de Calibración del Complejo Tiocianato de Hierro (III)
DISOLUCION DE FeCl3 DISOLUCION DE NH4SCN
TUBO 0.0001 M (mL) 0.5 M (mL) H2O (mL)
1 0.5 0.15 4.35
2 1 0.15 3.85
3 1.5 0.15 3.35
4 2.5 0.15 2.35
5 3.5 0.15 1.35
6 4.5 0.15 0.35
7 (BLANCO) 0 0.15 4.85
Determinación de la Concentración de Fe3+ en la Disolución Problema
Resultados/discusión.
Determinación del Espectro de Absorción del Complejo Tiocianato de Fierro (III)
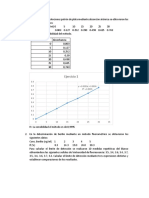
Con los resultados construya una gráfica de absorbancia contra longitud de onda y determine la
longitud de onda de máxima absorbancia para el complejo rojo de tiocianato de fierro (III).
Muestre a su profesor la longitud de onda seleccionada antes de continuar con la elaboración de
la curva de calibración y la cuantificación de hierro en su muestra problema.
Elaboración de la Curva de Calibración del Complejo Tiocianato de Fierro (III)
Construya una gráfica de absorbancia contra concentración molar de Fe 3+. Compruebe en que
intervalo hay linearidad, y por lo tanto, la ley de Beer se cumple. Obtenga la ecuación de la recta y
el coeficiente de correlación (R2) para ver que tan bien se ajustan sus datos a la línea recta.
Determinación de la concentración de Fe 3+ en la Disolución Problema
Obtenga la media de sus tres determinaciones de absorbancia y la desviación estándar. Con la
ecuación de la recta obtenida en el punto anterior, encuentre la concentración de FeCl 3 de su
muestra problema. Solicite a su profesor la concentración real de su muestra problema y reporte la
exactitud y la precisión de su determinación.
Cuestionario.
1. El cloruro férrico no absorbe en la región del visible, ¿qué pasa cuando se le combina con
el tiocianato de amonio? ¿Por qué se desarrolló un color rojo? ¿Cómo se llama a los
reactivos como el tiocianato de amonio que al combinarse con el analito generan un color
que puede absorber en la región del visible?
2. ¿Qué factores se deben tomar en cuenta para la determinación espectrofotométrica de
iones inorgánicos por formación de complejos?
3. ¿Cuál es la diferencia entre absortividad (a) y absortividad molar (ε)?
4. ¿Qué cuidados se deben tener con las celdas del espectrofotómetro?
Conclusiones y referencias bibliográficas.
También podría gustarte
- Fisica Parcial 3 CorteDocumento9 páginasFisica Parcial 3 CorteDina Luz Cabarcas MartinezAún no hay calificaciones
- Sistemas de oxidación-reducción: reacciones redox y celdas electroquímicasDocumento14 páginasSistemas de oxidación-reducción: reacciones redox y celdas electroquímicasMontserrat Concepción Portilla MarínAún no hay calificaciones
- Síntesis de anaranjado de metiloDocumento16 páginasSíntesis de anaranjado de metiloDelany BrendaAún no hay calificaciones
- PRELAB - Práctica 06Documento18 páginasPRELAB - Práctica 06Rigoberto Enrique Gómez LópezAún no hay calificaciones
- Práctica 5 - Método MohrDocumento10 páginasPráctica 5 - Método MohrJorgeLuisFR7Aún no hay calificaciones
- Determinación Volumétrica de Haluros Por Formación de PrecipitadosDocumento6 páginasDeterminación Volumétrica de Haluros Por Formación de PrecipitadosJorly Torres100% (1)
- Análisis de plata y berilio mediante absorción atómica y fluorometríaDocumento2 páginasAnálisis de plata y berilio mediante absorción atómica y fluorometríaNatasha VargasAún no hay calificaciones
- Comportamiento del capacitor planoDocumento10 páginasComportamiento del capacitor planoDaniel GiraldoAún no hay calificaciones
- Ejercicios de ElectroDocumento3 páginasEjercicios de ElectroMicael FazzAún no hay calificaciones
- Construcción de Escalas Químicas y su Aplicación a la Predicción de ReaccionesDocumento5 páginasConstrucción de Escalas Químicas y su Aplicación a la Predicción de ReaccionesAngelIsaiAún no hay calificaciones
- Guia Titulacion Complejometrica 2S 2019 532326Documento2 páginasGuia Titulacion Complejometrica 2S 2019 532326Kristofer Bonilla0% (1)
- Laboratorio de Fisicoquimica II - Equilibrio de DistribucionDocumento10 páginasLaboratorio de Fisicoquimica II - Equilibrio de DistribucionLuis Jesus Carbajal LozanoAún no hay calificaciones
- Taller 1Documento1 páginaTaller 1rafael millanAún no hay calificaciones
- informe anhídrido 9,10-dihidroantraceno-9,10-α,β-succínicoDocumento5 páginasinforme anhídrido 9,10-dihidroantraceno-9,10-α,β-succínicoISABELA RENTERIA RUIZAún no hay calificaciones
- EQUILIBRIO DE SISTEMAS NO IDEALES EN DISOLUCIONES ACUOSASDocumento2 páginasEQUILIBRIO DE SISTEMAS NO IDEALES EN DISOLUCIONES ACUOSASIdania CazasAún no hay calificaciones
- Problemas Del Tema de Los Cristales PDFDocumento2 páginasProblemas Del Tema de Los Cristales PDFluis0% (1)
- FisicoquimicaDocumento6 páginasFisicoquimicaDébora MartínezAún no hay calificaciones
- Práctica 5Documento8 páginasPráctica 5Ana ChaparroAún no hay calificaciones
- Informe de Laboratorio II (Analisis Organico Cualitativo RMN)Documento7 páginasInforme de Laboratorio II (Analisis Organico Cualitativo RMN)Julian Camilo Leon MartinezAún no hay calificaciones
- Serie EspectroquímicaDocumento10 páginasSerie Espectroquímicamariliaguillen20% (1)
- Aruquipa Mamani Cristhian Cinetica Quimica 8 PDFDocumento19 páginasAruquipa Mamani Cristhian Cinetica Quimica 8 PDFCristhian Aru.Aún no hay calificaciones
- Tarea 3Documento1 páginaTarea 3Andrea MuñozAún no hay calificaciones
- Absorcion AtomicaDocumento8 páginasAbsorcion AtomicaSacha Ordaz100% (1)
- Energías libres equilibrio químicoDocumento5 páginasEnergías libres equilibrio químicoLaura Cristina BrandAún no hay calificaciones
- PRÁCTICA 14 ColorimetríaDocumento6 páginasPRÁCTICA 14 ColorimetríaPablo SensoAún no hay calificaciones
- Lab Oratorio 8Documento18 páginasLab Oratorio 8erickasegoviacaceresAún no hay calificaciones
- Orta Pérez - PL2 y 3pdfDocumento35 páginasOrta Pérez - PL2 y 3pdfOsmyy OrtaAún no hay calificaciones
- Cuestionario 1 FQIIDocumento4 páginasCuestionario 1 FQIIBryan BautistaAún no hay calificaciones
- Momento1 Grupo 12Documento25 páginasMomento1 Grupo 12TCOAndres15 xAún no hay calificaciones
- Puntos de fusión y ebulliciónDocumento10 páginasPuntos de fusión y ebulliciónDiego Armando Frias VazquezAún no hay calificaciones
- Hilario Interfases Curvas - Ec Young Laplace Sin VideoDocumento18 páginasHilario Interfases Curvas - Ec Young Laplace Sin VideoDante MontañezAún no hay calificaciones
- GUÍA 7 de LABORATORIO - Enzimas MitocondrialesDocumento9 páginasGUÍA 7 de LABORATORIO - Enzimas MitocondrialesAlejandro ReyAún no hay calificaciones
- Tarea de Equilibrio de 2 ComponentesDocumento3 páginasTarea de Equilibrio de 2 ComponentesMaribel MamaniAún no hay calificaciones
- INFORME PRÁCTICA 5 Sulfatos (Autoguardado)Documento8 páginasINFORME PRÁCTICA 5 Sulfatos (Autoguardado)Jeremy HernandezAún no hay calificaciones
- Electro DosDocumento5 páginasElectro DosAna Gabriela Merma ChoqueAún no hay calificaciones
- Deduciendo la Ley de JurinDocumento22 páginasDeduciendo la Ley de Jurindiego97Aún no hay calificaciones
- Tarea No. 3 Espectro UV Visible Analisis Instrumental IBQ UAA 2021 (Completo 2)Documento10 páginasTarea No. 3 Espectro UV Visible Analisis Instrumental IBQ UAA 2021 (Completo 2)Derek Ebenezer Mata NavarroAún no hay calificaciones
- Marchas AnaliticasDocumento20 páginasMarchas AnaliticasPerlaZavaletaAún no hay calificaciones
- Clase 1 2019IIDocumento59 páginasClase 1 2019IIKatty Julieth Rangel GutierrezAún no hay calificaciones
- Semana 4Documento9 páginasSemana 4JV JhonnyAún no hay calificaciones
- Visita Planta de TratamientoDocumento4 páginasVisita Planta de TratamientoSalazar Terrazas Nicole VivianaAún no hay calificaciones
- Informe No 6 Frontera MovilDocumento5 páginasInforme No 6 Frontera MovilAndrea diazAún no hay calificaciones
- Informe de LaboratorioDocumento7 páginasInforme de Laboratorioaleven quispeAún no hay calificaciones
- Cronoamperometría: técnica electroquímica para evaluar sistemas reaccionantesDocumento16 páginasCronoamperometría: técnica electroquímica para evaluar sistemas reaccionantesDiego Evelio MuñozAún no hay calificaciones
- Determinación de Dureza en Muestras de Agua Por Volumetría de Formación de ComplejosDocumento3 páginasDeterminación de Dureza en Muestras de Agua Por Volumetría de Formación de Complejosjuan0521Aún no hay calificaciones
- Problemas Propuestos GravimetríaDocumento1 páginaProblemas Propuestos Gravimetríaalexandrachn100% (1)
- Tiosulfato y CobreDocumento3 páginasTiosulfato y CobrehenryAún no hay calificaciones
- Cuesti Segundo Parci-1labo Ana-AgapitoDocumento7 páginasCuesti Segundo Parci-1labo Ana-AgapitoCaballero Quiroz ReynaldoAún no hay calificaciones
- Titulaciones CoulombimetricasDocumento6 páginasTitulaciones CoulombimetricasNatalia ValenciaAún no hay calificaciones
- ProblemasDocumento2 páginasProblemasRolando Torres Pacheco0% (1)
- Propiedades Coligatias, Descenso Del Punto de CongelaciónDocumento3 páginasPropiedades Coligatias, Descenso Del Punto de CongelaciónJulián Andrés VanegasAún no hay calificaciones
- PolarografiaDocumento7 páginasPolarografiaLoRelys VeGaAún no hay calificaciones
- Iones ComplejosDocumento4 páginasIones ComplejosDany OjedaAún no hay calificaciones
- Analisis de Superficies Mediante AES - XPS y CEMSDocumento53 páginasAnalisis de Superficies Mediante AES - XPS y CEMSLuis AngelAún no hay calificaciones
- Informe 3 Trayectoria ParabólicaDocumento5 páginasInforme 3 Trayectoria ParabólicaRicardo JesusAún no hay calificaciones
- Potencial eléctrico y energía en problemas de físicaDocumento3 páginasPotencial eléctrico y energía en problemas de físicaMariana Plazas OrtizAún no hay calificaciones
- Practica N 2-ANALISIS QUIMICO CUANTITATIVODocumento8 páginasPractica N 2-ANALISIS QUIMICO CUANTITATIVOValentina LunaAún no hay calificaciones
- Informe N°7Documento8 páginasInforme N°7Richard AluchoAún no hay calificaciones
- Determinacion Colorimetrica Del HierroDocumento8 páginasDeterminacion Colorimetrica Del HierroWild Rocha0% (1)
- Análisis de hierro en jarabe por EAA de flamaDocumento15 páginasAnálisis de hierro en jarabe por EAA de flamaCesar Saccsa TacasAún no hay calificaciones
- EnsayoDocumento2 páginasEnsayoDanNyel CruzeAún no hay calificaciones
- Tecnologia de Los Materiales - CONTENIDO UNIDAD 1Documento7 páginasTecnologia de Los Materiales - CONTENIDO UNIDAD 1elindustrialAún no hay calificaciones
- Compatibilidad SanguineaDocumento13 páginasCompatibilidad SanguineaMariana Meza PerezAún no hay calificaciones
- Diagnostic Accuracy of Pulp Vital - En.esDocumento20 páginasDiagnostic Accuracy of Pulp Vital - En.esValeria sanchezAún no hay calificaciones
- Crianza de Aves de Reemplazo para Produccion ComercialDocumento120 páginasCrianza de Aves de Reemplazo para Produccion ComercialFausto Snk GarcesAún no hay calificaciones
- Definición de cereales, sus partes, composición y usos principalesDocumento10 páginasDefinición de cereales, sus partes, composición y usos principalesConcepcion BautistaAún no hay calificaciones
- Etimología de La Palabra AdolescenciaDocumento2 páginasEtimología de La Palabra AdolescenciaAntonio María Sastre JiménezAún no hay calificaciones
- Implementación del SG-SST en Carbuelectricos W.CH.CDocumento4 páginasImplementación del SG-SST en Carbuelectricos W.CH.Cdayana flauteroAún no hay calificaciones
- Guía Técnica Colombiana 86Documento10 páginasGuía Técnica Colombiana 86Luis Dario Mesa LeguizamonAún no hay calificaciones
- Resolución CABA 655Documento4 páginasResolución CABA 655Martin Perez AntelafAún no hay calificaciones
- AnamnesisDocumento9 páginasAnamnesisAngelica Reyes RodriguezAún no hay calificaciones
- La Pirámide Alimenticia: Grupos y BeneficiosDocumento2 páginasLa Pirámide Alimenticia: Grupos y BeneficiosJhosiitaVasquez100% (4)
- Actividad 1 Tema 1Documento5 páginasActividad 1 Tema 1Rolando RolesAún no hay calificaciones
- Trabajo Practico - Modalidad DistanciaDocumento15 páginasTrabajo Practico - Modalidad DistanciaNat StaAún no hay calificaciones
- Fallas de Horizontaly Pincushion en TV SlimDocumento7 páginasFallas de Horizontaly Pincushion en TV SlimVidal Velasquez80% (5)
- Estudio de CasosDocumento3 páginasEstudio de CasosCIRA DE LA HOZAún no hay calificaciones
- Recurso apelación divorcio alimentosDocumento4 páginasRecurso apelación divorcio alimentosVERÓNICA ELIZABETH GUERRA MENDOZAAún no hay calificaciones
- dc24s006 en EsDocumento15 páginasdc24s006 en EsEdiltrudis Padilla RomeroAún no hay calificaciones
- Tecnicas Conductuales en DiabetesDocumento4 páginasTecnicas Conductuales en DiabetesAcoj AcojAún no hay calificaciones
- Tesis Doctorado Manuel Minteguiaga. Versión BibliotecaDocumento578 páginasTesis Doctorado Manuel Minteguiaga. Versión BibliotecaNasha AbascalAún no hay calificaciones
- Recubrimiento ElectrolíticoDocumento6 páginasRecubrimiento ElectrolíticoNestor SanchezAún no hay calificaciones
- Estructura cable par trenzadoDocumento4 páginasEstructura cable par trenzadoAaron Morales100% (1)
- 3 Tema Factores Que Determinen La Atencion..Documento4 páginas3 Tema Factores Que Determinen La Atencion..Jennifer GarcíaAún no hay calificaciones
- Áreas Naturales Protegidas en MéxicoDocumento1 páginaÁreas Naturales Protegidas en Méxicoliz SalazarAún no hay calificaciones
- Suelo, Bosque y Biodiversidad.Documento39 páginasSuelo, Bosque y Biodiversidad.Pablo GalindoAún no hay calificaciones
- El Amor y La InfidelidadDocumento27 páginasEl Amor y La InfidelidadJulissa Rosa Castro CastroAún no hay calificaciones
- Fisioterapeuta CV DuitamaDocumento15 páginasFisioterapeuta CV DuitamaJAVIER GONZALEZAún no hay calificaciones
- BiodiversidadDocumento18 páginasBiodiversidadgonzaleztorresmonserrat31Aún no hay calificaciones
- Miura Limpieza Hepática Con BananasDocumento3 páginasMiura Limpieza Hepática Con Bananascarolina doartero100% (1)
- Investigacion MetodologiaDocumento4 páginasInvestigacion MetodologiamauricioAún no hay calificaciones
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (200)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Anatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasDe EverandAnatomía & 100 estiramientos Esenciales (Color): Técnicas, beneficios, precauciones, consejos, tablas de series, dolenciasCalificación: 4.5 de 5 estrellas4.5/5 (21)
- Reconstrucción de dientes endodonciados: Pautas de actuación clínicaDe EverandReconstrucción de dientes endodonciados: Pautas de actuación clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Desastres y emergencias. Prevención, mitigación y preparaciónDe EverandDesastres y emergencias. Prevención, mitigación y preparaciónCalificación: 4 de 5 estrellas4/5 (5)
- Resumen de Pensar rápido pensar despacio de Daniel KahnemanDe EverandResumen de Pensar rápido pensar despacio de Daniel KahnemanCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Interpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasDe EverandInterpretación del ECG: Una Guía Práctica e Intuitiva para Aprender a Leer el ECG y Diagnosticar y Tratar ArritmiasAún no hay calificaciones
- Disciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreDe EverandDisciplina Mental: Técnicas infalibles para lograr todo lo que te propones y eliminar la pereza y la procrastinación de tu vida para siempreCalificación: 5 de 5 estrellas5/5 (3)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Borges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonDe EverandBorges y la memoria: De "Funes el memorioso" a la neurona de Jennifer AnistonCalificación: 5 de 5 estrellas5/5 (4)
- Cómo hacer aviones de papel y otros objetos voladoresDe EverandCómo hacer aviones de papel y otros objetos voladoresAún no hay calificaciones
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Notas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesDe EverandNotas de clase. Manual de farmacognosia: Análisis microscópico y fitoquímico, y usos de plantas medicinalesAún no hay calificaciones
- Zensorialmente : Dejá que tu cuerpo sea tu cerebroDe EverandZensorialmente : Dejá que tu cuerpo sea tu cerebroAún no hay calificaciones
- Trucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasDe EverandTrucos para Leer la Mente de los Demás: Cómo Adivinar el Pensamiento de los Demás con Poco Esfuerzo. 2 Libros en 1 - Secretos de la Psicología Oscura, Cómo ser un Detector de MentirasCalificación: 4.5 de 5 estrellas4.5/5 (3)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- El cerebro del niño explicado a los padresDe EverandEl cerebro del niño explicado a los padresCalificación: 4.5 de 5 estrellas4.5/5 (147)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- La invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleDe EverandLa invasión de la pseudociencia: Claves para orientarse en un mundo en donde casi todo es posibleCalificación: 4.5 de 5 estrellas4.5/5 (15)