Documentos de Académico
Documentos de Profesional
Documentos de Cultura
P7. Prelab
Cargado por
Karina Sotomayor0 calificaciones0% encontró este documento útil (0 votos)
13 vistas3 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
13 vistas3 páginasP7. Prelab
Cargado por
Karina SotomayorCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 3
Ana Elisa Osornio Díaz Arochi
Laboratorio de Química Orgánica
6 de octubre del 2021
P7. ISOMERIZACÓN DEL ÁCIDO MALEICO.
PRELABORATORIO (10 puntos)
1. Elabora un diagrama de flujo de los pasos a seguir en la parte experimental.
Libreta
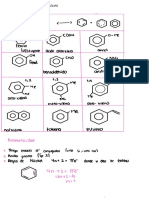
2. Investiga las estructuras del ácido maleico y fumárico y coloca en una tabla sus
puntos de fusión, densidad y solubilidad en agua.
Nombre Ácido maleico Ácido fumárico
Fórmula C4H4O4 C4H4O4
Estructura
Punto de fusión 404 K (131 °C) 287 °C (560 K)
Densidad 1,59 g/cm³ 1,64 g/cm³
Solubilidad en 78 g/100 ml (25 °C) Agua y alcohol
agua
3. Analiza las estructuras y explica las diferencias en sus propiedades físicas recabadas
en el punto anterior.
Ácido maleico. Tiene menor punto de fusión, entonces pasa de sólido a líquido
más rápido.
Ácido fumárico. Tiene menor densidad, entonces estaría más arriba.
Ácido fumárico. Tiene menor solubilidad, entonces no se disuelve tan fácilmente.
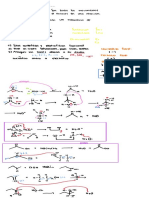
4. Escribe el mecanismo de reacción de la isomerización del ácido maleico a fumárico
catalizada por HCl en medio acuoso.
Ana Elisa Osornio Díaz Arochi
Laboratorio de Química Orgánica
6 de octubre del 2021
5. Investiga cuál es la utilidad de poner una reacción a reflujo.
El reflujo se utiliza principalmente para producir el calentamiento de reacciones que
poseen mayor temperatura que la temperatura ambiente por lo que conviene mantener el
volumen de la reacción constante. Esto permite realizar procesos a temperaturas
superiores al ambiente (reacciones, recristalizaciones, etc), evitando la pérdida de
disolvente por evaporación y que éste salga a la atmósfera.
Consideraciones:
El proceso continuo de evaporación y condensación de disolvente en refrigerante (está en
dispositivo experimental), es el reflujo.
La mayor parte de reacciones que requieren calentamiento se llevan a cabo a reflujo, es
decir, a la temperatura de ebullición normal del disolvente (realmente, la temperatura de
una mezcla a reflujo es ligeramente superior al punto de ebullición del disolvente).
Para garantizar el enfriamiento óptimo del refrigerante, el agua debe entrar por la toma
inferior y salir por la superior con un flujo moderado y continuo, manteniéndose en todo
momento la camisa del refrigerante llena de agua.
Nunca debe calentarse una reacción en matraz cerrado, ya que las sobrepresiones pueden
hacerlo estallar.
Algunas reacciones requieren, además, una atmósfera seca. En esos casos, se suele
acoplar a la boca superior del refrigerante un tubo acodado con cloruro cálcico (su
carácter higroscópico evita la entrada del agua presente en la atmósfera al reactor). En
estos casos, hay que asegurar que el tubo permita el paso del aire, para evitar posibles
sobrepresiones.
Ana Elisa Osornio Díaz Arochi
Laboratorio de Química Orgánica
6 de octubre del 2021
Procedimiento: Se efectúa acoplando a la boca (o a una de las bocas) del matraz que contiene la
reacción un refrigerante de reflujo. A medida que se procede a la calefacción del matraz, la
temperatura aumenta evaporando parte del disolvente. Los vapores de este ascienden por el
cuello del matraz hasta el refrigerante, donde se condensa (por acción del agua fría que circula por
la camisa exterior) volviendo de nuevo al matraz. Esto establece un reflujo continuo de disolvente
que mantiene el volumen de la reacción constante.
6. ¿Cuál es la importancia del HCl en la reacción?
Pues simplemente por su protón de hidrógeno que, al reaccionar con el ácido maleico,
éste pueda transformarse en ácido fumárico.
7. ¿Cómo se prepara una solución de HCl al 24% w/w?
g soluto
w / w= ( 100 )
g disolución
w/ w (g disolvente) 24 ( g disolvente) .
Ya despejado todo :g soluto= = =
100−w/w 100−24 76
8. ¿Cómo se prepara una solución de HCl 1M?
m
M=
L(PM )
m=M (L)(PM )=1(.)(36.458 g/ mol)
También podría gustarte
- Cuestionario 1 QMC-200Documento5 páginasCuestionario 1 QMC-200marco asturizagaAún no hay calificaciones
- Bitacora de TrabajoP4)Documento3 páginasBitacora de TrabajoP4)Alexis GudiñoAún no hay calificaciones
- Laboratorio SLNDocumento11 páginasLaboratorio SLNsantiagoAún no hay calificaciones
- Gravimétrica sulfatosDocumento8 páginasGravimétrica sulfatosAlejandro OlveraAún no hay calificaciones
- Preparación y valoración de solucionesDocumento8 páginasPreparación y valoración de solucionesJuan Sebastian Salgado NaranjoAún no hay calificaciones
- Informe de Química - Propiedades ColigativasDocumento8 páginasInforme de Química - Propiedades ColigativasBRANDON PADILLA FLOREZAún no hay calificaciones
- Reporte 1Documento26 páginasReporte 1Jenifer López100% (1)
- Universidad Nacional de Ingeniería Facultad de Ingeniería Química Y TextilDocumento8 páginasUniversidad Nacional de Ingeniería Facultad de Ingeniería Química Y TextilmarialuisallamocaAún no hay calificaciones
- Lab. Propiedades ColigativasDocumento2 páginasLab. Propiedades ColigativasMarithza Yadira Galindo LozanoAún no hay calificaciones
- Informe 7Documento7 páginasInforme 7Roger LopezAún no hay calificaciones
- Solubilidad Informe UnmsmDocumento27 páginasSolubilidad Informe Unmsmjudith4greenAún no hay calificaciones
- Protocolo 3 - Javier - Canteo 2 13Documento12 páginasProtocolo 3 - Javier - Canteo 2 13JAVIER ALEJANDRO CANTEO MARTINEZAún no hay calificaciones
- Lab ROF-6Documento7 páginasLab ROF-6Liliana CalixtoAún no hay calificaciones
- Analitica N°3 EFECTO DEL ION COMUNDocumento8 páginasAnalitica N°3 EFECTO DEL ION COMUNPilar Ta RuAún no hay calificaciones
- Informe 1. Quimica IiDocumento37 páginasInforme 1. Quimica IiSandra Alejandro BustamanteAún no hay calificaciones
- Re 10 Lab 021 001 Quimica Organica II 1Documento41 páginasRe 10 Lab 021 001 Quimica Organica II 1JhennyAún no hay calificaciones
- Reporte Final OrganicaDocumento10 páginasReporte Final OrganicaArely Patricia Rubio GamezAún no hay calificaciones
- Química OrgánicaDocumento5 páginasQuímica OrgánicaLeidy Viviana Burbano OrtegaAún no hay calificaciones
- Determinación de propiedades coligativasDocumento9 páginasDeterminación de propiedades coligativasPABLO CRUZ RAMIREZAún no hay calificaciones
- Practica 7 - Org PDFDocumento3 páginasPractica 7 - Org PDFJuan CarlosAún no hay calificaciones
- Reacciones QuimicaDocumento39 páginasReacciones Quimicadarkwolf1003Aún no hay calificaciones
- Cuestionario QuimicaDocumento6 páginasCuestionario Quimicaanon_501158537Aún no hay calificaciones
- CRISTALIZACIONDocumento9 páginasCRISTALIZACIONLemon TeaAún no hay calificaciones
- Practica 2. RecristalizacionDocumento5 páginasPractica 2. RecristalizacionLuismi HernandezAún no hay calificaciones
- Taller de Ingenieria D.A IVDocumento6 páginasTaller de Ingenieria D.A IVbolanos.julianaAún no hay calificaciones
- Manual de LabboratorioDocumento30 páginasManual de Labboratorioluis antonio pascual lozanoAún no hay calificaciones
- Laboratorio N°1Documento6 páginasLaboratorio N°1Laura Verónica VillaAún no hay calificaciones
- Practica 4 QuimicaDocumento5 páginasPractica 4 QuimicaDenhi R.Aún no hay calificaciones
- Sintesis - de - Anhidrido Ftalico Por Medio de Intercambio AnhidridoDocumento5 páginasSintesis - de - Anhidrido Ftalico Por Medio de Intercambio AnhidridoAndrea Hernández Carreño0% (1)
- Obtencion de Sulfato de Cobre PentahidratadoDocumento9 páginasObtencion de Sulfato de Cobre PentahidratadoBrenVigueras100% (1)
- Prácticas QOIII PDFDocumento19 páginasPrácticas QOIII PDFElmer CurioAún no hay calificaciones
- 1IM12 S8PE Granados Rodriguez Sandra GuadalupeDocumento12 páginas1IM12 S8PE Granados Rodriguez Sandra Guadalupenicolas granadosAún no hay calificaciones
- Informe de Química 8Documento7 páginasInforme de Química 8docc 14100% (1)
- Lección Propiedades Coligativas JCDocumento6 páginasLección Propiedades Coligativas JCZP Seller67% (3)
- P3 OrganicaDocumento2 páginasP3 OrganicaJonathan Díaz ValdezAún no hay calificaciones
- Cristalización de ácido benzoicoDocumento5 páginasCristalización de ácido benzoicoselena leonAún no hay calificaciones
- Informe 3 de InorganicaDocumento7 páginasInforme 3 de InorganicaSergio Leonardo Elias Carbajal DiazAún no hay calificaciones
- Reporte - P4 - Equipo 17Documento17 páginasReporte - P4 - Equipo 17roberto blazquezAún no hay calificaciones
- Previo p1Documento11 páginasPrevio p1Alex StarrAún no hay calificaciones
- Informe Propiedades ColigativasDocumento7 páginasInforme Propiedades ColigativasAlan CuellarAún no hay calificaciones
- 5TO INFORME DE FIQUI Punto CrioscópicoDocumento22 páginas5TO INFORME DE FIQUI Punto CrioscópicoNatalia Cano Moore100% (5)
- REPORTE N°7 Primer AvanzeDocumento8 páginasREPORTE N°7 Primer AvanzeAlfaro Barrientos Diego MaximilianoAún no hay calificaciones
- Informe Quimica3DESDocumento4 páginasInforme Quimica3DESSaúl PalmaAún no hay calificaciones
- Soluciones y ColoidesDocumento5 páginasSoluciones y ColoidesCristian ClarosAún no hay calificaciones
- Practica 1. Obtencion de CiclohexenoDocumento9 páginasPractica 1. Obtencion de Ciclohexenoosmar BAAún no hay calificaciones
- Practica 10Documento3 páginasPractica 10Ricardo CruzAún no hay calificaciones
- Determinacion Del Coeficiente de Solubilidad de Una Sal AnhidraDocumento5 páginasDeterminacion Del Coeficiente de Solubilidad de Una Sal AnhidraCarlosSusulPeñaMaGañaAún no hay calificaciones
- Informe de Recuperacion - TerminadoDocumento22 páginasInforme de Recuperacion - TerminadoMaira TipanAún no hay calificaciones
- Informe 5 - Recristalizacion de Productos OrganicosDocumento10 páginasInforme 5 - Recristalizacion de Productos OrganicosCarlos MenesesAún no hay calificaciones
- Cuestionarios Isomeria y SustitucionDocumento5 páginasCuestionarios Isomeria y SustitucionAngie JaimesAún no hay calificaciones
- Bqu01 Lab #6 (Lïq Soluciones)Documento8 páginasBqu01 Lab #6 (Lïq Soluciones)Brayan Rivera Argumedo100% (1)
- INFORME Nº6 (ENTALPIA DE UNA REACCION DE NEUTRALIZACION ACIDO - BASE) Andrés-PachecoDocumento6 páginasINFORME Nº6 (ENTALPIA DE UNA REACCION DE NEUTRALIZACION ACIDO - BASE) Andrés-PachecoKeivin Andres PachecoAún no hay calificaciones
- Práctica - # - 6 (LQG) 2010Documento4 páginasPráctica - # - 6 (LQG) 2010César David Franchi Bethencourt67% (3)
- Quimica 4.... ParteDocumento7 páginasQuimica 4.... ParteCrhistian Aquino YupanquiAún no hay calificaciones
- Soluciones 2Documento15 páginasSoluciones 2BrandonAún no hay calificaciones
- Guia de Laboratorio 2Documento7 páginasGuia de Laboratorio 2JhomiraRoñaAún no hay calificaciones
- Procedimiento AguasDocumento8 páginasProcedimiento AguasIglesia Internacional Jesus ElReyAún no hay calificaciones
- INFORME 1 FISICOQUIMICA 2 LabDocumento15 páginasINFORME 1 FISICOQUIMICA 2 Labariel yana morgaAún no hay calificaciones
- Análisis de Una Columna de Absorción de Co2Documento5 páginasAnálisis de Una Columna de Absorción de Co2David EcheverryAún no hay calificaciones
- Compuestos CarbonilicosDocumento1 páginaCompuestos CarbonilicosKarina SotomayorAún no hay calificaciones
- Tarea 4Documento2 páginasTarea 4Karina SotomayorAún no hay calificaciones
- Fundamentos Termodinámicos)Documento4 páginasFundamentos Termodinámicos)Karina SotomayorAún no hay calificaciones
- Ejercicio 9Documento2 páginasEjercicio 9Karina SotomayorAún no hay calificaciones
- Problema Adicional Segundo Examen ParcialDocumento4 páginasProblema Adicional Segundo Examen ParcialKarina SotomayorAún no hay calificaciones
- Arenos o AromaticosDocumento1 páginaArenos o AromaticosKarina SotomayorAún no hay calificaciones
- Haluros de AlquiloDocumento1 páginaHaluros de AlquiloKarina SotomayorAún no hay calificaciones
- Interpol An Do ActDocumento1 páginaInterpol An Do ActKarina SotomayorAún no hay calificaciones
- Flujo VolumétricoDocumento1 páginaFlujo VolumétricoKarina SotomayorAún no hay calificaciones
- Múltiple Entrada y Múltiple SalidaDocumento1 páginaMúltiple Entrada y Múltiple SalidaKarina SotomayorAún no hay calificaciones
- ProblemarioDocumento4 páginasProblemarioKarina SotomayorAún no hay calificaciones
- Balance Por Unidad IzquierdaDocumento2 páginasBalance Por Unidad IzquierdaKarina SotomayorAún no hay calificaciones
- Bomba CalorimetricaDocumento1 páginaBomba CalorimetricaKarina SotomayorAún no hay calificaciones
- Flujo VolumétricoDocumento1 páginaFlujo VolumétricoKarina SotomayorAún no hay calificaciones
- Segundo ParcialDocumento5 páginasSegundo ParcialKarina SotomayorAún no hay calificaciones
- Ejercicios Semanales 2Documento4 páginasEjercicios Semanales 2Karina SotomayorAún no hay calificaciones
- Cálculos Volumétricos Con Ec.'s de EstadoDocumento2 páginasCálculos Volumétricos Con Ec.'s de EstadoKarina SotomayorAún no hay calificaciones
- Balance de Energía para Un Sistema Cerrado-Gas IdealDocumento1 páginaBalance de Energía para Un Sistema Cerrado-Gas IdealKarina SotomayorAún no hay calificaciones
- Problemario Segundo ParcialDocumento9 páginasProblemario Segundo ParcialKarina SotomayorAún no hay calificaciones
- Problemas de ConversiónDocumento1 páginaProblemas de ConversiónKarina SotomayorAún no hay calificaciones
- Parcial 3Documento4 páginasParcial 3Karina SotomayorAún no hay calificaciones
- Ecuaciones Cúbicas de EstadoDocumento4 páginasEcuaciones Cúbicas de EstadoKarina SotomayorAún no hay calificaciones
- Tarea 4Documento2 páginasTarea 4Karina SotomayorAún no hay calificaciones
- Problemas Balances MonocomponentesDocumento4 páginasProblemas Balances MonocomponentesKarina SotomayorAún no hay calificaciones
- Ejercicios Semanales 3Documento5 páginasEjercicios Semanales 3Karina SotomayorAún no hay calificaciones
- Balance Por Unidad IzquierdaDocumento2 páginasBalance Por Unidad IzquierdaKarina SotomayorAún no hay calificaciones
- Examen 1Documento1 páginaExamen 1Karina SotomayorAún no hay calificaciones
- Ejercicio 9Documento2 páginasEjercicio 9Karina SotomayorAún no hay calificaciones
- Ejercicios Semanales 2Documento4 páginasEjercicios Semanales 2Karina SotomayorAún no hay calificaciones
- Total Life Changes (TLC) Manual de Pérdida de PesoDocumento15 páginasTotal Life Changes (TLC) Manual de Pérdida de PesoNoe Caudillo50% (2)
- El MédicoDocumento2 páginasEl MédicoNery HernandezAún no hay calificaciones
- Física I. Profesorado en Química. Unidad 2Documento37 páginasFísica I. Profesorado en Química. Unidad 2Gabo_SchAún no hay calificaciones
- Acta Visita Fabricas de Envases F230-Pm02-IvcDocumento8 páginasActa Visita Fabricas de Envases F230-Pm02-IvcJuan OrtegaAún no hay calificaciones
- Ecuaciones Diferenciales de Orden SuperiorDocumento6 páginasEcuaciones Diferenciales de Orden SuperiorFiorela SCAún no hay calificaciones
- Fuentes Del Derecho Ambiental Diapositivas - IrmaDocumento8 páginasFuentes Del Derecho Ambiental Diapositivas - IrmaRudiel VasquezAún no hay calificaciones
- Prueba de Diagnostico Tecnologia 8 BasicoDocumento4 páginasPrueba de Diagnostico Tecnologia 8 BasicoCaroline Renee Rojas MirandaAún no hay calificaciones
- Rreconocimiento de Puntos de Control (ONCOY LAZO DANNY LUIS)Documento11 páginasRreconocimiento de Puntos de Control (ONCOY LAZO DANNY LUIS)Alex Anderson Casca BolivarAún no hay calificaciones
- Taller de Testing y Calidad de SoftwareDocumento25 páginasTaller de Testing y Calidad de SoftwaresmrmellaAún no hay calificaciones
- Copia MalaDocumento62 páginasCopia MalaMaycol CanoAún no hay calificaciones
- 8 Cristales Mágicos para Brujas PrincipiantesDocumento14 páginas8 Cristales Mágicos para Brujas Principiantesalexa blake blake100% (2)
- Tarea Marco Teórico MetodologíaDocumento11 páginasTarea Marco Teórico MetodologíaFERNANDO PAUL BALCAZAR IZQUIERDOAún no hay calificaciones
- Mat 9u4 PDFDocumento46 páginasMat 9u4 PDFFranco IrigoyenAún no hay calificaciones
- NeuroCoaching Como Oportunidad V2Documento15 páginasNeuroCoaching Como Oportunidad V2Ditmar LafitteAún no hay calificaciones
- Hoja de Vida Formato UnicoDocumento7 páginasHoja de Vida Formato UnicoLa papelería com PopayanAún no hay calificaciones
- Ser Competente en Tecnologia - Una Necesidad para El DesarrolloDocumento9 páginasSer Competente en Tecnologia - Una Necesidad para El DesarrolloCesari Rico GaleanaAún no hay calificaciones
- Los Efectos de Los Lubricantes en La Salud Humana.Documento11 páginasLos Efectos de Los Lubricantes en La Salud Humana.Gabriela Arreaga MgalAún no hay calificaciones
- Informe - Laboratorio 2 FluidosDocumento43 páginasInforme - Laboratorio 2 FluidosVictor UrbanoAún no hay calificaciones
- Universidad Itsmo AmericanaDocumento6 páginasUniversidad Itsmo AmericanaPatricia DiazAún no hay calificaciones
- Algebraactividadsemana 4Documento9 páginasAlgebraactividadsemana 4Alfredo CoronadoAún no hay calificaciones
- Cultivo de BeterragaDocumento16 páginasCultivo de BeterragaFlavio Lagos GutierrezAún no hay calificaciones
- Hoja de Seguridad - Stroby® DFDocumento10 páginasHoja de Seguridad - Stroby® DFSalud Ocupacional - Agricola El Cactus S.A.Aún no hay calificaciones
- Diagnóstico de daños comunes en los pistones de un motorDocumento2 páginasDiagnóstico de daños comunes en los pistones de un motorSebastián Aaron González CantoAún no hay calificaciones
- Comunicacion OrganizacionalDocumento6 páginasComunicacion OrganizacionalKarla Nicole CAún no hay calificaciones
- Catálogo de Máquinas de Gimnasio PDF - Línea Luxuty ConvergentesDocumento35 páginasCatálogo de Máquinas de Gimnasio PDF - Línea Luxuty ConvergentesToni GutierrezAún no hay calificaciones
- UntitledDocumento4 páginasUntitledojeador fantasyAún no hay calificaciones
- Tutorial Alta Lead The WayDocumento52 páginasTutorial Alta Lead The WayMónica Benito LeónAún no hay calificaciones
- Sesion de Aprendizaje N°30Documento10 páginasSesion de Aprendizaje N°30Nelly Dionicia Romero Rodriguez100% (4)
- Pe Lindley 202006 Fin BCDocumento12 páginasPe Lindley 202006 Fin BCCristhian HMAún no hay calificaciones
- Ejercicios de NIOSH-camiDocumento7 páginasEjercicios de NIOSH-camiLUZ CAMILA ARROSQUIPA SUNIAún no hay calificaciones