Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Ejemplo - Informe 9
Cargado por
Xflk lsbtTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Ejemplo - Informe 9
Cargado por
Xflk lsbtCopyright:
Formatos disponibles
lOMoARcPSD|6729515
Informe equilibrio liquido vapor
Química (Universidad Nacional Mayor de San Marcos)
StuDocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
4. DETALLES EXPERIMENTALES
4.1 MATERIALES Y REACTIVOS
a) Materiales
- Equipo especial para puntos de ebullición
- Termómetro de decimas
- Mechero de alcohol
- Refractómetro
- Tubos con tapones de corcho
- Pipetas
b) Reactivos
- 1-propanol Q.P (A)
- Agua destilada (B)
- Acetona
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
4.2 PROCEDIMIENTO EXPERIMENTAL
4.2.1 Determinación de los puntos de ebullición del sistema
a) Se armó el equipo especial para puntos de ebullición, que esta formado por un balón de
125 mL, un refrigerante de reflujo, un separador para retirar el destilado. El equipo estaba
limpio y seco.
b) Se colocó 20 mL de A en el balón y se colocó el termómetro.
c) Se calentó la muestra hasta obtener una ebullición a temperatura constante, evitando
sobrecalentamiento y se anotó la temperatura de ebullición.
d) Con agua helada se enfrió el balón de destilación y se tomó con una pipeta una muestra del
residuo en un tubo limpio y seco y se tapó, al mismo tiempo se extrajo en un tubo seco una
muestra de destilado y se tapó.
e) Se añade cada incremento de la tabla Nº , según el sistema elegido y se repite c) y d) para
cada incremento.
f) Se lavó y seco el balón y se colocó 20mL de B y se repitió los pasos c), d) y e) y añadiendo
los incrementos dados.
4.2.2 Determinación de la composición de las mezclas
a) En tubos con tapón de corcho se preparó 3 mL de las mezclas indicadas en la tabla Nº
b) Se midió el indice de refracción de cada una de las mezclas.
c) Se midió el indice de refracción de los residuos y destilados extraídos.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
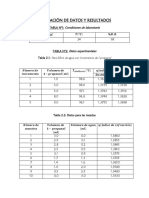
5. TABULACIÓN DE DATOS Y RESULTADOS EXPERIMENTALES
TABLA Nº1: Condiciones experimentales de laboratorio
Presión (mmHg) Temperatura (ºC) HR (%)
756 21 94
TABLA Nº2: Sistema B -> A
Numero de Volumen del Punto de Indice de Indice de
muestra incremento de B ebullición refracción refracción
para añadir a 20 mL (ºC) destilado residuo
de A (mL)
01 0.4 95.5 1.3831 1.3845
02 0.4 92.5 1.3817 1.3843
03 0.4 91.2 1.3808 1.3841
04 0.5 89.5 1.3801 1.3835
05 0.5 88.5 1.3789 1.3830
06 0.5 87.0 1.3786 1.3821
TABLA Nº3: Sistema A -> B
Numero de Volumen del Punto de Indice de Indice de
muestra incremento de A ebullición refracción refracción
para añadir a 20mL (ºC) destilado residuo
de B
07 1.0 95 1.3733 1.3360
08 3.0 93 1.3732 1.3420
09 5.0 92 1.3763 1.3519
10 7.0 94 1.3758 1.3604
11 8.0 93 1.3687 1.3717
12 8.5 93.5 1.3741 1.3761
13 9.0 95 1.3773 1.3778
14 9.5 92 1.3800 1.3782
TABLA Nº4: Curva patrón
Numero de Volumen de Volumen de Volumen Indice de Temperatura
muestra A (mL) B (mL) total (mL) refracción (ºC)
patrón
01-P 3.0 0.0 3.0 1.3839 21.6
02-P 2.9 0.1 3.0 1.3812 21.6
03-P 2.8 0.2 3.0 1.3756 21.6
04-P 2.5 0.5 3.0 1.3750 21.6
05-P 2.1 0.9 3.0 1.3739 21.6
06-P 1.7 1.3 3.0 1.3719 21.6
07-P 1.4 1.6 3.0 1.3686 21.6
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
08-P 1.0 2.0 3.0 1.3579 21.6
09-P 0.5 2.5 3.0 1.3488 21.6
10-P 0.0 3.0 3.0 1.3328 21.6
TABLA Nº5: Composición del destilado y del residuo
Muestra Composición destilado Composición residuo
01 0.7600 1
02 0.6710 1
03 0.6190 1
04 0.5890 0.8200
05 0.3596 0.7600
06 0.5250 0.6770
07 0.3350 0.0150
08 0.3540 0.0230
09 0.4120 0.0560
10 0.4110 0.1050
11 0.2390 0.3040
12 0.3596 0.4130
13 0.4410 0.4770
14 0.5890 0.4450
TABLA N°6: Temperaturas de ebullición
T ebullición n-propanol T ebullición agua destilada T ebullición azeótropo (°C)
(°C) (°C)
97.4 99.9 86.2
DENSIDAD DEL AGUA (TEÓRICA)
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
DENSIDAD DEL N-PROPANOL (TEORICO)
10. APÉNDICE
10.1 CUESTIONARIO
1. Para las mezclas liquidas binarias ideales, explique la aplicación de las leyes de
Dalton y Raoult.
Esta ley de Dalton es la ley de las presiones parciales y establece que en una mezcla de gases
cada gas ejerce una presión igual que la que ejercería si él ocupara el volumen solamente. A
esta presión que ejerce cada componente es lo que se conoce como presión parcial del
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
componente. La presión total del sistema seria la suma de las presiones parciales de todos los
componentes de la mezcla.
La ley de Raoult establece que la presión parcial de vapor de cada componente de una mezcla
ideal de líquidos es igual a la presión de vapor del componente puro multiplicado por la
fracción molar del componente dentro de la mezcla.
Es importante notar que en la ley de Dalton se esta hablando de la presión parcial de una
mezcla de gases, mientras que en la ley de Raoult se esta hablando de la presión parcial de
vapor de una mezcla ideal de líquidos.
2.- Describa y proponga un método experimental para un sistema homologo que aplique
los objetivos de loas práctica.
La presente invención se encuentra relacionada con un método para la separación de
mezclas azeotrópicas de al menos dos componentes, mediante la utilización de nanopartículas
o nanoestructuras de cerámica. Dichas partículas alteran la distribución de equilibrio del
sistema, desplazando el punto azeotrópico y reduciendo las temperaturas de evaporación de la
mezcla. El método comprende las etapas de: seleccionar las nanopartículas o nanoestructuras
de óxido metálico de acuerdo con su compatibilidad con la mezcla química azeotrópica a ser
separada; dispersar las nanopartículas o nanoestructuras de óxido metálico en la mezcla
química azeotrópica; adicionar la dispersión a una cámara de separación; separar la mezcla
química, obteniendo una corriente de vapor que comprende los productos más volátiles y una
corriente líquida que comprende las especies menos volátiles junto con las partículas de
óxido metálico; y alternativamente alimentar la corriente líquida a procesos de recuperación
de partículas.
3.- Adjunte y comente brevemente una publicación científica indexada de los últimos 5
años en referencia al estudio realizado.
MEDICIÓN DEL EQUILIBRIO LÍQUIDO-VAPOR DEL SISTEMA
METANOL-ACETATO DE METILO A 580 mmHg
En este trabajo se midió experimentalmente el equilibrio líquido vapor para el sistema binario
Metanol - Acetato de Metilo a 580 mmHg. Las mediciones experimentales fueron realizadas
utilizando un equipo con recirculación tipo Cottrell. Los datos obtenidos fueron comparados
con los resultados adquiridos de la simulación del equilibrio líquido vapor del sistema bajo
estudio. En la simulación se empleó el modelo de actividad NRTL para representar la no
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
idealidad de la fase líquida (con parámetros encontrados en la literatura), y la ecuación de
estado de Hayden O´Connel para la no idealidad de la fase vapor. De igual manera, se
correlacionaron los datos para encontrar nuevos parámetros del modelo de actividad en
NRTL. Además, a partir de datos experimentales medidos a 760 mmHg encontrados en la
literatura para el sistema estudiado, se verificó la ley de Vresky, la cual permite sin necesidad
de cálculos rigurosos predecir la dirección de desplazamiento de un azeótropo binario cunado
se varía la presión del sistema.
Fuente:
http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-
28042006000100002&lang=pt
2. INTRODUCCIÓN
El presente informe a tratar tiene como objetivo principal determinar el diagrama de
temperatura-composición, para sistemas de líquidos volátiles cuyo comportamiento es
cercano al ideal.
El equilibrio líquido-vapor obedece a mezclas azeotrópicas, que se caracterizan por tener
composiciones constantes en la fase vapor y en la fase líquida, en el punto azeotrópico de la
mezcla donde éste representa la máxima composición de destilado.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
Las mezclas azeotrópicas obedecen a soluciones reales, ya que no obedecen a las leyes de
Raoult y Dalton presentando desviaciones positivas y negativas respecto a esta ley.
La elevación del punto de ebullición que observamos en la experiencia es útil para determinar
la masa molecular relativa de materiales solubles no volátiles.
A su vez, también es útil en un experimento de destilación, el vapor es atraído y condensado
completamente
En ingeniería el término "destilación" se aplica sólo para aquellas operaciones en las cuales la
vaporización de una mezcla líquida produce una fase de vapor que contiene más de un
componente que del otro, queriendo recuperar uno o algunos de los componentes en estado
puro. No obstante, en escala industrial no es práctico este procedimiento, por lo cual en las
industrias de petróleo, del alquitrán de hulla y del alcohol etílico se usan las columnas de
fraccionamiento.
3. PRINCIPIOS TEÓRICOS
3.1 LEY DE RAOULT
Una de las características coligativas1 de soluciones es la disminución de la presión de
vapor que ocurre cuando se agrega soluto a un solvente puro. Raoult encontró que cuando se
agregaba soluto a un solvente puro disminuía la presión de vapor del solvente. Entre más se
agrega más disminuye la presión de vapor. Este estatuto llego a ser conocido como ley de
Raoult.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
Desde un punto de vista molecular, si introducimos partículas no-volátiles de soluto, iones o
moléculas, en un solvente puro, algunas de las partículas del soluto tomarán la posición de
moléculas solventes en la superficie de la solución. La evaporación es un fenómeno
superficial por lo que las moléculas o iones no se convertirán en vapor cuando están
sumergidas por debajo de la superficie. Las partículas sumergidas tienen a otras partículas
que las rodean y las fuerzas entre éstas son suficientes para evitar que las partículas
sumergidas superen dichas fuerzas con la energía cinética disponible para su separación. Sin
embargo las partículas superficiales tienen solamente las partículas debajo de ellas en el
estado líquido. Por lo tanto, las moléculas superficiales son capaces de superar estas fuerzas
internas entre las partículas y entran en estado de vapor. Si las partículas del soluto toman el
lugar de moléculas del solvente y son partículas de soluto no-volátiles, estas bloquean las
moléculas de solvente y evitan la vaporización. Por lo tanto, la presión de vapor del solvente
será menos como resultado de la presencia de las partículas del soluto. A mayor cantidad de
partículas del soluto en la solución (aumento de la concentración) más posiciones
superficiales serán bloqueadas.
La ley de Raoult se expresa matemáticamente como:
3.2 MEZCLA AZEOTROPICA
Un azeótropo, es una mezcla de compuestos químicos (dos o más) diferentes en estado
líquido, los cuales ebullicionan a constante temperatura, y actúan como si fuesen un solo
compuesto químico.
Los azeótropos pueden llegar a ebullición al alcanzar una temperatura mayor, media o más
baja que la de los compuestos químicos que conforman la mezcla, consiguiendo seguir
encontrándose en estado líquido y conservando la composición que tenían en un inicio, al
igual que ocurre con el vapor, por lo cual se hace imposible conseguir separarlos por
destilación de tipo simple o a través de las extracciones líquido-vapor usando otras sustancias
líquidas iónicas como puede ser por ejemplo el cloruro de 1-butil-3metilimidazolio.
Cuando un azeótropo llega a ebullición a través de una temperatura alta máxima se le
denomina azeótropo de ebullición máxima, y en cambio, el que alcanza la ebullición a una
temperatura baja mínima, se le conoce como azeótropo de ebullición mínima.
3.3 SOLUCIONES REALES
Se conocen muchos ejemplos de disoluciones binarias en las que la tendencia de escape de
las moléculas de un componente está alterada por la proximidad de las moléculas del otro.
Estas disoluciones denominadas reales o no ideales no obedecen a la ley de Raoult para todo
el intervalo de su composición. Se admiten dos tipos de desviaciones de la ley de Raoult:
desviación positiva y desviación negativa.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
Cuando la atracción entre moléculas de diferente especie, por ejemplo, moléculas A y B, es
mayor que si se tratase de moléculas iguales como A y A, y B y B, la presión de vapor de la
disolución es menor que la que cabía esperar para una disolución ideal, produciéndose una
desviación negativa. Si la desviación es suficientemente grande, la curva de la presión total
de vapor presenta un mínimo, como se observa en la figura 2, donde A es el cloroformo y B
la acetona.
9. BIBLIOGRAFÍA
- Maron y Pruton, Fundamentos de la Fisicoquímica, editorial Limusa S.A, 2010
- CRC Handbook of Chemistry and Physics 87th Edition.
- Castellan G., “Fisicoquímica”, 2a Ed., Ed. Addison Wesley Longman S. A., México, 1998.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
TABLA DE CONTENIDO
Pag.
RESUMEN
INTRODUCCION
PRINCIPIOS TEORICOS
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
DETALLES EXPERIMENTALES
TABULACION DE DATOS Y RESULTADOS EXPERIMENTALES
EJEMPLOS DE CALCULOS
ANALISIS Y DISCUSIÓN DE RESULTADOS
CONCLUSIONES Y RECOMENDACIONES
BIBLIOGRAFIA
APENDICE
1. RESUMEN
La presente práctica experimental del equilibrio liquido-vapor tuvo como finalidad
determinar el diagrama de temperatura vs composición y el diagrama x-y para un sistema de
una mezcla liquida de dos componentes, para ello utilizamos un equipo especial para puntos
de ebullición.
Las condiciones con las que trabajamos en el laboratorio fueron de presión 756
mmHg, temperatura 21 ºC y HR 94%. Primero se armó el equipo especial para puntos de
ebullición y se agregó a un balón 20 mL de n-propanol para determinar su punto de ebullición
y luego se adiciono pequeñas cantidades de agua para obtener diferentes puntos de ebullición,
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
lo mismo se realizó de manera inversa, colocando 20 mL de agua en el balón y agregando n-
propanol, las muestras de destilado y residuo se les medirá el indice de refracción para
determinar las gráficas correspondientes de composición del componente más volátil, en este
caso el n-propanol.
La temperatura de ebullición del n-propanol fue de 97.4 ºC y la del punto azeotrópico 86.2 ºC
y con una composición molar de 0.515.
En el momento de la destilación se debe tomar la temperatura cuando el sistema empieza a
condensar, no ha hervir, para ello se debe mantener un calentamiento uniforme y lento sobre
el balón.
Se recomienda que la medición de los volúmenes deba ser exacta, ya que es indispensable
para los cálculos posteriores.
7. ANÁLISIS Y DISCUSIÓN DE RESULTADOS
En el sistema n-propanol agregando agua se observó que la temperatura de ebullición
iba disminuyendo debido a que al haber presencia de un alcohol este ebullira primero
que el agua (que ebulle a 100 ºC) por ser el n-propanol más volátil.
El punto de ebullición del azeótropo resulto ser mínimo debido a que en cada mezcla
se observaba un punto de ebullición menor a la de los componentes puros.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
La curva patrón debió salir lo más exacta posible porque es desde esa grafica que
calculamos las fracciones molares para la determinación de la composición del punto
azeotrópico.
8. CONCLUSIONES Y RECOMENDACIONES
El punto azeotrópico es mínimo y por lo tanto es una desviación positiva de la ley
de Raoult.
Las mezclas cuya concentración es menor que la correspondiente, dan lugar en la
ebullición a un vapor más rico en el componente más volátil que el líquido de
partida.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
lOMoARcPSD|6729515
UNMSM-FQIQ DPTO. ACAD. DE FISICOQUÍMICA
La grafica de composición en el destilado vs composición en el residuo nos da el
punto en donde las dos composiciones son iguales.
Las muestras de destilado y residuo deben ser de volumen igual para asi no
modificar la concentración.
El calentamiento con el mechero de alcohol debe ser en forma circular para asi
evitar un calentamiento brusco.
Descargado por Milagros Rojas (matiasrojasapolo@gmail.com)
También podría gustarte
- Informe de Fiqu II Equilibrio Liquido VaporDocumento13 páginasInforme de Fiqu II Equilibrio Liquido VaporWalter HernandezAún no hay calificaciones
- Regla de FasesDocumento19 páginasRegla de FasesKevin VizcarraAún no hay calificaciones
- Informe N°2 (Mezclas Azeótropicas) Grupo 4Documento19 páginasInforme N°2 (Mezclas Azeótropicas) Grupo 4Frank BustosAún no hay calificaciones
- Ejercicios de TQMDocumento11 páginasEjercicios de TQMKaty Melsi Cordova VelasquezAún no hay calificaciones
- L3 LTP7 PeebDocumento14 páginasL3 LTP7 Peebmila PPAún no hay calificaciones
- Trabajo Final de Cáculo IIDocumento22 páginasTrabajo Final de Cáculo IILuis CoaquiraAún no hay calificaciones
- Practica 1: Determinación Experimental de La Presión de Vapor de Un Líquido PuroDocumento10 páginasPractica 1: Determinación Experimental de La Presión de Vapor de Un Líquido PuroEloisa InfiniteAún no hay calificaciones
- Informe RefractómetroDocumento3 páginasInforme RefractómetroEliana pico100% (1)
- Practica - 3 - Rectificacion Por Cachuchas de Burbujeo - Lopez Cortes Jose FernandoDocumento16 páginasPractica - 3 - Rectificacion Por Cachuchas de Burbujeo - Lopez Cortes Jose Fernandomelisa.09.16.01Aún no hay calificaciones
- Inf - Alcohol en GelDocumento15 páginasInf - Alcohol en GelMilagros Huaytalla RamírezAún no hay calificaciones
- PRÁCTICA 2 Termometría, Densitometría y RefractometríaDocumento10 páginasPRÁCTICA 2 Termometría, Densitometría y Refractometríamarutorres941Aún no hay calificaciones
- COESCA Ejercicios Semana 9Documento32 páginasCOESCA Ejercicios Semana 9Cristhian Cordova PonceAún no hay calificaciones
- Rep 3 Equilib L V TerminadoDocumento15 páginasRep 3 Equilib L V TerminadoAreli CervantesAún no hay calificaciones
- 0 AryDocumento2 páginas0 Arydmitryvx100% (1)
- Reporte 2 Regimen No PermanenteDocumento6 páginasReporte 2 Regimen No PermanenteMariana Olalde VenturaAún no hay calificaciones
- LPS Recopilacion de PrácricasDocumento98 páginasLPS Recopilacion de PrácricasNaomi GuerreroAún no hay calificaciones
- Efecto del tiempo de residencia en la conversión de reactores CSTR en serieDocumento11 páginasEfecto del tiempo de residencia en la conversión de reactores CSTR en seriePaul Vallejo PossoAún no hay calificaciones
- 2 - Biofisica PracticaDocumento9 páginas2 - Biofisica PracticaDidi GAún no hay calificaciones
- Practica 7 Reporte.Documento9 páginasPractica 7 Reporte.Angel Anakin Gomez SanchezAún no hay calificaciones
- Informe 9 CalculosDocumento10 páginasInforme 9 CalculosnubrolitoAún no hay calificaciones
- Equilibrio Liquido Vapor Informe 1Documento11 páginasEquilibrio Liquido Vapor Informe 1Joaquín GarcíaAún no hay calificaciones
- Práctica 2 LIQI Regimen NO PermanenteDocumento22 páginasPráctica 2 LIQI Regimen NO PermanenteAlan ZamudioAún no hay calificaciones
- Practica 2Documento5 páginasPractica 2Pepe VRAún no hay calificaciones
- Informe4 - Isotermas de Adsorción - Cardenas - Chávez-Arroyo - Flores & SanchezDocumento11 páginasInforme4 - Isotermas de Adsorción - Cardenas - Chávez-Arroyo - Flores & SanchezAbril Chavez-Arroyo EnzianAún no hay calificaciones
- Laboratorio de Análisis Instrumental 1 Reporte RefractometríaDocumento8 páginasLaboratorio de Análisis Instrumental 1 Reporte RefractometríaMaria Vanessa Dominguez AcevedoAún no hay calificaciones
- Regresión LinealDocumento10 páginasRegresión LinealANDRESAún no hay calificaciones
- Labo1.perdida de Carga.Documento53 páginasLabo1.perdida de Carga.Rosa Carbajal Tello100% (1)
- Procesosinforme 1Documento20 páginasProcesosinforme 1Lourdes Lizbeth GonzalesAún no hay calificaciones
- Informe Determinación Del Índice de RefracciónDocumento18 páginasInforme Determinación Del Índice de RefracciónOLGA MARCELA CASTILLO HERNANDEZAún no hay calificaciones
- Destilación continua: Estudio de la razón de reflujoDocumento15 páginasDestilación continua: Estudio de la razón de reflujoRODRIGO GONZALEZ PEREAAún no hay calificaciones
- Calor Absorbido DisipadoDocumento12 páginasCalor Absorbido DisipadoDaniel Lago VigilioAún no hay calificaciones
- Método GraficoDocumento6 páginasMétodo GraficoJaanee RiverooAún no hay calificaciones
- Informe PolarimetríaDocumento16 páginasInforme PolarimetríaEdgar Andres Cardona DuqueAún no hay calificaciones
- Método de Carter y Tracy RadialDocumento17 páginasMétodo de Carter y Tracy RadialJuan Luis PeraltaAún no hay calificaciones
- Practica 1Documento18 páginasPractica 1Adry G100% (1)
- Ejercicio 4Documento5 páginasEjercicio 4AnTrAx T.LAún no hay calificaciones
- Practica 3 Termo3Documento9 páginasPractica 3 Termo3Anonymous jU0TwwIAún no hay calificaciones
- Practica No. 1Documento20 páginasPractica No. 1Carolina GilbirdAún no hay calificaciones
- Laboratorio de Análisis Instrumental 1 Reporte PolarimetríaDocumento6 páginasLaboratorio de Análisis Instrumental 1 Reporte PolarimetríaMaria Vanessa Dominguez AcevedoAún no hay calificaciones
- Destilacion BatchDocumento5 páginasDestilacion Batchmaka12345Aún no hay calificaciones
- Practica de Laboratorio FQDocumento10 páginasPractica de Laboratorio FQDavidAún no hay calificaciones
- Equilibrio de fases en sistemas binariosDocumento12 páginasEquilibrio de fases en sistemas binariosMau OrtegaAún no hay calificaciones
- Tarea 2Documento6 páginasTarea 2monik100% (1)
- Equilibrio de fases para agua puraDocumento11 páginasEquilibrio de fases para agua puraUsuario 184Aún no hay calificaciones
- Determinación de los valores D, Z y F de Bacillus sp. en condiciones específicasDocumento7 páginasDeterminación de los valores D, Z y F de Bacillus sp. en condiciones específicasjeniAún no hay calificaciones
- Diagramas de EquilibrioDocumento6 páginasDiagramas de EquilibriomarianAún no hay calificaciones
- Ingenieria Quimica: Laboratorio y Taller de Proyectos Séptimo SemestreDocumento12 páginasIngenieria Quimica: Laboratorio y Taller de Proyectos Séptimo SemestreErika GarciaAún no hay calificaciones
- Reporte Practica 5 Destilacion ESIQIEDocumento22 páginasReporte Practica 5 Destilacion ESIQIEAraceli GarcíaAún no hay calificaciones
- Destilacion BachDocumento13 páginasDestilacion Bachherald anco gomezAún no hay calificaciones
- Laboratorio #6 Control de Calidad 2017Documento38 páginasLaboratorio #6 Control de Calidad 2017aleAún no hay calificaciones
- Diagrama de Sillen.Documento3 páginasDiagrama de Sillen.YENNIFER REBECA SANTOS CALDERONAún no hay calificaciones
- Informe 1 Crioscopia Casi FinalDocumento8 páginasInforme 1 Crioscopia Casi FinalAnita UshiñaAún no hay calificaciones
- Distribución de Tiempos de Residencia Lab de ReactoresDocumento18 páginasDistribución de Tiempos de Residencia Lab de ReactoresManuel Alejandro Sanabria LiendroAún no hay calificaciones
- Diagrama de Fases 2Documento17 páginasDiagrama de Fases 2Alexhitoo TlvAún no hay calificaciones
- Dia Numero Cinco QuimicaDocumento5 páginasDia Numero Cinco Quimicasebastian espitiaAún no hay calificaciones
- Metodo de JobDocumento6 páginasMetodo de JobVERONICA ALEXANDRA RODRIGUEZ MORENOAún no hay calificaciones
- Termicas Labo 1Documento7 páginasTermicas Labo 1thiagoAún no hay calificaciones
- Informe Nº04 Yefri y Darvich PDFDocumento7 páginasInforme Nº04 Yefri y Darvich PDFYefriPerezAún no hay calificaciones
- Modelado fenomenológico del proceso de combustión por difusión diéselDe EverandModelado fenomenológico del proceso de combustión por difusión diéselAún no hay calificaciones
- Introducción a la dinámica computacional de fluidos (CFD) en Ingeniería Química.De EverandIntroducción a la dinámica computacional de fluidos (CFD) en Ingeniería Química.Aún no hay calificaciones
- Constantes BásicasDocumento15 páginasConstantes BásicasXflk lsbtAún no hay calificaciones
- Clase 11 G. Gas Natural - Generacion Electrica y PetroquimicaDocumento34 páginasClase 11 G. Gas Natural - Generacion Electrica y PetroquimicaXflk lsbtAún no hay calificaciones
- Clase 12 D. Ciclo CombinadoDocumento11 páginasClase 12 D. Ciclo CombinadoXflk lsbtAún no hay calificaciones
- Clase 13.ciclos de RefrigeraciónDocumento30 páginasClase 13.ciclos de RefrigeraciónXflk lsbtAún no hay calificaciones
- Clase 11 E.conferencia Cogeneracion y Ahorro de EnergiaDocumento25 páginasClase 11 E.conferencia Cogeneracion y Ahorro de EnergiaXflk lsbtAún no hay calificaciones
- Clase 09 Eficiencia Isentropica de Toberas, Ahorro de Energía en CompresoresDocumento26 páginasClase 09 Eficiencia Isentropica de Toberas, Ahorro de Energía en CompresoresXflk lsbtAún no hay calificaciones
- Clase 16. Flujo Compresible en Toberas y DifusoresDocumento46 páginasClase 16. Flujo Compresible en Toberas y DifusoresXflk lsbtAún no hay calificaciones
- Flujo Isotermico de Gases en TuberiasDocumento12 páginasFlujo Isotermico de Gases en TuberiasXflk lsbtAún no hay calificaciones
- Clase 10. Compresion y Expansion Real de Compresores y TurbinasDocumento18 páginasClase 10. Compresion y Expansion Real de Compresores y TurbinasXflk lsbtAún no hay calificaciones
- Plantilla StarsDocumento1 páginaPlantilla StarsMarianaAún no hay calificaciones
- Clase 11 A Generacion de Energia Ciclo Potencia A GasDocumento39 páginasClase 11 A Generacion de Energia Ciclo Potencia A GasXflk lsbtAún no hay calificaciones
- Clase 11 C. Generacion de Energia Ciclo Potencia A GasDocumento17 páginasClase 11 C. Generacion de Energia Ciclo Potencia A GasXflk lsbtAún no hay calificaciones
- BrushPen MinDocumento7 páginasBrushPen MinXflk lsbtAún no hay calificaciones
- Caligrafía Imprenta Mayúscula by CarlysletritasDocumento9 páginasCaligrafía Imprenta Mayúscula by CarlysletritasXflk lsbt100% (1)
- Carátula + Mapa Mental + Apunte AmarilloDocumento3 páginasCarátula + Mapa Mental + Apunte AmarilloXflk lsbtAún no hay calificaciones
- Apuntes DigitalesDocumento13 páginasApuntes DigitalesAna EstefaniaAún no hay calificaciones
- Plantilla Figuras MinimalDocumento1 páginaPlantilla Figuras MinimalElda TorresAún no hay calificaciones
- Informe N°10 Regla de FasesDocumento29 páginasInforme N°10 Regla de FasescarmenAún no hay calificaciones
- Apunte PastelDocumento1 páginaApunte PastelXflk lsbtAún no hay calificaciones
- Apunte RojoDocumento1 páginaApunte RojoXflk lsbtAún no hay calificaciones
- Apunte Verde AguaDocumento1 páginaApunte Verde AguaXflk lsbtAún no hay calificaciones
- Apunte NaranjitaDocumento2 páginasApunte NaranjitaXflk lsbtAún no hay calificaciones
- Definición y subtemasDocumento1 páginaDefinición y subtemasKarol Guarin VillamizarAún no hay calificaciones
- Carátula + Mapa Mental + Apunte MoradoDocumento3 páginasCarátula + Mapa Mental + Apunte MoradoXflk lsbtAún no hay calificaciones
- Ejemplo - Informe 11Documento23 páginasEjemplo - Informe 11Xflk lsbtAún no hay calificaciones
- Apunte NaranjaDocumento1 páginaApunte NaranjaXflk lsbtAún no hay calificaciones
- Ejemplo - Informe 9Documento24 páginasEjemplo - Informe 9Xflk lsbtAún no hay calificaciones
- Regla de Fases DiagramaDocumento16 páginasRegla de Fases DiagramaJoselyn Matias BrañezAún no hay calificaciones
- Ejemplo - Informe 11Documento11 páginasEjemplo - Informe 11Xflk lsbtAún no hay calificaciones
- Investigación Experimental Sobre La Dislexia en Niños de PrimariaDocumento36 páginasInvestigación Experimental Sobre La Dislexia en Niños de PrimariaYoselynAún no hay calificaciones
- 03 Rendimiento Global de La InstalaciónDocumento8 páginas03 Rendimiento Global de La InstalaciónPaul PiguaveAún no hay calificaciones
- Segundo Día - Evaluación Pedagógica y Entrevista - 2023Documento4 páginasSegundo Día - Evaluación Pedagógica y Entrevista - 2023Raul Mayor0% (1)
- Memorándum 001 - 2023Documento2 páginasMemorándum 001 - 2023Kristel Lucero Alexandra Mendoza RomanAún no hay calificaciones
- DivisorTensionCorrienteDocumento18 páginasDivisorTensionCorrienteJordy Ubillus GuillenAún no hay calificaciones
- Criticas Al Inductivismo IngenuoDocumento5 páginasCriticas Al Inductivismo IngenuoNadia Valeria MaldiniAún no hay calificaciones
- VestimentaDocumento4 páginasVestimentaMarc ZenAún no hay calificaciones
- Evaluación Continua N°03Documento12 páginasEvaluación Continua N°03FelipeAún no hay calificaciones
- Sílabo de Panadería y PasteleríaDocumento17 páginasSílabo de Panadería y PasteleríaLuis Ricardo Reyes ValladolidAún no hay calificaciones
- "T" Horizontal, Perfil "I", Aluminio: THI - 24 24 - 24 - P5Documento1 página"T" Horizontal, Perfil "I", Aluminio: THI - 24 24 - 24 - P5DianaHerreraAún no hay calificaciones
- Análisis Teórico y Grafico de ReferenteDocumento22 páginasAnálisis Teórico y Grafico de ReferenteManchas NyaAún no hay calificaciones
- Jorge Norberto Cornejo La Estrella FlamigeraDocumento6 páginasJorge Norberto Cornejo La Estrella FlamigeraAnibal SuarezAún no hay calificaciones
- La Globalización y El Comercio InternacionalDocumento5 páginasLa Globalización y El Comercio InternacionalJerome MartinezAún no hay calificaciones
- Aproximaciones Conceptuales Representativas para Cada Rama de La PsicologíaDocumento5 páginasAproximaciones Conceptuales Representativas para Cada Rama de La PsicologíaGustavo GuzmánG0% (1)
- Primera PracticaDocumento16 páginasPrimera PracticaKellys BritoAún no hay calificaciones
- Miranda Ramirez Ana Rosa M17S1AI2Documento14 páginasMiranda Ramirez Ana Rosa M17S1AI2Alexander MWAún no hay calificaciones
- Ensayo de La Salud BucalDocumento6 páginasEnsayo de La Salud BucalfrabciscoAún no hay calificaciones
- Modulo Comunicación para La ComprensiónDocumento16 páginasModulo Comunicación para La ComprensiónBasilio Cruz MillánAún no hay calificaciones
- Infografia Inteligencia EmocionalDocumento2 páginasInfografia Inteligencia EmocionalJohn Beltrán Ramírez67% (3)
- Presentacion Final WordDocumento14 páginasPresentacion Final WordJonathan Valerio Angles MengoaAún no hay calificaciones
- Fugas - James RhodesDocumento226 páginasFugas - James RhodesYazmina DíazAún no hay calificaciones
- Matematica5 11Documento90 páginasMatematica5 11maridido2009Aún no hay calificaciones
- Hoja 10 2021Documento2 páginasHoja 10 2021Karolina GliwaAún no hay calificaciones
- LenguajeDocumento18 páginasLenguajegleidysAún no hay calificaciones
- Conditional Sentences ExplainedDocumento7 páginasConditional Sentences ExplainedHufflyAún no hay calificaciones
- Deshidratacion OsmoticaDocumento13 páginasDeshidratacion Osmoticaanita renosa alvarezAún no hay calificaciones
- Aquagen DeskalDocumento1 páginaAquagen DeskaljilljiAún no hay calificaciones
- Talento SudamericanoDocumento11 páginasTalento SudamericanoLuis Fernando Laiza Infantes100% (1)
- Escurrimiento Superficial PDFDocumento45 páginasEscurrimiento Superficial PDFFranco CorsinoAún no hay calificaciones
- Plan de Trabajo Instalacion de Tuberias de Cobre Rev1Documento7 páginasPlan de Trabajo Instalacion de Tuberias de Cobre Rev1Jose Alvitrez100% (3)