Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fisiopatologia de La Diabetes I PDF
Cargado por
Jimmy StephensDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Fisiopatologia de La Diabetes I PDF
Cargado por
Jimmy StephensCopyright:
Formatos disponibles
www.medigraphic.org.
mx
Revista de Endocrinologa y Nutricin
Vol. 21, No. 3 Julio-Septiembre 2013 pp 98-106
Artculo de revisin
Fisiopatologa de la diabetes y los mecanismos
de muerte de las clulas pancreticas
Rodolfo Daniel Cervantes-Villagrana,* Jos Miguel Presno-Bernal**
Resumen
La diabetes mellitus es una enfermedad metablica caracterizada por un defecto en la regulacin de la glucemia por la insulina.
En la actualidad, la prevalencia de diabetes es alta en la poblacin mexicana, ocupando el segundo lugar en las principales causas
de mortalidad. La diabetes comnmente se clasifica con base en el origen que la desencadena, por lo cual existe la diabetes tipo 1,
tipo 2, MODY, entre otras. La fisiopatologa de la enfermedad involucra un deterioro progresivo de la integridad de las clulas
pancreticas encargadas de la secrecin de insulina en respuesta al incremento de la glucemia. La muerte celular como consecuencia
de la hiperglucemia es un proceso comn en los diferentes tipos de diabetes, y el esclarecimiento de los mecanismos involucrados
en dicho proceso permitir el desarrollo de nuevas estrategias teraputicas tiles para prevenir el dao e incluso revertir la prdida de la masa celular en pacientes con diabetes avanzada. En este trabajo se revisan algunos procesos que se alteran durante la
diabetes, como la secrecin de insulina y la sealizacin del receptor para insulina, adems de los mecanismos que participan en
la prdida de la integridad de las clulas pancreticas por fenmenos inflamatorios.
Palabras clave: Diabetes, apoptosis, clulas .
Abstract
Diabetes mellitus is a metabolic disease characterized by a defect in the regulation of blood glucose by insulin. Currently, the
prevalence of diabetes is high in the Mexican population, ranking as the second leading cause of mortality. Commonly diabetes
is classified based on the trigger source, whereby diabetes is type 1, type 2, MODY, among others. The pathophysiology of the
disease involves progressive deterioration of the integrity of pancreatic -cells responsible for the secretion of insulin in response
to increased blood glucose. Cell death as a result of hyperglycemia is a common process in the different types of diabetes, and the
elucidation of the mechanisms involved in this process will foster the development of new therapeutic strategies useful in preventing the damage and even reversing the loss of cell mass in patients with advanced diabetes. In this paper, we review some of the
processes that are altered during diabetes, including insulin secretion, and insulin receptor signaling, as well as the mechanisms
involved in the loss of integrity of the pancreatic -cells by inflammatory phenomena.
Key words: Diabetes, apoptosis, -cells.
www.medigraphic.org.mx
* Departamento de Investigacin Clnica, Laboratorio Carpermor.
** Direccin Proyectos e Investigacin.
Grupo Diagnstico Mdico Proa.
Recibido: 07-Mayo-2013
Aceptado: 13-Junio-2013
Este artculo puede ser consultado en versin completa en http://www.medigraphic.com/endocrinologia
Revista de Endocrinologa y Nutricin 2013;21(3):98-106
Introduccin
La diabetes mellitus pertenece a un grupo de enfermedades metablicas y es consecuencia de la deciencia en el efecto de la insulina, causada por una
alteracin en la funcin endocrina del pncreas o
por la alteracin en los tejidos efectores, que pierden
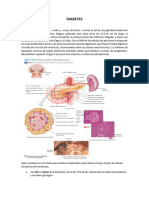
su sensibilidad a la insulina.1 Los islotes pancreticos
estn constituidos por cuatro tipos celulares: clulas
, , y PP o F, las cuales sintetizan y liberan hormonas como insulina, glucagn, somatostatina y el
polipptido pancretico, respectivamente. Durante
la diabetes mellitus, la glucemia se eleva a valores
anormales hasta alcanzar concentraciones nocivas
para los sistemas siolgicos, provocando dao en
el tejido nervioso (neuropatas), alteraciones en la
retina (retinopata), el rin (nefropata) y en prcticamente el organismo completo, con un pronstico
letal si no se controla.2
La diabetes mellitus representa un grave problema de salud pblica. Su incidencia oscila entre el
1-2% de la poblacin mundial. El tipo ms frecuente
es la diabetes no insulinodependiente (DMNID), o
tipo 2. Segn el INEGI, en el 2010 fue la segunda
causa de muerte en mujeres y varones en Mxico:
en ese ao se registraron 592,018 defunciones,
cuyas principales causas fueron las enfermedades
del corazn (105,144), la diabetes mellitus (82,964)
y los tumores malignos (70,240). La mortalidad es
ms prevalente en mujeres (43,267) que en hombres
(39,692). La Encuesta Nacional de Salud y Nutricin
(ENSANUT) 2012 muestra que se increment la
prevalencia de diabetes hasta en 9.1% en la poblacin mexicana, principalmente en mujeres con ms
de 40 aos. El estudio de esta enfermedad se ha
convertido en una prioridad, dadas su prevalencia
y complejidad. En esta revisin se estudian algunos
mecanismos que se alteran durante la diabetes,
como la secrecin de insulina y la sealizacin del
receptor para insulina, adems de aqullos que participan en la prdida de la integridad de las clulas
pancreticas. Los nuevos hallazgos en relacin con
la muerte de las clulas han permitido explorar
el diseo de nuevas estrategias para determinar el
pronstico de la enfermedad, as como el diseo de
nuevas terapias para impedir la muerte de las clulas
y, posiblemente, la terapia celular para suplantar
y revertir el proceso patolgico.
al aporte energtico del consumo de alimentos.
Su liberacin es inducida principalmente en respuesta al incremento de glucemia, pero al mismo
tiempo es regulada por diversas sustancias (nutrimentos, hormonas gastrointestinales, hormonas pancreticas, neurotransmisores del sistema
nervioso autnomo, entre otras). La glucosa, los
aminocidos, los cidos grasos y los cuerpos cetnicos favorecen la secrecin de insulina, al igual
que la activacin del receptor 2-adrenrgico y
la estimulacin del nervio vago, mientras que los
receptores 2-adrenrgicos inhiben la liberacin
de insulina.3-5
La despolarizacin de la clula provoca la liberacin de insulina; el proceso inicia con el aumento
de la concentracin plasmtica de carbohidratos:
la fructosa y la glucosa ingresan en la clula a
travs del transporte facilitado mediado por el
transportador de glucosa 2 (GLUT2). El GLUT2 es
un transportador de glucosa con baja anidad, se
expresa en el hgado, rin, clulas del pncreas y
en la membrana basolateral de las clulas epiteliales del intestino delgado.6,7 El GLUT2 participa en la
regulacin de la secrecin de insulina: slo permite
el transporte de glucosa cuando la concentracin
plasmtica alcanza el umbral de anidad como
sustrato de GLUT2 (>70mg/dL), y en respuesta
conduce a la liberacin de la cantidad requerida
de insulina para mantener la concentracin de glucosa. Despus de la ingesta de alimento, el hgado,
por su parte, es capaz de incorporar la glucosa a
travs del GLUT2 para convertirla rpidamente en
glucgeno (polmero de carbohidratos como almacn de los mismos). De forma inversa, durante el
perodo postprandial tardo (perodo comprendido
entre 6 y 8 horas de ayuno), el glucgeno sufre
degradacin para generar molculas de glucosa,
que salen de la clula heptica a la circulacin sistmica, preservando de esta manera la glucemia en
valores siolgicos; por lo anterior, el GLUT2 es un
transportador bidireccional que puede transportar
glucosa desde la sangre al tejido o desde el tejido
hacia la sangre, segn se requiera. El GLUT2 tiene
tambin la capacidad de transportar fructosa, por
la presencia de un segmento existente en GLUT5
(transportador de fructosa clsico), y sustituye el
presente en GLUT de alta anidad por la glucosa,
como el GLUT1. El GLUT5 es un transportador
especco para fructosa que se expresa fundamentalmente en las clulas del ribete en cepillo
del intestino delgado, donde modula la absorcin
de fructosa desde el lumen a la clula epitelial intestinal, y no reconoce a la glucosa.8,9
www.medigraphic.org.mx
Liberacin y accin de la insulina
La liberacin de insulina es un proceso indispensable en la homeostasis del cuerpo como respuesta
99
100
Rodolfo Daniel Cervantes-Villagrana y col. Fisiopatologa de la diabetes y los mecanismos de muerte de las clulas pancreticas
Tras el ingreso de la glucosa (o fructosa) al
interior de la clula mediante el GLUT2, el carbohidrato es fosforilado (glucosa-6-fosfato, G6-P) por la glucocinasa; este proceso determina
la velocidad de gluclisis y de los subsecuentes
procesos oxidativos que culminan con el incremento en la relacin ATP/ADP del citosol. Finalmente, la despolarizacin de la clula ocurre a
causa del cierre de los canales de K+ sensibles a
ATP (KATP), incrementando el potencial de membrana hasta alcanzar la apertura de canales de
Ca2+ dependientes de voltaje tipo L. La entrada
de Ca2+ citoslico induce la fusin de la vescula
exoctica que contiene insulina con la membrana
plasmtica.3,10,11
El canal KATP es un octmero compuesto de
cuatro subunidades Kir 6.2 y cuatro SUR1; ambos
tipos de subunidades tienen dominios de unin a
nucletidos. La subunidad Kir 6.2 se encarga de
la respuesta inhibidora inducida por la unin con
ATP. La subunidad SUR1 tiene sitios de unin para
el ADP y el diazxido (que favorecen la apertura
del conducto), as como para las sulfonilureas y
meglitinida (ambas inhiben la apertura conducto);
por lo tanto, algunas mutaciones en las subunidades alteran la liberacin de insulina.12,13 Las protenas cinasa C y A (PKC y PKA, respectivamente)
participan en la fosforilacin de protenas que
promueven la exocitosis de insulina; adems, pueden fosforilar al canal KATP, facilitando su cierre.3
Transduccin de seales del receptor
a insulina
La insulina es un miembro de la familia de pptidos denominada factores de crecimiento
insulinoides (IGF). El IGF-1 o somatomedina es
un mediador de la hormona del crecimiento; los
receptores de insulina y de IGF-1 tienen una relacin tan estrecha que la insulina puede unirse con
baja anidad al receptor de IGF-1 y viceversa.14 El
receptor de insulina est presente en todas las
clulas de los mamferos, tiene actividad tirosinacinasa intrnseca y est conformado por dos
subunidades y dos . Las subunidades son
extracelulares y tienen el sitio de unin a ligando,
mientras que las subunidades son hidrofbicas
y atraviesan la membrana, tienen un dominio con
varios residuos de tirosina, un dominio tirosinacinasa y un sitio de unin a ATP. Cuando se une la
insulina al receptor, la subunidad inuye en la
para accionar la tirosinacinasa, se autofosforila en
residuos de tirosina, y esto inicia la actividad de
cinasa contra otras protenas como los sustratos
del receptor de insulina (IRS-1 a 4), que junto con
la protena Shc participan como protenas de andamiaje para otras.
El receptor de insulina se internaliza inmediatamente despus de la unin con insulina, lo que
puede llevar a su degradacin o reciclaje.2,15 La
actividad de la tirosinacinasa disminuye por el
AMPc o la fosforilacin de residuos de serina/
treonina en la subunidad ; con frecuencia, la PKC
y la PKA fosforilan los residuos serina/treonina del
receptor para nalizar la sealizacin, pero esta
modicacin postraduccional puede producir
insulinorresistencia inducida por la secrecin excesiva de catecolaminas en situaciones adversas;2
adems, las diversas cinasas serina/treonina tambin fosforilan los IRSs como mecanismo de retroalimentacin negativa del receptor a insulina.16
La mutacin en el sitio del ATP o el reemplazo de
los residuos de tirosina en el receptor de insulina
produce su desensibilizacin a pesar de la unin
de la insulina.15
Existen dos isoformas del receptor para insulina producto del procesamiento alternativo del
RNAm, el IR-A y B. En el msculo y pncreas se
expresa principalmente el receptor IR-A y es colocalizado con el IRS-1, mientras que en el hgado,
el tejido adiposo blanco y pardo, y en los riones
se expresa el IR-B junto con el IRS-3. La va transduccional de cada receptor lleva a dos seales
distintas, el IR-A sealiza fundamentalmente vas
antiapoptticas, mientras que el IR-B sealiza la
diferenciacin celular.17-19 El efecto de la insulina
sobre las clulas promueve la supervivencia para
mantener la funcin e integridad de las mismas.
Los IRS son molculas que participan en la
sealizacin de insulina para el crecimiento, supervivencia y metabolismo. El IRS-1 y -2 inducen
la translocacin de GLUT1 y GLUT4 a la membrana
celular; el IRS-3 y -4 actan de manera negativa
en la sealizacin del receptor IGF-1 por supresin del IRS-1 y -2. Estudios sugieren que el IRS-1
incrementa la secrecin de insulina inducida por
glucosa y sulfonilureas en las clulas .20 Los IRS
pueden activar a la fosfatidilinositol-3-cinasa
(PI3K), enzima que fosforila fosfatidilinositol-4,5bifosfato (PIP2) para producir fosfatidilinositol3,4,5-trifosfato (PIP3) como segundo mensajero
para activar diferentes protenas como la protena
cinasa B (PKB/Akt), la cual, dentro de sus funciones, activa factores de transcripcin,15 activa la
sintasa de glucgeno y participa en la antiliplisis;
la PKB participa en la translocacin de GLUT4
www.medigraphic.org.mx
Revista de Endocrinologa y Nutricin 2013;21(3):98-106
101
en adipocitos.21 Un polimorsmo en el IRS-1 de
humano se asocia con la resistencia a la insulina
y el riesgo de desarrollar diabetes tipo 2 a travs
de la inhibicin del sitio tirosinacinasa.15
islotes y contra GAD o contra insulina representa
un riesgo alto para desarrollar diabetes tipo 1.15
Clasificacin y epidemiologa
de las hiperglucemias
La obesidad mrbida se asocia con el desarrollo
de diferentes enfermedades, entre las que destacan la diabetes y la hipertensin. La obesidad es
una consecuencia de la ingesta continua y desregulada de alimento rico en contenido energtico
que no es aprovechado como consecuencia de
una baja actividad metablica y/o sedentarismo,
por lo tanto, se almacena y acumula en tejido
graso. Durante esta situacin, el pncreas tiene
una hiperactividad por la concentracin alta y
constante de glucosa en sangre, con una secrecin
de insulina elevada para conservar la glucemia en
niveles normales.25
Las causas que desencadenan la diabetes
tipo 2 se desconocen en el 70-85% de los pacientes; al parecer, influyen diversos factores
como la herencia polignica (en la que participa
un nmero indeterminado de genes), junto con
factores de riesgo que incluyen la obesidad,
dislipidemia, hipertensin arterial, historia familiar de diabetes, dieta rica en carbohidratos,
factores hormonales y una vida sedentaria.
Los pacientes presentan niveles elevados de
glucosa y resistencia a la accin de la insulina
en los tejidos perifricos.24 Del 80 al 90% de
las personas tienen clulas sanas con capacidad de adaptarse a altas demandas de insulina
(obesidad, embarazo y cortisol) mediante el
incremento en su funcin secretora23 y en la
masa celular.26 Sin embargo, en el 10 al 20% de
las personas se presenta una deficiencia de las
clulas en adaptarse, lo cual produce un agotamiento celular, con reduccin en la liberacin
y almacenamiento de insulina.23
La diabetes tipo 2 se asocia con una falta de
adaptacin al incremento en la demanda de insulina, adems de prdida de la masa celular por la
glucotoxicidad. Sin embargo, el receptor a insulina
presenta alteraciones en su funcin. Cuando la insulina se une a su receptor en clulas del msculo, inicia
las vas de sealizacin complejas que permiten la
translocacin del transportador GLUT4 localizado
en vesculas hacia la membrana plasmtica para
llevar a cabo su funcin de transportar la glucosa
de la sangre al interior de la clula.27 La sealizacin
del receptor termina cuando es fosforilado en los
residuos de serina/treonina en la regin intracelular
para su desensibilizacin, y nalmente esto permite
la internalizacin del receptor.28,29
Las hiperglucemias se clasican principalmente en
diabetes tipo 1, tipo 2, hiperglucemias asociadas a
mutaciones y algunas hiperglucemias producto de
circunstancias traumticas o secundarias a otras
enfermedades. En el cuadro I se enlistan algunas
hiperglucemias y su clasicacin desde el punto
de vista de su etiologa.
Fisiopatologa y aspectos moleculares
de la diabetes tipo 1
La diabetes tipo 1, tambin conocida como diabetes insulinodependiente, inicia comnmente
desde la infancia y se considera una enfermedad
inamatoria crnica causada por la destruccin
especca de las clulas en los islotes de Langerhans del pncreas. Como se mencion anteriormente, estas clulas tienen como funcin
primordial la secrecin de insulina en respuesta
al incremento en la glucemia.22 Existen distintas
causas por las cuales puede ocurrir la destruccin
de los islotes: virus, agentes qumicos, autoinmunidad cruzada o, incluso, una predisposicin
gnica.23
Durante la etapa previa al inicio de la diabetes
tipo 1, en el 80% de los individuos se detectan
anticuerpos contra antgenos citoplasmticos o
membranales de las clulas pancreticas como
la descarboxilasa del cido glutmico 65 y 67
(GAD65 y 67), la protena de choque trmico 65
(Hsp-65), y contra insulina.15 Sin embargo, la mayor
susceptibilidad para desarrollar diabetes tipo 1 se
encuentra en los genes del antgeno leucocitario
humano (HLA clase II) del cromosoma 6, que contribuyen con el 50% del riesgo, y son asociados
algunos polimorsmos genticos en los sitios de
unin del pptido.22,24 Mediante la identicacin
de estos anticuerpos en personas sanas, se establece el riesgo de desarrollar la enfermedad; por
ejemplo, la presencia de anticuerpos contra insulina conere un riesgo pequeo, mientras que la
combinacin de anticuerpos contra clulas de los
Fisiopatologa de la diabetes tipo 2
www.medigraphic.org.mx
Rodolfo Daniel Cervantes-Villagrana y col. Fisiopatologa de la diabetes y los mecanismos de muerte de las clulas pancreticas
102
Diabetes tipo MODY (maturity-onset
diabetes of the young) y otras hiperglucemias
La glucocinasa (hexocinasa IV) es una enzima
que funciona como un sensor de glucosa y cataliza su fosforilacin; se expresa en tejidos que
regulan el metabolismo de la glucosa, como el
hgado y pncreas. Las mutaciones en el gen de
dicha enzima ocurren en cierto tipo de diabetes del adulto de inicio juvenil (maturity-onset
diabetes of the young, MODY2), y llevan a una
disminucin en la capacidad de fosforilar la glucosa.15 Cuando las clulas se someten a dosis
altas de glucosa de manera crnica, disminuye
la cantidad y la actividad de la glucocinasa;
adems, la glicacin de factores de trascripcin
del gen de glucocinasa, reduce el ARNm y se
revierte con aminoguanidina.30
En la diabetes gestacional, el aumento de
estrgenos y progesterona produce hiperplasia
de las clulas del pncreas y, por consiguiente,
se afecta el metabolismo de los carbohidratos,
aumentando la secrecin de insulina. Durante
la segunda mitad del embarazo (a partir de las
24-28 semanas), el metabolismo de los carbohidratos se afecta al aumentar la produccin de
somatostatina corinica humana placentaria,
prolactina, cortisol y glucagn, lo que contribuye
a una diminucin de la tolerancia a la glucosa y
a mayor resistencia a la insulina.24 Tambin se ha
determinado hipovitaminosis D; al administrar
esta vitamina, la hiperglucemia gestacional dismi-
Cuadro I. Clasificacin de los diferentes tipos de hiperglucemias causadas por diversas mutaciones genticas y secundarias
a un proceso patolgico. Modificado de Guzmn y Madrigal, 2003; Davis, 2006.
Tipo
Caracterstica
Diabetes tipo 1 (insulinodependiente)
DM de tipo 1A
DM de tipo 1B
Destruccin autoinmune de las clulas .
Carecen de inmunomarcadores indicadores de un proceso autoinmune destructivo de las
clulas pancreticas. La categora 1B idioptica.
Diabetes tipo 2 (no insulinodependiente)
DM tipo 2 comn
Vara entre resistencia a la insulina predominante con dficit relativo de insulina y
defecto secretor de insulina predominante con resistencia a la insulina.
Diabetes del adulto de inicio juvenil
MODY 1
MODY 2
MODY 3
MODY 4
MODY 5
MODY 6
MODY X
Mutacin en gen del factor nuclear de hepatocitos 4 (HNF-4).
Mutacin en el gen de glucocinasa.
Mutacin en gen del factor nuclear de hepatocitos 1 (TCF-1).
Mutacin en el gen del factor promotor insulnico 1 (IPF1).
Mutacin en el gen del factor nuclear de hepatocitos 1 (HNF-1).
Mutacin en el gen de diferenciacin neurgena (NEUROD1).
Mutacin en el gen de RNAt de leucina mitocndrica.
Mutaciones en el gen de la insulina.
Mutaciones en el gen del receptor.
Tipos de diabetes secundarias a circunstancias o patologas primarias
Diabetes por pancreatopata
www.medigraphic.org.mx
Diabetes como consecuencia de endocrinopatas
Otras
MODY = maturity onset diabetes of the young.
Pancreatitis crnica
Operaciones quirrgicas
Diabetes tropical
Enfermedad de Cushing
Glucocorticoides
Acromegalia
Diabetes gestacional
Diabetes secundaria a supresin inmunitaria
Diabetes que acompaa sndromes genticos como el de Prader-Willi
Diabetes por farmacoterapia
Revista de Endocrinologa y Nutricin 2013;21(3):98-106
nuye de manera rpida y transitoria, quiz porque
incrementa la sensibilidad a la glucosa. La deciencia de vitamina D resulta en una resistencia a
la insulina, incrementa la sntesis y secrecin de
insulina, quiz por la activacin de canales de Ca2+
dependientes de voltaje mediante un mecanismo
transduccional desconocido; cabe resaltar la presencia del receptor citoslico/nuclear de vitamina
D en las clulas . La entrada de Ca2+ facilita la exocitosis, as como la activacin de endopeptidasas
que convierten proinsulina en insulina.31
Los glucocorticoides como la dexametasona en
exceso disminuyen el IRS-1 e incrementan el IRS-2;
adems, disminuyen la actividad de la PI3K y PKB
en adipocitos.21 Las mismas alteraciones se presentan
en hepatocitos
infectados
con el virus de
Este documento
es elaborado
por Medigraphic
la hepatitis C en la va transduccional del receptor
a insulina.32 En los pacientes diabticos se detecta
hipercortisolemia, que es una de las causas de la
deciencia en la cicatrizacin de heridas, porque
los glucocorticoides disminuyen la sntesis de
colgeno tipo I y II.33 En algunos pacientes con
diabetes tipo 2 se ha diagnosticado la enfermedad
de Cushing, que consiste en un adenoma hipersecretor de la hormona corticotropina (ACTH) en
la glndula pituitaria, que provoca hipercortisolemia; la extraccin del tumor por ciruga mejora la
sensibilidad a la insulina, as como la tolerancia a
la glucosa.34
Muerte de las clulas -pancreticas
en la diabetes tipo 1
Los mecanismos de destruccin o muerte de las
clulas -pancreticas son diversos, pero involucran una respuesta autoinmune mediada por
anticuerpos especcos contra protenas de las
clulas , as como la actividad directa de clulas
inmunes, como clulas T citotxicas (CTc) y natural killer (NK).35 En el diagnstico de diabetes
tipo 1, los primeros anticuerpos detectados son
contra insulina. Los autoanticuerpos pueden ser
transferidos desde la madre diabtica tipo 1 al
feto durante el embarazo. Los anticuerpos contra
insulina permanecen en el neonato por un ao, y
los dirigidos contra GAD (decarboxilasa del cido
glutmico), hasta ms de 18 meses.22 Adems, los
anticuerpos contra la albmina srica bovina y
la casena producen una inmunidad cruzada con
la insulina y las clulas del pncreas;36 estudios
muestran que el consumo de leche de vaca a
temprana edad puede ser diabetognica en nios
con familiares con diabetes tipo 1.24
103
La destruccin de las clulas se asocia principalmente con la activacin de dos vas apoptticas: la va por la perforina-granzima y la va del
ligando Fas (FasL).37 Estos inductores apoptticos son sintetizados en CTc y NK; la perforina, la
granzima y algunas citocinas inamatorias son
liberadas sobre la supercie de la clula objetivo. Por otro lado, el FasL se localiza como una
protena integral en la membrana de la clula T
y reconoce a un receptor de la muerte conocido
como Fas o CD95, el cual se encuentra implicado en el desarrollo de diabetes tipo 1 y 2.35 Los
ratones con una mutacin en el gen del receptor
Fas no desarrollan diabetes, y los anticuerpos
ZB4 capaces de antagonizar a Fas muestran una
proteccin de las clulas .23
El exceso crnico de glucosa exacerba el dao
en el pncreas, produce toxicidad en las clulas
-pancreticas (glucotoxicidad) e involucra la
activacin de la apoptosis por el receptor Fas a
travs del incremento en la produccin de IL-1.23
La glucotoxicidad induce la produccin de IL-1 en
la clula y, en consecuencia, la sobreexpresin de
Fas en la membrana. El incremento de la expresin
de la protena inhibitoria FLICE (FLIP) inhibe la
apoptosis inducida por la activacin del receptor
Fas y por las citocinas mediante el bloqueo de
la activacin de la caspasa 8; por el contrario, la
sealizacin del receptor Fas se dirige a la proliferacin. Sin embargo, la excesiva estimulacin
con glucosa puede disminuir la expresin de FLIP,
facilitando la va de apoptosis.26
La expresin de Fas inducida por citocinas requiere la activacin del factor nuclear B (NFB),
ste se encuentra en el citoplasma de manera
normal unido a una protena inhibidora de B
(IB) y es activado por la fosforilacin de IB
(por la cinasa IKK) y su posterior degradacin
en proteosoma. La glucosa, la IL-1 y el incremento de Ca2+ intracelular inducen la activacin
de NFB; por lo tanto, el bloqueo de la va de
este factor de transcripcin evita la apoptosis
inducida por citocinas; por ejemplo, el bloqueo
de la actividad de IKK por el salicilato de sodio
(frmaco antiinamatorio no esteroideo) protege a las clulas de apoptosis por glucosa
e IL-1, previene el incremento del receptor de
prostaglandinas EP3, disminuye los niveles de
AMPc y la produccin de ON.23 La bsqueda de
una estrategia ecaz de inmunomodulacin es
un reto actual. El bloqueo del FasL o del receptor Fas con anticuerpos puede ser un blanco
teraputico til para evitar la apoptosis de las
www.medigraphic.org.mx
104
Rodolfo Daniel Cervantes-Villagrana y col. Fisiopatologa de la diabetes y los mecanismos de muerte de las clulas pancreticas
clulas ; sin embargo, la repercusin de los
efectos adversos es desconocida.38
En cultivos celulares de los islotes, la glucotoxicidad puede revertirse con insulina o con los
factores de crecimiento insulinoide (IGF-1 y IGF-2),
que incrementan la supervivencia de las clulas
por activacin de las protenas ERK1/2, PI3K
y mTOR va IRS-2. La hiperglucemia produce la
glicacin de molculas celulares, incrementa las
especies reactivas del oxgeno y activa la familia
de protenas cinasas activadas por mitgeno
(MAPKs).39 En clulas epiteliales del intestino, los
altos niveles de glucosa disminuyen los niveles
de glutation, fomentando la generacin de estrs
oxidativo; sin embargo, puede ser revertido por
el uso del antioxidante cido -lipoico y la inhibicin de NFB incrementa los niveles de glutation.
Tambin, el incremento de glucosa promueve la
actividad de iNOS, mientras que la inhibicin de
NFB evita el incremento de actividad de iNOS.40
La citocina proinamatoria TNF induce apoptosis
de las clulas , y su efecto se potencia por el
IFN.35
Muerte de las clulas -pancreticas
en la diabetes tipo 2
La mayora de los triglicridos del cuerpo se
encuentran en el tejido adiposo (>95%), y la liplisis determina el suministro de cidos grasos
sistmicos; la insulina y las catecolaminas son
los principales reguladores de este proceso. La
insulina tiene un efecto antilipoltico, y durante la
diabetes se pierde, incrementa la liplisis e induce hipertrigliceridemia mediante la produccin
de lipoprotena de muy baja densidad (VLDL),
proceso que contribuye a la aterognesis.41 Las
cadenas largas de cidos grasos en el plasma normalmente son reguladas por la insulina, y durante
la resistencia a la insulina, incrementan y producen
toxicidad de clulas (lipotoxicidad), que junto
con la toxicidad de la glucosa dan el fenmeno
diabtico (glucolipotoxicidad).23,42
El tejido adiposo tiene la capacidad de liberar
diversas protenas diabetognicas como el TNF,
la IL-6, leptina, adipocitocinas, resistina y cidos
grasos libres, los cuales incrementan en la obesidad y pueden afectar a las clulas , mientras
que la adiponectina disminuye.43,44 La leptina es
una hormona sintetizada en el tejido adiposo;
acta en el centro de saciedad localizado en el
hipotlamo, donde disminuye el apetito al inducir
la sensacin de saciedad; durante la obesidad, el
receptor para leptina en el sistema nervioso se
desensibiliza, lo cual evita la saciedad y favorece
el incremento gradual en la ingesta de alimento.45
Mientras tanto, en el pncreas la leptina puede
inducir apoptosis en las clulas porque inhibe la
biosntesis de insulina, incrementa reacciones inamatorias y produce estrs oxidativo. Durante la
diabetes autoinmune, la administracin de leptina
acelera el proceso diabetognico, fenmeno que
relaciona a la obesidad con la diabetes. La resistina
produce aumento de citocinas como la IL-6 y TNF
al activar el NFB, mientras que la adiponectina
es antiinamatorio por supresin de fosforilacin
de IB y, por lo tanto, inactivacin de NFB.23,26 En
general, la prdida en el equilibrio en la concentracin local y sistmica de citocinas deletreas y
protectoras de la funcin de las clulas culmina
con la muerte celular.46
La liplisis es el proceso en el que los triglicridos son hidrolizados a mono- y diglicridos
intermedios hasta cidos grasos y glicerol mediante la activacin de la lipasa sensible a hormona
(HSL). La insulina estimula la lipasa de lipoprotena
(LPL), que se encarga de fraccionar en partculas
a las lipoprotenas unidas a triglicrido para que,
de esta manera, puedan incorporarse al tejido
adiposo.41 Algunos cidos grasos libres y lipoprotenas son proapoptticos para la clula , otros
son protectores, de tal manera que la exposicin
prolongada por ejemplo, de palmitato parece
ser altamente txica, mientras que el cido graso monosaturado como el oleato protege a la
clula de apoptosis inducida por el palmitato
y la glucosa.26 Las terapias modernas que se encuentran en investigacin consideran el uso de
clulas troncales o precursoras pancreticas que
puedan reprogramarse para la generacin de clulas funcionales con la capacidad de integrarse
en el pncreas como una estrategia teraputica
en diabetes.47
www.medigraphic.org.mx
Conclusiones
Los procesos involucrados en la muerte de las
clulas durante la diabetes tipo 1 y 2 requieren
un estudio exhaustivo para comprender la siopatologa y los blancos teraputicos que permitan
Revista de Endocrinologa y Nutricin 2013;21(3):98-106
el diseo de nuevos frmacos. La prevencin del
proceso de muerte o el rescate de las clulas frente al proceso inamatorio permitirn avanzar en la
resolucin de esta enfermedad; incluso es posible
pensar en la implementacin del uso de clulas
madre o precursoras que puedan dar lugar a la
diferenciacin de las clulas para compensar la
prdida en pacientes con la enfermedad en curso.
17.
18.
19.
Bibliografa
Polonsky KS: The past 200 years in diabetes. N Engl J
Med. 2012; 367: 1332-1340.
2. Taylor R, Agius L: The biochemistry of diabetes. Biochem
J. 1988; 250: 625-640.
3. Doyle ME, Egan JM: Pharmacological agents that directly
modulate insulin secretion. Pharmacol Rev. 2003; 55: 105-131.
4. Zhao A, Ohara-Imaizumi M, Brissova M, Benninger RKP,
Xu Y, Hao Y, Abramowitz J, Boulay G, Powers AC, Piston
D, Jiang M, Nagamatsu S, Birnbaumer L, Gu G: Go represses insulin secretion by reducing vesicular docking in
pancreatic -cells. Diabetes. 2010; 59: 2522-2529.
5. Santulli G, Lombardi A, Sorriento D, Anastasio A, Del Giudice
C, Formisano P, Bguinot F, Trimarco B, Miele C, Iaccarino G:
Age-related impairment in insulin release: the essential role
of (2)-adrenergic receptor. Diabetes. 2012; 61: 692-701.
6. Mardones L, Ormazabal V, Romo X, Jaa C, Binder P,
Pea E, Vergara M, Ziga FA: The glucose transporter-2
(GLUT2) is a low affinity dehydroascorbic acid transporter.
Biochem Biophys Res Commun. 2011; 410: 7-12.
7.
Zheng Y, Scow JS, Duenes JA, Sarr MG: Mechanisms of
glucose uptake in intestinal cell lines: role of GLUT2. Surgery. 2012; 151: 13-25.
8. Bermdez V, Bermdez F, Arraiz N, Leal E, Linares S,
Mengual E, Valdelamar L, Rodrguez M, Sey H, Amell A,
Carrillo M, Silva C, Acosta A, Aez J, Andara C, Angulo V,
Martins G: Biologa molecular de los transportadores de
glucosa: clasicacin, estructura y distribucin. Archivos
Venezolanos de Farmacologa y Teraputica. 2007; 26:
76-86.
9. Wright EM, Loo DD, Hirayama BA: Biology of human sodium glucose transporters. Physiol Rev. 2011; 91: 733-794.
10. Lang J: Molecular mechanisms and regulation of insulin
exocytosis as a paradigm of endocrine secretion. Eur J
Biochem. 1999; 259: 3-17.
11. Ashcroft FM: ATP-sensitive potassium channelopathies:
focus on insulin secretion. J Clin Invest. 2005; 115: 2047-2058.
12. Miki T, Nagashima K, Seino S: The structure and function
of the ATP-sensitive K+ channel in insulin-secreting pancreatic beta-cells. J Mol Endocrinol. 1999; 22: 113-123.
13. Saint-Martin C, Arnoux JB, de Lonlay P, Bellann-Chantelot
C: KATP channel mutations in congenital hyperinsulinism.
Seminars in Pediatric Surg. 2011; 20: 18-22.
14. Fujimoto K, Polonsky KS: Pdx1 and other factors that
regulate pancreatic -cell survival. Diabetes Obes Metab.
2009; 11: 30-37.
15. Davis SN: Insulina, hipoglucemiantes orales y propiedades
farmacolgicas del pncreas endocrino. In: Brunton LL,
Lazo JS, Parker KL y cols. Goodman y Gilman. Las bases
farmacolgicas de la teraputica. 11th ed. McGraw-Hill;
2006. pp. 1613-1645.
16. Copps KD, White MF: Regulation of insulin sensitivity
by serine/threonine phosphorylation of insulin receptor
1.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
substrate proteins IRS1 and IRS2. Diabetologia. 2012; 55:
2565-2582.
Serrano R, Villar M, Martnez C, Carrascosa JM, Gallardo
N, Andrs A: Differential gene expression of insulin receptor isoforms A and B and insulin receptor substrates
1, 2 and 3 in rat tissues: modulation by aging and differentiation in rat adipose tissue. J Mol Endocrinol. 2005;
34: 153-161.
Ozaki K: Insulin receptor-related receptor in rat islets of
Langerhans. Eur J Endocrinol. 1998; 139: 244-247.
Belore A, Frasca F, Pandini G, Sciacca L, Vigneri R: Insulin
receptor isoforms and insulin receptor/insulin-like growth
factor receptor hybrids in physiology and disease. Endocr
Rev. 2009; 30: 586-623.
Sesti G, Federici MF, Hribal ML, Lauro D: Defects of the
insulin receptor substrate (IRS) system in human metabolic disorders. FASEB J. 2001; 15: 2099-2111.
Burn J, Liu HX, Jensen J, Eriksson JW: Dexamethasone
impairs insulin signalling and glucose transport by depletion of insulin receptor substrate-1, phosphatidylinositol
3-kinase and protein kinase B in primary cultured rat
adipocytes. Eur J Endocrinol. 2002; 146: 419-429.
Achenbach P, Bonifacio E, Koczwara K, Ziegler AG:
Natural history of type 1 diabetes. Diabetes. 2005; 54:
S25-S31.
Maedler K: Beta cells in type 2 diabetes a crucial contribution to pathogenesis. Diabetes Obes Metab. 2008; 10:
408-420.
Guzmn JN, Madrigal BE: Revisin de las caractersticas
clnicas, metablicas y genticas de la diabetes mellitus.
Bioquimia. 2003; 28: 14-23.
Sharabi Y: Management of the unholy trinity diabetesobesity-hypertension (diabesotension). Diabetes Metab
Res Rev. 2012; In press.
Donath MY, Ehses JA, Maedler K, Schumann DM, Ellingsgaard H, Eppler E, Reinecke M: Mechanisms of -cell death
in type 2 diabetes. Diabetes. 2005; 54: S108-S113.
Chen Y, Wang Y, Zhang J, Deng Y, Jiang L, Song, Wu
XS, Hammer JA, Xu T, Lippincott-Schwartz J: Rab10 and
myosin-Va mediate insulin-stimulated GLUT4 storage
vesicle translocation in adipocytes. J Cell Biol. 2012; 198:
545-560.
Cipolletta E, Campanile A, Santulli G, Sanzari E, Leosco D,
Campiglia P, Trimarco B, Iaccarino G: The G protein coupled
receptor kinase 2 plays an essential role in beta-adrenergic
receptor-induced insulinresistance. Cardiovasc Res. 2009;
84: 407-415.
Stckli J, James DE: Insulin action under arrestin. Cell
Metab. 2009; 9: 213-214.
Kooptiwut S, Kebede M, Zraika S, Visinoni S, Aston MK,
Favaloro J, Tikellis C, Thomas MC, Forbes JM, Cooper
ME, Dunlop M, Proietto J, Andrikopoulos S: High glucoseinduced impairment in insulin secretion is associated
with reduction in islet glucokinase in a mouse model of
susceptibility to islet dysfunction. J Mol Endocrinol. 2005;
35: 39-48.
Palomer X, Gonzlez JMC, Blanco FV, Mauricio D: Role of
vitamin D in the pathogenesis of type 2 diabetes mellitus.
Diabetes Obes Metab. 2008; 10: 185-197.
Negro F, Alaei M: Hepatitis C virus and type 2 diabetes.
World J Gastroenterol. 2009; 15: 1537-1547.
Bitar MS: Glucocorticoid dynamics and impaired wound
healing in diabetes mellitus. Am J Pathol. 1998; 152: 547-554.
Taniguchi T, Hamasaki A, Okamoto M: Subclinical hypercortisolism in hospitalized patients with type 2 diabetes
mellitus. Endocr J. 2008; 55: 429-432.
www.medigraphic.org.mx
31.
32.
33.
34.
105
106
Rodolfo Daniel Cervantes-Villagrana y col. Fisiopatologa de la diabetes y los mecanismos de muerte de las clulas pancreticas
35. Kim S, Kim KA, Suk K, Kim YH, Oh SH, Lee MK, Kim KW,
Lee MS: Apoptosis of human islet cells by cytokines. Immune Netw. 2012; 12: 113-117.
36. Vaarala O, Knip M, Paronen J, Hmlinen AM, Muona P,
Vtinen M, Ilonen J, Simell O, Akerblom HK: Cows milk
formula feeding induces primary immunization to insulin
in infants at genetic risk for type 1 diabetes. Diabetes.
1999; 48: 1389-1394.
37. Mandrup-Poulsen T: -Cell apoptosis stimuli and signaling.
Diabetes. 2001; 50: S58-S63.
38. Hamad AR, Arcara K, Uddin S, Donner T: The potential
of Fas ligand (apoptosis-inducing molecule) as an unconventional therapeutic target in type 1 diabetes. Front
Immunol. 2012; 3: 196.
39. Ma F, Wei Z, Shi C, Gan Y, Lu J, Frank SJ, Balducci J, Huang
Y: Signaling cross talk between growth hormone (GH)
and insulin-like growth factor-I (IGF-I) in pancreatic islet
-cells. Mol Endocrinol. 2011; 25: 2119-2133.
40. Powell LA, Warpeha KM, Xu W, Walter B, Trimble ER: High
glucose decreases intracellular glutathione concentrations
and upregulates inducible nitric oxide synthase gene
expression in intestinal epithelial cells. J Mol Endocrinol.
2004; 33: 797-803.
41. Coppack SW, Jensen MD, Miles JM: In vivo regulation of
lipolysis in humans. J Lipid Res. 1994; 35: 177-193.
42. Kluth O, Mirhashemi F, Scherneck S, Kaiser D, Kluge R,
Neschen S, Joost HG, Schrmann A: Dissociation of lipo-
43.
44.
45.
46.
47.
toxicity and glucotoxicity in a mouse model of obesity
associated diabetes: role of forkhead box O1 (FOXO1) in
glucose-induced beta cell failure. Diabetologia. 2011; 54:
605-616.
Berg AH, Scherer PE: Adipose tissue, inammation, and
cardiovascular disease. Circ Res. 2005; 96: 939-949.
Mathieu P, Poirier P, Pibarot P, Lemieux I, Desprs JP: Visceral
obesity: the link among inammation, hypertension, and
cardiovascular disease. Hypertension. 2009; 53: 577-584.
Varela L, Horvath TL: Leptin and insulin pathways in POMC
and AgRP neurons that modulate energy balance and
glucose homeostasis. EMBO Rep. 2012. In press.
Wang C, Guan Y, Yang J: Cytokines in the progression of
pancreatic -cell dysfunction. Int J Endocrinol. 2010; 2010:
515136.
Soejitno A, Prayudi PK: The prospect of induced pluripotent stem cells for diabetes mellitus treatment. Ther Adv
Endocrinol Metab. 2011; 2: 197-210.
Correspondencia:
M. en C. Rodolfo Daniel Cervantes-Villagrana
Dr. Enrique Gonzlez Martnez Nm. 109,
Col. Santa Mara La Ribera, 06400,
Del. Cuauhtmoc, Mxico, D.F.
Tel: 1946 1012
E-mail: rdancervantes@hotmail.com
www.medigraphic.org.mx
También podría gustarte
- Diabetes - 1 With Cover Page v2Documento10 páginasDiabetes - 1 With Cover Page v2cesar gomezAún no hay calificaciones
- Fisiopatología de la diabetes y los mecanismos de muerte de las células β pancreáticasDocumento10 páginasFisiopatología de la diabetes y los mecanismos de muerte de las células β pancreáticasDaniela AtencioAún no hay calificaciones
- Fisiopatología Diabetes MellitusDocumento5 páginasFisiopatología Diabetes MellitusFrancisco Javier ChavezAún no hay calificaciones
- Fapi1 U2 A2 BelgDocumento11 páginasFapi1 U2 A2 BelgElena LucioAún no hay calificaciones
- Aspectos Moleculares en La Diabetes Mellitus.Documento12 páginasAspectos Moleculares en La Diabetes Mellitus.lesly giangAún no hay calificaciones
- Case Files Biochemistry 3E by Harms, Konrad P.Seifert JR., William E.Strobel, Henry W.Toy, Eugene C (Z-Lib - Org) - 125-131 ESDocumento8 páginasCase Files Biochemistry 3E by Harms, Konrad P.Seifert JR., William E.Strobel, Henry W.Toy, Eugene C (Z-Lib - Org) - 125-131 ESbopeepout papuAún no hay calificaciones
- Diabetes Mellitus Tipo 2: Conociendo Su FisiopatologiaDocumento9 páginasDiabetes Mellitus Tipo 2: Conociendo Su FisiopatologiaWilbert Quispe MaytaAún no hay calificaciones
- Insulinas e Hipoglicemiantes Orales 2Documento13 páginasInsulinas e Hipoglicemiantes Orales 2Margaret RendónAún no hay calificaciones
- Fisiopatologia de La DiabetesDocumento58 páginasFisiopatologia de La Diabeteseder tovar rementeriaAún no hay calificaciones
- Conversatorio de A Diabetica - FinalDocumento14 páginasConversatorio de A Diabetica - FinalLaura del marAún no hay calificaciones
- Actualizacion en DM Tipo 2Documento47 páginasActualizacion en DM Tipo 2sofialaramedinaAún no hay calificaciones
- DM GrupalDocumento10 páginasDM GrupalAlexandra FiqueredoAún no hay calificaciones
- ProcesoDocumento50 páginasProcesoPizán Estrada Luis AlbertoAún no hay calificaciones
- Trabajo Fisiologia Diabetes 1Documento8 páginasTrabajo Fisiologia Diabetes 1maria alejandraAún no hay calificaciones
- Farmacoterapia de Las Diabetes CompletoDocumento27 páginasFarmacoterapia de Las Diabetes CompletoBenjamin Alonso Rodriguez MadalengoitiaAún no hay calificaciones
- Octeto Ominoso de La DiabetesDocumento10 páginasOcteto Ominoso de La DiabetesNicolas Torres100% (4)
- Fisiopatología de La Diabetes Tipo 2Documento4 páginasFisiopatología de La Diabetes Tipo 2Luis Miguel Marlo EstelaAún no hay calificaciones
- Bioquímica de La DiabetesDocumento14 páginasBioquímica de La DiabetesMeda Mamani100% (1)
- Diabetes Tipo 2 Gluco-lipo-Toxicidad y Disfuncion de La Celula Beta PancreaticaDocumento20 páginasDiabetes Tipo 2 Gluco-lipo-Toxicidad y Disfuncion de La Celula Beta PancreaticaZahyra PcgAún no hay calificaciones
- Patologia de CarbohidratosDocumento22 páginasPatologia de CarbohidratosChristian Hidalgo AmasifuenAún no hay calificaciones
- DiabetesDocumento8 páginasDiabetesDaisys AcuñaAún no hay calificaciones
- Cuestionario Fisiopatología - Diabetes MellitusDocumento7 páginasCuestionario Fisiopatología - Diabetes MellitusCarla Marliz Ore Jaime100% (1)
- Universidad Privada Norbert Wiener Trabajo Diabetes Tipo 2 - Zip (Andrea Astucuri)Documento43 páginasUniversidad Privada Norbert Wiener Trabajo Diabetes Tipo 2 - Zip (Andrea Astucuri)Roxana Magaly Chavez PillacaAún no hay calificaciones
- DiabetesDocumento12 páginasDiabetesdairo garciaAún no hay calificaciones
- Tratamiento de La Diabetes Miellitus en CaninosDocumento8 páginasTratamiento de La Diabetes Miellitus en CaninosMARIA CAMILA BALLEN CABALLEROAún no hay calificaciones
- Articulo SGLT2Documento16 páginasArticulo SGLT2Santos Pardo GómezAún no hay calificaciones
- DM 1Documento7 páginasDM 1luis martinez garciaAún no hay calificaciones
- DiabetesDocumento4 páginasDiabetesKathia MariaAún no hay calificaciones
- Universidad Privada Norbert Wiener Trabajo Diabetes Tipo 2 FinalDocumento47 páginasUniversidad Privada Norbert Wiener Trabajo Diabetes Tipo 2 FinalRoxana Magaly Chavez PillacaAún no hay calificaciones
- Diabetes Dm2 FinalDocumento72 páginasDiabetes Dm2 FinalLupita Padilla SánchezAún no hay calificaciones
- Análisis Molecular de La Disfunción de La Célula B Pancreática en La Progresión de La Diabetes Tipo 2. Su Aplicación A Nuevos Blancos TerapéuticosDocumento86 páginasAnálisis Molecular de La Disfunción de La Célula B Pancreática en La Progresión de La Diabetes Tipo 2. Su Aplicación A Nuevos Blancos TerapéuticosEnrique Hernández VillaseñorAún no hay calificaciones
- Resumen - Diabetes Mellitus Tipo 2Documento10 páginasResumen - Diabetes Mellitus Tipo 2Elizabeth TotoyAún no hay calificaciones
- Ensayo - Fisiopatologia de DiabetesDocumento5 páginasEnsayo - Fisiopatologia de DiabetesdanielaAún no hay calificaciones
- Proteínas, Lípidos y Carbohidratos PDFDocumento7 páginasProteínas, Lípidos y Carbohidratos PDFRoberto OrnanoAún no hay calificaciones
- Diabetes Mellitus Tipo 1Documento8 páginasDiabetes Mellitus Tipo 1Anthony RiverasAún no hay calificaciones
- CAPÍTULO 43 Páncreas Endocrino y FarmacoterapiaDocumento21 páginasCAPÍTULO 43 Páncreas Endocrino y FarmacoterapiawendypardoramirezAún no hay calificaciones
- Diabetes, Fracturas, Quemaduras, CanceresDocumento54 páginasDiabetes, Fracturas, Quemaduras, CanceresGabriela RodriguezAún no hay calificaciones
- Diabetes MellitusDocumento10 páginasDiabetes Mellitusjorgin chavezAún no hay calificaciones
- Diabetes Mellitus MDocumento23 páginasDiabetes Mellitus MLibertad Arrasco GálvezAún no hay calificaciones
- Anatomia Del PancreasDocumento3 páginasAnatomia Del PancreasENGELS PONCE GONZALES100% (1)
- Fisiopatología de La DiabetesDocumento53 páginasFisiopatología de La DiabetesIsidoro De PazAún no hay calificaciones
- Proyecto PDFDocumento12 páginasProyecto PDFDavid HernandezAún no hay calificaciones
- Diabetes MellitusDocumento23 páginasDiabetes Mellitusev26318188Aún no hay calificaciones
- Lipotoxicidad y DiabetesDocumento8 páginasLipotoxicidad y DiabetesSebastian Tabares Rodriguez100% (1)
- Genética de La DiabetesDocumento2 páginasGenética de La DiabetesAna Paola Vértiz RomeroAún no hay calificaciones
- Diabetes Mellitus ADADocumento19 páginasDiabetes Mellitus ADAJessy Quezada100% (1)
- DiabetesDocumento9 páginasDiabetesFrancisco Javier Rosales Flores “LH”Aún no hay calificaciones
- TP de Laboratorio Metabolismo de Los Hidratos de CarbonoDocumento7 páginasTP de Laboratorio Metabolismo de Los Hidratos de CarbonoIvan VazquezAún no hay calificaciones
- Inhibidores Metabolicos de Los CarbohidratosDocumento5 páginasInhibidores Metabolicos de Los CarbohidratosMichelleAún no hay calificaciones
- Enfermedades Por Deposito de GlucogenoDocumento16 páginasEnfermedades Por Deposito de GlucogenoAnabelle Chalén0% (1)
- Dialnet FundamentosBiomolecularesDeLaDiabetesMellitus 4788212Documento8 páginasDialnet FundamentosBiomolecularesDeLaDiabetesMellitus 4788212Rossmery RosadoAún no hay calificaciones
- Diabetes MellitusDocumento49 páginasDiabetes MellitusFabian Eduardo100% (5)
- Diabetes Mellitus Revision de Tema PDFDocumento9 páginasDiabetes Mellitus Revision de Tema PDFJuan David Rivera PAún no hay calificaciones
- HipoglucemiantesDocumento11 páginasHipoglucemiantesSusanaRamírezAparicioAún no hay calificaciones
- Diabetes Mellitus Tipo Ii GeneticosDocumento2 páginasDiabetes Mellitus Tipo Ii GeneticosANGIE LEONELA MENDOZA NAQUICHEAún no hay calificaciones
- Glucogenosis MonografiaDocumento12 páginasGlucogenosis MonografiaPaulRamirezCribillerosAún no hay calificaciones
- Enfermedad de Von GierkeDocumento9 páginasEnfermedad de Von GierkeSebastian AcostaAún no hay calificaciones
- Resumen Y Guía De Estudio - El Código De La Diabetes: Prevenga Y Revierta La Diabetes Tipo 2 NaturalmenteDe EverandResumen Y Guía De Estudio - El Código De La Diabetes: Prevenga Y Revierta La Diabetes Tipo 2 NaturalmenteAún no hay calificaciones
- SaludDocumento65 páginasSaludJimmy StephensAún no hay calificaciones
- Teologia Ravi ZachariasDocumento71 páginasTeologia Ravi ZachariasJimmy Stephens100% (4)
- Norman Geisler Islamismo Al DescubiertoDocumento176 páginasNorman Geisler Islamismo Al DescubiertoJosé Leiva Copado100% (6)
- SemaforizaciónDocumento8 páginasSemaforizaciónYeraldim Lopez50% (2)
- Spanish-La Gracia de Dios 1993Documento49 páginasSpanish-La Gracia de Dios 1993Jimmy StephensAún no hay calificaciones
- Gelabert Martin-Vivir La Salvacion. Ediciones San Pablo PDFDocumento68 páginasGelabert Martin-Vivir La Salvacion. Ediciones San Pablo PDFJimmy Stephens100% (1)
- LAS PARABOLAS DE JESUS - Una Aplicación para Hoy - Roberto FrickeDocumento143 páginasLAS PARABOLAS DE JESUS - Una Aplicación para Hoy - Roberto Frickeferchobo100% (18)
- Wuolah-Free-Farmacia Clínica y FarmacoterapiaDocumento122 páginasWuolah-Free-Farmacia Clínica y FarmacoterapiaJimmy StephensAún no hay calificaciones
- Aafh Manual de Farmacovigilancia Hospitalaria Version Final PDFDocumento307 páginasAafh Manual de Farmacovigilancia Hospitalaria Version Final PDFJimmy StephensAún no hay calificaciones
- Wayne Grudem - Teologia Sistematica (9-14)Documento128 páginasWayne Grudem - Teologia Sistematica (9-14)api-2617139496% (28)
- Hiperresistinemia y Desregulación Metabólica Caso de EstadisticaDocumento16 páginasHiperresistinemia y Desregulación Metabólica Caso de EstadisticaerikaAún no hay calificaciones
- Tejido Adiposo PDFDocumento46 páginasTejido Adiposo PDFNicole RangelAún no hay calificaciones
- La Ciencia Del SueñoDocumento8 páginasLa Ciencia Del SueñoerikaAún no hay calificaciones
- Docente: Dr. Bendezu Martinez Andres G. Alumno: Tovar Hinostroza Jesus GDocumento32 páginasDocente: Dr. Bendezu Martinez Andres G. Alumno: Tovar Hinostroza Jesus GJesus Gabriel Tovar HinostrozaAún no hay calificaciones
- Comida Mental - Rubén González MonrealDocumento84 páginasComida Mental - Rubén González MonrealAnonymous r4wJtE100% (1)
- BIOLOGIA-SELECTIVIDAD-EXAMEN 3 RESUELTO-CATALUÑA-www - SIGLO21X.blogspotDocumento8 páginasBIOLOGIA-SELECTIVIDAD-EXAMEN 3 RESUELTO-CATALUÑA-www - SIGLO21X.blogspotmonografiasxAún no hay calificaciones
- Gonzales y Bernal. Diagnostico y Manejo de Obesidad en Perros (2011) (Muy Bueno)Documento13 páginasGonzales y Bernal. Diagnostico y Manejo de Obesidad en Perros (2011) (Muy Bueno)CarolinaWoywoodLAún no hay calificaciones
- El Estrés y Sus Efectos - Joseph-BravoDocumento12 páginasEl Estrés y Sus Efectos - Joseph-BravoiMarkonikovAún no hay calificaciones
- AdipoquinasDocumento40 páginasAdipoquinasWalter Oscar TubaroAún no hay calificaciones
- El SobrepesoDocumento13 páginasEl SobrepesoMaldonado Gonzalez Javier Humberto 1301Aún no hay calificaciones
- Sistema VenusDocumento6 páginasSistema VenussistemavenuslhAún no hay calificaciones
- Obesidad en Niños y AdolescentesDocumento6 páginasObesidad en Niños y AdolescentesRoberto GuanipaAún no hay calificaciones
- Lipoplastia Asistida Por Laser - Dra. LysenkoDocumento139 páginasLipoplastia Asistida Por Laser - Dra. LysenkoAlejandro AngelAún no hay calificaciones
- Manejo de Pequeños Rumiantes Prepúberes Bases Fisiológicas y Enfoque ClínicoDocumento10 páginasManejo de Pequeños Rumiantes Prepúberes Bases Fisiológicas y Enfoque ClínicoCarlos MartínezAún no hay calificaciones
- Informe de Obesidad BioquimicaDocumento14 páginasInforme de Obesidad BioquimicaValery Ornella Timana EspinozaAún no hay calificaciones
- Monografía ObesidadDocumento30 páginasMonografía ObesidadGustavo Castro100% (2)
- Diabetes Mellitus WordDocumento25 páginasDiabetes Mellitus WordAnibal Monge100% (2)
- Semana 4Documento17 páginasSemana 4Mxl CrlsAún no hay calificaciones
- Ayuno IntermitenteDocumento10 páginasAyuno Intermitentehenry cervantes cardeñaAún no hay calificaciones
- Antipsicóticos de 2da Generación PDFDocumento12 páginasAntipsicóticos de 2da Generación PDFSana Sana FarmaciaAún no hay calificaciones
- Proteinas DesacoplantesDocumento7 páginasProteinas DesacoplantesNicolás Sanhueza PetitAún no hay calificaciones
- Amenorrea Primaria AbordajeDocumento5 páginasAmenorrea Primaria Abordajechistina138Aún no hay calificaciones
- Clase de Rasgos MonogenicosDocumento81 páginasClase de Rasgos MonogenicosCapry De Leon RadaAún no hay calificaciones
- Nutrición Inteligente The Best Damn Body Hacking Protocol PDFDocumento163 páginasNutrición Inteligente The Best Damn Body Hacking Protocol PDFcmas17100% (1)
- EndocrinoDocumento10 páginasEndocrinoRosales López MarianaAún no hay calificaciones
- GhrelinaDocumento28 páginasGhrelinaMedardo Antonio Díaz CéspedesAún no hay calificaciones
- Informe de Exposición - Histología y Genética ObstétricaDocumento31 páginasInforme de Exposición - Histología y Genética ObstétricaJoe Alexander Varas J.Aún no hay calificaciones
- Auriculoterapia Colombia PDFDocumento81 páginasAuriculoterapia Colombia PDFCata CastroAún no hay calificaciones
- Monografía - ObesidadDocumento41 páginasMonografía - Obesidadisaco153101236% (14)
- Teorias de La NeurocienciaDocumento11 páginasTeorias de La Neurociencialuiguidel33% (3)