Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fisiología Humana, Un Enfoque Integrador
Cargado por
Tatiana GonzalezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Fisiología Humana, Un Enfoque Integrador
Cargado por
Tatiana GonzalezCopyright:
Formatos disponibles
Fisiología humana, un enfoque integrador
Octava edición
Capítulo 2
Interacciones moleculares
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Acerca de este capítulo
2.1 Moléculas y enlaces
2.2 Interacciones no covalentes
2.3 Interacciones proteicas
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.1 Bioquímica de lípidos
Ácidos grasos
Fatty Acids
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.1 Bioquímica de lípidos
Formación de lípidos
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.1 Bioquímica de lípidos
Moléculas relacionadas con los lípidos
Lipid-Related Molecules
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.2 Bioquímica de hidratos de carbono
Monosacáridos
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.2 Bioquímica de hidratos de carbono
Azúcares de seis carbonos y disacáridos
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.2 Bioquímica de hidratos de carbono
Polisacáridos
Polysaccharides
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.3 Bioquímica de proteínas
Aminoácidos Amino Acids
All amino acids have a carboxyl group (–COOH), an amino group
(–NH2), and a hydrogen attached to the same carbon. The fourth
bond of the carbon attaches to a variable “R” group.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.3 Bioquímica de proteínas
Aminoácidos en proteínas naturales
Amino Acids in Natural Proteins
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.3 Bioquímica de proteínas
Estructura primaria de péptidos y proteínas
Estructura primaria
• Oligopéptidos {oligo-, pocos}: 2–9 aminoácidos
• Polipéptidos: 10–100 aminoácidos
• Proteínas: > 100 aminoácidos
Secuencia de aminoácidos
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.3 Bioquímica de proteínas
Estructura secundaria de péptidos y proteínas
Estructura secundaria
La estructura secundaria Los ángulos de enlaces covalentes
es creada, fundamentalmente, entre aminoácidos determinan la
por puentes de hidrógeno entre estructura secundaria.
Cadenas o asas adyacentes.
-hélice Las cadenas
forman hojas
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.3 Bioquímica de proteínas
Estructura terciaria de péptidos y proteínas
Estructura terciaria
La estructura terciaria es
La forma tridimensional de la
proteína.
Proteínas fibrosas
Colágeno Proteínas
globulares
Las estructuras terciarias pueden ser una mezcla de
estructuras secundarias. Las hojas beta se muestran como
cintas planas, y las alfa-hélices, como cintas enrolladas.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.3 Bioquímica de proteínas
Estructura cuaternaria de péptidos y proteínas
Estructura cuaternaria
Se combinan múltiples
subunidades mediante
enlaces no covalentes.
Las moléculas de
hemoglobina están
formadas por cuatro
subunidades proteicas
globulares.
Hemoglobina
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Nucleotide
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.4 Nucleótidos y ácidos nucleicos
Moléculas de nucleótidos únicos
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.4 Ácidos nucleicos
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.4 Nucleótidos y ácidos nucleicos
Apareamiento de bases
Base-Pairing
. Editorial Médica Panamericana © 2019. Todos los derechos reservados
• Las biomoléculas no tienen que ser puramente un tipo de
molécula.
• Las proteínas conjugadas son proteínas combinadas con
otra biomolécula.
Ejemplo: lipoproteínas – proteínas que transportan lípidos
• Las moléculas glucosiladas son moléculas unidas a hidratos
de carbono. Por ejemplo, glucoproteínas y glucolípidos en
las membranas celulares
• Las biomoléculas formadas por unidades repetidas son
polímeros.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Grupos funcionales
• Combinaciones de elementos que aparecen con frecuencia en las
moléculas biológicas.
• Se mueven entre las moléculas como una sola unidad.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Cuadro 2.1 Grupos funcionales comunes
TABLE 2.1 Common Functional Groups
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Los electrones tienen 4 roles biológicos
importantes
1. Enlaces covalentes.
2. Iones.
3. Electrones de alta energía.
4. Radicales libres.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Cuadro 2.2 Iones importantes del cuerpo
TABLE 2.2 Important Ions of the Body
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.5 Átomos y moléculas
-
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.5 Átomos y moléculas
Isótopos y iones
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.5 Átomos y moléculas
Biomoléculas Proteins
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Los enlaces covalentes entre los átomos
crean moléculas
• Los enlaces fuertes requieren energía para formarse o romperse.
• Comparten pares de electrones.
• Enlaces únicos, dobles y triples.
• Moléculas polares y no polares.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.6(a-b) Enlaces moleculares
Enlaces covalentes
Covalent Bonds
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Iones
• Los iones son átomos con carga.
– Cationes.
▪ Electrones perdidos.
▪ Con carga positiva (+).
– Aniones.
▪ Electrones ganados.
▪ Con carga negativa (–).
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Los enlaces no covalentes facilitan las
interacciones reversibles
• Enlace iónico.
– Atracción electrostática entre iones.
– Los átomos ganan o pierden electrones.
– Las cargas opuestas se atraen.
• Puente de hidrógeno.
– Enlace débil que requiere poca energía para formarse o
romperse.
– Atracción entre un átomo de H y un átomo cercano de O, N o F.
– Tensión superficial del agua.
• Fuerzas de Van der Waals.
– Atracciones débiles e inespecíficas entre átomos.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.6(c-e) Enlaces moleculares
Enlaces no covalentes
Noncovalent Bonds
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.7 Soluciones
Terminología
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.7 Soluciones
Expresiones de la cantidad de soluto
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.7 Soluciones
Expresiones de volumen
Expresiones de volumen
El volumen suele expresarse en litros (L) o mililitros (mL)
{milli-, 1/1000}. Una convención de volumen usada en medicina es
el decilitro (dL), que es 1/10 de un litro, o 100 mL.
Prefijos
deci- (d) 1/10 1 × 10–1
mili- (m) 1/1000 1 × 10–3
micro- (µ) 1/1 000 000 1 × 10–6
nano- (n) 1/1 000 000 000 1 × 10–9
pico- (p) 1/1 000 000 000 000 1 × 10–12
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.7 Soluciones
Expresiones de concentración
Answer
5% solution = 5 g glucose dissolved in water to make a
final volume of 100 mL solution.
5 g glucose/100 mL = ? g/500 mL
25 g glucose with water added to give a final volume of
500 mL
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.8 Interacciones moleculares
(a) Interacciones hidrófilas
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.8 Interacciones moleculares
(b) Interacciones hidrófobas
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.8 Interacciones moleculares
(c) Formas moleculares
Editorial Médica Panamericana © 2019. Todos los derechos reservados
La forma molecular está relacionada con la
función molecular
• Los enlaces moleculares son fundamentales para determinar la
forma molecular.
• Las proteínas tienen las formas más complejas y variadas.
– Estructura primaria.
– Estructuras secundarias.
▪ Alfa hélice.
▪ Láminas B.
– Estructura terciaria.
▪ Proteínas globulares.
▪ Enlaces disulfuro (S-S).
▪ Proteínas fibrosas.
– Estructura cuaternaria.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.3 Bioquímica de las proteínas
Estructuras de péptidos y proteínas
Structure of Peptides and Proteins
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Los hidrogeniones en solución pueden
alterar la forma molecular
• El H+ libre puede participar en los puentes de hidrógeno y las fuerzas
de Van der Waals.
– Puede modificar la fuerza o la conformación de una molécula.
• pH.
– Medida de la concentración de H libres.
▪ pH < 7 es ácido.
▪ pH > 7 es alcalino.
• Los ácidos son moléculas que liberan H + cuando se disuelven en
agua.
• El amortiguador modera los cambios de pH
– El anión bicarbonato (HCO3-) es un amortiguador importante en el
cuerpo humano
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.9 pH
Ácidos y bases
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.9 pH
Editorial Médica Panamericana © 2019. Todos los derechos reservados
1. Enzimas.
2. Transportadores de membrana.
3. Moléculas señal.
4. Receptores.
5. Proteínas de unión.
6. Inmunoglobulinas.
7. Proteínas reguladoras.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
• Sitios de unión.
• Ligando comparado con sustrato.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Las proteínas son selectivas con respecto a
las moléculas a las que se unen
• Especificidad – la capacidad de una proteína de unirse a cierto
ligando o a un grupo de ligandos estrechamente relacionados.
• La unión del ligando requiere complementariedad molecular.
• Modelo de ajuste inducido de la unión proteína-ligando.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.10 El modelo de ajuste inducido
de la union proteína-ligando
En este modelo de unión a proteínas,
la forma del sitio de unión no
coincide con exactitud con la L1
forma de los ligandos (L).
Sitios de unión
PROTEÍNA
L2
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Las reacciones de unión de las proteínas son
reversibles
• Afinidad – grado en el cual una proteína está unida a un ligando.
• Equilibrio – la velocidad de unión es exactamente igual a la velocidad
de separación.
• Constante de equilibrio (Keq).
• Las reacciones de la union obedecen a la ley de acción de las
masas.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.11 La ley de acción de las masas
Editorial Médica Panamericana © 2019. Todos los derechos reservados
La constante de disociación indica afinidad
• Constante de disociación (Kd).
• Competidores – los ligandos relacionados compiten por el sitio de
unión.
• Agonistas – ligandos competidores que imitan las acciones del otro.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Múltiples factores afectan la unión de las
proteínas
• Isoformas – proteínas estrechamente relacionadas – la función es similar
pero la afinidad por los ligandos difiere.
• Activación.
– Activación proteolítica.
– Cofactores.
▪ Iones.
▪ Pequeños grupos funcionales orgánicos.
• Modulación/Moduladores.
– Moduladores químicos– se unen en forma reversible o irreversible a
proteínas y alteran su afinidad por la unión o su actividad.
▪ Inhibidores competitivos comparados con antagonistas irreversibles.
▪ Moduladores alostéricos comparados con moduladores covalentes.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Cuadro 2.3 Factores que afectan la unión
de las proteínas
TABLE 2.3 Factors That Affect Protein Binding
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.12 Activación e inhibición de las
proteínas – Activación (a)
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.12 Activación e inhibición de las
proteínas – Activación (b-c)
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.12 Activación e inhibición de las
proteínas – Activación (d-e)
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Múltiples factores afectan la unión de las
proteínas
• Moduladores físicos.
– Temperatura.
– pH.
– El cuerpo regula la cantidad de proteínas en las células.
▪ Regulación positiva comparada con regulación negativa.
– La velocidad de la reacción puede alcanzar un máximo.
▪ Concentración del ligando.
▪ Saturación – velocidad máxima de la reacción.
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.13
Factores que influyen en la actividad de las
proteínas (a) Temperatura y pH
Editorial Médica Panamericana © 2019. Todos los derechos reservados
Figura 2.13
Factores que influyen en la actividad de las
proteínas
Cantidad de (b) proteína y (c) ligando
Editorial Médica Panamericana © 2019. Todos los derechos reservados
También podría gustarte
- Fisiologia1, GeneralDocumento61 páginasFisiologia1, GeneralMonica Garcia AbadAún no hay calificaciones
- Bioquimica y Biomoleculas Clase 2021Documento19 páginasBioquimica y Biomoleculas Clase 2021Ruth Yeimi Ochasara FrancoAún no hay calificaciones
- BioquimicaDocumento11 páginasBioquimicaTaatiiaanaa CastillooAún no hay calificaciones
- Taler 7 ProteinasDocumento5 páginasTaler 7 ProteinasJUAN GABRIEL MALLAMA PENAAún no hay calificaciones
- ContextualizaciónDocumento8 páginasContextualizacióncarlos jimenezAún no hay calificaciones
- Taller Sobre MacromoléculasDocumento1 páginaTaller Sobre MacromoléculasDavid Iglesias montielAún no hay calificaciones
- Material de Apoyo Complementario BiomoléculasDocumento13 páginasMaterial de Apoyo Complementario BiomoléculasWalquirias NaiAún no hay calificaciones
- Biomoléculas y BioquímicaDocumento12 páginasBiomoléculas y BioquímicaRachelle VargasAún no hay calificaciones
- Bromatología Proteinas Mara GonzalezDocumento2 páginasBromatología Proteinas Mara GonzalezMara GonzálezAún no hay calificaciones
- Introducción A La BioquímicaDocumento40 páginasIntroducción A La BioquímicaOscar Cardona PantojaAún no hay calificaciones
- Tema 1.8 - Proteínas y Ácidos NucleicosDocumento10 páginasTema 1.8 - Proteínas y Ácidos Nucleicosluzangelapabon2007Aún no hay calificaciones
- Banco de PreguntasDocumento5 páginasBanco de PreguntasKatherine RoaAún no hay calificaciones
- Apuntes Biologia Opción BDocumento169 páginasApuntes Biologia Opción BpaulapenaharoAún no hay calificaciones
- Respuestas Taller Unal BiologiaDocumento5 páginasRespuestas Taller Unal BiologiaorxikiuAún no hay calificaciones
- Moléculas y MetabolismoDocumento12 páginasMoléculas y MetabolismoLucía TorresAún no hay calificaciones
- Bioquímica General - CLASE 29 MARZO-1Documento20 páginasBioquímica General - CLASE 29 MARZO-1Shone ThensyAún no hay calificaciones
- Tema 1Documento45 páginasTema 1Jaime SnchzAún no hay calificaciones
- Biomoleculas (Organicas e Inorganicas)Documento32 páginasBiomoleculas (Organicas e Inorganicas)Kiara Jurado VillegasAún no hay calificaciones
- Taller Biomoleculas PDFDocumento3 páginasTaller Biomoleculas PDFPaola MontealegreAún no hay calificaciones
- RCHJD R2.2 02Documento6 páginasRCHJD R2.2 02Jonathan RamirezAún no hay calificaciones
- Unidad 3 - Nutrición MicrobianaDocumento13 páginasUnidad 3 - Nutrición MicrobianaJose ReynosoAún no hay calificaciones
- Elementos BiogenesicosDocumento21 páginasElementos BiogenesicosMelany HudsonAún no hay calificaciones
- Semana 2 MFHDocumento9 páginasSemana 2 MFHEdimar Moya100% (1)
- Biomoleculas Organicas e InorganicasDocumento32 páginasBiomoleculas Organicas e InorganicasPaola Guti100% (1)
- Prelab 3 Desnaturalización de ProteinasDocumento10 páginasPrelab 3 Desnaturalización de ProteinasZucely CastilloAún no hay calificaciones
- Taller Recuperacion Grado 11 Del 2020Documento9 páginasTaller Recuperacion Grado 11 Del 2020osterjorgeAún no hay calificaciones
- 2 - U1 - Guia N°2 - BiomoleculasDocumento4 páginas2 - U1 - Guia N°2 - BiomoleculasValentina PerezAún no hay calificaciones
- Clase 3 Biomoléculas Orgánicas Carbohidratos y LípidosDocumento37 páginasClase 3 Biomoléculas Orgánicas Carbohidratos y LípidosWilly Aranda CanalesAún no hay calificaciones
- Cuestionario de BioquimicaDocumento11 páginasCuestionario de BioquimicaWendy NatalyAún no hay calificaciones
- Química orgánica tallerDocumento4 páginasQuímica orgánica tallerJuan Gabriel MusususAún no hay calificaciones
- PROTEINASDocumento16 páginasPROTEINASYasmin SalasAún no hay calificaciones
- Quimica 3Documento17 páginasQuimica 3Damaris Genesis Cerna ZapataAún no hay calificaciones
- Biomolnoculas 1 Hidratos de Carbono Iae 2022 1 2022031109403701Documento17 páginasBiomolnoculas 1 Hidratos de Carbono Iae 2022 1 2022031109403701tadeo sarmientoAún no hay calificaciones
- Elementos Vitales de Los Seres VivosDocumento4 páginasElementos Vitales de Los Seres VivosVictor Hugo AlejandroAún no hay calificaciones
- Aminoacidos Taller BioquimicaDocumento5 páginasAminoacidos Taller BioquimicaMARIANAAún no hay calificaciones
- Taller Macromoléculas - Grupo MiércolesDocumento5 páginasTaller Macromoléculas - Grupo Miércolesdianagope06Aún no hay calificaciones
- Taller Quimica AplicadaDocumento4 páginasTaller Quimica AplicadacristiandromerAún no hay calificaciones
- Tarea de La Clase Teorica N3 Aminoacidos y Proteinas (E)Documento10 páginasTarea de La Clase Teorica N3 Aminoacidos y Proteinas (E)Claudia Sofia Leonardo GarciaAún no hay calificaciones
- Aminoácidos, proteínas y enzimas: Cuestionario de repasoDocumento22 páginasAminoácidos, proteínas y enzimas: Cuestionario de repasoMIREYA HOLGUIN MENDEZAún no hay calificaciones
- Bioquímica: estudio de la materia viva a nivel molecularDocumento12 páginasBioquímica: estudio de la materia viva a nivel molecularJulián ImperialAún no hay calificaciones
- BiomoleculaaDocumento28 páginasBiomoleculaaMariana Rodríguez De la MoraAún no hay calificaciones
- C4. Introduccin A La BioqumicaDocumento26 páginasC4. Introduccin A La BioqumicaMELANIE THAMAR ARNESAún no hay calificaciones
- Introducción A La Bioquímica-18Documento5 páginasIntroducción A La Bioquímica-18Anonymous bAPNg8b100% (1)
- BIOLOGIA YaDocumento8 páginasBIOLOGIA Yaangie tapiasAún no hay calificaciones
- UDocumento4 páginasUmaylethAún no hay calificaciones
- 1.3 Biomoléculas I - BCDocumento14 páginas1.3 Biomoléculas I - BCfranciscolabraAún no hay calificaciones
- Bioquímica Parcial 1Documento5 páginasBioquímica Parcial 1laura ortizAún no hay calificaciones
- Las Moléculas Son Producto de La Unión de Dos o Más Átomos Mediante Enlaces QuímicosDocumento39 páginasLas Moléculas Son Producto de La Unión de Dos o Más Átomos Mediante Enlaces QuímicosWilliam WillAún no hay calificaciones
- Proteínas y lípidos: identificación mediante pruebasDocumento26 páginasProteínas y lípidos: identificación mediante pruebasKely Paola Suricallo MenendezAún no hay calificaciones
- Proteínas - BioquímicaDocumento8 páginasProteínas - BioquímicaManuel AlcalaAún no hay calificaciones
- Nociones Fundamentales de La Quimica BioDocumento321 páginasNociones Fundamentales de La Quimica BioKatie MhAún no hay calificaciones
- Unidad 2 Presentación 3Documento8 páginasUnidad 2 Presentación 3Patricio Emiliano González BernardinoAún no hay calificaciones
- Unidad 1 BiomoleculasDocumento26 páginasUnidad 1 BiomoleculasBERNARDITA ERRAZURIZ BALMACEDAAún no hay calificaciones
- Biología GrupoDocumento5 páginasBiología GrupoLesly Defaz71% (28)
- U1 Clase 4 202320 DBIO1070 Biomoléculas II y Célula AnimalDocumento25 páginasU1 Clase 4 202320 DBIO1070 Biomoléculas II y Célula AnimalMichelle langenbachAún no hay calificaciones
- 5 BiomoleculasDocumento10 páginas5 BiomoleculasDavid VillacresAún no hay calificaciones
- Clase 1 Introduccion A La Bioquimica I AmmedDocumento25 páginasClase 1 Introduccion A La Bioquimica I Ammedchaconmiguel543Aún no hay calificaciones
- Química de macrocomponentes de alimentosDe EverandQuímica de macrocomponentes de alimentosAún no hay calificaciones
- Desarrollo FetalDocumento17 páginasDesarrollo FetalTatiana Gonzalez100% (1)
- Sopa de LetrasDocumento1 páginaSopa de LetrasTatiana GonzalezAún no hay calificaciones
- Tejidos conectivos: estructura y funciones de la matriz extracelularDocumento62 páginasTejidos conectivos: estructura y funciones de la matriz extracelularTatiana GonzalezAún no hay calificaciones
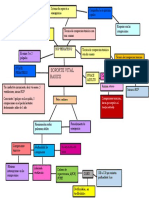
- Mapa Mental Soporte Vital BasicoDocumento1 páginaMapa Mental Soporte Vital BasicoTatiana GonzalezAún no hay calificaciones
- Tejido Epitelial OriginalDocumento51 páginasTejido Epitelial OriginalTatiana GonzalezAún no hay calificaciones
- Fisiología Humana, Un Enfoque IntegradorDocumento60 páginasFisiología Humana, Un Enfoque IntegradorTatiana GonzalezAún no hay calificaciones
- Cierrre Eje CelularDocumento73 páginasCierrre Eje CelularTatiana GonzalezAún no hay calificaciones
- Dolor lumbar y abdominalDocumento4 páginasDolor lumbar y abdominalTatiana GonzalezAún no hay calificaciones
- Historia ClinicaDocumento5 páginasHistoria ClinicaTatiana GonzalezAún no hay calificaciones
- Vitamina DDocumento1 páginaVitamina DTatiana GonzalezAún no hay calificaciones
- Terminología MédicaDocumento25 páginasTerminología MédicaLalo Canalizo Veliz67% (3)
- Reglas y fundamentos del baloncestoDocumento2 páginasReglas y fundamentos del baloncestorobbie8710Aún no hay calificaciones
- Ficha Zinc Sebum SimpleDocumento2 páginasFicha Zinc Sebum Simpleernestosand100% (1)
- Práctica 5. ProteínasDocumento7 páginasPráctica 5. ProteínasNNNNAún no hay calificaciones
- 01a - T04 - Las Proteínas - EsquemasDocumento22 páginas01a - T04 - Las Proteínas - EsquemasPablo MartosAún no hay calificaciones
- Estabilidad de medicamentos: IntroducciónDocumento350 páginasEstabilidad de medicamentos: IntroducciónAngelRanAún no hay calificaciones
- INTRODUCCIÓNDocumento16 páginasINTRODUCCIÓNLucas Miranda CassaniAún no hay calificaciones
- Obtención de glicina a partir de ácido halogenado mediante reacción de Hell-Volhard-ZelinskyDocumento2 páginasObtención de glicina a partir de ácido halogenado mediante reacción de Hell-Volhard-ZelinskyErick LoAún no hay calificaciones
- Pruebas Generales A.A Y ProteinasDocumento7 páginasPruebas Generales A.A Y ProteinasAlejandro Gómez PradoAún no hay calificaciones
- Proyecto de TesisDocumento34 páginasProyecto de Tesisluis100% (1)
- Determinación Cualitativa de Moléculas OrgánicasDocumento3 páginasDeterminación Cualitativa de Moléculas Orgánicascarreno.penafiel.danaheAún no hay calificaciones
- Clase # 2 de Bioquimica Ii. Unidad I Proteinas.Documento3 páginasClase # 2 de Bioquimica Ii. Unidad I Proteinas.Roger Cruz ValverdeAún no hay calificaciones
- Informe Biologia de ProteinasDocumento12 páginasInforme Biologia de ProteinaswiliansAún no hay calificaciones
- Peptidos de Importancia BiologicaDocumento12 páginasPeptidos de Importancia BiologicaPaola MoraAún no hay calificaciones
- Desnaturalización de proteínas: efectos del calor, pH y metalesDocumento12 páginasDesnaturalización de proteínas: efectos del calor, pH y metalesFabian GuillermoAún no hay calificaciones
- Serie Didáctica Qca de La VidaDocumento104 páginasSerie Didáctica Qca de La VidaCarlos Alfredo LópezAún no hay calificaciones
- Justificación de Las Preguntas Del Parcial Referente A Pruebas BioquimicasDocumento2 páginasJustificación de Las Preguntas Del Parcial Referente A Pruebas BioquimicasLaLo LujanAún no hay calificaciones
- Práctico ProteínasDocumento3 páginasPráctico ProteínasVeronica Rodriguez MoyanoAún no hay calificaciones
- Guía de Estudio 3 - 2018Documento4 páginasGuía de Estudio 3 - 2018Pee Wee Martini100% (1)
- Laboratorio 7Documento10 páginasLaboratorio 7DANIELA MURCIA BETANCOURAún no hay calificaciones
- Reacciones de AminoacidosDocumento2 páginasReacciones de AminoacidosJocelyn OrtegaAún no hay calificaciones
- ActinidinaDocumento12 páginasActinidinaNancy EscobarAún no hay calificaciones
- Proteínas: estructura, formación y funcionesDocumento31 páginasProteínas: estructura, formación y funcionesAllison Castro IbarraAún no hay calificaciones
- PROTEINASDocumento11 páginasPROTEINASVirginia MorilloAún no hay calificaciones
- Determinación de Aminoácidos Terminales Con Grupo Alfa Amino Libre Método de SangerDocumento3 páginasDeterminación de Aminoácidos Terminales Con Grupo Alfa Amino Libre Método de SangerGabrielAún no hay calificaciones
- ESTUDIODELSUERO DesbloqueadoDocumento139 páginasESTUDIODELSUERO DesbloqueadoAbimaelAún no hay calificaciones
- BIOMOLECULASDocumento21 páginasBIOMOLECULASdanAún no hay calificaciones
- METODOS PARA LA DETERMINACIÓN DE PROTEÍNA TOTAL (Recuperado Automáticamente)Documento5 páginasMETODOS PARA LA DETERMINACIÓN DE PROTEÍNA TOTAL (Recuperado Automáticamente)Honey BeeAún no hay calificaciones
- Julio 2015 Opción BDocumento4 páginasJulio 2015 Opción BJorge Azuara ChulviAún no hay calificaciones
- Amino Acid OsDocumento9 páginasAmino Acid OsDonaldo LeonAún no hay calificaciones
- FequipomDocumento102 páginasFequipomhjowar aguilarAún no hay calificaciones
- Práctica No.4 "Reacciones Colorimétricas para Identificación de Aminoácidos y Proteínas"Documento10 páginasPráctica No.4 "Reacciones Colorimétricas para Identificación de Aminoácidos y Proteínas"Stephanie ChaparroAún no hay calificaciones