0% encontró este documento útil (0 votos)
103 vistas11 páginasPractica 7 - Balance
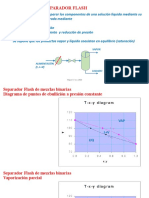
Este documento presenta los objetivos, materiales y métodos de una práctica de laboratorio para determinar la curva de temperatura-composición de soluciones binarias de líquidos azeotrópicos. Los estudiantes medirán puntos de ebullición y realizarán lecturas de índice de refracción para mezclas de acetona y cloroformo, y luego graficarán los datos y calcularán constantes termodinámicas para analizar las propiedades de la mezcla y la presencia de un azeótropo.
Cargado por
1701635jDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
103 vistas11 páginasPractica 7 - Balance
Este documento presenta los objetivos, materiales y métodos de una práctica de laboratorio para determinar la curva de temperatura-composición de soluciones binarias de líquidos azeotrópicos. Los estudiantes medirán puntos de ebullición y realizarán lecturas de índice de refracción para mezclas de acetona y cloroformo, y luego graficarán los datos y calcularán constantes termodinámicas para analizar las propiedades de la mezcla y la presencia de un azeótropo.
Cargado por
1701635jDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como PDF, TXT o lee en línea desde Scribd