Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe Cloruros Grupo5 COMPLETO
Cargado por
Lucia Luna Garcia CroxattoDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe Cloruros Grupo5 COMPLETO
Cargado por
Lucia Luna Garcia CroxattoCopyright:
Formatos disponibles
Química Analítica Aplicada – UTN FRM
CLORUROS
Determinación de cloruros en salmuera por MÉTODO DE MOHR Y VOLHARD.
Introducción
Se entiende por salmuera inicial la solución de cloruro de sodio adicionada a las vasijas con
aceitunas una vez concluidos los lavados. La concentración inicial de dicha salmuera
desciende su concentración a medida que se va estabilizando con los frutos y este valor es
el que se debe considerar para hacer selectivo el medio de fermentación.
Una concentración inicial que supere el 8% puede provocar arrugamientos en las olivas e
impedir el desarrollo de la flora microbiana deseable. Si por el contrario, es muy baja (2 al
3%), resulta insuficiente para impedir el desarrollo de la flora indeseable. De lo dicho se
deduce la necesidad de controlar la salmuera que se adicione, como así también su
concentración durante el proceso de fermentación.
MARCO TEÓRICO
Método de Mohr: Utilizamos la formación y posterior valoración de un precipitado donde el
ion cloruro precipita como AgCl, utilizándose como reactivo patrón una solución de nitrato de
plata y el ion cromato como indicador. Es importante que la precipitación del indicador ocurra
cerca del punto de equivalencia de la titulación. Al ser el cromato de plata más soluble que el
cloruro de plata, si se agrega iones plata la solución que contiene una concentración
considerable de ion cloruro y una pequeña de ion cromato, precipita el cloruro de plata y no
se formaria el cromato de plata hasta que la concentración del ion plata alcance un calor lo
suficientemente grande como para exceder el producto de solubilidad. Se observa el punto
final de la valoración cuando la solución amarilla debido al cromato se torna roja por la
reacción. En esta tecnica lo que cambia de color es el PRECIPITADO no la SOLUCIÓN.
1° reacción analitica de titulación: solubilidad del AgCl 1,8e-10
2° reacción indicadora: solubilidad Ag2CrO4 1,1e-12
Tipo de error: por exceso (visualización de la aparición del cromato de plata)
Como la solubilidad del Ag2CrO4(s) es mayor que la del AgCl (s), este último precipita
primero.
Limitaciones:
- no se puede usar para soluciones diluidas de cloruro;
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
- el ph debe estar entre 6,3 y 10,5; si el ph es menos 6,3 utilizamos carbonato ácido de
sodio o bórax para alcalinizar y si el ph es mayor a 10,5 se acidifica con ácido acético;
● si el ph es muy ácido el cromato pasa a cromato ácido lo que conlleva
a formar el dicromato de color rojo e interfiere con el punto de
equivalencia, es decir con la reaccion indicadora.
● si el ph > 10 , el medio alcalino hace reaccionar a la plata formando
óxidos insolubles (AgOH)
- la solución debe tener un pH cercano a la neutralidad, ideal de 8,3.
Método de Volhard: es una titulación por retorno del ion plata agregado en exceso con
sulfocianuro el cual colorea la solución de rojo anaranjado al unirse con el ión hierro (III) una
vez que se titula completamente la plata.
En este método lo que se produce es un cambio de color en la solución y no en el precipitado
y no hace falta la preparación de un blanco porque el punto de equivalencia es casi igual al
punto final (Ve es aproximadamente igual al Vf).
Tipo de error: por defecto, y la fuente de error es la rxn de metátesis.
El kps del Sulfocianuro de plata es menor, entonces si el precipitado de cloruro de plata no
está bien protegido ( con que lo protejo???????)el tiocianato puede reaccionar con la plata
del cloruro de plata y no con la plata en exceso y esto es lo que se conoce como rxn de
metátesis.
Limitación:
- Debe trabajarse en medio ácido, de lo contrario el hierro se hidroliza para formar el
hidróxido férrico evitando así identificar la coloración rojiza.
Para el método de Fajans la titulación es directa como para el método de Mohr siendo la
fluoresceína el indicador que vira a rojo debido al fluoresceinato de plata formado por
adsorción
OBJETIVOS
Determinar las cantidades del ión cloruro en la matriz analizada y comparar los valores
obtenidos con los parámetros establecidos por la legislación para cada caso.
MOHR (método directo)
MATERIALES
- Matraz Erlenmeyer de 250 ml
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
- Bureta graduada de 10 ml
- Matraz 100 ml
- Soporte de bureta
REACTIVOS
- Solución de Nitrato de Plata 0.1 N valorada (reactivo titulante)
- Solución de Cromato de Potasio al 5% (indicador)
MUESTRA
- salmuera, dilución 2:100
PROCEDIMIENTO
1° preparar la dilución de la salmuera 2:100 (2 ml de salmuera en 98 ml de agua destilada)
en matraz;
2° adicionamos 4 gotas de indicador K2CrO4;
3° llevamos 20 ml de la dilución a un erlenmeyer de 200 ml;
4°titulamos con AgNO3 hasta el viraje de amarillo a rojo ladrillo. En un punto intermedio de la
titulación notaremos un precipitado blanco producto de la formación del AgCl.
VALORES OBTENIDOS
- Volumen de AgNO3 gastado en muestra 3,2 ml
- Volumen de AgNO3 gastado en blanco 0,1 ml
CÁLCULOS
% de NaCl = 0,0585 x 0,1eq/l x (3,2ml - 0,1ml) x100 x50 = 4,53 de NaCl
20 ml
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
VOLHARD (método indirecto)
MATERIALES
- Matraz Erlenmeyer de 250 ml
- Bureta graduada de 10 ml
- Matraz 100 ml
- Soporte de bureta
REACTIVOS
- Solución de Nitrato de Plata 0.1 N
- Solución de sulfato férrico amónico (indicador)
- Ácido nítrico
- Solución de tiocianato de potasio 0,1 N (agente valorante)
MUESTRA
- salmuera, dilución 1:50
PROCEDIMIENTO
1° preparar la dilución de la salmuera 1:50 (1 ml de salmuera en 49 ml de agua destilada)
en matraz;
2° llevamos 20 ml de la dilución a un Erlenmeyer de 200 ml y añadimos AgNO3 en exceso,
5ml;
3° agregar ácido nítrico y 5 gotas de indicador sulfato férrico amónico;
4° Titulamos con tiocianato de potasio hasta el viraje del precipitado blanco (formación de
sulfocianuro de plata) a rojo sangre.
VALORES OBTENIDOS
- Volumen de KSCN gastado en muestra 1,1 ml
CÁLCULOS
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
%NaCl = (5cm3 - 1,1cm3) x 0,1eq/l x 0,0585 x100 x50 =5,7% NaCl
20 ml
LEGISLACIÓN
CONCLUSIONES
Teniendo en cuenta el código alimentario argentino y realizando dos técnicas diferentes
para la determinación de cloruros, concluimos que la muestra de salmuera utilizada se
encuentra aproximadamente dentro de los parámetros establecidos.
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
TECNICA MOHR
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
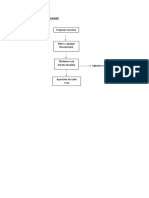
DIAGRAMA DE FLUJO
CLORUROS: MÉTODO DE MOHOR
Preparar dilución 1:50 de
salmuera (1 ml sal. – 50
agua)
Llevamos una
alícuota de 20 ml
al Erlenmeyer
Agregamos 4 gotas
de indicador
K2CrO4
Medir Ph: si es inferior a 6 agregar
Carbonato sódico y si es mayor
Enrazar bureta con
solución de AgNO3 a 8,3 agrego acido acético
0,1 N
Titular con nitrato de
plata, ppdo blanco
Formación de AgCl
Seguir titulando hasta el
viraje a rojo ladrillo
(formación de Ag2CrO4)
Realizar el ensayo
en blanco
Realizar cálculos
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
TECNICA VOLHARD
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
BECCERO – CESTIER – GARCÍA CROXATTO
Química Analítica Aplicada – UTN FRM
DIAGRAMA DE FLUJO
CLORUROS: MÉTODO DE VOLHARD
Preparar una dilución 1:50 y
tomar una alícuota de 20 ml
Agregar solución de
AgNO3 con un ligero
exceso conocido (5ml)
Adicionar indicador
sulfato férrico y
ácido nítrico
Titular exceso con
tiocianato de
potasio 0,1 N
Aparición de ppdo
blanco (formación de
sulfocianuro de plata)
Titular hasta el
viraje a rojo sangre
BECCERO – CESTIER – GARCÍA CROXATTO
También podría gustarte
- En Qué Tipos de Análisis Se Pueden Emplear La Técnica Volumétrica Que Se Realizó en El LaboratorioDocumento4 páginasEn Qué Tipos de Análisis Se Pueden Emplear La Técnica Volumétrica Que Se Realizó en El Laboratoriobrayan felipe de hoyos jimenezAún no hay calificaciones
- Determinación de Cloruro - Vol. PrecipitaciónDocumento10 páginasDeterminación de Cloruro - Vol. PrecipitaciónAngie CampoverdeAún no hay calificaciones
- Laboratorio #10Documento8 páginasLaboratorio #10kate vilcapaza Charca0% (1)
- Laboratorio #10Documento9 páginasLaboratorio #10michaelAún no hay calificaciones
- Determinación de cloruros por métodos volumetricosDocumento5 páginasDeterminación de cloruros por métodos volumetricosHelver GalargaAún no hay calificaciones
- ULpractica de ArgentometriaDocumento6 páginasULpractica de ArgentometriaCarmenAún no hay calificaciones
- Argentometria Parte II - Determinacion deDocumento8 páginasArgentometria Parte II - Determinacion deStefy MuñekAún no hay calificaciones
- Practica Profesionalizante I: ObjetivosDocumento6 páginasPractica Profesionalizante I: ObjetivosRuben Eduardo LunaAún no hay calificaciones
- Pract.4 Volumetria de Precipitacion Analisis de Plata en AleacionesDocumento10 páginasPract.4 Volumetria de Precipitacion Analisis de Plata en Aleacionesjuan carlosAún no hay calificaciones
- Determinación de Halogenuros Por El Método de Fajans y VolhardDocumento7 páginasDeterminación de Halogenuros Por El Método de Fajans y VolhardJosselyn Remache0% (2)
- Argentometria Parte I - Preparación y Valoración de Una Solución de Nitrato de Plata.Documento7 páginasArgentometria Parte I - Preparación y Valoración de Una Solución de Nitrato de Plata.Miller EspinozaAún no hay calificaciones
- Informe de Laboratorio de Aguas Determinacion de ClorurosDocumento10 páginasInforme de Laboratorio de Aguas Determinacion de ClorurosFrancisco FGAún no hay calificaciones
- Laboratorio #09Documento29 páginasLaboratorio #09LISYA ANDREINA QUISPE ENRIQUEZAún no hay calificaciones
- Laboratorio de Analisis 3 Volumetria de PrecipitacionDocumento22 páginasLaboratorio de Analisis 3 Volumetria de PrecipitacionBrian WilliamsAún no hay calificaciones
- MARCO TEORICO Completado 8.4 D e FDocumento8 páginasMARCO TEORICO Completado 8.4 D e FEsthefanyAún no hay calificaciones
- Reporte Cloruros.Documento7 páginasReporte Cloruros.Cadete Virgilio azuetaAún no hay calificaciones
- Volumétrica de precipitación: métodos de Mohr, Volhard y FajansDocumento17 páginasVolumétrica de precipitación: métodos de Mohr, Volhard y FajansNestor MotoloAún no hay calificaciones
- Determinacion de Cloruros y CianurosDocumento11 páginasDeterminacion de Cloruros y CianurosDaniel Morales100% (1)
- Lab 7determinacion Decloruros Por El Metodo de MorhDocumento6 páginasLab 7determinacion Decloruros Por El Metodo de MorhCarlitos VelasquezAún no hay calificaciones
- CUESTIONARIO Quimicccccca ADocumento2 páginasCUESTIONARIO Quimicccccca AcristianAún no hay calificaciones
- Determinacion Argentometrica de Cloruros en SueroDocumento3 páginasDeterminacion Argentometrica de Cloruros en SueroYessy XinaAún no hay calificaciones
- Argentometría: Titulación de clorurosDocumento10 páginasArgentometría: Titulación de clorurosNenisKaroAún no hay calificaciones
- Determinación de cloruros, plata y zinc por métodos volumétricosDocumento18 páginasDeterminación de cloruros, plata y zinc por métodos volumétricosJhonatanAún no hay calificaciones
- Volumetria PrecipitacónDocumento7 páginasVolumetria PrecipitacónJOSE JOSE LORA SANCHEZAún no hay calificaciones
- Determinación de Cloruros PDFDocumento7 páginasDeterminación de Cloruros PDFCinthia Larico EspinalAún no hay calificaciones
- Marco Teórico ClorurosDocumento9 páginasMarco Teórico ClorurosAndrea del AguilaAún no hay calificaciones
- Determinación de cloruros en suero fisiológico mediante argentometríaDocumento15 páginasDeterminación de cloruros en suero fisiológico mediante argentometríaOLGA VEGAAún no hay calificaciones
- Practica 8 Determ. de ClorurosDocumento4 páginasPractica 8 Determ. de ClorurosJavier San Juan Mercado100% (1)
- Determinacion de ClorurosDocumento9 páginasDeterminacion de ClorurosKevinAmayaAún no hay calificaciones
- Titulaciones de PrecipitacionDocumento7 páginasTitulaciones de PrecipitacionAngelly LópezAún no hay calificaciones
- Métodos de Volumetría Por PrecipitaciónDocumento20 páginasMétodos de Volumetría Por PrecipitaciónEquipo8 Analitica100% (2)
- Determinacion de Cloruros en Una Muestra Acuosa Mediante Los Metodos de Precipitacion de Mohr y VolhardDocumento5 páginasDeterminacion de Cloruros en Una Muestra Acuosa Mediante Los Metodos de Precipitacion de Mohr y VolhardLiz VillarAún no hay calificaciones
- Determinación de cloruros y cianuros en muestras de sal, agua y materiales usando los métodos de Mohr y LiebigDocumento29 páginasDeterminación de cloruros y cianuros en muestras de sal, agua y materiales usando los métodos de Mohr y LiebigJorman Iván Barrera VergaraAún no hay calificaciones
- Volumetria PrecipitacionDocumento13 páginasVolumetria PrecipitacionLeonel Carlos Rivero MamaniAún no hay calificaciones
- Volume TriaDocumento17 páginasVolume TriaDaniel SantillánAún no hay calificaciones
- Determinación de haluros por el método de FajansDocumento3 páginasDeterminación de haluros por el método de FajansAndrés Aleán100% (1)
- Comparación de Métodos de Volumetría de Precipitación para Análisis de Cloruro en Muestra Comercial de SueroDocumento6 páginasComparación de Métodos de Volumetría de Precipitación para Análisis de Cloruro en Muestra Comercial de SueroNatalia León PatiñoAún no hay calificaciones
- Practica 2 Determinación de ClorurosDocumento8 páginasPractica 2 Determinación de ClorurosEdgarIvanNuñezEscobar0% (1)
- Volumetria de Precipitacion ArgentometricaDocumento3 páginasVolumetria de Precipitacion ArgentometricaRodriigo ValenciiaAún no hay calificaciones
- Practica 5 ArgentrometriaDocumento8 páginasPractica 5 ArgentrometriaSebastián Tello ArmijosAún no hay calificaciones
- Técnicas cualitativas en alimentosDocumento5 páginasTécnicas cualitativas en alimentosjhonny chambi mamaniAún no hay calificaciones
- Análisis volumétrico de cloruros por métodos de Mohr y VolhardDocumento4 páginasAnálisis volumétrico de cloruros por métodos de Mohr y Volhard93arte50% (2)
- Preinforme 6 - Volumetría PrecipitaciónDocumento8 páginasPreinforme 6 - Volumetría PrecipitacióndffandinioAún no hay calificaciones
- Laboratorio 2 de Análisis Volumétrico Por PrecipitaciónDocumento11 páginasLaboratorio 2 de Análisis Volumétrico Por PrecipitaciónAngel Vegoline Cuevas FerrerasAún no hay calificaciones
- Cloruros, Cloro Activo, OD, MO Suelo (Grupo 3)Documento23 páginasCloruros, Cloro Activo, OD, MO Suelo (Grupo 3)Mauricio FariasAún no hay calificaciones
- Determinación de Cloruros en Una Muestra Acuosa Mediante Dos MetodosDocumento5 páginasDeterminación de Cloruros en Una Muestra Acuosa Mediante Dos MetodosximenaAún no hay calificaciones
- LAB Analitica Practica 7Documento6 páginasLAB Analitica Practica 7Jonathan VelazquezAún no hay calificaciones
- Practica 6 y 7Documento10 páginasPractica 6 y 7yopoboyAún no hay calificaciones
- Informe de AqDocumento12 páginasInforme de AqJavier TabaraAún no hay calificaciones
- Determinación de Cloruros en Una Muestra Acuosa Mediante Dos MetodosDocumento5 páginasDeterminación de Cloruros en Una Muestra Acuosa Mediante Dos MetodosMelisa M CordobaAún no hay calificaciones
- COMPLEJOMETRÍADocumento17 páginasCOMPLEJOMETRÍAEdwin Roger AranibarAún no hay calificaciones
- CLORUROSDocumento2 páginasCLORUROSfytfuoyyoAún no hay calificaciones
- Determinación de cloruros por métodos volumétricos y gravimétricosDocumento6 páginasDeterminación de cloruros por métodos volumétricos y gravimétricosVivi Mar CSiAún no hay calificaciones
- Determinación de cloruros en salmueras por el método de MohrDocumento3 páginasDeterminación de cloruros en salmueras por el método de MohrVanessaAún no hay calificaciones
- Analisis 7 8 InformeDocumento21 páginasAnalisis 7 8 InformeDante MontañezAún no hay calificaciones
- Quia de LaboratorioDocumento6 páginasQuia de Laboratoriofrancisco cardenasAún no hay calificaciones
- Determinacion de ClorurosDocumento4 páginasDeterminacion de CloruroschirinoslaaAún no hay calificaciones
- Volumetría de PrecipitaciónDocumento4 páginasVolumetría de PrecipitaciónEdwin RodriguezAún no hay calificaciones
- Volumetria de Precipitacion 1Documento5 páginasVolumetria de Precipitacion 1anderson yesidAún no hay calificaciones
- 2 - Adhesivo Universal Personal PDFDocumento5 páginas2 - Adhesivo Universal Personal PDFIndy MotaAún no hay calificaciones
- CalibraciDocumento20 páginasCalibraciLucia Luna Garcia CroxattoAún no hay calificaciones
- Diagrama de Flujo FajansDocumento1 páginaDiagrama de Flujo FajansLucia Luna Garcia CroxattoAún no hay calificaciones
- Diagrama de Flujo de VolhardDocumento1 páginaDiagrama de Flujo de VolhardLucia Luna Garcia CroxattoAún no hay calificaciones
- Diagrama de Flujo de MhorDocumento1 páginaDiagrama de Flujo de MhorLucia Luna Garcia CroxattoAún no hay calificaciones
- ACIDEZ EN ACEITE TRANSFORMADOR DiagramaDocumento1 páginaACIDEZ EN ACEITE TRANSFORMADOR DiagramaLucia Luna Garcia CroxattoAún no hay calificaciones
- B Oxidacion Expo Insaturados UuDocumento17 páginasB Oxidacion Expo Insaturados UuKarin Vargas BazánAún no hay calificaciones
- Química Orgánica III Grupos FuncionalesDocumento12 páginasQuímica Orgánica III Grupos FuncionalesCarolina0% (1)
- Cuestionario Sobre El AguaDocumento10 páginasCuestionario Sobre El AguaEduardo Contreras HernandezAún no hay calificaciones
- Dow Corning High Vacuum GreaseDocumento4 páginasDow Corning High Vacuum GreaseFelix Alcides EscobarAún no hay calificaciones
- NeutralizacionDocumento1 páginaNeutralizacionMichael Cano BAún no hay calificaciones
- Metalurgía de Hierros y AcerosDocumento51 páginasMetalurgía de Hierros y AcerosRené GVAún no hay calificaciones
- Reglamento Técnico Ambiental Calidad Del Aire 2018Documento22 páginasReglamento Técnico Ambiental Calidad Del Aire 2018Ambiorys M. Pérez R.Aún no hay calificaciones
- Taller 1Documento4 páginasTaller 1KEVIN ALDAIR TORRES CALLAAún no hay calificaciones
- Cicloalcanos 2020-IiDocumento7 páginasCicloalcanos 2020-IiPedro CruzAún no hay calificaciones
- INFORME 1 - HalogenosDocumento15 páginasINFORME 1 - HalogenosNICOL ELIZABETH MILLA CRUZAún no hay calificaciones
- 000 Informe Final de Pruebas Experimentales Comparativas de Cal Liquida - 2015 - 2016 - Directiva 1-2015 IIDocumento56 páginas000 Informe Final de Pruebas Experimentales Comparativas de Cal Liquida - 2015 - 2016 - Directiva 1-2015 IIAlcajer Miguel Alarcon EspinozaAún no hay calificaciones
- Cuáles Son Los Niveles de Organización de La MateriaDocumento4 páginasCuáles Son Los Niveles de Organización de La MateriaLuis GuamaniAún no hay calificaciones
- Taller 2 Grupos FuncionalesDocumento6 páginasTaller 2 Grupos FuncionalesMiguel Angel Carrillo ArizaAún no hay calificaciones
- Marcha AnaliticaDocumento1 páginaMarcha AnaliticaJorge GuerraAún no hay calificaciones
- Taller Unidad No 2, 3 y 4 Estructura Atómica, Tabla Periodica, NomenclaturaDocumento20 páginasTaller Unidad No 2, 3 y 4 Estructura Atómica, Tabla Periodica, NomenclaturaIsmael GarciaAún no hay calificaciones
- Características Químicas Del AguaDocumento2 páginasCaracterísticas Químicas Del AguaAlma RodríguezAún no hay calificaciones
- Agua RegiaDocumento4 páginasAgua RegiaEccler Huashuayllo Castillo100% (1)
- Proceso WackerDocumento12 páginasProceso WackerMoy Fuentes100% (1)
- Equílibrío QuímicoDocumento2 páginasEquílibrío QuímicoAndres AudelloAún no hay calificaciones
- Biomaterial EsDocumento1 páginaBiomaterial Esmanuel estradaAún no hay calificaciones
- Química SNNA2Documento150 páginasQuímica SNNA2Soledad NuñezAún no hay calificaciones
- Práctica #3 - HidrocarburosDocumento5 páginasPráctica #3 - HidrocarburosElizabeth TacillaAún no hay calificaciones
- Metodo Del Simple Tanteo y AlgebraicoDocumento2 páginasMetodo Del Simple Tanteo y AlgebraicoDanaNoelia BellidoLedezmaAún no hay calificaciones
- Ejercicios Tema 6 - 22-23Documento6 páginasEjercicios Tema 6 - 22-23agustin cabreraAún no hay calificaciones
- Guias de Labs 7 y 8Documento15 páginasGuias de Labs 7 y 8Lala RiveraAún no hay calificaciones
- Lab 3 - 4Documento4 páginasLab 3 - 4Laura VillamilAún no hay calificaciones
- Tipos de Solucion PatronDocumento5 páginasTipos de Solucion PatronMarleny ZMAún no hay calificaciones
- Libro de Quimica Revisado2018 (Reparado)Documento154 páginasLibro de Quimica Revisado2018 (Reparado)Jairo RojanoAún no hay calificaciones
- Presentacion LixiviacionDocumento27 páginasPresentacion LixiviacionAlfredo Enrigues Sanchez DrullaAún no hay calificaciones
- UNIDADES QUÍMICAS DE MASA Y ESTEQUIOMETRÍADocumento3 páginasUNIDADES QUÍMICAS DE MASA Y ESTEQUIOMETRÍAWilson MuñozAún no hay calificaciones