Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Hidrocarburos Aromaticos III 2020
Cargado por
Jessenia Ponce VillatoroDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Hidrocarburos Aromaticos III 2020
Cargado por
Jessenia Ponce VillatoroCopyright:
Formatos disponibles
HIDROCARBUROS AROMATICOS
Objetivos.
1. Conocer la historia y los científicos que apartaron sus descubrimientos a la identificación de
compuestos aromáticos
2. Identificar las características y fundamentos del carácter aromático y saber nombrar los
compuestos aromáticos y sus derivados.
3. Determinar el mecanismo de sustitución electrofílica aromática y predecir los productos en
reacciones comunes como: halogenación, nitración, sulfonación, alquilación y acilación de Friedel-
Crafts.
4. Conocer la naturaleza activante y desactivante, así como la orientación orto-para y meta de los
sustituyentes y utilizar este conocimiento para predecir la o las posiciones de sustitución
electrofílica aromática sobre moléculas que contienen sustituyentes en anillos aromáticos.
5. Predecir los productos de reacción de compuestos aromáticos y emplear esas reacciones en el
diseño de síntesis.
6. Conocer los principales compuestos aromáticos heterocíclicos de interés industrial y sus
principales aplicaciones.
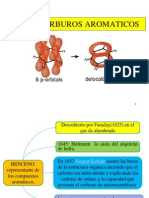
Historia del benceno
En 1825, Faraday aisló un compuesto puro que presentaba un punto de ebullición de 80ºC, a partir de una
mezcla aceitosa que condensaba del gas del alumbrado, que era el combustible que se empleaba en las
lámparas de gas. El resultado del análisis elemental realizado a dicho compuesto mostraba una proporción
de carbono e hidrógeno de 1:1, lo cual resultaba ser inusualmente pequeña, ya que teóricamente
corresponde a una fórmula empírica de CH.
Posteriormente Mitscherlich sintetizó el mismo compuesto, calculo la densidad de vapor, lo que le
permitió obtener el peso molecular que era aproximadamente 78, el cual corresponde a una fórmula
molecular de C 6 H6 . Como dicho compuesto se había obtenido a partir de la goma benjuí, se le denomino
bencina y a partir de ahí derivó el nombre a benceno como actualmente se le conoce.
Ya a finales del siglo XIX se fueron descubriendo muchos otros compuestos que parecían estar
relacionados con el benceno pues tenían bajas relaciones de hidrógeno a carbono y despedían aromas
agradables, además presentaban la peculiaridad de que se podían convertir en benceno o compuestos
afines. A este grupo de compuestos se le llamo aromáticos por presentar aromas agradables.
Posteriormente el estudio de la estabilidad que presentaban estos compuestos, llevo consigo que el
término aromático se utilizara para designar a compuestos que presentaban una estabilidad muy similar,
independientemente de su olor. Como consecuencia a los otros compuestos orgánicos que no presentaban
estas características (alcanos, alquenos, alquinos,....) se les denomino alifáticos que significa semejantes a
las grasas.
En general, podemos decir que los compuestos aromáticos están constituidos por el benceno y todos
aquellos compuestos que presentan un comportamiento químico similar y que dan lugar a la serie
aromática, la cual se construye a partir del benceno, fundamentalmente de dos formas:
Quimica M edica 2 QQ-112 Página 1
Dra. Diana C. Aguilar
1.- Mediante la simple sustitución de los átomos de hidrógeno del núcleo bencénico por otros
sustituyentes (bencenos sustituidos).
2.- Mediante la unión de uno o más anillos adicionales (aromáticos o no), con sustituyentes o no, a una o
más posiciones del anillo bencénico progenitor (derivados aromáticos polinucleares).
Los hidrocarburos aromáticos se caracterizan por su tendencia a la sustitución
heterolítica, a diferencia de los hidrocarburos alifáticos que como ya hemos visto presentaban reacciones
de adición y sustitución.
Aunque el benceno se conoce desde 1825, y sus propiedades físicas y químicas son mejor conocidas que
la de cualquier otro compuesto orgánico, su estructura no pudo ser determinada de forma satisfactoria
hasta 1931. El principal problema era debido no a la complejidad de la molécula en sí, sino que era
consecuencia del limitado desarrollo de la teoría estructural alcanzado en aquella época.
Como ya señalamos se conocía su fórmula molecular (C 6 H6 ), pero el problema estaba en conocer como se
disponían los átomos en la estructura. En 1858 Kekulé propuso que los átomos de carbono se podían unir
entre sí para formar cadenas. Posteriormente en 1865 propuso para poder resolver el problema del
benceno, que estas cadenas carbonadas a veces se pueden cerrar formando anillos. Para representar la
estructura del benceno se habían propuesto las siguientes:
Todos estos intentos de representar la estructura del benceno representaban las distintas formas en
que se trataba de reflejar la inercia química del benceno. Recientemente Van Temelen sintetizó el
benceno de Dewar "biciclo (2,2,0) hexadieno", sustancia que sufre una rápida isomerización de
enlace de valencia para dar benceno.
Los compuestos aromáticos son el benceno y los compuestos de comportamiento químico similar. Las
propiedades aromáticas son las que distinguen al benceno de los hidrocarburos alifáticos. La molécula
bencénica es un anillo de un tipo muy especial. Hay ciertos compuestos, también, que parecen diferir
estructuralmente del benceno y sin embargo se comportan de manera similar. Resulta que estos
compuestos se parecen estructuralmente al benceno, en su estructura electrónica básica, por lo que
también son aromáticos.
Quimica M edica 2 QQ-112 Página 2
Dra. Diana C. Aguilar
Los hidrocarburos alifáticos -alcanos, alquenos y alquinos y sus análogos cíclicos- reaccionan
principalmente por adición y sustitución por radicales libres: la primera ocurre en los enlaces múltiples; la
segunda, en otros puntos de la cadena alifática. Vimos que estas mismas reacciones suceden en las partes
hidrocarbonadas de otros compuestos alifáticos. La reactividad de estas partes se afectada por la presencia
de otros grupos funcionales, y la reactividad de estos últimos, por la presencia de la parte hidrocarburos.
En cambio, veremos que los hidrocarburos aromáticos se caracterizan por su tendencia a sustitución
heterolítica. Además, estas mismas reacciones de sustitución son características de anillos aromáticos
dondequiera que aparezcan, independientemente de los otros grupos funcionales que la molécula pudiera
contener. Estos últimos afectan a la reactividad de los anillos aromáticos, y viceversa.
Características de los compuestos aromáticos.
Benceno
Propiedades físicas. El benceno es un líquido incoloro, móvil con olor dulce a esencias.
Es soluble en éter, nafta y acetona. También se disuelve en alcohol y en la mayoría de los solventes
orgánicos.
Disuelve al yodo y las grasas.
Su densidad es de 0,89 gramos sobre centímetros cúbicos.
Punto fusión: 5,5 °C.
Punto ebullición: 80°C.
Fórmula: C 6 H6 .
Peso molecular: 78 gramos.
CONDICIONES PARA LA AROMATICIDAD
Para que un compuesto sea aromático, y por tanto posea una elevada estabilidad termodinámica y una
reactividad química diferente de la de los alquenos y polienos conjugados, debe cumplir las siguientes
condiciones:
1) Su estructura debe ser cíclica y debe contener enlaces dobles conjugados.
2) Cada átomo de carbono del anillo debe presentar hidridación sp2, u ocasionalmente sp, con al menos
un orbital p no hidrizado.
3) Los orbitales p deben solaparse para formar un anillo continuo de orbitales paralelos. La estructura
debe ser plana o casi plana para que el solapamiento de los orbitales p sea efectivo.
4) Además debe cumplir la regla de Hückel cuyo enunciado es el siguiente:
Para que un compuesto sea aromático el número de electrones p en el sistema cíclico tiene que ser 4n + 2,
siendo n un número entero.
Si el número de electrones pí en el sistema cíclico es 4n, siendo n un número entero, el compuesto es anti-
aromático.
Quimica M edica 2 QQ-112 Página 3
Dra. Diana C. Aguilar
Al emplear la regla de Hückel se debe estar seguro que el compuesto bajo consideración cumple con los
criterios de un sistema aromático o anti-aromático, es decir debe tener un anillo continuo de orbitales p
que se solapan en una conformación plana.
El benceno es un anuleno con un anillo continuo de orbitales p que se solapan. En el benceno hay seis
electrones pí de modo que es un sistema 4n+2, con
n =1. La regla de Hückel predice que el benceno será aromático.
REGLA DE HUCKEL
Se definen como compuestos aromáticos aquellos que presentan orbitales moleculares cíclicos planos,
conteniendo 4 n +2 electrones П deslocalizados, en donde n es un número entero, positivo incluyendo el
cero. Ejemplos:
Veremos algunos ejemplos de compuestos que no son aromáticos:
Quimica M edica 2 QQ-112 Página 4
Dra. Diana C. Aguilar
NOMENCLATURA
Los bencenos monosustituidos se nombran terminando el nombre del sustituyente en benceno.
Algunos derivados monosustituidos del benceno tienen nombres comunes ampliamente aceptados .
En bencenos disustituidos se emplean los prefijos orto (benceno 1,2-disustituido), meta (benceno 1,3-disustituido)
y para (benceno 1,4-disustituido) para indicar la posición de los sustituyentes en el anillo.
Quimica M edica 2 QQ-112 Página 5
Dra. Diana C. Aguilar
En bencenos con más de dos sustituyentes, se numera el anillo de modo que los sustituyentes tomen los menores
localizadores. Si varias numeraciones dan los mismos localizadores se da preferencia al orden alfabético.
CH3 COOH OH
CH3 Br
CH3
H3CO NO2
Br
1,2,3 Trimetil Benceno Ac. 2,4 Dibromo Benzoico 3- Metoxi – 5 – Nitro - Fenol
Quimica M edica 2 QQ-112 Página 6
Dra. Diana C. Aguilar
Br OH CH3
Br Br O2N NO2 O2N NO2
Br Br
Br NO2 NO2
Hexa bromo Benceno 2,4,6 – Trinitro Fenol 2,4,6 – Trinitro Tolueno
Ac. picrico TNT
REACCIONES DEL BENCENO
1. Nitración del benceno
El benceno reacciona con la mezcla nitrico-sulfurico adicionando grupos nitro.
+ H2 O
El electrófilo de esta reacción es el catión nitronio. NO 2 +. Las concentraciones de este catión en el
ácido nitrico son muy bajas para nitrar el benceno, por ello es necesario añadir ácido sulfúrico.
2.-Halogenación del Benceno
El benceno reacciona con halógenos en presencia de ácidos de Lewis para formar derivados halogenados.
La cloración se puede llevar a cabo de forma similar a la bromación. La reacción con flúor y yodo se
realiza muy poco frecuentemente. En el caso del flúor la reacción es dificil de controlar por su elevada
reactividad. Por el contrario, el yodo reacciona lentamente y tiene un equilibrio desfavorable.
3.-Sulfonación del Benceno
La reaccion del benceno [1] con una disolución de trióxido de azufre en ácido sulfúrico produce ácidos
bencenosulfónicos [2].
Quimica M edica 2 QQ-112 Página 7
Dra. Diana C. Aguilar
4a.-Síntesis de Friedel y Crafts, Alquilación
El benceno reacciona con los haluros de alquilo, en presencia de Cloruro de aluminio anhidro como
catalizador, formando homólogos.
El ataque sobre el anillo bencénico por el ion CH3 electrofilico es semejante al realizado por el ion Cl en
la halogenación
4b.-Síntesis de Friedel y Crafts, Acilacion
En el caso más simple, la reacción entre un haluro de acilo y una molécula de benceno en presencia de un
ácido de Lewis como catalizador, habitualmente AlX3 . Los productos son acilbenceno (o fenilcetona) y
haluro de hidrógeno.
INTRODUCCION DE UN SEGUNDO SUSTITUYENTE AL ANILLO ARO MATICO
Las reacciones más comunes del benceno son las reacciones de sustitución. Los sustituyentes producen
diversos efectos sobre la reactividad y orientación de una nueva sustitución. Considerando estos efectos
los sustituyentes se clasifican en:
Reactividad
o Activadores. Aumentan la reactividad.
o Inhibidores. Disminuyen la reactividad.
Orientación
o Ortoparadirigentes. El nuevo sustituyente se sitúa en posición orto o para respecto a él
(pero no meta).
o Metadirigentes. En nuevo sustituyente se sitúa en posición meta respecto a él.
En general, los activadores son ortoparadirigentes y los inhibidores son metadirigentes.
Quimica M edica 2 QQ-112 Página 8
Dra. Diana C. Aguilar
Sustitución electrofílica aromática
Activadores potentes
Activadores moderados
Orientadores orto-para
Activadores débiles
Inhibidores débiles
Inhibidores potentes
Orientadores meta
Inhibidores moderados
La bromación electrófilica, del metilbenceno (tolueno) da sustitución orto y para.
Reacciones de la cadena lateral en los derivados del benceno.
a) Reacciones de oxidación de la cadena lateral. Un anillo aromático imparte estabilidad adicional al
átomo de carbono más cercano de sus cadenas laterales. El anillo aromático y un átomo de carbono de
una cadena lateral pueden sobrevivir a una oxidación vigorosa con permanganato para formar una sal de
ácido benzoico. Esta reacción es útil para preparar derivados de ácido benzoico si los demás grupos
funcionales del anillo aromático son resistentes a la oxidación.
b) Reacciones de Halogenación radical de la cadena lateral. Los alquilbencenos participan en
reacciones de Halogenacion por radicales libres mucho más fácilmente que los alcanos, porque la
sustracción de un átomo de hidrógeno de la posición bencílica genera un radical bencilo estabilizado por
Quimica M edica 2 QQ-112 Página 9
Dra. Diana C. Aguilar
resonancia. Por ejemplo, el etilbenceno reacciona con bromo, en ausencia de ácidos de Lewis, bajo
irradiación fotoquímica para formar el a-bromoetilbenceno.
La formación de este compuesto se explica mediante un mecanismo radicalario. En la etapa de iniciación
el bromo molecular se escinde homolíticamente para formar dos radicales bromo. En la etapa de
propagación el radical bromo abstrae un átomo de hidrógeno de la posición bencílica originando un
radical bencílico, que está estabilizado por resonancia con el anillo aromático. El radical bencílico
reacciona con el bromo molecular para dar lugar al a-bromoetilbenceno y a un radical bromo que inicia de
nuevo el ciclo radicalario.
Quimica M edica 2 QQ-112 Página 10
Dra. Diana C. Aguilar
BIBLIOGRAFIA
1. Primo Yúfera, E. Química Orgánica Básica y Aplicada. De la molécula a la Industria. Editorial
Reverté (2010).
2. McMurry, J. Química Orgánica. Grupo Editorial Iberoamericano (2013).
3. Wade, L.G. Química Orgánica. Ed. Prentice-Hall (2013).
4. SOLOMONS G. 1995. México. Fundamentos de Química Orgánica. Editorial LIMUSA.
5. MORRISON R. & BOYD R. 1990. México. Química Orgánica. Editorial A.W. Iberoamericana.
6. WADE L.G. 1993. México. Química Orgánica. Editorial Hispano-Americana.
7. VOLLHART C. 1996. España. Química Orgánica. Editorial Omega.
Quimica M edica 2 QQ-112 Página 11
Dra. Diana C. Aguilar
También podría gustarte
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- SINTESIS de Williamson (Obtencion de Acido FenoxiaceticoDocumento16 páginasSINTESIS de Williamson (Obtencion de Acido Fenoxiacetico.:("*"BLacK BuLLeT"*"):.93% (28)
- De la estructura atómica a la quiralidad.: Algunos conceptos de la químicaDe EverandDe la estructura atómica a la quiralidad.: Algunos conceptos de la químicaCalificación: 5 de 5 estrellas5/5 (1)
- Compuestos AromaticosDocumento143 páginasCompuestos AromaticosJuan Wilfredo Hernandez Diaz100% (1)
- Hidrocarburos AromaticosDocumento82 páginasHidrocarburos AromaticosCesar AvilaAún no hay calificaciones
- 2 Guia NomenclaturaDocumento12 páginas2 Guia NomenclaturaFranco Fernández MedinaAún no hay calificaciones
- Hidrocarburos AromaticosDocumento120 páginasHidrocarburos AromaticosHeidy EspejoAún no hay calificaciones
- Hidrocarburos Alifáticos y Aromáticos TrabajoDocumento6 páginasHidrocarburos Alifáticos y Aromáticos TrabajoRossanaMarquezDiazAún no hay calificaciones
- Guia AromaticosDocumento8 páginasGuia AromaticosReyna RomanoAún no hay calificaciones
- AromaticidadDocumento6 páginasAromaticidadMilagros Valinotti GaunaAún no hay calificaciones
- Informe de Laboratorio de Hidrocarburos AromaticosDocumento20 páginasInforme de Laboratorio de Hidrocarburos Aromaticosalejandro50% (2)
- Proyecto AromaticoDocumento9 páginasProyecto AromaticoRuben Andrés MGAún no hay calificaciones
- Sesión 6. AromáticosDocumento30 páginasSesión 6. AromáticosDayana AhumadaAún no hay calificaciones
- Presentación Aromáticos MonosustituidosDocumento48 páginasPresentación Aromáticos MonosustituidosRamon Enrique Hinostroza GutierrezAún no hay calificaciones
- Estructuras de Kekule OrganicaDocumento5 páginasEstructuras de Kekule OrganicaAracelyGomez100% (1)
- QUÍMICA ORGÁNICA - AromáticosDocumento60 páginasQUÍMICA ORGÁNICA - AromáticosMARCO ANTONIO PEREZ SALDAÑAAún no hay calificaciones
- Hidrocarburo AromáticoDocumento9 páginasHidrocarburo AromáticoFares Jared Salomon LandaAún no hay calificaciones
- Hidrocarburos AromáticosDocumento10 páginasHidrocarburos AromáticosYolehidis Franchesca Sena VasquezAún no hay calificaciones
- Hidrocarburos AromáticosDocumento25 páginasHidrocarburos AromáticosXiomyAún no hay calificaciones
- Compuestos AromáticosDocumento28 páginasCompuestos AromáticosMARIA FERNANDA CARRASQUILLA CASTILLO ESTUDIANTEAún no hay calificaciones
- AR-I Presentación Aromáticos MonosustituidosDocumento50 páginasAR-I Presentación Aromáticos MonosustituidosConstantino AquilesAún no hay calificaciones
- Anillo aromático historiaDocumento2 páginasAnillo aromático historiaJosue Hernandez MrkzAún no hay calificaciones
- Compuestos Aromáticos Junio 2015Documento47 páginasCompuestos Aromáticos Junio 2015maikAún no hay calificaciones
- Síntesis benceno propiedadesDocumento23 páginasSíntesis benceno propiedadesHESLER ADRIÁN GODOY CRUZ100% (1)
- Practica Numero 4Documento30 páginasPractica Numero 4JulianaJudithGarbozoSaenz100% (2)
- Compuestos Aromáticos: Compuestos Aromáticos, en Química Orgánica, Un Grupo Amplio deDocumento14 páginasCompuestos Aromáticos: Compuestos Aromáticos, en Química Orgánica, Un Grupo Amplio deAreli CGAún no hay calificaciones
- Compuestos AromáticosDocumento53 páginasCompuestos AromáticosJEAN CAMILO PORRAS RICOAún no hay calificaciones
- Benceno: Estructura y propiedadesDocumento114 páginasBenceno: Estructura y propiedadesLuis DominguezAún no hay calificaciones
- Informe Hidrocarburos Aromaticos Chamaco Mamani Leslie LisbethDocumento15 páginasInforme Hidrocarburos Aromaticos Chamaco Mamani Leslie LisbethJhoselyn Isabel Usmayo QuispeAún no hay calificaciones
- Hidrocarburos AromáticosDocumento9 páginasHidrocarburos AromáticosdonisemilioAún no hay calificaciones
- Hidrocarburos aromáticosDocumento23 páginasHidrocarburos aromáticosliz_prsAún no hay calificaciones
- Tema 1.1Documento11 páginasTema 1.1Yhoselyn MareñoAún no hay calificaciones
- Compuestos AromáticosDocumento16 páginasCompuestos AromáticosKatherine YisselAún no hay calificaciones
- AltagraciaDocumento20 páginasAltagraciaJhoanny VásquezAún no hay calificaciones
- Clase 4 Compuestos Aromáticos PDFDocumento5 páginasClase 4 Compuestos Aromáticos PDFMaria PlazaAún no hay calificaciones
- Hidrocarburo AromáticoDocumento64 páginasHidrocarburo AromáticoCristhian MenaAún no hay calificaciones
- Compuestos AromáticosDocumento16 páginasCompuestos AromáticosEunice PalmersAún no hay calificaciones
- AromaticosDocumento12 páginasAromaticosAnonymous ZQLU09VAún no hay calificaciones
- AROMATICOSDocumento41 páginasAROMATICOSDiana castelblanco avilaAún no hay calificaciones
- Arenos y BencenosDocumento15 páginasArenos y BencenosChavaCoconBernardoAún no hay calificaciones
- Hidrocarburos AromaticosDocumento12 páginasHidrocarburos AromaticosEstefy Patiño OrellanaAún no hay calificaciones
- Aromaticidad y BencenoDocumento5 páginasAromaticidad y BencenoJulia Rojas100% (1)
- Historia Del Benceno y Sus Estructuras y Estructura de KeKuleDocumento12 páginasHistoria Del Benceno y Sus Estructuras y Estructura de KeKuleBrandon Eliel Cortes GuerreroAún no hay calificaciones
- Hidrocarburos aromáticos: concepto, estructura y efectos en la saludDocumento5 páginasHidrocarburos aromáticos: concepto, estructura y efectos en la saludMariaAún no hay calificaciones
- 11Documento8 páginas11Rotiseria MatuteAún no hay calificaciones
- Compuesto AromáticosDocumento2 páginasCompuesto AromáticosJohana OjedaAún no hay calificaciones
- Compuestos AromaticosDocumento38 páginasCompuestos AromaticosJuancruzapAún no hay calificaciones
- Trabajo QuimicaDocumento6 páginasTrabajo QuimicaMarielys Rojas de RojasAún no hay calificaciones
- Hidrocarburos Aromáticos RADIOLOGÍADocumento10 páginasHidrocarburos Aromáticos RADIOLOGÍALaura FernandezAún no hay calificaciones
- Unidad 4 Benceno y AromaticidadDocumento30 páginasUnidad 4 Benceno y Aromaticidadmalito malitoAún no hay calificaciones
- Practica Numero 4Documento30 páginasPractica Numero 4AngelitoLeónAún no hay calificaciones
- Compuestos AromaticosDocumento38 páginasCompuestos AromaticosMarianny Cuello BautistaAún no hay calificaciones
- Hidrocarburos AromáticosDocumento7 páginasHidrocarburos AromáticosDaniela Muñoz VargasAún no hay calificaciones
- Compuestos Aromaticos 2FDocumento14 páginasCompuestos Aromaticos 2FValeria HaroAún no hay calificaciones
- AROMATICOS Guia 2020Documento9 páginasAROMATICOS Guia 2020Ange QuinteroAún no hay calificaciones
- T2 11° Hidrocarburos AromáticosDocumento8 páginasT2 11° Hidrocarburos AromáticosEdna Milena Capera SilvaAún no hay calificaciones
- Hidrocarburos AromaticosDocumento37 páginasHidrocarburos AromaticosValentina OrtizAún no hay calificaciones
- Benceno y FenolesDocumento16 páginasBenceno y FenolesBre Ceron MuñozAún no hay calificaciones
- INTRODUCCIÓNDocumento1 páginaINTRODUCCIÓNJessenia Ponce VillatoroAún no hay calificaciones
- Reacciones de Alquenos y Alquinos III-2021Documento10 páginasReacciones de Alquenos y Alquinos III-2021Jessenia Ponce VillatoroAún no hay calificaciones
- Reacciones Hidrocarburos Alifáticos y AromáticosDocumento13 páginasReacciones Hidrocarburos Alifáticos y AromáticosJessenia Ponce VillatoroAún no hay calificaciones
- Hidrocarburos Alifaticos - Alcanos III-2021Documento25 páginasHidrocarburos Alifaticos - Alcanos III-2021Jessenia Ponce VillatoroAún no hay calificaciones
- Ejercicios - de - Esteroisomeria - y - Carbohidratos 2020Documento8 páginasEjercicios - de - Esteroisomeria - y - Carbohidratos 2020Honey Heart Relaciones PúblicasAún no hay calificaciones
- Ejercicios Formulación OrgánicaDocumento16 páginasEjercicios Formulación OrgánicaDarkCompany96Aún no hay calificaciones
- GlúcidosDocumento3 páginasGlúcidosSaraAún no hay calificaciones
- Actividad FormativaDocumento3 páginasActividad FormativaJosu Gonzalez0% (1)
- Taller de Química OrgánicaDocumento9 páginasTaller de Química OrgánicaJuan Paulo Clavijo RojasAún no hay calificaciones
- Solubilidad de compuestos orgánicos e inorgánicosDocumento5 páginasSolubilidad de compuestos orgánicos e inorgánicosDaniela Marin LibrerosAún no hay calificaciones
- 1 Isomería Estructural de CadenaDocumento9 páginas1 Isomería Estructural de CadenaANDRIC AZAEL �LVAREZ LOMEL�Aún no hay calificaciones
- Alquenos 2021Documento119 páginasAlquenos 2021OSCAR DANIEL ARREDONDO GAÑANAún no hay calificaciones
- Analisis FuncionalDocumento10 páginasAnalisis FuncionalRocío Hernández SotoAún no hay calificaciones
- Práctica # 5 Síntesis de Ácido SulfanílicoDocumento5 páginasPráctica # 5 Síntesis de Ácido SulfanílicoLaura RamirezAún no hay calificaciones
- Clase 10 Bencenicos o Aromatico (1) (1) (Solo Lectura)Documento39 páginasClase 10 Bencenicos o Aromatico (1) (1) (Solo Lectura)Walter Jesus Villegas ChisculAún no hay calificaciones
- Informe #8Documento29 páginasInforme #8Mayli Martinez AñancaAún no hay calificaciones
- Introduccion A La Química OrgánicaDocumento3 páginasIntroduccion A La Química Orgánicalisbeth vargasAún no hay calificaciones
- Copia de 2.23. Formulación y Nomenclatura de Compuestos Orgánicos. Compuestos Con Más de Dos Grupos FuncionalesDocumento7 páginasCopia de 2.23. Formulación y Nomenclatura de Compuestos Orgánicos. Compuestos Con Más de Dos Grupos FuncionalesFelipe TovarAún no hay calificaciones
- Alcoholes y ÉteresDocumento42 páginasAlcoholes y ÉteresDeily Llamo100% (1)
- Reacciones de AlcoholesDocumento7 páginasReacciones de AlcoholesJuan BustamanteAún no hay calificaciones
- Practica 4 Oxidacion de AldehídosDocumento3 páginasPractica 4 Oxidacion de AldehídosAlejandra Pérez ReyesAún no hay calificaciones
- Formulario Quimica ComunDocumento18 páginasFormulario Quimica ComunMisael VargasAún no hay calificaciones
- 005 Apunte - Materiales Org - Inorg - VGVDocumento6 páginas005 Apunte - Materiales Org - Inorg - VGVfotoseuro23Aún no hay calificaciones
- CicloalcanosDocumento13 páginasCicloalcanoscarlosAún no hay calificaciones
- AISLAMIENTODELIMONENODocumento7 páginasAISLAMIENTODELIMONENOCarolina OrdóñezAún no hay calificaciones
- Las Células Son Estructuras Increíblemente Complejas y Variadas CAPITULO 2Documento34 páginasLas Células Son Estructuras Increíblemente Complejas y Variadas CAPITULO 2acdc29111967Aún no hay calificaciones
- Grupos carbonilo biomoléculasDocumento20 páginasGrupos carbonilo biomoléculasDänï AyäläAún no hay calificaciones
- Fundamentos de PolímerosDocumento64 páginasFundamentos de Polímeroswmcf231091Aún no hay calificaciones
- Estructura de Las ProteinasDocumento2 páginasEstructura de Las ProteinasJosmel yañezAún no hay calificaciones
- Practica 15. SÍNTESIS DE 2-FENILINDOLDocumento13 páginasPractica 15. SÍNTESIS DE 2-FENILINDOLAdriana MarinAún no hay calificaciones
- Cartilla-Hidrocarburoa AromáticosDocumento3 páginasCartilla-Hidrocarburoa AromáticosMARIA JOSE QUIROGAS CUELLOAún no hay calificaciones
- Hidrocarburos - Polimeros-HeterociclicosDocumento40 páginasHidrocarburos - Polimeros-Heterociclicoslaura sifuentes amezAún no hay calificaciones