Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Procesado Termico-Cinetica Quimica20-21
Cargado por
Henry E. GonzalezTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Procesado Termico-Cinetica Quimica20-21
Cargado por
Henry E. GonzalezCopyright:
Formatos disponibles
TEMA 4
PROCESADO TERMICO Y CINÉTICA QUÍMICA EN ALIMENTOS
INTRODUCCIÓN
Los alimentos por su naturaleza no son estables, dado que en
ellas ocurren diversos cambios físico-químico y además están
propensos a sufrir alteraciones microbianas.
Uno de los procedimientos físicos de que se dispone para la
conservación de alimentos y de esta manera aumentar la vida
útil de los mismos es la aplicación del calor. Existiendo
modalidades del tratamiento térmico, si el objetivo es la
destrucción de los microorganismos se aplica la
pasteurización y la esterilización, el primero también es
empleado para la inactivación de enzimas.
Los parámetros de la cinética de destrucción microbiana por
el uso del calor también son validos para los casos de
degradación de vitaminas, enzimas, pardeamiento no-
enzimático, oxidación de lípidos o de alguna reacción que
afecte la calidad de un alimento en particular.
Esta sección define los parámetros del procesado térmico y su
relación con la cinética química en alimentos, y además se
resuelven problemas aplicativos y de interés practico.
El Autor
Ing°. Edwin Macavilca T.
PARÁMETROS DEL PROCESADO TERMICO
4.1 Tiempo de reducción decimal o valor D
Es el tiempo de reducción decimal o el tiempo necesario
para destruir el 90 % de los microorganismos. Es igual
al numero de minutos precisos para que la línea de
supervivencia atraviese un ciclo logarítmico y puede
calcularse a partir del inverso de la pendiente de la
línea de supervivencia y se determina la siguiente
expresión;
D = t / (Log No - Log Nt) (4.1)
ó Nt/No = 10-t/D (4.2)
Donde:
D = tiempo de reducción decimal (min)
T = tiempo (min)
No = número de microorganismos originales presentes
Nt = número de microorganismos después del tratamiento
térmico
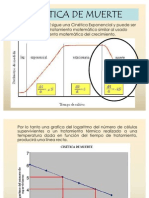
Figura 4.1. Grafico de supervivencia
Por la naturaleza logarítmica de la muerte de los
microorganismos por la acción letal del calor indica que
no es posible llegar al cero absoluto, por mas tiempo
que dure el tratamiento, por ejemplo si un
microorganismo presenta un D110°C= 1min, es decir en 1
minuto de tratamiento a 110 °C se destruirá el 90% de
las células supervivientes, si se prolonga el
tratamiento otro minuto mas se obtendrá un 99% de
destrucción y así las reducciones serán sucesivas del
99.9%, 99.99%, etc. Es decir sobreviven 10%, 1%, 0.1%,
0.01%, etc, esto indica que en la practica hay la
probabilidad de encontrar 1 espora viable en 1 por cada
10 envases, 1 por cada 100 envases, 1 por cada 1000
envases, etc.
Ing°. Edwin Macavilca T.
El concepto de 12D implica que la esterilización de
alimentos de pH superior a 4.5 es necesario suponer la
presencia de una espora de Clostritium botulinum por
envase y que después del tratamiento térmico sólo puede
permanecer viable una espora por 1012 envases.
4.2 valor Z
Es el valor que corresponde al numero de grados precisos
para aumentar la temperatura para que la línea de
termodestrucción atraviese un ciclo logarítmico y es
igual a los grados centígrados que es necesario aumentar
o disminuir la temperatura para que el valor D,
respectivamente, disminuya o aumente 10 veces. Su
determinación se realiza a partir de la siguiente
expresión;
Z=
(T 2 − T1)
(LogD1 − LogD2) (4.3)
Donde:
Z = número de grados (°C)
T1 y T2 = temperaturas de tratamiento (°C)
D1 y D2 = valores D a las temperaturas anteriores
Figura 4.2. Grafica de termodestrucción
Los valores z para las esporas bacterianas suelen
situarse entre 7 y 12 °C y para las bacterias no
esporuladas entre 4 y 6 °C.
Ing°. Edwin Macavilca T.
4.3 Tiempo de muerte térmica o Valor F
Es el equivalente en minutos de las letalidades
combinadas de todas las integraciones tiempo -
temperatura en el punto de calentamiento mas tardío para
un producto durante su tratamiento térmico, es decir el
tiempo requerido a una temperatura dada para reducir la
población microbiana presente en un alimento hasta un
nivel deseado.
Cuando el valor FTZ se refiere a 121 °C con un valor Z de
10
10°C ( F121 ) se designa como Fo.
El valor F se calcula, suponiendo que el calentamiento y
el enfriamiento son instantáneos, a partir de la
siguiente expresión:
F = D (Log No-Log Nt) (4.4)
Donde:
F = tiempo (min) requerido para lograr el grado de
reducción de la población microbiana hasta el nivel
deseado.
D= tiempo de reducción decimal a la temperatura de
tratamiento.
No= número inicial de microorganismos
Nt= número final al que se pretende llegar.
4.4 Probabilidad de deterioro
La probabilidad de deterioro se usa para calcular el
número de envases deteriorados producidos durante el
procesado de un cierta cantidad de producto.
La relación que determina el probable nivel de deterioro
se deduce a partir de la Ec. 4.1, donde t=F, por tanto;
Log No - Log Nt= F/D, luego si r es el número de envases
procesados y si el objetivo es llegar a un proceso
térmico donde se alcance una probabilidad de un
microorganismo en el lote (Log rNt 0), entonces se
tiene;
Log (rNo) = F/D o rNo = 10 F/D (4.5)
Por tanto
1 No
= F (4.6)
r
10 D
Ing°. Edwin Macavilca T.
4.5 Relación entre la Cinética química y los parámetros del
Procesado térmico
La velocidad de las reacciones bioquímicas y enzimáticas
describen un mecanismo semejante a lo que experimentan
el desarrollo o destrucción microbiana ante el efecto de
la temperatura, es por ello que es preciso establecer la
relación entre los parámetros de la cinética química y
los del procesado térmico.
4.5.1 El Valor D y la constante de velocidad de reacción(k)
La cinética de reacción que describe una reacción
química en un alimento esta definida como;
Qt
Ln = −kt (4.7)
Qo
y del mismo modo la relación cinética que describe la
disminución de la población microbiana es;
Nt
Ln = −kt (4.8)
No
Donde:
k = Constante de velocidad de reacción (tiempo-1)
t = tiempo
Qt = cantidad del componente que reacciona al tiempo t
Qo = cantidad inicial del componente a reaccionar
No= número inicial de microorganismos
Nt= número de microorganismo al tiempo t
Ambas relaciones describen una cinética de primer
orden, y haciendo un cambio de la base logarítmica
neperiana a decimal y posteriormente por una
comparación se tiene que;
k = 2.303 / D (4.9)
4.5.2 El Valor Z y Q10
La relación de las constantes de velocidad de reacción
a temperaturas que difieren por 10 °C se le conoce
como Q10, este término también es llamado como la
sensibilidad de temperatura de la reacción para un
cierto rango de temperatura, y se define como;
Q10 = Velocidad de la reacción a T2(=T1+10)°C (4.10)
Velocidad de la reacción a T1 °C
DT 1
De la Ec. 4.9 se tiene; Q10 = (4.11)
DT 2
Ing°. Edwin Macavilca T.
De la Ec. 4.3 donde T2-T1=10°C se tiene;
DT 1
= 1010 / Z (4.12)
DT 2
Por lo tanto; Q10 = 1010 / Z (4.13)
4.5.3 La energía de Activación (Ea) y el Valor Z
La influencia de la temperatura en la velocidad de la
reacción puede ser descrita usando la relación de
Arrhenius, como sigue
EA
− RT
k = ko e
(4.14)
Donde ko es el factor pre-exponencial o de frecuencia,
EA es la energía de activación, R es la constante de
gas ideal, y T es la temperatura (escala absoluta).
Linealizando la Ec. 4.14 se tiene;
Ea
Ln(k ) = Ln(ko) − (4.15)
RT
Luego para un cambio de temperatura TA1 y TA2 en K1 y K2
respectivamente, después de restar ambos cambios se
tiene;
k 2 Ea 1 1
Ln = ( − ) (4.16)
k1 R TA1 TA2
Teniendo en cuenta la Ec. 4.9 y 4.12 y en logaritmo
decimal se obtiene;
T 2 − T1 Ea 1 1
= ( − ) (4.17)
Z 2.303R TA1 TA2
Como TA2-TA1= T2-T1, entonces
2.303R
Ea =
(TA1 xT A2 ) (4.18)
Z
Si, la diferencia no es mucha entre TA2 y TA1, de modo
que TA2TA1= T A21
2.303R 2
Entonces; Ea = TA (4.19)
Z
Ing°. Edwin Macavilca T.
4.5.4 La energía de Activación (Ea) y Q10
La relación entre el valor de Ea y Q10 se establecen a
partir de las Ec. 4.10 y 4.15, de donde;
kT +10 k 0 exp − Ea / R(TA + 10)
Si, Q10 = = , entonces;
kT k 0 exp − Ea / RT A
Ea 10
LogQ10 = (4.20)
2.303R TA (TA + 10)
4.6 Método analítico en el calculo de la esterilización
comercial
Para determinar el cálculo del tiempo de esterilización,
este método hace uso de la siguiente fórmula:
j I
B = f h Log h h (4.21)
g
Donde;
B = es el tiempo (minutos) del proceso
fh = velocidad de calentamiento ó el tiempo (minutos) de
calentamiento que logra atravesar un ciclo
logarítmico en la grafica de penetración de calor
jh= tiempo (minutos) de inducción de calentamiento ó
factor de retraso antes de la curva de calentamiento
asuma una línea recta en la grafica de penetración
de calor.
jh= Tr – Tpih (4.22)
Tr - Tih
Tr= Temperatura del medio de calentamiento en el
autoclave
Tpih= Temperatura pseudoinicial de calentamiento de la
curva de penetración de calor
Tih= Temperatura inicial del alimento al inicio del
proceso
Ih= diferencia entre la temperatura del autoclave y la
inicial del alimento al inicio del proceso de
calentamiento.
Ih= Tr - Tih
g = diferencia entre al temperatura del autoclave y la
máxima final del producto
Ing°. Edwin Macavilca T.
Por las ecuaciones anteriores se tiene;
Log( jhIh) = Log[jh(Tr-Tih)] (4.23)
A excepción de g (que se encuentra en tablas), el resto de
los datos se obtienen de la gráfica de penetración de
calor(figura 4.3).
Figura 4.3. Curva de penetración de calor
Vinters et al mencionado por Singh (1996) menciona que para
microorganismos con un valor de z=18°F(10 °C), el valor de
Log(g) puede ser determinado empíricamente por la relación de
fh/U, donde U es el tiempo requerido a la temperatura Tr para
llevar a cabo la misma cantidad de destrucción bacteriana que
el valor de Fo del proceso (tiempo de muerte térmica a Tr),
su relación con Fo y el valor de F1 que es el que corresponde
al de la temperatura del autoclave, es:
U= FoF1 (4.24)
Donde F1 = Log −1 (250 − Tr ) / z = 10 (250−Tr ) / z (4.25)
Por lo tanto; fh/U = fh/FoF1
Si el valor de fh/U es mayor de 0.6, se considera la siguiente
relación;
Log(g) = 0.042808(log fh/U)5-0.35709(log fh/U)4+1.1929(log fh/U)3-
2.1296(log fh/U)2+2.48447(log fh/U)-0.28274 (4.26)
Y si el valor de fh/U es menor de 0.6, se considera lo
siguiente;
Log(g) = [0.71(fh/U) –1]/(fh/U) (4.27)
Ing°. Edwin Macavilca T.
4.7 PROBLEMAS RESUELTOS
4.7.1 Determinar el Valor de D para un microorganismo si se
dispone de los siguientes datos de resistencia térmica
para una suspensión de esporas.
Tiempo (minutos) Número de supervivientes
0 106
15 2.9x105
30 8.4x104
45 2.4x104
60 6.9x103
Dibujar la curva de supervivencia en coordenadas normales
y semilogarítmicas
Desarrollo;
Datos:
Los datos de tiempo (minutos) y Numero de supervivientes
se puede apreciar en la figura 4.5.
Planteamiento:
Se representará el Número de superviviente en una gráfica
semilogarítmica y a partir de esta se obtiene la
pendiente con la cual se puede calcular el valor D. El
problema se resolverá usando la hoja de calculo EXCEL
donde la pendiente es calculada en base a un modelo de
regresión lineal.
Solución:
En la figura 4.4 se muestra la evolución del numero de
supervivientes con respecto al tiempo (minutos)
1.2E+06
Población Supervivientes
1.0E+06
8.0E+05
6.0E+05
4.0E+05
2.0E+05
0.0E+00
0 15 30 45 60
Tiempo (min)
Figura 4.4
En la figura 4.5 se muestra el programa en la hoja de
calculo para resolver el problema 4.7.1
Ing°. Edwin Macavilca T.
Figura 4.5
En la figura 4.6 se muestra el resultado obtenido en la
hoja de calculo donde el valor de D= 27.75 minutos.
Figura 4.6
4.7.2 Los resultados de un experimento de resistencia térmica
dieron un valor de D de 7.5 minutos a 110 °C. Si había
4.9x104 supervivientes a los 10 minutos, calcular el
cociente (N/No) a los 5, 15 y 20 minutos.
Desarrollo;
Datos:
D=7.5 minutos
N (10 min)=4.9x104
Ing°. Edwin Macavilca T.
Planteamiento:
Se toman valores de tiempo cada 5 minutos de 0 a 20,
luego se calcula el valor de N en base a la población 10
minutos y aplicando la ecuación 10(t/D + log(N))
Los valores del cociente (N/No) se calculan en base a la
siguiente ecuación; 10-t/D
Solución:
En la figura 4.7 se muestra la programación de la hoja de
calculo para resolver el problema 4.7.2
Figura 4.7
En la figura 4.8 se muestra el resultado obtenido en la
hoja de calculo donde se aprecia los valores de N y el
cociente (N/No) para tiempos de 5, 15 y 20 minutos.
Figura 4.8
4.7.3 Determinar el valor de z para un microorganismo que
presenta los siguientes tiempos de reducción decimal,
D120= 6 minutos, D116= 1.5 minutos, D121= 0.35 minutos y
D127= 0.09 minutos.
Datos:
Los datos de temperatura (°C) y D se puede apreciar en la
figura 4.9.
Planteamiento:
Se representará el valor de D en una gráfica
semilogarítmica y a partir de esta se obtiene la
pendiente con la cual se puede calcular el valor de z.
El problema se resolverá usando la hoja de calculo
Ing°. Edwin Macavilca T.
EXCEL donde la pendiente es calculada en base a un
modelo de regresión lineal.
Solución:
En la figura 4.9 se muestra la programación en la hoja de
calculo para resolver el problema 4.7.3
Figura 4.9
En la figura 4.10 se muestra el resultado obtenido en la
hoja de calculo donde el valor de z= 9.2 °C.
Figura 4.10
4.7.4 Un valor de 7 minutos para Fo en un producto provoca
una pérdida aceptable económicamente. Determinar el
tiempo del proceso a 115 °C.
Datos:
10
Fo121 = 7 min
T2 =115 °C
Ing°. Edwin Macavilca T.
Planteamiento:
Asumiendo que Fo=7 corresponde a un valor de Z=10 y a una
temperatura de T1= 121°C, se pide calcular Fo para una
temperatura de T2=115°C, y esta se calcular a partir de
la siguiente ecuación;
T1 −T2
FT 2
= 10 z
FT 1
Solución:
Despejando FT2 y reemplazando los datos, se tiene;
121−115
FT 2 = 7x10
10
FT2 = 27.867 min
10
El tiempo para el nuevo proceso es; F115 = 27.867 min
4.7.5 Determinar el valor de Q10 del proceso térmico mostrado
en el problema 4.7.3.
Planteamiento:
Se empleará la ecuación Q10= 1010/z, el valor de z es 9.2 y
fue calculado en el problema 4.7.3
Solución:
Para un valor de z=9.2 °C, se tiene un valor de Q10=12.25
tal como se aprecia en la figura 4.10.
4.7.6 Si el valor z de un microorganismo es 19 °C, calcular
el valor Q10.
Dato:
Valor de Z = 19 °C
Planteamiento:
El calculo se hará en base a la ecuación Q10= 10(10/Z)
Solución:
Q10= 10(10/19)
Q10= 3.36
4.7.7 Si el valor z de un microorganismo es 16.5 °C y el D121
es 0.35 minutos ¿qué valor toma D110?
Desarrollo:
Datos:
Valor de Z = 16.5 °C
T1= 110 °C
T2= 121 °C
DT1= ?
DT2= 0.35 minutos
Ing°. Edwin Macavilca T.
Planteamiento:
El valor de DT1 puede ser calculando a partir de la
siguiente ecuación;
T2 − T1
Z=
log DT 1 − log DT 2
Que despejando se tiene;
T −T
log DT 2 + 2 1
DT 1 = 10 Z
Solución:
121−110
log(0.35) +
Reemplazando los datos se tiene; DT 1 = 10 16.5
D110 = 10(0.21)
Luego se tiene que el valor de D110 =1.62 minutos
4.7.8 La retención de la vitamina B en la carne de cerdo
puede describirse mediante los siguientes datos,
obtenidos a 121 °C:
tiempo % retención
2.6 95
7.4 90
15.0 80
47.0 50
El valor Z de la vitamina B es 12 °C y el valor Fo para
el deterioro del organismo son 15 minutos. Determinar el
proceso que proporcionará una retención de la vitamina B
del 99%.
Datos:
Para la Vitamina B;
Valor de Z = 12 °C
Temperatura de proceso = 121 °C (T1)
Para el organismo;
Fo = 15 minutos (F1)
Asumiendo un valor de Z = 10 °C
Planteamiento:
Se pide determinar el proceso para retener un 99% de la
vitamina B en la carne de cerdo, es decir la temperatura
y el tiempo que inducirán esta condición.
A continuación se indican los pasos a seguir para dar
solución al problema 5.7.8;
Paso 1:
Con los datos de tiempo-% de retención determinar la
constante de velocidad k para una reacción de orden cero
y de primer orden, mediante un modelo de regresión
lineal.
Ing°. Edwin Macavilca T.
Paso 2:
Seleccionar la constante de velocidad k, de acuerdo al
mejor ajuste del modelo de regresión lineal para ambos
orden de reacción;
Orden cero; %RInicial -%Rt = kt
Primer orden; Ln(%RInicial/%Rt)=kt
Donde;
%Rinicial = es el % de Retención inicial de Vitamina B
%Rt = es el % de retención al tiempo t
k = es la constante de velocidad
t = tiempo
La selección del mejor ajuste se realiza de acuerdo al
coeficiente de determinación r2 de la regresión lineal
creada con los datos de tiempo-% de retención. Este paso
se resolverá usando la hoja de calculo EXCEL .
Paso 3:
Predecir el tiempo para una retención de un 99% de
vitamina B, de acuerdo al modelo y velocidad de reacción
k, calculado en el paso anterior. Este tiempo toma el
valor de F2.
Paso 4:
Calcular la temperatura del proceso (T2)para el tiempo
predecido (F2 calculado), según la relación;
T2 −T1
F1
= 10 z
F2
Solución:
En la figura 4.11 se muestra la programación en la hoja
de calculo para resolver el problema 4.7.8, ambos
modelos deben mostrar el valor de k y de r2.
Figura 4.11
Ing°. Edwin Macavilca T.
En la figura 4.12 se muestra el resultado obtenido en la
hoja de calculo donde se aprecia los valores de r2 y el
mayor ajuste corresponde a una reacción de primer orden
(R²1 > R²0 es decir 0.9994 > 0.9965)
Figura 4.12
El resultado indica que la constante de velocidad de
reacción k es 0.01461, y proyectado el intercepto da
Ln(4.5999)=99.47% con estos datos se llega a un
resultado que el tiempo del proceso es de 0.328 min., y
la temperatura es de 137.6°C.
Si se considera que la concentración de la vitamina B
inicialmente es 100%, las condiciones del proceso sería:
F2 = t = Ln(99/100)/-0.01461
F2 = t = 0.688
así mismo la temperatura será;
T2 = 10xLog(15/0.688) + 121 °C
T2 = 134.38 °C
Esto indica que para obtener una retención del 99% de la
vitamina B en la carne de cerdo es necesario someter a
un proceso de un tiempo de 0.688 y a una temperatura de
134.38 °C.
4.7.9 Para asegurar que el C. Botulinum sobrevive en poco más
de un ejemplar entre un billón de envases procesados se
utiliza un proceso de 12D. Calcular la población máxima
posible por envase que mantendría esta probabilidad de
deterioro.
Ing°. Edwin Macavilca T.
Datos:
Valor de Fo = 12D
Número de envases procesados, r=1012
No = ? (población inicial por envase)
Planteamiento:
Se usa la siguiente relación de probabilidad de
deterioro;
1 N
= F o/ D
r 10
En vista que el valor de Fo está en función del valor de
D, no es necesario contar con este valor.
Solución:
Reemplazando los datos se tiene;
1 N
12
= 12Do / D
10 10
1012D / D
No = = 1
1012
Esto indica que para mantener esta probabilidad de
deterioro, la máxima población de C. Botulinum por
envase es de un (1) microorganismo.
4.7.10 El microorganismo que provoca deterioro en un producto
alimentario crudo tienen un valor de D de 5 minutos.
Calcular la probabilidad de deterioro si la población
inicial por envase es 10 y se utiliza un proceso
equivalente a un Fo= 3 minutos.
Datos:
D = 5 minutos
Fo= 3 minutos
No = 10 (población inicial por envase)
Planteamiento:
Se usa la siguiente relación de probabilidad de
deterioro;
1 N
= F o/ D
r 10
Solución;
Reemplazando los datos se tiene;
1 10
= 3/ 5
r 10
Ing°. Edwin Macavilca T.
10 3 / 5
r= = 0.4
10
Este resultado indica que se puede esperar el deterioro
de un envase con una probabilidad de 40%, dado que el
tiempo del proceso (Fo) es insuficiente.
4.7.11 Se pretende fabricar sardinas enlatadas (pH 6.0)
aderezadas con laurel y pimienta negra en envases de
100 g. Los análisis microbiológicos han revelado que
los ingredientes, en su conjunto, contienen 1 espora
de B. Stearothermophilus/100 g y 100 esporas de Cl.
Sporogenes/100 g. Los valores D121 son,
respectivamente, 4 min y 1.5 min, y la esterilidad
comercial se ha establecido en 1/104. Calcular el
valor de Fo.
Desarrollo
Planteamiento:
Debido a que es un alimento con un valor de pH mayor de
4.5 se debe aplicar el concepto de 12D.
El valor de Fo para el Cl. Botulinum es 2.52 min.
Solución:
Calculo del valor Fo para el B. Stearothermophilus
Fo = 4 (Log 1 – Log 1/104) = 16 min.
Calculo del valor Fo para el Cl. Sporogenes
Fo = 1.5 (Log 100 – Log 1/104) = 9.0 min.
El valor de Fo es la cantidad de minutos que asegurarían
la esterilidad comercial de los envases de sardina y en
a los 16 minutos.
4.7.12 En un estudio de la estabilidad de una bebida se
evalúa la concentración del Aspartame como un factor
de calidad en función del tiempo, obteniéndose los
siguientes datos a 30 °C;
Tiempo(días) Concentración(mg)
0 3.550
28 3.036
42 2.633
64 2.575
91 2.066
119 1.716
147 1.494
176 1.364
200 1.193
Ing°. Edwin Macavilca T.
Determinar el orden cinético y su respectiva constante
de velocidad (k), también determinar el porcentaje de
perdida del Aspartame para un tiempo de 100 días.
Desarrollo;
Planteamiento:
Con los datos de tiempo-Concentración del Aspartame se
calculará la constante de velocidad k para ambas
reacciones cinéticas de cero y primer orden de acuerdo a
un modelo de regresión lineal, y mediante el más alto
valor del coeficiente de determinación r2 de la
regresión lineal se determinará el orden cinético, todos
estos cálculos se desarrollan usando la hoja de calculo
EXCEL , teniendo en cuenta que;
Reacción de orden cero; k= (Co-Ct)/t
Reacción de primer orden; k= Ln(Co/Ct)/t
Porcentaje de perdida (%)=(1-e-kt)x100
Donde:
k = constante de velocidad
t = tiempo (días)
Co = Concentración inicial del Aspartame (mg)
Ct = Concentración del Aspartame al tiempo t
Solución:
En la figura 4.13 se muestra la programación en la hoja
de calculo para resolver el problema 4.7.12 considerando
ambos modelos de orden cinético.
Figura 4.13
Ing°. Edwin Macavilca T.
En la figura 4.14 se muestra el resultado obtenido en la
hoja de calculo donde se aprecia los valores de r2 y el
mayor ajuste corresponde a una reacción de primer orden
(R²1 > R²0 es decir 0.9896 > 0.955)
Figura 4.14
Se acuerdo a los resultados el orden cinético de primer
orden con una constante de velocidad de 0.00548 (1/días)
y un 42.238 % de pérdida de Aspartame a los 100 días.
4.7.13 En una prueba acelerada de la estabilidad de una
bebida se evalúa la pérdida del Aspartame como
indicador de su calidad durante su almacenamiento y
distribución. Las constantes de velocidad (k) fueron
obtenidas considerando una reacción cinética de
primer orden, donde;
Temperatura(°C) Constante de velocidad(1/días)
30 0.00548847
37 0.01537291
45 0.04826421
Determinar la Energía de activación, la constante de
velocidad (k) a 25°C , el valor de Q10 y el porcentaje
de perdida del Aspartame a los 100 días y a 25°C.
Desarrollo:
Planteamiento;
Con los datos de temperatura-Constante de velocidad (k)
se calculará la energía de activación dado que la
pendiente de ambos datos en un modelo de regresión
Ing°. Edwin Macavilca T.
lineal corresponde a un valor de Ea/R. Este valor de la
energía de activación (Ea) permitirá otros valores de K
a diferentes temperaturas y lo mismo es el caso de Q10,
todos estos cálculos se desarrollan usando la hoja de
calculo EXCEL , teniendo en cuenta que;
k = k 0 e − Ea / RT (Ecuación de Arrhenius)
Reacción de primer orden; k= Ln(Co/Ct)/t
− Ea
R (T+10 −T )
Q10 = e
Porcentaje de perdida (%)=(1-e-kt)x100
Donde:
k = constante de velocidad
k0= Pseudo cero constante de velocidad
Ea= Energía de Activación (Cal/g-mol)
R= Constante de gases ideales (1.988 Cal/g-mol°K)
T= Temperatura absoluta (°K)
t = tiempo (días)
Co = Concentración inicial del Aspartame (mg)
Ct = Concentración del Aspartame al día t
Solución:
En la figura 4.15 se muestra la programación en la hoja
de calculo para resolver el problema 4.7.13 considerando
la pendiente Ea/R según el modelo de regresión lineal de
la ecuación de Arrhenius en forma linealizada.
Figura 4.15
Ing°. Edwin Macavilca T.
En la figura 4.16 se muestra el resultado obtenido en la
hoja de calculo donde se aprecia los valores de la
pendiente de la Ecuación de Arrhenius en forma
linealizada, el valor de Ko, la constante de velocidad
(k=0.0025) para una temperatura de 25°C en una reacción
de primer orden, así mismo el valor de Q10 es de 4.58
entre 25 y 35 °C, la perdida del Aspartame a 25°C y
durante 100 días es de 22.3%
Figura 4.16
4.7.14 Un proceso térmico para un alimento en conserva emplea
una temperatura de autoclave de 255 °F, y la
temperatura inicial del producto es 130 °F. Los
parámetros de velocidad de calentamiento obtenidos de
experimentos previamente dirigidos son jh =0.98 y
fh=11 min. El mínimo valor de Fo para el proceso ha
sido determinado como 8.5 para un microorganismo con
un valor de z = 18 °F. Calcular el tiempo del proceso
Si en el medio del proceso, fue determinado que la
temperatura de la retorta era incorrectamente fijada
en 245 °F, cuánto tiempo adicional del proceso es
necesario para lograr la letalidad deseada?.
Desarrollo:
Planteamiento;
Con los datos de la velocidad de calentamiento, el valor
de Fo y de las temperaturas del proceso se calculará la
el tiempo de proceso (B, Ecuación 4.21), para lo cual el
valor de Log(g) se determinara según las ecuaciones 4.26
Ing°. Edwin Macavilca T.
y 4.27 estos cálculos se desarrollan usando la hoja de
calculo EXCEL , para el caso donde la temperatura de
autoclave cambia a 245 °F, se programará en otra columna
con el mismo procedimiento, para luego determinar el
tiempo adicional de tratamiento térmico;
Solución:
En la figura 4.17 se muestra la programación en la hoja
de calculo para resolver el problema 5.7.14 considerando
que para el calculo de Log(g) en la celda B12, se debe
formular la siguiente función:
=SI(B10<0.6,(0.71*B10-1)/B10,0.042808*B11^5-0.35709*B11^4
+1.1929*B11^3-2.1296*B11^2+2.48447*B11-0.28274)
Para la celda C12 es la misma función pero considerando
las celda de referencia C10 y C11.
Figura 4.17
En la figura 4.18 se muestra el resultado obtenido en la
hoja de calculo donde se aprecia los valores de B para
ambos casos, en donde la Temperatura de autoclave es de
255°F y de 245°F.
Ing°. Edwin Macavilca T.
Figura 4.18
Los resultados muestran que cuando se usa una temperatura
de autoclave de 255°F, el tiempo de proceso calculado es
de 18.3 minutos. Este tiempo debe aumentarse a 30.9
minutos, si la temperatura del autoclave es
incorrectamente fijada a 245°F, existiendo un tiempo
adicional de 12.62 minutos.
4.8 BIBLIOGRAFIA
BARBOSA, C. G; 1999. Manual Laboratorio Ingeniería de Alimentos.
Edit. Acribia S. A. ESPAÑA
FELLOWS, P. 1994. Tecnología del Procesado de los Alimentos. Edit.
Acribia S. A., Zaragoza, ESPAÑA.
GEANKOPLIS, C, J. 1998. Introducción de las operaciones unitarias,
Terc. Edic. Edit. Alhambra, S. A. MEXICO.
ORDÓÑEZ, J., et al. 1998. Tecnología de los Alimentos. Vol. I;
Componentes de los Alimentos y Procesos. Edit. ACRIBIA S. A.
Zaragoza, ESPAÑA
SINGH, P. R; HELDMAN, D. 1998. Introducción a la Ingeniería de
los alimentos. Edit. Acribia S. A., Zaragoza. ESPAÑA.
SINGH. P. R. 1996 Computer Applications in Food Technology. Use of
Spreadsheets in Graphical, Statistical, and Process Analyses.
Academic Pres. San Diego. California. USA.
Ing°. Edwin Macavilca T.
También podría gustarte
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- ALBURESDocumento5 páginasALBURESArturo Carrillo100% (2)
- Capitulo Iv Tratamiento TermicoDocumento129 páginasCapitulo Iv Tratamiento TermicoDiana VentAún no hay calificaciones
- Métodos de BigelowDocumento50 páginasMétodos de BigelowMiguel Luyo SánchezAún no hay calificaciones
- Capitulo Vi-Ing IIIDocumento43 páginasCapitulo Vi-Ing IIINay Champi Cueto0% (1)
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Destruccion TermicaDocumento31 páginasDestruccion TermicaMiguel Luyo SánchezAún no hay calificaciones
- Valores D Z F F0Documento7 páginasValores D Z F F0Leonel AlalunaAún no hay calificaciones
- Practica de Tratamiento TermicoDocumento16 páginasPractica de Tratamiento TermicoDiana Muñoz CisnerosAún no hay calificaciones
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaDe EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaCalificación: 3 de 5 estrellas3/5 (2)
- Cinética de La Destruccion Termica de Los MicroorganismosDocumento195 páginasCinética de La Destruccion Termica de Los MicroorganismosVictor Terry100% (1)
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Metodo de BallDocumento8 páginasMetodo de BallpamelaAún no hay calificaciones
- Cinética de Muerte TérmicaDocumento39 páginasCinética de Muerte TérmicaDiego LuceroAún no hay calificaciones
- Determinación de HumedadDocumento2 páginasDeterminación de HumedadMamo56% (9)
- 1 Sistemas TerapéuticosDocumento3 páginas1 Sistemas TerapéuticosKatherin ToapantaAún no hay calificaciones
- AGROINDUSTRIA LibroDocumento46 páginasAGROINDUSTRIA Libroaurace180263% (16)
- Hipoclorito de SodioDocumento23 páginasHipoclorito de Sodiowilliam barzola quispeAún no hay calificaciones
- Cinética de Destrucción TérmicaDocumento2 páginasCinética de Destrucción TérmicaCamilita Mishelle MierAún no hay calificaciones
- Cinetica de Muerte TermicaDocumento30 páginasCinetica de Muerte TermicaGabriela Vargas González67% (3)
- Tecnologia de AlimentosDocumento137 páginasTecnologia de AlimentosKevin M. MoyaAún no hay calificaciones
- Método General de BigelowDocumento6 páginasMétodo General de Bigelowlungata67% (3)
- Cinetica de Destru...Documento7 páginasCinetica de Destru...jorge henryAún no hay calificaciones
- Proceso TérmicoDocumento47 páginasProceso TérmicoJulio Inti BarretoAún no hay calificaciones
- Base Matematica Del Calculo de Tratamiento TermicoDocumento49 páginasBase Matematica Del Calculo de Tratamiento TermicoIan Carlo Yanac CucchiAún no hay calificaciones
- UntitledDocumento5 páginasUntitledTalía CastiglioniAún no hay calificaciones
- Operaciones Unitarias Tema Ii - 6 Procesado Termico, CongelamientoDocumento33 páginasOperaciones Unitarias Tema Ii - 6 Procesado Termico, CongelamientoHEIDY SHEYLA HERRERA ILLANESAún no hay calificaciones
- Cinética de Muerte TérmicaDocumento39 páginasCinética de Muerte TérmicaElizabeth Izurieta RodriguezAún no hay calificaciones
- Muerte TérmicaDocumento30 páginasMuerte TérmicaANDREA VANESA TRIANA PENALOZAAún no hay calificaciones
- Esterilización Oscar ArangoDocumento95 páginasEsterilización Oscar ArangoAlexander NaspiAún no hay calificaciones
- Cinética de Inactivación de MicroorganismosDocumento16 páginasCinética de Inactivación de MicroorganismosMaricarmenAún no hay calificaciones
- Cliclo EsterilizacionDocumento3 páginasCliclo EsterilizacionBárbara Martínez Guerra0% (1)
- Esterilizacion de BiorreactoresDocumento69 páginasEsterilizacion de BiorreactoresAlejandro Josue Leon MedinaAún no hay calificaciones
- ESTERILIZACIÓNDocumento21 páginasESTERILIZACIÓNIsabella Muñoz TrochezAún no hay calificaciones
- Cinetica y Validacion Procesos Termicos 2013Documento101 páginasCinetica y Validacion Procesos Termicos 2013Gino Carbajal JavierAún no hay calificaciones
- Conservacion Por Calor de Los AlimentosDocumento39 páginasConservacion Por Calor de Los AlimentosWilliam Ra100% (3)
- Temperatura y Microorganismos - PracticoDocumento5 páginasTemperatura y Microorganismos - PracticoJosheloteAún no hay calificaciones
- Cinetica Destruccion TermicaDocumento15 páginasCinetica Destruccion Termicaelver regalado goicocheaAún no hay calificaciones
- Practica 9 FisicoquimicaDocumento14 páginasPractica 9 FisicoquimicaLeicy Camila TineoAún no hay calificaciones
- ExpoDocumento42 páginasExpoJhan MonteroAún no hay calificaciones
- Esterilización de AlimentosDocumento39 páginasEsterilización de AlimentosAgostina PadovanAún no hay calificaciones
- Trabajo de Analisis Matematico 4Documento40 páginasTrabajo de Analisis Matematico 4zeeshanAún no hay calificaciones
- Unidad II Semana 4Documento29 páginasUnidad II Semana 4shirleyAún no hay calificaciones
- Tratamiento Termico 1.4Documento28 páginasTratamiento Termico 1.4Rocio MillaAún no hay calificaciones
- Clase 7Documento17 páginasClase 7Roberto SotoAún no hay calificaciones
- Cinetica de Muerte ADocumento21 páginasCinetica de Muerte Aanon_15958247Aún no hay calificaciones
- IV Tratamiento Termico de LecheeeDocumento56 páginasIV Tratamiento Termico de LecheeeHerald HeraldAún no hay calificaciones
- Método de Bigelow, Formula, Teixeira, Hayakawa y Lenz-Neiver Guevara CoronelDocumento13 páginasMétodo de Bigelow, Formula, Teixeira, Hayakawa y Lenz-Neiver Guevara CoronelNEIVERAún no hay calificaciones
- Cinética de MuerteDocumento21 páginasCinética de MuerteGisela LuceroAún no hay calificaciones
- Rosa y Púrpura Digitalismo Tendencia Principal Fandom Presentación DivertidaDocumento15 páginasRosa y Púrpura Digitalismo Tendencia Principal Fandom Presentación DivertidaRAQUEL NANCY VELIZ SAGARVINAGAAún no hay calificaciones
- Terminado. Efecto de La Temperatura en La Velocidad de Reaccion de Permanganato y OxalatoDocumento14 páginasTerminado. Efecto de La Temperatura en La Velocidad de Reaccion de Permanganato y Oxalatoveronica RodriguezAún no hay calificaciones
- Aplicaciones de Ecuaciones DiferencialesDocumento7 páginasAplicaciones de Ecuaciones DiferencialesLUIGIAún no hay calificaciones
- Orden de ReacciónDocumento13 páginasOrden de ReacciónEnri Nori TrejoAún no hay calificaciones
- Régimen TransitorioDocumento27 páginasRégimen TransitorioEnrique Belzu Rios100% (1)
- Tratamiento TermicoDocumento3 páginasTratamiento TermicoMily Benavides CiezaAún no hay calificaciones
- TEMA 8 Tecno 1Documento22 páginasTEMA 8 Tecno 1Laura hernandezAún no hay calificaciones
- Calculo Tiempo EsterilizacionDocumento9 páginasCalculo Tiempo EsterilizacionCristhianVilchezAún no hay calificaciones
- Cinética de MuerteDocumento21 páginasCinética de MuerteSandy Yalid Gonzalez MelendezAún no hay calificaciones
- Tema-2.4.0 Presentación FundamentosDocumento42 páginasTema-2.4.0 Presentación FundamentosMaria Gomez SabaterAún no hay calificaciones
- Calor Latente de Vaporizaci NDocumento3 páginasCalor Latente de Vaporizaci NDaniel LadinoAún no hay calificaciones
- Laboratorio Nº8Documento13 páginasLaboratorio Nº8Armando Ibarra FernandezAún no hay calificaciones
- 04.09.2020 - IpiiDocumento29 páginas04.09.2020 - IpiiGénesis LópezAún no hay calificaciones
- Seminario 2 TecnologiaDocumento17 páginasSeminario 2 TecnologiaBoris NoriegaAún no hay calificaciones
- Factores Que Intervienen en La Fijacion de Precios 1Documento27 páginasFactores Que Intervienen en La Fijacion de Precios 1Henry E. GonzalezAún no hay calificaciones
- Octogonos en Exceso de GrasasDocumento3 páginasOctogonos en Exceso de GrasasHenry E. GonzalezAún no hay calificaciones
- Aceite de Semillas de CitricosDocumento58 páginasAceite de Semillas de CitricosHenry E. GonzalezAún no hay calificaciones
- Determinacion de La Vida Util de Ajo en Polvo Mediante Pruebas Aceleradas Aslt Tesis 1997Documento119 páginasDeterminacion de La Vida Util de Ajo en Polvo Mediante Pruebas Aceleradas Aslt Tesis 1997Henry E. GonzalezAún no hay calificaciones
- Balance de Materia Aplicado A La PreparaDocumento9 páginasBalance de Materia Aplicado A La PreparaHenry E. GonzalezAún no hay calificaciones
- R000001920 PDFDocumento692 páginasR000001920 PDFAnonymous QmETbwbAún no hay calificaciones
- Licores y CremasDocumento25 páginasLicores y CremasEvelyn Vanesa GonzalesAún no hay calificaciones
- Ebook Reto 3 PDFDocumento35 páginasEbook Reto 3 PDFSebastián MartínezAún no hay calificaciones
- Ficha Técnica Del Producto RevisadoDocumento5 páginasFicha Técnica Del Producto RevisadoAnonymous 9NDvJMKhywAún no hay calificaciones
- Cinco Mitos y Verdades Sobre El ChocolateDocumento4 páginasCinco Mitos y Verdades Sobre El Chocolateal ortizAún no hay calificaciones
- Analisis The FounderDocumento2 páginasAnalisis The FounderMiryan MeraAún no hay calificaciones
- p00320 100ideasfalsasperro PVP PDFDocumento7 páginasp00320 100ideasfalsasperro PVP PDFWilmar Lizcano DuranAún no hay calificaciones
- Informe 11 InformaticaDocumento4 páginasInforme 11 InformaticaLuismarcelo Rojas SalvatierraAún no hay calificaciones
- Gheeeloroliquidido 854678 UDocumento2 páginasGheeeloroliquidido 854678 USanacion AncestralAún no hay calificaciones
- Evaluación de La Calidad Del Agua de La Quebrada HuaycoloroDocumento21 páginasEvaluación de La Calidad Del Agua de La Quebrada HuaycoloroWilfredoAún no hay calificaciones
- Licenciatura en Administración CulinariaDocumento2 páginasLicenciatura en Administración CulinariatadeotenientehdzAún no hay calificaciones
- Monzogo Nº27Documento16 páginasMonzogo Nº27Francisco J. MorenoAún no hay calificaciones
- Estado Actual de Los Cultivos PDFDocumento194 páginasEstado Actual de Los Cultivos PDFMariiaFrchOliverosCAún no hay calificaciones
- GESTION DE LA CALIDAD - Producto Académico N°1Documento19 páginasGESTION DE LA CALIDAD - Producto Académico N°1Luis Torres100% (1)
- Hne RiboflavinafDocumento2 páginasHne RiboflavinafDavid HerSoAún no hay calificaciones
- Informe de La Accion Voluntaria RSDocumento24 páginasInforme de La Accion Voluntaria RSMarielena PURIZACA GARCIAAún no hay calificaciones
- Con El Dolor de Mi Alma PDFDocumento170 páginasCon El Dolor de Mi Alma PDFAngie Marquez RosalesAún no hay calificaciones
- Propósito de Las Instalaciones PecuariasDocumento9 páginasPropósito de Las Instalaciones Pecuariaspaola patricia alvear mayAún no hay calificaciones
- Quimica Secuencia 8Documento4 páginasQuimica Secuencia 8licel almintar OlayaAún no hay calificaciones
- 95718f01-6302-4258-92d6-a350f2d77637Documento68 páginas95718f01-6302-4258-92d6-a350f2d77637MiguelAngelAlvarezMartinezAún no hay calificaciones
- 3Documento2 páginas3Maribel RomeroAún no hay calificaciones
- 25 Colmos para ReírDocumento1 página25 Colmos para Reírjohn carvajalAún no hay calificaciones
- TESISDocumento117 páginasTESISGeorges Gandhi Chunga PeñaAún no hay calificaciones
- Dieta KosherDocumento3 páginasDieta Kosherjhon pilliguaAún no hay calificaciones
- AuditoriasDocumento22 páginasAuditoriasNicolás GalvánAún no hay calificaciones
- Aspectos Técnicos de Seguridad: Tripulante de Cabina de PasajerosDocumento26 páginasAspectos Técnicos de Seguridad: Tripulante de Cabina de PasajerospedroAún no hay calificaciones