0% encontró este documento útil (0 votos)
292 vistas12 páginasDeterminación de Puntos de Fusión en Farmacia
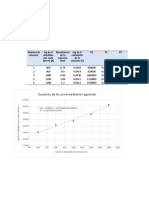
Este documento presenta los objetivos y procedimientos de tres laboratorios sobre puntos de fusión y diagramas de fases. El Laboratorio 4 describe cómo medir el punto de fusión de sustancias como la difenilamina y la vainillina usando métodos de calentamiento. El Laboratorio 5 explica cómo obtener un diagrama de fases para el sistema naftaleno-timol y determinar su punto eutéctico. Finalmente, el Laboratorio 6 tiene como objetivo obtener el diagrama de fases del sistema etanol-aceite de menta-agua, un sistema de tres component
Cargado por
AtnissDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
292 vistas12 páginasDeterminación de Puntos de Fusión en Farmacia
Este documento presenta los objetivos y procedimientos de tres laboratorios sobre puntos de fusión y diagramas de fases. El Laboratorio 4 describe cómo medir el punto de fusión de sustancias como la difenilamina y la vainillina usando métodos de calentamiento. El Laboratorio 5 explica cómo obtener un diagrama de fases para el sistema naftaleno-timol y determinar su punto eutéctico. Finalmente, el Laboratorio 6 tiene como objetivo obtener el diagrama de fases del sistema etanol-aceite de menta-agua, un sistema de tres component
Cargado por
AtnissDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd