Documentos de Académico
Documentos de Profesional
Documentos de Cultura
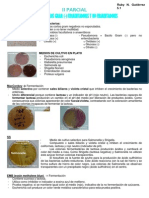
Las Pruebas Bioquímicas
Cargado por
weigh17Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Las Pruebas Bioquímicas
Cargado por
weigh17Copyright:
Formatos disponibles
Aqu estn algunas de las Pruebas Bioqumicas ms frecuentes:
Fermentacin de la lactosa (Mc Conkey) Agar Hierro de Kliger (KIA) Prueba del
Indol Citrato de Simmons Agar Hierro Lisina (LIA) Agar Urea de Christiansens
Prueba de la Fenilalanina (PPA) Reduccin de los Nitratos Movilidad RM - VP
Oxidasa y Catalasa
Fermentacin de la lactosa (Mc Conkey)
El agar Mc Conkey es un medio slido, diferencial y selectivo. Se usa para la
discriminacin de bacterias con capacidad de fermentar la lactosa (Lac + y -
).Composicin g/l :
- Peptona 20.0 : fuente de nitrgeno y carbono para las Lac -.
- Lactosa 10.0 : fuente de carbono para las Lac +.
- Sales biliares 2.5 : le confiere carcter selectivo, inhibiendo el crecimiento de Gram +.
- Cloruro sdico 5.0 : para mantener la tonicidad del medio (evitar osmosis).
- Rojo neutro 0.05 : indicador que va hacer que el medio vire de coloracin. Si las
bacterias son Lac +, producirn cidos derivados de la fermentacin que darn al medio
un aspecto rosceo; si por el contrario son Lac -, el medio se basificar por el uso de la
peptona y se tornar amarillo.
- Cristal violeta 0.001 : interfiere junto con las sales biliares en la selectividad del
medio.
- Agar-agar 15.0: da consistencia al medio
Prueba del Indol
Pone de manifiesto la presencia de la encima Triptofanasa en nuestras bacterias, si esta
presente degradar el triptofano y liberar al medio Indol, para revelar su presencia usaremos
el reactivo de Kovac; si hay indol se formar un anillo rojo en la superficie, sino este ser
amarillo. Para esto sembramos en caldo con triptofano.
Citrato de Simmons
Se usa para determinar si el organismo es capaz de utilizar el citrato como nica
fuente de carbono y compuesto amoniacales como nica fuente de nitrgeno. El
medio contiene citrato sdico, fosfato de amonio y azul de bromotimol como
indicador; este se tornar azul cuando el medio se basifica. Las bacterias que
metabolizan el citrato liberan iones amonio al medio (degradacin del fosfato
amnico) lo que provoca que este se alcalinice y el indicador vire azul.
Agar Hierro Lisina LIA
Este medio pone de manifiesto:
- Si la bacteria posee la enzima descarboxilasa (LDC). el
medio contiene como indicador Purpura de Bromocresol,
cuando la lisina se descarboxila, el medio se acidifica y
el indicador vira amarillo en el fondo.
- Si es productora de c. sulfhdrico, en cuyo caso el
precipitado negro nos impedir ver si es LDC + o -.
- Si es productora de gas.
1. LDC -, NO H2S, PRODUCTORA GAS.
2. LDC + -, PRODUCTROA H2S Y GAS.
3. LDC - , NO H2S, PRODUCTORA DE GAS
Agar UREA
Pone de manifiesto la actividad de la enzima ureasa, para degradar la urea en dos molculas
de amoniaco. El medio lleva como indicador Rojo fenol, que se torna amarillo cuando es
negativo y rosa cuando es positivo. Hay que tener precaucin por que tambin puede ocurrir
que no se produzca cambio de coloracin, en este caso es negativo. el medio posee un color
rosceo (mucho menos intenso que los verdaderos positivos) lo
que puede llevarnos a error (considerar falsos positivos).
Prueba de la Fenilalanina Desaminasa (PPA)
Determina la capacidad e la bacteria para desaminar el aminocido
fenilalanina en cido fenilpirvico por accin de la enzima
Fenilalanina desaminasa, esto va a producir una acidificacin del
medio, que se va a poner de manifiesto mediante la aplicacin de
0,2 - 0,3 mL de Cloruro frrico al 10 %, si hay en el medio c.
fenilpirvico aparece una coloracin verde-azulada.
PPA - PPA +
Reducion de Nitratos
Va a poner de manifiesto la capacidad de transformar los Nitratos en Nitritos. Para esto
inoculamos tres tubos en el medio para dicha prueba y los incubamos 24, 49 y 72 horas
respectivamente. Tras 24 h. aadimos 2 o 3 gotas del reactivo "A-B", si aparece coloracin rojo
cereza indica que es positivo, si no aparece coloracin es un presunto negativo, para
confirmarlo basta con aadir una punta de esptula de Zinc y si realmente es negativo se
tornara rojo. Si el ultimo da (72 h.) la bacteria da negativo, entonces podemos decir con
seguridad que no tiene capacidad para reducir los nitratos.
Positivo Presunto negativo
Movilidad
Se realiza una siembra en picadura, y tras incubar 24 h. observamos si se ha producido
crecimiento entorno a la zona inoculada.
Rojo de Metilo - Voges Proskauer
Las enterobacterias son anaerobios facultativos que usan la glucosa en dos fases: 1
Degradan la glucosa por la va oxidativa hasta que consumen el oxigeno del medio. 2
Metabolizan la glucosa por la va fermentativa, que puede ser de dos tipos:
- Fermentacin cido mixta: los productos finales son cidos orgnicos, que disminuyen
el pH del medio, lo que se manifiesta con el Rojo de metilo.
- Fermentacin butiln-gliclica: los productos finales, como butanodiol y etanol, son
neutros y producen como intermediarios acetoina, que puede detectarse con el reactivo
de Voges Proskauer, el react. A que es KOH, y el B alfa-naftol, estos reaccionan con la
acetoina originando coloraciones violceas.
Para realizar el ensayo, dividimos el medio inoculado y que ha incubado tres das en dos
tubos (la mitad en cada uno) y revelamos con los reactivos.
Rojo de metilo (posit. y negat.)
Voges Proskauer (negativo)
Prueba de la Oxidasa y la Catalasa
Ambas pruebas se caracterizan por poder realizarse de forma inmediata a partir de
nuestro cultivo problema.
La oxidasa, es una prueba que se usa para poner de manifiesto el sistema
citocromoxidasa, que se encuentra en organismos aerobios, anaerobios facultativos y
ocasionalmente en microaerfilos, careciendo los anaerobios estrictos de esta. El
mtodo ms frecuento es el indirecto, se realiza en un trocito de papel de filtro, de forma
que colocamos una gota del reactivo de Kovacs en el papel y posteriormente tomamos
parte de nuestra colonia con el asa de siembra, que frotaremos sobre el papel. El
resultado ser positivo se se produce una reaccin de color a los pocos segundos.
La catalasa, va a degradar el peroxido de oxigeno que se produce como consecuencia de
la acumulacin de oxigeno. Para esto en un tubo de ensayo colocamos 2 o 3 ml de
peroxido de oxigeno, tomamos muestra con el asa de siembra y la introducimos en el
tubo, el resultado ser positivo si se observa la produccin de pequeas burbujas.
http://perso.wanadoo.es/microdominguez/a.htm
http://perso.wanadoo.es/microdominguez/coprocultivo.htm
http://inmunologia.galeon.com/
http://www.ispch.cl/lab_amb/serv_lab/salmonella.html
http://wwwmesa4.blogspot.com/
http://microbiologiabioanalisis.blogspot.com/2012/06/bienvenidos-al-blog-de-
microbiologia.html
http://tamyvelasquezporta.blogspot.com/2013/07/consideraciones-generales-para-
lectura.html
http://quizlet.com/17046489/microbiology-lab-final-flash-cards/
http://miyospiral.blogspot.com/2013/12/practica-8-coprocultivo.html
http://ankirinaslaboratory.tumblr.com/post/85160317597/bateria-bioquimica-de-klebsiella-
pneumoniae
http://ankirinaslaboratory.tumblr.com/tagged/Microbiologia
identificacin salmonella a shared
También podría gustarte
- Manejo Seguro Del NaSH (v.2007)Documento35 páginasManejo Seguro Del NaSH (v.2007)Daniela TorresAún no hay calificaciones
- Seguridad en Espacios ConfinadosDocumento62 páginasSeguridad en Espacios Confinadosaldo3abAún no hay calificaciones
- Presentación Monitor Altair4xDocumento31 páginasPresentación Monitor Altair4xEsteban Rocha50% (2)
- Pruebas Bioquímicas para La Identificación de BacteriasDocumento33 páginasPruebas Bioquímicas para La Identificación de BacteriasMaria Fernanda Callejas ArriagaAún no hay calificaciones
- Pruebas BioquímicasDocumento20 páginasPruebas BioquímicasJhenny1995Aún no hay calificaciones
- Practica 2. Bacter Pruebas BioquimicasDocumento5 páginasPractica 2. Bacter Pruebas BioquimicasPaolaAún no hay calificaciones
- Pruebas Bioquímicas ApuntesDocumento24 páginasPruebas Bioquímicas ApuntesOLGA ITZEL VALADEZ CHIRINOAún no hay calificaciones
- Pruebas BioquimicasDocumento9 páginasPruebas BioquimicasVianneyPinedaAún no hay calificaciones
- AGARESDocumento21 páginasAGARESRosa Guerra CalderonAún no hay calificaciones
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017De EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017Aún no hay calificaciones
- Espacios Confinados. Rpoyecto Espadelada. GaliciaDocumento35 páginasEspacios Confinados. Rpoyecto Espadelada. Galiciabengozar100% (4)
- Prueba Bioquímica TSIDocumento2 páginasPrueba Bioquímica TSIFelipe NizoAún no hay calificaciones
- Pr-Sso-01-Met Procedimiento de Trabajo en Interior Tunel Liner Rev 00Documento19 páginasPr-Sso-01-Met Procedimiento de Trabajo en Interior Tunel Liner Rev 00LeonelGaeteMontecinos100% (1)
- Presentación I Matpel IIIDocumento321 páginasPresentación I Matpel IIIluiseduardo_plc100% (1)
- Aislamiento de EnterobacteriasDocumento32 páginasAislamiento de EnterobacteriasJhonn Simon VasquezAún no hay calificaciones
- Baterias BioquimicasDocumento8 páginasBaterias BioquimicasMaya IbáñezAún no hay calificaciones
- Fermentación de La LactosaDocumento4 páginasFermentación de La LactosaAlejandro ReyesAún no hay calificaciones
- TALLER BACTERIOLOGIA Pract 3Documento3 páginasTALLER BACTERIOLOGIA Pract 3Johan D. Tatis EscuderoAún no hay calificaciones
- Previo 7 Bioquimica .1Documento7 páginasPrevio 7 Bioquimica .1MisaelAún no hay calificaciones
- Pruebas BioquímicasDocumento4 páginasPruebas BioquímicasEDUARDO GONZALEZ CASTROAún no hay calificaciones
- Pruebas Bioquímicas Analisis FinalDocumento4 páginasPruebas Bioquímicas Analisis Finalcarlos chairesAún no hay calificaciones
- Analisis de Pruebas BioquimicasDocumento14 páginasAnalisis de Pruebas BioquimicasJuan Camilo Restrepo LlorenteAún no hay calificaciones
- Pruebas BioquimicasDocumento29 páginasPruebas BioquimicasPabloCoilaMirandaAún no hay calificaciones
- CitrobacterDocumento12 páginasCitrobacteraranza moguelAún no hay calificaciones
- Pruebas Bioquímicas para EnterobacteriasDocumento4 páginasPruebas Bioquímicas para EnterobacteriasGonzales AnaAún no hay calificaciones
- Guía Metabolismo MicrobianoDocumento6 páginasGuía Metabolismo MicrobianoDiego MontaguthAún no hay calificaciones
- Pruebas Bioquimicas para BacteriologíaDocumento19 páginasPruebas Bioquimicas para BacteriologíaUlises AllecAún no hay calificaciones
- Pruebas Bioquímicas para MicrobiologiaDocumento6 páginasPruebas Bioquímicas para MicrobiologiaJose Emmanuel GaonaAún no hay calificaciones
- Pruebas Bioquímicas y Medios de Cultivo BacteriologíaDocumento27 páginasPruebas Bioquímicas y Medios de Cultivo BacteriologíaJessica VanegasAún no hay calificaciones
- MICROBIOLOGIA (Practica 7)Documento16 páginasMICROBIOLOGIA (Practica 7)Josue Huaringa ValderramaAún no hay calificaciones
- Pruebas BQ - Salmonella, E.coli y MasDocumento24 páginasPruebas BQ - Salmonella, E.coli y MasMarcela ZamoraAún no hay calificaciones
- Pruebas BioquímicasDocumento13 páginasPruebas BioquímicasYaneth veronica Delgado huamaniAún no hay calificaciones
- Pruebas Bioquímicas y Medios de Cultivo 2Documento15 páginasPruebas Bioquímicas y Medios de Cultivo 2Jordi ClaudioAún no hay calificaciones
- Pruebas Bioquimicas PDFDocumento3 páginasPruebas Bioquimicas PDFNatiAún no hay calificaciones
- RepasoDocumento10 páginasRepasoArgaez Palma AntonioAún no hay calificaciones
- Practica 4 de Laboratorio Secion 4Documento7 páginasPractica 4 de Laboratorio Secion 4Alter MannAún no hay calificaciones
- ANALISIS DE RESULTADOS - Salmonella Sp.Documento4 páginasANALISIS DE RESULTADOS - Salmonella Sp.martin torresAún no hay calificaciones
- Informe 9Documento9 páginasInforme 9Jose Carlos SanchezAún no hay calificaciones
- Mediante Esta Prueba Se Detecta La Liberación de Indol en Un Cultivo BacterianoDocumento5 páginasMediante Esta Prueba Se Detecta La Liberación de Indol en Un Cultivo Bacterianoeleazzar64Aún no hay calificaciones
- Pruebas Bioquimicas, Medios de Cultivo para SalmonellaDocumento11 páginasPruebas Bioquimicas, Medios de Cultivo para SalmonellaMarcela ZamoraAún no hay calificaciones
- Práctica 4Documento16 páginasPráctica 4katiaAún no hay calificaciones
- Pruebas Bioquimicas MicrobiologiaDocumento64 páginasPruebas Bioquimicas MicrobiologiaJesús Adrián Gómez OrtizAún no hay calificaciones
- ENTEROBACTERIASDocumento8 páginasENTEROBACTERIASMario FernandoAún no hay calificaciones
- Pruebas BioquímicasDocumento15 páginasPruebas BioquímicasPriscy GuzmánAún no hay calificaciones
- Lab 6. Pruebas Cualitativas para CarbohidratosDocumento12 páginasLab 6. Pruebas Cualitativas para CarbohidratosJulio LeítonAún no hay calificaciones
- Pruebas BioquímicasDocumento15 páginasPruebas BioquímicasVianey Paola BarreraAún no hay calificaciones
- Agar TsiDocumento5 páginasAgar TsiLuis Machuca MorenoAún no hay calificaciones
- PRUEBAS BIOQUÍMICAS E Identificacion de Las BacteriasDocumento21 páginasPRUEBAS BIOQUÍMICAS E Identificacion de Las BacteriasAlvaro Ttito LoaizaAún no hay calificaciones
- Las Pruebas Bioquímicas Se Basan en La Determinación de La Presencia o Ausencia de Diferentes Enzimas Codificadas Por El Material Genético Del Cromosoma BacterianoDocumento6 páginasLas Pruebas Bioquímicas Se Basan en La Determinación de La Presencia o Ausencia de Diferentes Enzimas Codificadas Por El Material Genético Del Cromosoma BacterianoJayke MaybiAún no hay calificaciones
- AGAR MACCONKEY Medio de Cultivo SólidoDocumento5 páginasAGAR MACCONKEY Medio de Cultivo SólidoRuvina Reque TorricoAún no hay calificaciones
- Practica 9 Uacj Enterobacterias Pruebas BioquimicasDocumento10 páginasPractica 9 Uacj Enterobacterias Pruebas BioquimicasCarlos Ramos Carrasco0% (1)
- Identificación de Microorganismo DesconocidoDocumento17 páginasIdentificación de Microorganismo DesconocidoJösêii ChâmörröAún no hay calificaciones
- Enterobacterias Practica Microbiologia by GiovaniDocumento6 páginasEnterobacterias Practica Microbiologia by GiovaniGiovani Montes ChavezAún no hay calificaciones
- Micro PrevioDocumento5 páginasMicro PrevioAngelicaBaezAún no hay calificaciones
- Resultados Pruebas Bioquimcas Practica 8Documento4 páginasResultados Pruebas Bioquimcas Practica 8kevinAún no hay calificaciones
- CitratoDocumento4 páginasCitratoFernandaJuarezAún no hay calificaciones
- Pruebas Bioquimicas para EnteorbacteriaDocumento9 páginasPruebas Bioquimicas para EnteorbacteriaMichel JonathanAún no hay calificaciones
- Laboratorio 4 Pruebas BioquímicasDocumento9 páginasLaboratorio 4 Pruebas BioquímicasVALENTINA MURCIA MARTINEZAún no hay calificaciones
- Informe Glucidosy Proteinas Jhoja SMDocumento8 páginasInforme Glucidosy Proteinas Jhoja SMJhojan Abel SALCEDO MACHACAAún no hay calificaciones
- Trabajo - Samuel SotoDocumento9 páginasTrabajo - Samuel SotoSilviaCarrascalAún no hay calificaciones
- Tincion de HongosDocumento11 páginasTincion de HongosMaira PialejoAún no hay calificaciones
- Pruebas BioquimicasDocumento7 páginasPruebas BioquimicasReyes GardeniaAún no hay calificaciones
- Pruebas BioquimicasDocumento7 páginasPruebas BioquimicasReyes GardeniaAún no hay calificaciones
- Prueba de La OxidasaDocumento8 páginasPrueba de La OxidasaGilberto Acosta SernaAún no hay calificaciones
- Informe Carbohidratos, 100% CalidadDocumento14 páginasInforme Carbohidratos, 100% CalidadJorge Gustavo Santiago Soto100% (1)
- Ensayos MicrobiológicosDocumento7 páginasEnsayos MicrobiológicosMaría Iris Ochoa SantiagoAún no hay calificaciones
- Pruebas Bioquimicas MejoradoDocumento43 páginasPruebas Bioquimicas Mejoradojudoka88Aún no hay calificaciones
- TR-03 - Influencia AmbientalDocumento1 páginaTR-03 - Influencia Ambientalweigh17Aún no hay calificaciones
- A-01 - Mapa de UbicacionDocumento1 páginaA-01 - Mapa de Ubicacionweigh17Aún no hay calificaciones
- TR-08 - Zona de VidaDocumento1 páginaTR-08 - Zona de Vidaweigh17Aún no hay calificaciones
- Caso ADocumento2 páginasCaso Aweigh17Aún no hay calificaciones
- TR-04 - Geologia RegionalDocumento1 páginaTR-04 - Geologia Regionalweigh17Aún no hay calificaciones
- Memoria DescriptivaDocumento7 páginasMemoria Descriptivaweigh17Aún no hay calificaciones
- V-03 - Influencia AmbientalDocumento1 páginaV-03 - Influencia Ambientalweigh17Aún no hay calificaciones
- V-08 - Cobertura VegetalDocumento1 páginaV-08 - Cobertura Vegetalweigh17Aún no hay calificaciones
- V-05A - Intensidad SismicaDocumento1 páginaV-05A - Intensidad Sismicaweigh17Aún no hay calificaciones
- V-05 - Zonificacion SismicaDocumento1 páginaV-05 - Zonificacion Sismicaweigh17Aún no hay calificaciones
- V-09 - Zona de VidaDocumento1 páginaV-09 - Zona de Vidaweigh17Aún no hay calificaciones
- MZ-08 - Zonas de VidaDocumento1 páginaMZ-08 - Zonas de Vidaweigh17Aún no hay calificaciones
- V-07 - Tipo de SueloDocumento1 páginaV-07 - Tipo de Sueloweigh17Aún no hay calificaciones
- V-04 - Geologia RegionalDocumento1 páginaV-04 - Geologia Regionalweigh17Aún no hay calificaciones
- Anexo 4.2.10 - Mapa de Areas Naturales ProtegidasDocumento1 páginaAnexo 4.2.10 - Mapa de Areas Naturales Protegidasweigh17Aún no hay calificaciones
- Mapa FisiograficoDocumento1 páginaMapa Fisiograficoweigh17Aún no hay calificaciones
- Presentacion 2Documento6 páginasPresentacion 2weigh17Aún no hay calificaciones
- Mapa de Cobertura VegetalDocumento1 páginaMapa de Cobertura Vegetalweigh17Aún no hay calificaciones
- Mapa de Zonas de VidaDocumento1 páginaMapa de Zonas de Vidaweigh17Aún no hay calificaciones
- Mapa HidrogeologicoDocumento1 páginaMapa Hidrogeologicoweigh17Aún no hay calificaciones
- G-05 - Geologia RegionalDocumento1 páginaG-05 - Geologia Regionalweigh17Aún no hay calificaciones
- CU-07 - Uso Mayor de TierrasDocumento1 páginaCU-07 - Uso Mayor de Tierrasweigh17Aún no hay calificaciones
- Lamina IsoaceleracionesDocumento1 páginaLamina Isoaceleracionesweigh17Aún no hay calificaciones
- A-05 - Intensidad SismicaDocumento1 páginaA-05 - Intensidad Sismicaweigh17Aún no hay calificaciones
- Mapa GeomorfologiaDocumento1 páginaMapa Geomorfologiaweigh17Aún no hay calificaciones
- RS-01 - Ubicacion Politica PDFDocumento1 páginaRS-01 - Ubicacion Politica PDFweigh17Aún no hay calificaciones
- UP-01 - Ubicacion PoliticaDocumento1 páginaUP-01 - Ubicacion Politicaweigh17Aún no hay calificaciones
- Componentes Fundo UvaDocumento28 páginasComponentes Fundo Uvaweigh17Aún no hay calificaciones
- AS-01 - Ubicacion PoliticaDocumento1 páginaAS-01 - Ubicacion Politicaweigh17Aún no hay calificaciones
- SC-10 - Zonificacion SismicaDocumento1 páginaSC-10 - Zonificacion Sismicaweigh17Aún no hay calificaciones
- Memoria Descritiva-LocalDocumento4 páginasMemoria Descritiva-LocalJorge Raul Zelaya MateoAún no hay calificaciones
- Respiradores EPPDocumento32 páginasRespiradores EPPFelix Flores CusacaniAún no hay calificaciones
- Espacios ConfinadosDocumento32 páginasEspacios ConfinadosPamela Yajaira Pesantes MejiaAún no hay calificaciones
- MSDS Havoline LS Gear Lubricant SAE 80W-90Documento9 páginasMSDS Havoline LS Gear Lubricant SAE 80W-90JAVIERAún no hay calificaciones
- Taller N°1Documento14 páginasTaller N°1Carlos Jesús Orellana ContrerasAún no hay calificaciones
- Absorción Química Como Sistema de Abatimiento Del H2S - 2doDocumento14 páginasAbsorción Química Como Sistema de Abatimiento Del H2S - 2doAdolfo Javier Lander PadrinoAún no hay calificaciones
- Mora GarciaDocumento201 páginasMora GarciaDiego Armando Flores GutierrezAún no hay calificaciones
- Azufre de La Desulfuración Del Gas y PetróleoDocumento3 páginasAzufre de La Desulfuración Del Gas y PetróleoAndrés Gallardo AlbercaAún no hay calificaciones
- Peligros Riesgos (Shampoo)Documento3 páginasPeligros Riesgos (Shampoo)Erick PalmiroAún no hay calificaciones
- GMP-HS-E-005 Trabajo en Espacios Confinados v3 260617Documento6 páginasGMP-HS-E-005 Trabajo en Espacios Confinados v3 260617fparilloAún no hay calificaciones
- FuncionsDocumento5 páginasFuncionsCesar Mendoza100% (1)
- 5.2.8 Riesgo y Seguridad en El Muestreo y Análisis de Aguas ResidualesDocumento160 páginas5.2.8 Riesgo y Seguridad en El Muestreo y Análisis de Aguas ResidualesCadete Virgilio azuetaAún no hay calificaciones
- Fenomenos Cadavericos TempranosDocumento5 páginasFenomenos Cadavericos TempranosDaniel Carbajal RamirezAún no hay calificaciones
- Monitoreo de Gases Bajo TierraDocumento28 páginasMonitoreo de Gases Bajo TierraPablo J. HuertasAún no hay calificaciones
- Tesis Ingenieria Ambiental - Cuantificación Del Metano - FDocumento96 páginasTesis Ingenieria Ambiental - Cuantificación Del Metano - FLuisAún no hay calificaciones
- Que Es La Nomenclatura? deDocumento40 páginasQue Es La Nomenclatura? deFelix Esteban Solano ChavezAún no hay calificaciones
- 04 Sida Eg G-Lube Sp-Ceran XM 220Documento29 páginas04 Sida Eg G-Lube Sp-Ceran XM 220mariela carolina ValdebenitoAún no hay calificaciones
- 06-HIDROTERMALISMO TransportePrecipitacionMetalesDocumento52 páginas06-HIDROTERMALISMO TransportePrecipitacionMetalesNIKE ALDO MAMANI CARLOSAún no hay calificaciones
- Cemento Frio CVOODocumento10 páginasCemento Frio CVOOdiana ortizAún no hay calificaciones
- Proceso de CrustáceosDocumento65 páginasProceso de Crustáceosandy vermorAún no hay calificaciones
- S10.s1 - MATERIALDocumento25 páginasS10.s1 - MATERIALKeLly Jasmin Nery MacedoAún no hay calificaciones
- Estados de Oxidacion AzufreDocumento19 páginasEstados de Oxidacion AzufreYorlady0% (1)
- Srta. Andrea Peña SEADocumento43 páginasSrta. Andrea Peña SEAvizcarramasterAún no hay calificaciones