Documentos de Académico
Documentos de Profesional
Documentos de Cultura
01.2 Estructura y Enlace Parte 2
Cargado por
Luis Angel Caceres Sotelo0 calificaciones0% encontró este documento útil (0 votos)
9 vistas12 páginasDerechos de autor
© © All Rights Reserved
Formatos disponibles
PPT, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPT, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
9 vistas12 páginas01.2 Estructura y Enlace Parte 2
Cargado por
Luis Angel Caceres SoteloCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como PPT, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 12
Estructura y Enlace parte 2
Ph. D. Ing. Amb. Lizardo Visitación Figueroa
Fuerzas Intermoleculares
Dipolo – dipolo
Puente de hidrógeno
Dispersión de London
Dipolo - dipolo
éter dimetílico
δ+
δ- (CH3OCH3)
δ+ δ-
Son fuerzas intermoleculares que se forman por atracción
electrostática de moléculas polares.
Puente de Hidrógeno
δ+ δ- Ácido acético
(CH3COOH)
Se forman por atracción electrostática de moléculas polares, donde
el polo positivo está formado por un hidrógeno unido a un elemento
muy electronegativo (N, O, F).
Dispersión de London
δ-
δ- δ+
δ-
δ-
δ+ nonano
δ+
δ+ (C9H20)
δ+
δ+
δ+ δ-
δ+ δ-
δ+ δ-
δ-
δ-
δ+
Se forman por atracción electrostática de moléculas no polares, donde
se generan dipolos instantáneos por el movimiento de la nube
electrónica.
Relación entre estructura y Prop. físicas
Solubilidad
Punto de Fusión y ebullición
Viscosidad
Acidez
Solubilidad
Puente de
Hidrógeno
Ácido hexanoico
(C5H11COOH)
y etanol (C2H5OH)
Dispersión
de London
Los compuestos orgánicos pueden solubilizarse en solventes
polares (agua) y no polares (benceno). Esta propiedad se
justifica por la formación de fuerzas intermoleculares
características.
Punto de Fusión y ebullición
Butanol butano propano
La presencia de grupos funcionales polares, y la mayor superficie de
contacto entre las moléculas de un compuesto, son los responsables
de los puntos de fusión y ebullición.
Viscosidad
Es la resistencia de una sustancia a fluir, esta resistencia se debe
a la existencia de fuerzas intermoleculares. por ejemplo el
propanotriol es más viscoso que el propanol
Carácter ácido base
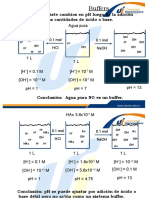
HA H 2 O A 1 H 3O 1
H O A
1 1
3
Ka
HA
Un ácido es aquella sustancia que dona un ion hidrógeno (H+) ,
base es aquella sustancia que acepta el ion hidrógeno. Los ácidos
orgánicos son ácidos débiles, la fuerza de éstos ácidos se
describe con la constante de equilibrio llama constante de acidez
Ka
Carácter Ácido base
Ácido Nombre pKa
Ácido más
débil
CH3COCH3 Acetona 19.3
CH3CH2OH Etanol 16
H2O Agua 15.74
CH3OH Metanol 15.54
Ácido
más
CH3COOH Ácido Acético 4.76
fuerte
Carácter ácido
CH3CH2CH2COOH CH3CH2CHClCOOH CH3CHClCH2COOH
Ka = 1.5 x 10-5 Ka = 1.39 x 10-3 Ka = 8.9 x 10-5
pKa = 4.82 pKa = 2.86 pKa = 4.05
También podría gustarte
- LIR. Farmacología, 7ma Edición - Karen Whalen - (E-Pub - Me) PDFDocumento1187 páginasLIR. Farmacología, 7ma Edición - Karen Whalen - (E-Pub - Me) PDFCristian Espinoza96% (23)
- Agua y PH - AmortiguadorasDocumento58 páginasAgua y PH - AmortiguadorasKaren PérezAún no hay calificaciones
- QuimicaorganicagdfgdsgDocumento467 páginasQuimicaorganicagdfgdsgOmar Sanchez PerezAún no hay calificaciones
- Facultad de Ingeniería Química y Textil: Ciclo Académico 2022-1Documento26 páginasFacultad de Ingeniería Química y Textil: Ciclo Académico 2022-1Alfaro Barrientos Diego MaximilianoAún no hay calificaciones
- 07 - Fuerzas IntermolecularesDocumento17 páginas07 - Fuerzas IntermolecularesAriana Ansherly Salazar AriasAún no hay calificaciones
- Introd-Quim OrgánicaDocumento78 páginasIntrod-Quim OrgánicaJULIO CESAR BRACHO PEREZAún no hay calificaciones
- 01 Clase Introducción Interacciones MolecularesDocumento39 páginas01 Clase Introducción Interacciones MolecularesJHONJAYRO MARCOS SAAVEDRA VENTURAAún no hay calificaciones
- Cambio Físico y Cambio QuímicoDocumento10 páginasCambio Físico y Cambio Químicofernando stiven diaz penagosAún no hay calificaciones
- 1.2-Fuerzas Intermoleculares y SólidosfinalDocumento18 páginas1.2-Fuerzas Intermoleculares y SólidosfinalGustavo CabralAún no hay calificaciones
- SolventeDocumento7 páginasSolventeIris Azucena Fernández SalazarAún no hay calificaciones
- Fuerzas IntermolecularesDocumento38 páginasFuerzas Intermolecularesmichael15201150% (2)
- Enlaces IntermolecularesDocumento18 páginasEnlaces IntermolecularesLoren Paredes Garay100% (1)
- Unidad 4 - FUERZAS IntermolecularesDocumento25 páginasUnidad 4 - FUERZAS IntermolecularesAnderson GuarnizoAún no hay calificaciones
- Practica 4 Enlace QuimicoDocumento6 páginasPractica 4 Enlace QuimicoDhariana Sarahi Lope AnccoAún no hay calificaciones
- Guía Fuerzas Intermoleculares PDFDocumento12 páginasGuía Fuerzas Intermoleculares PDFpalomaAún no hay calificaciones
- Fuerzas Intermoleculares 2310Documento39 páginasFuerzas Intermoleculares 2310carlos rodriguezAún no hay calificaciones
- Teoria 1 Parte 3Documento33 páginasTeoria 1 Parte 3AndreaLopezAún no hay calificaciones
- Actividad Unione Químicas FinalDocumento3 páginasActividad Unione Químicas FinalAilin GamarraAún no hay calificaciones
- Clase 6 QGDocumento15 páginasClase 6 QGJosé LimaAún no hay calificaciones
- SIDWEB Fuerzas IntermolecularesDocumento71 páginasSIDWEB Fuerzas IntermolecularesAndrea MatamorosAún no hay calificaciones
- Fuerzas IntermolecularesDocumento27 páginasFuerzas IntermolecularesJulio Cèsar Torres HernándezAún no hay calificaciones
- 01 - Interacciones MolecularesDocumento43 páginas01 - Interacciones MolecularesPAM LAZAROAún no hay calificaciones
- Fuerzas IntermolecularesDocumento21 páginasFuerzas IntermolecularesRaedbeflo14Aún no hay calificaciones
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS Intermolecularesdannaeh gomez cortesAún no hay calificaciones
- 8a Sesion Fuerzas IntermolecularesDocumento23 páginas8a Sesion Fuerzas IntermolecularesJoseAún no hay calificaciones
- Cepre Uni Exfinal 2002 2Documento17 páginasCepre Uni Exfinal 2002 2rosherAún no hay calificaciones
- Tema 2 - Quimica - ALUMNOSDocumento99 páginasTema 2 - Quimica - ALUMNOSKelly Johana Melendez ZapataAún no hay calificaciones
- Tema 1.2 Estructura, Propiedades y Nomenclatura de Compuestos Orgánicos PDFDocumento52 páginasTema 1.2 Estructura, Propiedades y Nomenclatura de Compuestos Orgánicos PDFJuan Diego LosadaAún no hay calificaciones
- Tema 1.2 Estructura, Propiedades y Nomenclatura de Compuestos OrgánicosDocumento31 páginasTema 1.2 Estructura, Propiedades y Nomenclatura de Compuestos OrgánicosJhon MoralesAún no hay calificaciones
- Tema 2Documento27 páginasTema 2aanitahpAún no hay calificaciones
- TREPEVy FI - APDocumento11 páginasTREPEVy FI - APNot easy CodeAún no hay calificaciones
- Enlace Quimico 4Documento31 páginasEnlace Quimico 4sheyla ayelin jaramillo castroAún no hay calificaciones
- Liquidos 2Documento11 páginasLiquidos 2lisseth calleAún no hay calificaciones
- LIQUIDOSDocumento10 páginasLIQUIDOSlisseth calleAún no hay calificaciones
- Interacciones Interparticulares: Fuerzas de London (O Fuerzas de Dispersión)Documento4 páginasInteracciones Interparticulares: Fuerzas de London (O Fuerzas de Dispersión)Agustin Rivera tapiAún no hay calificaciones
- Taller Semana 7Documento4 páginasTaller Semana 7jhassury jhammely pocomucha chuquillanqui0% (1)
- I-2020 Taller Fuerzas IntermolecularesDocumento3 páginasI-2020 Taller Fuerzas IntermolecularesDiegoVillalbaAún no hay calificaciones
- Enlace Quimico IIIDocumento36 páginasEnlace Quimico IIIFranchesca SotomayorAún no hay calificaciones
- Tarea Sobre Enlaces Químicos FdeA Prop FìsicasDocumento4 páginasTarea Sobre Enlaces Químicos FdeA Prop Fìsicaslia.campoverde.uAún no hay calificaciones
- Enlace Quimico y Fuerzas Actividad Aula - FichaDocumento13 páginasEnlace Quimico y Fuerzas Actividad Aula - FichaDiego Piñella ArévaloAún no hay calificaciones
- Fuerzas IntermolecularesDocumento15 páginasFuerzas IntermolecularesLeo SAún no hay calificaciones
- 16-Enlaces Químicos IIDocumento17 páginas16-Enlaces Químicos IIJuanMegoAún no hay calificaciones
- Fuerzas IntermolecularesDocumento28 páginasFuerzas IntermolecularesLINA SOFIA RIVAS COLLAZOSAún no hay calificaciones
- Enlace Químico. ElectrolitosDocumento18 páginasEnlace Químico. ElectrolitosJose Alexander Ballesteros HerediaAún no hay calificaciones
- Ejercicio 2Documento5 páginasEjercicio 2William LozanoAún no hay calificaciones
- Composición Química de La CélulaDocumento32 páginasComposición Química de La CélulaHoracio Bernardo Prieto CairusAún no hay calificaciones
- Fuerzas IntermolecularesDocumento38 páginasFuerzas Intermolecularesluis camargoAún no hay calificaciones
- Tema 1 Conceptos BasicosDocumento58 páginasTema 1 Conceptos BasicosRei ContrerasAún no hay calificaciones
- Fuerzas IntermolecularesDocumento6 páginasFuerzas IntermolecularesJennifer BriceñoAún no hay calificaciones
- Tema 2 Enlace QuimicoDocumento21 páginasTema 2 Enlace QuimicoDavid DeelavillaAún no hay calificaciones
- Clase 2 QIM200Documento14 páginasClase 2 QIM200CelesteAún no hay calificaciones
- 3 PropFisicasAlcanos IsomeríaDocumento90 páginas3 PropFisicasAlcanos IsomeríaMateo CortezAún no hay calificaciones
- Guía Fuerzas IntermolecularesDocumento12 páginasGuía Fuerzas IntermolecularesPaulina Constenla SaideAún no hay calificaciones
- Estados de Agregacion de La Materia PDFDocumento32 páginasEstados de Agregacion de La Materia PDFAle ChiapperoAún no hay calificaciones
- 10 - Reactividad Del CarbonoDocumento28 páginas10 - Reactividad Del CarbonoLaura sañudoAún no hay calificaciones
- Unidad 09. REACCIONESDocumento46 páginasUnidad 09. REACCIONESscrappydooss15Aún no hay calificaciones
- Biologia Celular - Clase 01Documento71 páginasBiologia Celular - Clase 01api-3701781100% (1)
- Introducción a la química de los metales de transiciónDe EverandIntroducción a la química de los metales de transiciónAún no hay calificaciones
- Clase 6 - 7 EC E Intervención Del Gob.Documento28 páginasClase 6 - 7 EC E Intervención Del Gob.Luis Angel Caceres SoteloAún no hay calificaciones
- Clase 6 MercadoDocumento18 páginasClase 6 MercadoLuis Angel Caceres SoteloAún no hay calificaciones
- Estructura y Enlace Parte 4Documento27 páginasEstructura y Enlace Parte 4Luis Angel Caceres SoteloAún no hay calificaciones
- Estructura y Enlace Parte 4Documento27 páginasEstructura y Enlace Parte 4Luis Angel Caceres SoteloAún no hay calificaciones
- Sesión 2 AsincrónicoDocumento10 páginasSesión 2 AsincrónicoLuis Angel Caceres SoteloAún no hay calificaciones
- Hidrolisis Sales PDFDocumento4 páginasHidrolisis Sales PDFdfelias2219Aún no hay calificaciones
- TAREADocumento1 páginaTAREASamira AlavaAún no hay calificaciones
- Informe Equilibrio Acido BaseDocumento28 páginasInforme Equilibrio Acido BaseGabriela BaronAún no hay calificaciones
- Metodo VolhardDocumento11 páginasMetodo Volhardfrida segovianoAún no hay calificaciones
- Determinacion de Una Constante de Acidez Empleando Medidas PotenciometicasDocumento15 páginasDeterminacion de Una Constante de Acidez Empleando Medidas PotenciometicasMiguel Antony Zumaeta GonzalesAún no hay calificaciones
- Presentación Ipinza Jorge - Utfsm PDFDocumento20 páginasPresentación Ipinza Jorge - Utfsm PDFAnonymous OnoowoAún no hay calificaciones
- Guia LFAQ-201910Documento51 páginasGuia LFAQ-201910Valeria NeiraAún no hay calificaciones
- Taller No8 2023-2Documento7 páginasTaller No8 2023-2ROCIO GRISSELL ORTEGA PEZOAún no hay calificaciones
- Clase Buffers 1Documento45 páginasClase Buffers 1Josselyn CazarAún no hay calificaciones
- Práctica No8Documento5 páginasPráctica No8ROXANA VALDEZ GOMEZAún no hay calificaciones
- Química 2º. Test Ácido-BaseDocumento11 páginasQuímica 2º. Test Ácido-Basecivervirus69100% (1)
- Problemas Resueltos de Teoría Ácido-Base PDFDocumento11 páginasProblemas Resueltos de Teoría Ácido-Base PDFLisi GómezAún no hay calificaciones
- Enfermedades Respiratorias.Documento23 páginasEnfermedades Respiratorias.Yuri RodriguezAún no hay calificaciones
- Química La Ciencia Central. Brown. Paginas - 699-709Documento11 páginasQuímica La Ciencia Central. Brown. Paginas - 699-709marco santoAún no hay calificaciones
- Corrección Lab #1Documento10 páginasCorrección Lab #1Valeria valenciaAún no hay calificaciones
- Informe Determinación Del PH y Preparación de Soluciones AmortiguadorasDocumento4 páginasInforme Determinación Del PH y Preparación de Soluciones AmortiguadorasNorela PicoAún no hay calificaciones
- Unidad 5 Aminas Con ReaccionesDocumento58 páginasUnidad 5 Aminas Con ReaccionesJIMENA MÁRQUEZ MORENOAún no hay calificaciones
- Prueba Ácido Base CepechDocumento3 páginasPrueba Ácido Base CepechFrancisco AlexisAún no hay calificaciones
- 10 Equilibrio Ácido-Base y PH - 054907Documento91 páginas10 Equilibrio Ácido-Base y PH - 054907naomi briñez francoAún no hay calificaciones
- Preguntas Acido BaseDocumento2 páginasPreguntas Acido BaseJOHN NASH ACADEMIA PREAún no hay calificaciones
- Desarrollo y Validación de Un Método Analítico Indicativo de Estabilidad Por HPLC para La Cuantificación de Rosuvastatina CálcicaDocumento17 páginasDesarrollo y Validación de Un Método Analítico Indicativo de Estabilidad Por HPLC para La Cuantificación de Rosuvastatina CálcicaStomy FernandezAún no hay calificaciones
- Practica2 BioquimicaDocumento8 páginasPractica2 BioquimicaVivian HenriquezAún no hay calificaciones
- La Oxidación Perácida de IsosafrolDocumento7 páginasLa Oxidación Perácida de IsosafrolJorge Alberto Estrada TorresAún no hay calificaciones
- T3 Traducción de Patente Europea: B03D 1/01 B03D 101/02Documento15 páginasT3 Traducción de Patente Europea: B03D 1/01 B03D 101/02Alvaro Perez MaytaAún no hay calificaciones
- Práctica 10 "Curva de Titulación Ácido-Base" Química General IIDocumento10 páginasPráctica 10 "Curva de Titulación Ácido-Base" Química General IIAXEL EDUARDO LONA AVIÑAAún no hay calificaciones
- Fuerza MonarcaDocumento20 páginasFuerza MonarcaPablo Jesus Hernandez Miranda'Aún no hay calificaciones
- Bioquímica General (BIO-003) : Guía de Actividades PrácticasDocumento36 páginasBioquímica General (BIO-003) : Guía de Actividades PrácticasMatías NiloAún no hay calificaciones
- C. B. - El Equilibrio Es Lo Que ImportaDocumento17 páginasC. B. - El Equilibrio Es Lo Que ImportaLaura NavarroAún no hay calificaciones
- Protocolo de Prácticas de Laboratorio Virtual Química Analítica e InstrumentalDocumento35 páginasProtocolo de Prácticas de Laboratorio Virtual Química Analítica e InstrumentalYulyPaolaGongoraGarciaAún no hay calificaciones