0% encontró este documento útil (0 votos)
13 vistas4 páginasClasificacio Lma
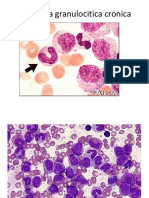
La leucemia mieloide crónica (LMC) es un síndrome mieloproliferativo clonal caracterizado por la presencia del cromosoma Filadelfia y el gen híbrido BCR-ABL, que se encuentra en el 95% de los casos. La enfermedad se presenta en tres fases: crónica, acelerada y crisis blástica, y puede ser asintomática o presentar síntomas como astenia y esplenomegalia. El tratamiento ha evolucionado con el uso de inhibidores de tirosin-quinasa como Imatinib, que han mejorado significativamente la calidad de vida y el pronóstico de los pacientes.
Cargado por
YANET ALCANTARADerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
13 vistas4 páginasClasificacio Lma
La leucemia mieloide crónica (LMC) es un síndrome mieloproliferativo clonal caracterizado por la presencia del cromosoma Filadelfia y el gen híbrido BCR-ABL, que se encuentra en el 95% de los casos. La enfermedad se presenta en tres fases: crónica, acelerada y crisis blástica, y puede ser asintomática o presentar síntomas como astenia y esplenomegalia. El tratamiento ha evolucionado con el uso de inhibidores de tirosin-quinasa como Imatinib, que han mejorado significativamente la calidad de vida y el pronóstico de los pacientes.
Cargado por
YANET ALCANTARADerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd