Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Informe de Preparación de Soluciones
Cargado por
Bernny José Castillo LázaroDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Informe de Preparación de Soluciones
Cargado por
Bernny José Castillo LázaroCopyright:
Formatos disponibles
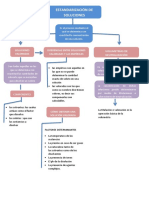
PREPARACIÓN DE SOLUCIONES
Jhon Ramos y Juan Rada
Facultad de ingeniería, 2do semestre
– laboratorio de bioquímica ; grupo
N°3 Universidad de sucre Cra 28
N°5.267 Barrio Puerta Roja
Sincelejo – Sucre (12/03/2024)
1. RESUMEN: ABSTRAC:
La preparación de soluciones es un proceso La preparación de soluciones es un proceso
fundamental en química que implica fundamental en química que implica la
disolución, y se sabe que las soluciones son disolución, y se sabe que las soluciones son
mezclas homogéneas constituidas por un mezclas homogéneas que consisten en un
solvente y una o más sustancias disueltas en él; solvente y una o más sustancias disueltas en
Dependiendo del estado físico de los él; Dependiendo del estado físico de los
componentes, estos pueden ser gaseosos, componentes, pueden ser gaseosos, líquidos o
líquidos o sólidos. Teniendo en cuenta estos sólidos. Teniendo en cuenta estos
antecedentes, el objetivo principal de la antecedentes, el objetivo principal de la
práctica fue desarrollar un método eficiente práctica fue desarrollar un método eficiente
para la preparación, determinación y para la preparación, determinación y
estandarización de soluciones químicas, con estandarización de soluciones químicas, con
énfasis en la concentración de las sustancias. énfasis en la concentración de las sustancias.
Para lograrlo se utilizaron procesos de Para lograrlo se utilizaron procesos de
decantación y cristalización. Luego de utilizar decantación y cristalización. Después de
estos métodos, se encontró que, en el método utilizar estos métodos, se encontró que, en el
de decantación, el cloruro de sodio se disolvía método de decantación, el cloruro de sodio se
en el agua y pequeños residuos quedaban en el disolvía en el agua y pequeños residuos
fondo debido a la sobresaturación, mientras permanecían en el fondo debido a la
que, en el método de cristalización, el cloruro sobresaturación, mientras que en el método
de sodio quedaba adherido a las paredes del de cristalización, el cloruro de sodio se
crisol de porcelana. . Observado esto, adhería a las paredes del crisol de porcelana.
concluimos que el agua y la sal son solubles Observando esto, concluimos que el agua y la
hasta cierta cantidad; y que una solución puede sal son solubles hasta cierta cantidad; y que
separarse mediante el método de una solución se puede separar por el método
cristalización. de cristalización.
Palabras claves: decantación | cloruro | Palabras clave: decantación | Cloruro |
cristalización | método | sodio | soluciones | Cristalización | Método | Sodio | Soluciones |
proceso | métodos | preparación. Proceso | Métodos |
2. INTRODUCCION
La solubilidad se refiere a la capacidad de una químicos, siguiendo protocolos precisos y
sustancia (soluto) para disolverse en un asegurando la exactitud de las
determinado medio (disolvente). Factores concentraciones.
como la temperatura, la presión y la naturaleza
Realizar experimentos para determinar la
del soluto y del disolvente afectan la
concentración de una solución desconocida
solubilidad. Los sólidos generalmente
mediante técnicas analíticas como titulación, u
aumentan su solubilidad al aumentar la
otros métodos químicos, garantizando
temperatura, mientras que los gases pueden
resultados precisos.
comportarse de manera diferente. La presión
afecta principalmente a la solubilidad de los
gases. Las sustancias con la misma polaridad
tienden a disolverse entre sí. La solubilidad se 3. RESULTADOS
expresa en gramos de soluto por litro de
disolvente y puede variar mucho entre
sustancias, desde muy soluble hasta
ligeramente soluble. Algunos ejemplos
comunes incluyen la sal disuelta en agua y los
refrescos saturados con dióxido de carbono.
Las interacciones entre las moléculas de soluto
y disolvente, así como la temperatura y presión
del sistema, son fundamentales para
comprender la solubilidad.
Algunas razones para usar la preparación de
soluciones serian, Precisión en las mediciones:
las soluciones permiten la dosificación precisa
de cantidades específicas de sustancias, lo cual
es crucial en análisis químicos, experimentos
y procesos industriales.
Facilidad de manipulación: Las soluciones son
más fáciles de manipular y transportar que los
sólidos o los gases, lo que las hace más fáciles
de usar en diversos contextos.
Control de concentración: La preparación de
soluciones permite controlar la concentración
de una sustancia en un disolvente, lo cual es
fundamental en la investigación científica y la
industria.
Con esto se tiene como objetivos, calcular y
preparar soluciones con concentraciones
específicas requeridas para experimentos
● Peso del agua evaporada = 5.16 ml
4. DISCUSION
PREPARACIÓN DE SOLUCIONES
Los cálculos realizados anteriormente tuvieron
como objetivo determinar la cantidad de soluto
de cada sustancia al agregarla a una solución,
siendo el agua destilada el principal solvente.
Para esto se requirió información teórica;
como, la masa molar de cada sustancia
utilizando ecuaciones que fueron de gran
ayuda para determinar la cantidad de soluto.
La cantidad de soluto requerida para realizar la
titulación de HCl es de 0.365 gramos del
mismo, para NaOH se determinó que se
requieren 0.4 gramos para realizar su
titulación.
NaCl
𝟓𝟖.𝟒𝟒𝒈 Para el porcentaje de pureza, la ecuación
𝑷𝑴
#𝑴𝒐𝒍𝒆𝒔 = = 𝒎𝒐𝒍
= 𝟎. 𝟓𝟖 𝒎𝒐𝒍 correspondiente para HCl se usó por separado,
𝑷.𝒈𝑵𝒂𝒄𝒍 𝟗𝟗.𝟗𝟖 𝒈
dando un porcentaje de gramos impuros de
0,98 g. De la misma manera se determinó el
𝑴=
#𝑴𝒐𝒍𝒆𝒔 𝟎.𝟓𝟖 𝒎𝒐𝒍
= 𝟎.𝟎𝟐𝟓 𝑳 = 𝟐𝟑. 𝟐 𝒎𝒐𝒍/𝑳 volumen del mismo, utilizando la ecuación
𝑽(𝑳) para encontrar la densidad (densidad =
masa/volumen), se encontró que el volumen
era 0.89 ml.
DATOS
PREPARACIÓN DE UNA SOLUCIÓN
● Peso vidrio reloj = 31.15g
SATURADA DE CLORURO DE SODIO Y
● Peso cápsula de porcelana = 62.15g DETERMINACIÓN DE SU
● Peso Vidrio reloj + cápsula de CONCENTRACIÓN
porcelana = 93.30g
● Peso Vidrio reloj + cápsula de
La recolección de datos para esta parte se basó
porcelana + 5 ml de solución =
en los procedimientos realizados durante la
99.98g práctica, utilizando como instrumentos un
● Peso de los 5 ml de solución = 6.68 g vidrio de reloj, una cápsula de porcelana, sal
● Peso del vidrio + vidrio de reloj + sal (cloruro de sodio) y 5 mL de solución.
seca = 94.82 g
● Peso de la sal seca = 1.52 g Para describir los datos iniciales se tuvo en
cuenta el peso de los diferentes instrumentos https://www.ensayostube.com/educac
para luego determinar los pesos de la sal y la ion/quimica/Preparacion-de-
solución de 5 ml. Por lo tanto, se utilizó el soluciones-PRAC73.php.
método de cristalización para encontrar los
pesos respectivos de estos instrumentos • LIBRETEXTS, 2022. 16.9:
mediante cálculos simples como sumas y Preparación de soluciones. LibreTexts
restas. Español [en línea]. Disponible en:
https://espanol.libretexts.org/Quimica
5.CONCLUSION /Qu%C3%ADmica_Introductoria%2
C_Conceptual_y_GOB/Qu%C3%AD
En este trabajo de preparación, determinación
mica_Introductoria_%28CK-
y estandarización de soluciones químicas, se
12%29/16%3A_Soluciones/16.09%3
ha demostrado la importancia de comprender
A_Preparaci%C3%B3n_de_solucioes
los procesos de disolución y la formación de
soluciones. A través de la práctica con métodos
• BOLÍVAR, G., 2020. Preparación de
como la decantación y la cristalización, se
soluciones: cómo se hace, ejemplos,
logró desarrollar un método eficiente para la
ejercicios. Lifeder [en línea].
preparación de soluciones, con un enfoque en
Disponible en:
la concentración de las sustancias.
https://www.lifeder.com/preparacion-
Se observó que tanto el agua como la sal son de-soluciones/.
solubles hasta cierta cantidad, y que la
cristalización es un método efectivo para • Skoog, D. A., Holler, F. J., & Crouch,
separar una solución. Los cálculos realizados S. R. (2017). Principles of
para determinar la cantidad de soluto necesario instrumental analysis. Cengage
en las soluciones, así como la recolección de Learning.
datos experimentales, han permitido avanzar
en la comprensión de la química de las
soluciones y la importancia de la precisión en
la preparación de soluciones químicas.
En resumen, este trabajo ha contribuido a
fortalecer los conocimientos sobre la
preparación de soluciones, la determinación de
concentraciones y la importancia de seguir
protocolos precisos en el laboratorio. Estos
aprendizajes son fundamentales para la
realización de experimentos químicos, análisis
precisos y el control de concentraciones en
diversos contextos científicos e industriales.
REFERENCIAS
• Preparación de soluciones - practica,
objetivos, marco teórico, parte
experimental - Ensayos. [en línea],
[sin fecha]. Disponible en:
También podría gustarte
- Soluciones Molares y NormalesDocumento4 páginasSoluciones Molares y NormalesEsteban MoreloAún no hay calificaciones
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadDe EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAún no hay calificaciones
- Reporte 1. AnalíticaDocumento7 páginasReporte 1. AnalíticaALAM DANIEL- HERNμNDEZ MALDONADOAún no hay calificaciones
- Informe de Lab N°7 Quimica GeneralDocumento25 páginasInforme de Lab N°7 Quimica Generalcousin RRAún no hay calificaciones
- Reporte DisolucionesDocumento6 páginasReporte DisolucionesAdam MartinezAún no hay calificaciones
- DOC-20240317-WA0027. Informe TerminadoDocumento12 páginasDOC-20240317-WA0027. Informe Terminadolivandavila1021Aún no hay calificaciones
- Reporte AnalíticaDocumento9 páginasReporte AnalíticaLuis Angel Dominguez MartinezAún no hay calificaciones
- PreinformeDocumento5 páginasPreinformeJair EscorciaAún no hay calificaciones
- Practica de Laboratorio N°5 2023-2Documento12 páginasPractica de Laboratorio N°5 2023-2Altamirano Lopez SandersAún no hay calificaciones
- Preparación de Soluciones IDocumento9 páginasPreparación de Soluciones IKatty Yulieth Sánchez Pérez0% (1)
- Informe de Quimica AnaliticaDocumento10 páginasInforme de Quimica Analiticachris ninaAún no hay calificaciones
- Tercer InformeDocumento11 páginasTercer InformeIngrid Lorena Burbano PortesAún no hay calificaciones
- Quimica Analitica Informe 3Documento8 páginasQuimica Analitica Informe 3Diego PalomequeAún no hay calificaciones
- Informe Laboratorio QuimicaDocumento22 páginasInforme Laboratorio QuimicaMiguel José Forero AriasAún no hay calificaciones
- Informe 1 QaDocumento5 páginasInforme 1 QaGiselle BonifacciniAún no hay calificaciones
- Informe Analítica N1Documento9 páginasInforme Analítica N1gina perezAún no hay calificaciones
- Laboratorio Química para IngenierosDocumento15 páginasLaboratorio Química para IngenierosAngelica Arauz GalanAún no hay calificaciones
- ESTANDARIZACIONDocumento5 páginasESTANDARIZACIONluceroAún no hay calificaciones
- Guía Práctica #6 SolucionesDocumento15 páginasGuía Práctica #6 SolucionesJohan Anthony Terry CamposAún no hay calificaciones
- Informe Nro 09 QuimicaDocumento17 páginasInforme Nro 09 QuimicaGianfranco VendezuAún no hay calificaciones
- NarvaezE - Grupo - 2cv2 - Reporte - de - Practica - 5docxDocumento4 páginasNarvaezE - Grupo - 2cv2 - Reporte - de - Practica - 5docxSerguio EspinosaAún no hay calificaciones
- Práctica N°10 QUIMICADocumento10 páginasPráctica N°10 QUIMICACarla GuardadoAún no hay calificaciones
- Práctica Laboratorio 4Documento14 páginasPráctica Laboratorio 4JOSUE SEBASTIAN VARGAS OCHOAAún no hay calificaciones
- Informe N8Documento9 páginasInforme N8Daniela SuarezAún no hay calificaciones
- Preparación y Valoración de HCL Al 0.1 NDocumento10 páginasPreparación y Valoración de HCL Al 0.1 NAryans Garden GyJho50% (4)
- Informe de Laboratorio IDocumento6 páginasInforme de Laboratorio IYised Florez Florez GiraldoAún no hay calificaciones
- Captura de Pantalla 2021-11-26 A La(s) 19.08.30Documento14 páginasCaptura de Pantalla 2021-11-26 A La(s) 19.08.30REYES NAVA ADRIANAAún no hay calificaciones
- G1 - Lab 9 Reacciones de Precipitación....Documento10 páginasG1 - Lab 9 Reacciones de Precipitación....Patricio Cuna cunaAún no hay calificaciones
- INFORME 4 (Preparación de Disoluciones)Documento13 páginasINFORME 4 (Preparación de Disoluciones)Leslie Garcia100% (1)
- 4.laboratorio de Quimica Industrial Disoluciones y SolubilidadDocumento12 páginas4.laboratorio de Quimica Industrial Disoluciones y Solubilidadalejandro suarezAún no hay calificaciones
- Preparacion SolucionesDocumento4 páginasPreparacion SolucionesStefani RiveraAún no hay calificaciones
- Practica Quimica 9Documento9 páginasPractica Quimica 9Jesus FloresAún no hay calificaciones
- SOLUCIONES QUIMICAS Practica 9Documento5 páginasSOLUCIONES QUIMICAS Practica 9Frank J'rAún no hay calificaciones
- Informe Oficial Fiqui CriosDocumento18 páginasInforme Oficial Fiqui CriosJuan Rodolfo Gomez RamosAún no hay calificaciones
- Informe 10 CriosDocumento7 páginasInforme 10 CriosMi LeAún no hay calificaciones
- Manual Practica QUÍMICA IIDocumento25 páginasManual Practica QUÍMICA IIvictor emanuelAún no hay calificaciones
- Solucion NormalDocumento6 páginasSolucion NormalAiram Fernanda Lugo OsunaAún no hay calificaciones
- Informe-5-Laboratorio-Grupo 8Documento5 páginasInforme-5-Laboratorio-Grupo 8Miguel SanchezAún no hay calificaciones
- INFORME ANALITICA SolucionesDocumento6 páginasINFORME ANALITICA SolucionesLuis Beraun AlaniaAún no hay calificaciones
- Informe 7-Preparación de SolucionesDocumento4 páginasInforme 7-Preparación de SolucionesYinoska Del Carmen Lemus BarrosAún no hay calificaciones
- UshhhhhhhhhhhhhhhhhhhhhhhDocumento11 páginasUshhhhhhhhhhhhhhhhhhhhhhhAndres Camilo Velez HerreraAún no hay calificaciones
- Informe Lab DisolucionesDocumento4 páginasInforme Lab Disolucionessalma.penarandaAún no hay calificaciones
- Reporte 5. AnalíticaDocumento6 páginasReporte 5. AnalíticaALAM DANIEL- HERNμNDEZ MALDONADOAún no hay calificaciones
- Guía de Laboratorio 3 - Estandarización de Reactivos y Soluciones.Documento6 páginasGuía de Laboratorio 3 - Estandarización de Reactivos y Soluciones.Erika Mary Yolanda PARRA ALVAREZAún no hay calificaciones
- Laboratorio en Modalidad de ArticuloDocumento8 páginasLaboratorio en Modalidad de ArticuloKathy Elizabeth ChinguadAún no hay calificaciones
- Informe 3 QuímicaDocumento3 páginasInforme 3 QuímicaJuan 2021Aún no hay calificaciones
- Informe N°6 Preparacion de Soluciones Lab - Quim.inorganicaDocumento15 páginasInforme N°6 Preparacion de Soluciones Lab - Quim.inorganicaEfrain GonzalesAún no hay calificaciones
- Practica 2 AnaliticaDocumento9 páginasPractica 2 AnaliticaJülý BäqūěAún no hay calificaciones
- PDF Articulo 3 Determinacion de La Curva de Solubilidad para Nitrato de Potasio y Otra Sal - CompressDocumento11 páginasPDF Articulo 3 Determinacion de La Curva de Solubilidad para Nitrato de Potasio y Otra Sal - CompressBrenda RuizAún no hay calificaciones
- Laboratorio #01 - Preparación y Valoración de HCL Al 0.1 NDocumento8 páginasLaboratorio #01 - Preparación y Valoración de HCL Al 0.1 NAnthony Salas CaballeroAún no hay calificaciones
- Informe Lab Analitica Finalizad0Documento11 páginasInforme Lab Analitica Finalizad0Ana ArizalAún no hay calificaciones
- Practica de Laboratorio #01 - Preparación de SolucionesDocumento24 páginasPractica de Laboratorio #01 - Preparación de SolucionesJordan Heyner Rodriguez IparraguirreAún no hay calificaciones
- Informe Práctica #10 Química LaboratorioDocumento13 páginasInforme Práctica #10 Química LaboratorioAndrea DuarteAún no hay calificaciones
- Práctica N 8 Química.Documento6 páginasPráctica N 8 Química.JhonnyAún no hay calificaciones
- Lab II de Quimica Informe 1 PreparacionDocumento3 páginasLab II de Quimica Informe 1 Preparacionsofia luna hanssenAún no hay calificaciones
- P6 - Eq 4-QA-1IV2BDocumento30 páginasP6 - Eq 4-QA-1IV2BLeón Pérez Gabriel EduardoAún no hay calificaciones
- Practica Soluciones Normalizadas 1Documento8 páginasPractica Soluciones Normalizadas 1Gianmarco Mamani LaricoAún no hay calificaciones
- Práctica 3Documento15 páginasPráctica 3Ari UCAún no hay calificaciones
- Caracteristicas Del Planeta TierraDocumento12 páginasCaracteristicas Del Planeta TierraWalter Condori ChipanaAún no hay calificaciones
- Conasec PDFDocumento2 páginasConasec PDFHector Hurtado100% (1)
- Soldadura Al Tubo de Servicio Del CompresorDocumento4 páginasSoldadura Al Tubo de Servicio Del CompresorNego LaraAún no hay calificaciones
- Informe de IsomeriaDocumento2 páginasInforme de IsomeriaALVARO marcanoAún no hay calificaciones
- Memoria de Calculo Electrico SuquichaDocumento5 páginasMemoria de Calculo Electrico SuquichasermucomAún no hay calificaciones
- Tarea 8 - Silogismos Válidos o InválidosDocumento2 páginasTarea 8 - Silogismos Válidos o InválidosMynor Lopez50% (2)
- Realismo en ItaliaDocumento1 páginaRealismo en ItaliaEsme MayaAún no hay calificaciones
- Evaluador Paarrrr RegaloDocumento6 páginasEvaluador Paarrrr RegaloSandra Molina NavarreteAún no hay calificaciones
- Teoria Del Estado ModernoDocumento2 páginasTeoria Del Estado ModernowilberAE100% (1)
- ALGORITMOS CompressedDocumento45 páginasALGORITMOS CompressedJHOAN JHONCLER BOCANEGRA PONCEAún no hay calificaciones
- Actividad 3 Ensayo Nomina ElectronicaDocumento4 páginasActividad 3 Ensayo Nomina ElectronicaBelquis Del Carmen TINOCO DIAZAún no hay calificaciones
- Todoen Uno Catalogo CompletoDocumento55 páginasTodoen Uno Catalogo CompletoStephany Sophia Urrutia BujatoAún no hay calificaciones
- Todos Somos Censores - NodelmanDocumento21 páginasTodos Somos Censores - Nodelmanlujanezca100% (1)
- Literatura y Estudios Culturales-Ariel González I-2011Documento8 páginasLiteratura y Estudios Culturales-Ariel González I-2011Jorge Eliecer Sierra MerchanAún no hay calificaciones
- AgendaDigital LibroDocumento703 páginasAgendaDigital LibroPe LUAún no hay calificaciones
- Tabla de DBA.Documento12 páginasTabla de DBA.maria9213Aún no hay calificaciones
- MAPA MENTAL Niveles Del Planeamiento EducativoDocumento1 páginaMAPA MENTAL Niveles Del Planeamiento EducativoCharlystudentAún no hay calificaciones
- Modelos No LinealesDocumento14 páginasModelos No LinealesDaniel AcuñaAún no hay calificaciones
- Procesamiento de Imágenes Con ArcGISDocumento35 páginasProcesamiento de Imágenes Con ArcGISRicardo AriasAún no hay calificaciones
- Estilo Apa UapDocumento21 páginasEstilo Apa UapMiguel Angel Quinto Hilario0% (1)
- S6 TEA ACCEDU Teorias CognitivasDocumento21 páginasS6 TEA ACCEDU Teorias CognitivasErick Ibarra :DAún no hay calificaciones
- UNIDAD 3 Investigación DocumentalDocumento22 páginasUNIDAD 3 Investigación DocumentalLuis Ortiz100% (1)
- La Belleza Del MatrimonioDocumento3 páginasLa Belleza Del MatrimonioYefry MarteAún no hay calificaciones
- Informe de BrujulaDocumento16 páginasInforme de Brujulaedson0% (1)
- Ciencias Sec. 5Documento3 páginasCiencias Sec. 5sebasti5n5sebasti5-1100% (1)
- CARACTERISTICASDocumento1 páginaCARACTERISTICASDaniel SilvaAún no hay calificaciones
- Conocemos Nuestra Escuela y Dibujamos: Sesión de AprendizajeDocumento6 páginasConocemos Nuestra Escuela y Dibujamos: Sesión de AprendizajeDenis Marilu Ordoñez Baldera0% (1)
- Contestación A La Demanda Minda ViteriDocumento13 páginasContestación A La Demanda Minda ViteriNaomy AguasAún no hay calificaciones
- CRASH TEST Seguridad Al VolanteDocumento3 páginasCRASH TEST Seguridad Al Volantejjossette2081100% (1)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- Neurociencia para vencer la depresión: La esprial ascendenteDe EverandNeurociencia para vencer la depresión: La esprial ascendenteCalificación: 4.5 de 5 estrellas4.5/5 (10)
- La revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaDe EverandLa revolución de la glucosa: Equilibra tus niveles de glucosa y cambiarás tu salud y tu vidaCalificación: 5 de 5 estrellas5/5 (203)
- Homo antecessor: El nacimiento de una especieDe EverandHomo antecessor: El nacimiento de una especieCalificación: 5 de 5 estrellas5/5 (1)
- Ondas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasDe EverandOndas de choque extracorpóreas radiales: Aplicación en patologías músculo esqueléticasCalificación: 5 de 5 estrellas5/5 (3)
- Sesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesDe EverandSesgos Cognitivos: Una Fascinante Mirada dentro de la Psicología Humana y los Métodos para Evitar la Disonancia Cognitiva, Mejorar sus Habilidades para Resolver Problemas y Tomar Mejores DecisionesCalificación: 4.5 de 5 estrellas4.5/5 (13)
- El psoas: Músculo vital (Color)De EverandEl psoas: Músculo vital (Color)Calificación: 3.5 de 5 estrellas3.5/5 (9)
- La medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónDe EverandLa medicina biorreguladora: Un enfoque holístico e innovador de la autocuraciónCalificación: 3.5 de 5 estrellas3.5/5 (2)
- Prácticas de refrigeración y aire acondicionadoDe EverandPrácticas de refrigeración y aire acondicionadoCalificación: 5 de 5 estrellas5/5 (6)
- Batidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoDe EverandBatidos Verdes Depurativos y Antioxidantes: Aumenta tu Vitalidad con Smoothie Detox Durante 10 Días Para Adelgazar y Bajar de Peso: Aumenta tu vitalidad con smoothie detox durante 10 días para adelgazar y bajar de pesoCalificación: 5 de 5 estrellas5/5 (2)
- 50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaDe Everand50 técnicas de mindfulness para la ansiedad, la depresión, el estrés y el dolor: Mindfulness como terapiaCalificación: 4 de 5 estrellas4/5 (37)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Zang Fu: Revelando la Cara del SíndromeDe EverandZang Fu: Revelando la Cara del SíndromeCalificación: 4.5 de 5 estrellas4.5/5 (2)
- El péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaDe EverandEl péndulo de sanación: Péndulo hebreo. Investigación y sistematización de la técnicaCalificación: 4.5 de 5 estrellas4.5/5 (27)
- Toma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasDe EverandToma de decisiones en las empresas: Entre el arte y la técnica: Metodologías, modelos y herramientasAún no hay calificaciones
- Ciencia de datos: La serie de conocimientos esenciales de MIT PressDe EverandCiencia de datos: La serie de conocimientos esenciales de MIT PressCalificación: 5 de 5 estrellas5/5 (1)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- Guía práctica para la refracción ocularDe EverandGuía práctica para la refracción ocularCalificación: 5 de 5 estrellas5/5 (2)
- Cuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresDe EverandCuerpo Tóxico: Como Liberar Tu Cuerpo De Las Toxinas Externas E Internas, Y Evitar Asi Los Efectos De Los Radicales LibresCalificación: 5 de 5 estrellas5/5 (2)
- Lactancia humana y fonoaudiología: Guía para madres lactantesDe EverandLactancia humana y fonoaudiología: Guía para madres lactantesCalificación: 5 de 5 estrellas5/5 (4)