Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Transplantes Clinica QX
Cargado por
eva.sotelo65910 calificaciones0% encontró este documento útil (0 votos)
5 vistas39 páginasexpo
Título original
transplantes-clinica-QX.pptx
Derechos de autor
© © All Rights Reserved
Formatos disponibles
PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoexpo
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
5 vistas39 páginasTransplantes Clinica QX
Cargado por
eva.sotelo6591expo
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como PDF, TXT o lea en línea desde Scribd
Está en la página 1de 39
Conservación de órganos
• Los dos métodos mas frecuentes son la hipotermia y la inhibición
farmacológica. Ambos lentifican las actividades metabólicas del órgano
extruido.
• Se introdujeron las soluciones frías de almacenamiento con el objeto de
aplacar algunos de los efectos adversos de la hipotermia o la sola inhibición
farmacológica. Las soluciones en cuestión son útiles para evitar la
inflamación celular y la perdida de potasio de las células.
• Sus ingredientes incluyen lactobionato (que evita la inflamación celular y la lesión
por reperfusion), rafinosa y almidón hidroxietilico (que aminora la turgencia de
células endoteliales y con ello reduce el edema). Tambien se utilizan ampliamente
las soluciones de histidina-triptofano-cetoglutarato.
• A pesar de los progresos en los métodos de conservación, sigue siendo
relativamente breve el lapso en el cual se puede almacenar de manera segura el
órgano (horas, no días), en particular con tejidos de donantes “apenas
satisfactorios”. Entre quienes reciben riñones, la función tardía del injerto se torna
notablemente mas frecuente después de que han transcurrido mas de 24 h de
isquemia fría, que obligue a diálisis temporal
Trasplante de riñón
• Ullman publico los datos de su primer intento de trasplante de un riñón humano en
1902, En los 50 años siguientes sus intentos resultaron en fracaso
• Joseph Murray realizo el primer trasplante de riñón llevado a buen termino en
1954, trasplanto el riñón de un gemelo idéntico a otro.
• La introducción de la AZA en 1960 señalo el comienzo de una nueva época en el
trasplante de riñones. Por medio de la combinación de cortico esteroides y AZA
para la inmunodepresión en fase sostén, la tasa de supervivencia anual del injerto de
un riñón de un donante emparentado vivo se acerco a 80% y, en el caso de un
donante fallecido, la cifra fue de 65%.
• Los receptores de un riñón proveniente de
un donante vivo tienen mejores resultados
a largo plazo, menor incidencia de la
función tardía del injerto y disminución de
los riesgos de complicaciones después del
trasplante. Asimismo, la naturaleza
planeada del trasplante de un donante vivo
brinda oportunidades especiales para el
tratamiento de desensibilización del
receptor si no hay compatibilidad ABO
entre el donante y el receptor o los
resultados de pruebas cruzadas de HLA
son positivos
Valoración previa del trasplante
• Cualquier problema detectado durante la valoración inicial de los sujetos elegibles
para trasplante se transmite al medico, al especialista, o a ambos, que refieren al
paciente, si se necesita valoración y tratamiento avanzados con el propósito de
mejorar en definitiva la atención global.
• Antes de comenzar la valoración medica previa al trasplante, se insta a los sujetos
elegibles para acudir a reuniones de grupo dedicadas a la enseñanza. La reunión es
coordinada por un especialista en trasplantes o un medico cirujano. En ella, se
busca familiarizar a los enfermos con el proceso de valoración anterior al trasplante
y con conceptos y términos médicos pertinentes.
Valoración medica
• Enfermedad cardiovascular: La diabetes y la hipertensión son las causas
principales de nefropatia cronica.
• La valoración del riesgo perioperatorio se basa en los síntomas y la tolerancia
del paciente al ejercicio. En todos los sujetos elegibles para el trasplante de
riñón, hay que obtener un electrocardiograma (ECG) de 12 derivaciones, en
reposo.
• Neoplasias malignas: Ante la posibilidad
de usar por largo tiempo fármacos
inmunodepresores, las personas que
reciben trasplante están expuestas a mayor
riesgo de presentar neoplasias malignas.
• En casi todos los pacientes en quienes se
ha administrado tratamiento de tumores
de baja gradación, con poco riesgo de
recurrencia se recomienda un lapso de
espera mínimo de dos años después del
tratamiento satisfactorio antes de pensar
en el trasplante de riñón, y en neoplasias
avanzadas es recomendable un lapso de
cinco años.
• Infecciones: En personas elegibles para trasplante que necesitan todas las
vacunaciones adecuadas a su edad según las directrices de los Centers for
Disease Control and Prevention (CDC), hay que realizar una anamnesis minuciosa
de infecciones y vacunaciones. En circunstancias optimas, es necesario
completar todas las vacunaciones por lo menos cuatro a seis semanas antes
de llevar a cabo el trasplante de riñón.
• Nefropatía: La tercera causa de perdida del
trasplante de riñón en los receptores es la
reaparición de glomerulopatias, como la
glomeruloesclerosis segmentaria focal.
• La nefropatía por inmunoglobulina A (IgA); el
síndrome hemolitico-uremico; el lupus
eritematoso sistémico y la glomerulonefritis
membranoproliferativa
• Hipercoagulopatia: En personas receptoras en peligro de presentar una
hipercoagulopatia, será mejor no llevar a cabo injertos renales de tipo
pediátrico y también cualquier aloinjerto con una estructura anatómica
vascular compleja.81 En dicha población, se recomienda seguir un protocolo
perioperatorio con anticoagulantes.
Valoración quirúrgica
• Valoración urológica: Es esencial la practica de cistouretrograma
• de micción y una exploración completa de la zona inferior del aparato urinario para
descartar obstrucción del cuello vesical.
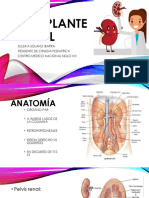
• Valoración vascular: Los sitios posibles para implantar un injerto de riñón incluyen aorta,
vena cava y vasos iliacos del receptor; por medio de la exploración física minuciosa, se
pueden detectar vasculopatías centrales, periféricas o de ambos tipos graves. Los signos
como una masa intraabdominal pulsatil, disminución o ausencia de pulsos periféricos,
claudicación, dolor en el reposo y llagas u otro tipo de perdida histica en las extremidades
inferiores, han de valorarse con mayor detenimiento por medio de CT o ecografía
abdominal, estudios Doppler y angiografía solos o en combinación
• Valoración inmunitaria: Antes de un trasplante de riñón, es importante
efectuar la tipificación sanguínea de grupos ABO y de HLA (HLA-A, -B y
-DR). Esta en fase de perfeccionamiento el método de búsqueda de
anticuerpos preformados contra antígenos HLA.
• El análisis de anticuerpo reactivo (PRA, panel reactive antibody) es un método
de detección que explora la capacidad del suero de un sujeto elegible para
trasplante de riñón para efectuar la lisis de linfocitos de un conjunto de
donantes con tipos de HLA.
• El nivel mayor de PARA (PRA, panel reactive antibody) identifica al paciente
expuesto a gran riesgo de presentar una prueba cruzada positiva y, por ello,
actúa como un marcador indirecto para medir la dificultad de identificar un
donante idóneo y el riesgo de rechazo del injerto.
• El ultimo adelanto en la detección de anticuerpos contra HLA es la técnica
Luminex, la cual utiliza micro partículas fluorescentes recubiertas de HLA y
citometria de flujo.
• Valoración psicosocial: La valoración psicosocial es esencial para asegurar
que los individuos elegibles entiendan los riesgos y los beneficios del método
y que cumplan con el régimen farmacológico inmunodepresor permanente.
Intervención quirúrgica del receptor
• Los aloinjertos de riñón casi siempre se trasplantan con técnica heterotopica. Se ha
aceptado la fosa iliaca como el sitio ideal para colocación del órgano por su proximidad
con la vejiga y los vasos iliacos del receptor.
• Después de anestesiar al receptor, se introduce una sonda gruesa de tres conductos en la
vejiga y se ocluye con una pinza por debajo de la lencería quirúrgica. El receptor cuyo
riñón original produce orina de forma natural, debe llenar la vejiga; en el individuo cuyo
riñón no cumple con tal requisito, se necesita llenar la vejiga con solución salina antes de la
creación de anastomosis uretral.
• La exposición del campo quirúrgico comienza con una incisión cutánea curvilínea uno o
dos traveses de dedo por arriba del pubis en la línea media y el borde lateral de la vaina de
los rectos anteriores. En sentido superior, la extensión de la incisión depende de la
complexión corporal y del tamaño del riñón donado
• Después de restaurar la circulación del riñón donado, se establece la
continuidad del aparato genitourinario por varias técnicas. La vía elegida
depende de factores como la longitud del uréter donado y el antecedente de
cirugía de vejiga en el receptor, la nefrectomía del riñón nativo o la radiación
pélvica. Los dos métodos mas comunes para restaurar la continuidad de
dicho aparato son el de Leadbetter-Politano y la modificación de Lich (es
decir, extra vesical), la ureteroneocistostomia que en realidad fue planeada
para evitar la reimplantación uretral.
Injertos con múltiples arterias renales
• Entre las opciones de reconstrucción vascular están implantar por separado las
arterias del riñón donado, reconstruir las múltiples arterias en un conducto común
o combinar varias arterias en un parche común de Carrel.
Injertos en bloque
• En el caso de trasplantes renales en bloque, se utilizan la aorta y la vena cava
del donante como los vasos de entrada y de salida, respectivamente. Como
consecuencia, la reconstrucción del injerto en bloque en fase previa al
trasplante es elemento clave para obtener buenos resultados. La vena cava y
la aorta del donante se cierran con material de sutura en su segmento por
arriba de los riñones (suprarrenal). Se ligan las ramas lumbares de la cava y la
aorta; es importante no disecar alrededor del hilio renal
Atención preoperatoria
• En el preoperatorio es importante obtener datos de la anamnesis y realizar una
exploración física cuidadosa.
• La valoración vascular inicial es indispensable y cualquier cambio en sus
resultados se analiza a fondo por medio de estudios de imagen apropiados.
Como se acostumbra en otros procedimientos quirúrgicos mayores, en la
etapa preoperatoria, se obtiene una radiografía de tórax en los individuos
elegibles para trasplante, así como un ECG de 12 derivaciones, tipificación y
pruebas cruzadas de sangre y se emprenden medidas profilácticas contra la
infección en el sitio quirúrgico
• En el transoperatorio, los receptores de trasplante deben estar perfectamente hidratados para
evitar ATN y han de recibir heparina antes de la oclusión vascular. Previo a la reperfusion
del riñón trasplantado, es indispensable conservar la presión venosa central deseada en
alrededor de 10 mmHg y, la presión sistólica, por arriba de 120 mmHg.
• En el posoperatorio Los elementos cruciales comprenden estabilidad hemodinámica y
equilibrio hidroelectrolítico. Para lograr un estado de euvolemia, la diuresis del receptor se
sustituye con un volumen igual o menor de soluciones IV cada hora, según el estado
medico. En quienes se intenta diuresis abundante y viva, a veces se necesita reposición
intensiva de electrolitos (que incluye calcio, magnesio y potasio). En receptores que
presentan ATN, sobrecarga de líquidos o hiperpotasemia, pueden ser necesarias
restricciones de líquidos para combatir esta ultima e incluso la hemodiálisis si se requiere.
Resultados
• Hoy día, el trasplante de riñón sigue siendo el injerto mas frecuente de
organo solido a escala mundial.
• Hoy día, la causa mas común de perdida del injerto es la muerte del receptor
(casi siempre por razones cardiovasculares) con un injerto funcional. La
causa que ocupa el segundo lugar es la nefropatia crónica del aloinjerto; esta
se caracteriza por deterioro lento e implacable de su función y quizá se debe
a múltiples factores (inmunitarios y no inmunitarios).
Trasplante de páncreas
• El trasplante logrado y funcional del páncreas es el único tratamiento definitivo por
largo tiempo en sujetos con diabetes mellitus insulinodependiente (IDDM,
insulin-dependent diabetes mellitus) que:
• a) restaura la hemostasia de la glucosa sin exponer a las personas al riesgo de
hipoglucemia profunda
• b) evita, frena o revierte la aparición o la evolución de complicaciones secundarias
de la enfermedad
Trasplantes de páncreas según las categorías de
los receptores
• Trasplante simultáneo de páncreas y riñones (SPK; simultaneous pancreas and
kidney) en diabéticos y pacientes urémicos.
• El receptor estaba obligado a recibir de modo permanente tratamiento
inmunodepresor, por la necesidad del trasplante de riñón, de tal forma que el
riesgo quirúrgico del trasplante de páncreas es un elemento adicional.
Cuando el trasplante SPK logra su cometido pleno, el receptor se libra de la
diálisis y de la insulina.
• Trasplante de páncreas después de injerto de riñón (PAK, pancreas after kidney) en diabetes y
sujetos pos urémicos.
• Los enfermos recibieron un trasplante de riñón de donante vivo o cadáver, pero se
tornaron elegibles para un trasplante de páncreas ulteriormente por el deficiente
control de la glucemia.
• Trasplante de páncreas solamente (PTA, pancreas transplant alone) en pacientes no urémicos
con diabetes mellitus frágil.
• Los pacientes no han generado todavia nefropatia diabetica avanzada, pero su
glucemia es notablemente lábil a pesar de los intentos mas intensivos de control.
Intervención quirúrgica en el donante
• Donantes fallecidos: Entre las contraindicaciones relativas se encuentran las
técnicas realizadas en el páncreas y todos los trastornos de dicha glándula,
como pancreatitis crónica y neoplasia mucinosa papilar intracanalicular. La
hiperglucemia en si misma no constituye contraindicación para la obtención
de la víscera, porque su causa en donantes con muerte cerebral.
• Durante la extracción del páncreas, se prefiere una técnica “intacta”; el
cirujano diseca el páncreas de forma que evita la manipulación directa de la
glándula, al mismo tiempo que obtiene otros órganos, como bazo, duodeno y
tejidos conjuntivos circundantes.
Preparación del injerto pancreático en una mesa
complementaria
• consiste en cuatro fases:
• a) extracción del bazo
• b) acortamiento, colocación de nuevas grapas, reforzamiento de suturas del
pedículo mesentérico
• c) “recorte” de cualquier exceso de tejido del duodeno en sus segmentos
distal y proximal junto con refuerzo de la hilera proximal de grapas
• d) reconstrucción arterial.
• La preparación del injerto en una “mesa complementaria” se realiza en una jofaina
llena de solución conservadora muy fría. La técnica mas común para crear un solo
conducto arterial que llegue al injerto de páncreas es la llamada reconstrucción del
injerto en "Y” y para ello se utiliza un segmento separado de la bifurcación de la
arterial iliaca del donante.
Intervención quirúrgica en el receptor
• En el curso de los años, se han descrito técnicas quirúrgicas diferentes para:
• a) “encauzar “ la secreción exocrina del páncreas: , las dos técnicas mas frecuentes
son el drenaje del segmento duodenal a la vejiga (drenaje vesical) o al intestine
delgado (drenaje entérico).
• b) realizar el tipo de drenaje venoso necesario: En lo que se refiere al drenaje
venoso, se prefiere el venoso general, al de la vena porta.
• El injerto de pancreas casi siempre se situa en el interior del abdomen y de
preferencia en el lado derecho, porque los vasos iliacos están en una posición mas
superficial.
• Las anastomosis venosas y arteriales se realizan con tecnica terminolateral; De forma
intencional, el cirujano conserva en un tramo corto la vena porta del donante y por
ello suele efectuarse ligadura y cortes de todas las ramas de la vena iliaca interna del
receptor para evitar tensiones en las anastomosis venosas.
• El drenaje vesical se lleva a cabo por anastomosis manual con material de sutura o
con grapas en que el lado anti mesentérico del duodeno donado se une con puntos a
la porción superior de la cupula vesical.
Complicaciones
• A esa tasa alta de complicaciones quirúrgicas contribuyen
• cuatro factores:
• a) la naturaleza misma del órgano, que muestra complicaciones quirúrgicas
inherentes y especificas del mismo y su escaso flujo sanguíneo
• b) la posibilidad de una fuga o de infección después de conectar dos vísceras huecas
• c) la mayor incidencia de episodios de rechazo porque el páncreas constituye uno
de los órganos solidos mas inmunogenos
• d) la enfermedad de base diabetes mellitus que predispone a las personas no solo a
infecciones sino también a complicaciones cardiovasculares y de otra índole.
• Las complicaciones quirúrgicas mas comunes son las trombosis (incidencia
de 5 a 15%); los abscesos intraabdominales (5 a 10%) y la hemorragia (6 a
8%). Otras complicaciones especificas del páncreas son inflamación del
injerto (que depende a menudo de lesiones durante la obtención o la
reperfusion); fistulas y seudoquistes pancreáticos.
Trasplante de páncreas de donante vivo
• El concepto de obtener la porción distal del páncreas de un donante vivo se
basa en la observación de que los pacientes que muestran trastornos
benignos o malignos de dicha glándula pueden ser objeto de
hemipancreatectomia distal, sin cambio grave alguno en su función
endocrina.
• El uso de donantes vivos también aminora el riesgo de rechazo del injerto en
comparación con el uso de órganos de donantes fallecidos.
Resultados
• Las técnicas de drenaje han cambiado con el paso del tiempo, asimismo: hoy
día predomina el drenaje entérico de las secreciones exocrinas del páncreas,
en combinación con el drenaje sistémico de la sangre venosa que sale del
injerto. Se han creado protocolos inmunodepresores orientados a medidas de
inducción de anticuerpos, seguidos de la administración de tacrolimus y
MMF para la fase de sostén.
Trasplante de islotes
• Un trasplante de islotes abarca la obtención del páncreas donado y su transporte a
una institución especializada en este tipo de trasplantes, en tanto se produce la
digestión enzimática; como paso siguiente se purifican los islotes del resto de los
tejidos digeridos y para ello se utilizan gradientes de densidad.
• La fase que sigue es que se cultivan los islotes purificados y se valoran su identidad,
viabilidad y potencia, y son introducidos mediante infusión en la vena porta de un
diabético receptor. Si se obtienen buenos resultados con esta técnica, las células
insulares “se incorporan” al receptor y secretan insulina, y así se logra un excelente
control “momento a momento” de la glucemia como se observa con el páncreas
completo trasplantado.
También podría gustarte
- TRASPLANTE RENAL: Tratamiento de elección de la IRCDocumento14 páginasTRASPLANTE RENAL: Tratamiento de elección de la IRCFabricio FaicanAún no hay calificaciones
- Trasplante RenalDocumento21 páginasTrasplante RenalDaly Felix RamosAún no hay calificaciones
- Trasplante Renal: Guía CompletaDocumento57 páginasTrasplante Renal: Guía CompletaJoseCarlos Gomar100% (3)
- Trasplante Hepatico Ortotopico. Tecnica QuirurgicaDocumento24 páginasTrasplante Hepatico Ortotopico. Tecnica QuirurgicaJenniffer FAún no hay calificaciones
- Biopsia Hepática TransyugularDocumento14 páginasBiopsia Hepática TransyugularJesús GamarraAún no hay calificaciones
- Trasplante RenalDocumento6 páginasTrasplante Renaldiana zuluagaAún no hay calificaciones
- Paciente Masculino de 43 Años de EdadDocumento5 páginasPaciente Masculino de 43 Años de EdadFrancoJimenezAndresJesusAún no hay calificaciones
- Trasplante de PáncreasDocumento7 páginasTrasplante de PáncreasJosé Luis Navarro RomeroAún no hay calificaciones
- Indicaciones para LeucorreduccionesDocumento21 páginasIndicaciones para LeucorreduccionesIngrid GamboaAún no hay calificaciones
- Informe Transplante de RiñonDocumento4 páginasInforme Transplante de RiñonLUISA BERTHA ADUVIRI CORDOVAAún no hay calificaciones
- Trasplante Renal Suleika SolanoDocumento57 páginasTrasplante Renal Suleika SolanoSuleika Solano100% (2)
- ExanguinooooDocumento12 páginasExanguinoooogarcia.ross.87Aún no hay calificaciones
- Funcion Del RiñonDocumento18 páginasFuncion Del RiñonBrayan Alejandro OvalleAún no hay calificaciones
- Protocolo de Tesis Colecistectomia AmbulatoriaDocumento3 páginasProtocolo de Tesis Colecistectomia AmbulatoriaBenjamin PaulinAún no hay calificaciones
- Transplante IntestinalDocumento29 páginasTransplante IntestinalSofia GuerreroAún no hay calificaciones
- Donante para Trasplante RenalDocumento32 páginasDonante para Trasplante RenalLeonardo PlacenciaAún no hay calificaciones
- Cuidados Críticos Del Paciente Transplantado Receptor de Órgano Sólido1Documento39 páginasCuidados Críticos Del Paciente Transplantado Receptor de Órgano Sólido1Alan Espíndola CruzAún no hay calificaciones
- Erc Terminal MinsalDocumento14 páginasErc Terminal Minsaljavii Rim BHAún no hay calificaciones
- Recuperaciï¿ N Cardiovascular CONARECDocumento111 páginasRecuperaciï¿ N Cardiovascular CONARECguiyAún no hay calificaciones
- 330 - 333 Cirugía Cardíaca. Evaluación Prequirúrgica y Scores de RiesgoDocumento4 páginas330 - 333 Cirugía Cardíaca. Evaluación Prequirúrgica y Scores de RiesgoMelina AlcaineAún no hay calificaciones
- Técnica de Colocación Vía CentralDocumento5 páginasTécnica de Colocación Vía CentralAlex lopezAún no hay calificaciones
- Cuidados de Enfermeria Transplante HepaticoDocumento30 páginasCuidados de Enfermeria Transplante Hepaticotumadre123456789Aún no hay calificaciones
- TRASPLANTE DE RIÑÓNDocumento3 páginasTRASPLANTE DE RIÑÓNJöśë Lüîš Crüž MãśşíAún no hay calificaciones
- Informe Autotransfusion Final 2Documento13 páginasInforme Autotransfusion Final 2Alexander Torres RiquelmeAún no hay calificaciones
- Trasplante Renal 2014Documento32 páginasTrasplante Renal 2014Vitrena StoreAún no hay calificaciones
- Trabajo FinalDocumento8 páginasTrabajo FinalGilbert CanedoAún no hay calificaciones
- Técnicas de MonitorizaciónDocumento173 páginasTécnicas de Monitorizacióngay tragavergasAún no hay calificaciones
- Tecnica QX de Trasplante RenalDocumento102 páginasTecnica QX de Trasplante RenalGinna Paola Reyes ClavijoAún no hay calificaciones
- Presentacion de Aferesis PDFDocumento34 páginasPresentacion de Aferesis PDFAna GuerraAún no hay calificaciones
- Retrasplante renal exitoso mediante desensibilización con plasmaferesis e inmunoglobulinaDocumento4 páginasRetrasplante renal exitoso mediante desensibilización con plasmaferesis e inmunoglobulinaGabriela Castaneda SolanoAún no hay calificaciones
- Criterios DX de Transplante RenalDocumento4 páginasCriterios DX de Transplante RenalMaRiana TorresAún no hay calificaciones
- Cuidado preoperatorio trasplante renalDocumento21 páginasCuidado preoperatorio trasplante renalyasmin_mg2008Aún no hay calificaciones
- Dialisis y GerontologiaDocumento11 páginasDialisis y GerontologiaFernanda GaiadAún no hay calificaciones
- Conceptos Básicos de Enfermería para La LaborDocumento23 páginasConceptos Básicos de Enfermería para La LaborKarina ParraAún no hay calificaciones
- Disfunción Hepatica - Trasplante HepaticoDocumento20 páginasDisfunción Hepatica - Trasplante HepaticoJessica Arenas DoblasAún no hay calificaciones
- CLINIC BARCELONA Protocolo Anestesia Transplante Renal POSTOPERATORIO ReanimacionDocumento10 páginasCLINIC BARCELONA Protocolo Anestesia Transplante Renal POSTOPERATORIO ReanimacionWerner BalcazarAún no hay calificaciones
- Pancreato Colangio Retrograda EndoscopicaDocumento19 páginasPancreato Colangio Retrograda Endoscopicarepre64Aún no hay calificaciones
- Exámenes Preoperatorios CardiovascularesDocumento25 páginasExámenes Preoperatorios CardiovascularesCamila Flores JimenezAún no hay calificaciones
- Preparacion PreoperatoriaDocumento13 páginasPreparacion Preoperatoriahuberth naval galvez bizarroAún no hay calificaciones
- Modulo 3. Resecciones HepaticasDocumento31 páginasModulo 3. Resecciones HepaticasLuis Puch Cetina100% (1)
- 06 ESTUDIO IMAGEN DONANTEDocumento32 páginas06 ESTUDIO IMAGEN DONANTEMaria Paula De la OssaAún no hay calificaciones
- Insuficiencia Renal CronicaDocumento9 páginasInsuficiencia Renal CronicaPaola MontesAún no hay calificaciones
- Absceso HepaticoDocumento28 páginasAbsceso HepaticoHector Manuel Suarez OrtegaAún no hay calificaciones
- PlaquetasDocumento37 páginasPlaquetasVictor Manuel Velazquez MartinezAún no hay calificaciones
- PRR: Prostatectomía radical retropúbica paso a pasoDocumento13 páginasPRR: Prostatectomía radical retropúbica paso a pasoJ JaimesAún no hay calificaciones
- Tarea Archivo Corregido TransplanteDocumento13 páginasTarea Archivo Corregido TransplanteEdwin Lionel Castillo MirandaAún no hay calificaciones
- Trastornos DigestivosDocumento7 páginasTrastornos DigestivosMiguel lópez salazarAún no hay calificaciones
- Trasplante de órganos y tejidos: historia, técnicas y retos actualesDocumento10 páginasTrasplante de órganos y tejidos: historia, técnicas y retos actualesPedro Jerry Sevilla RomeroAún no hay calificaciones
- 6ta Clase Post Trasplante RenalDocumento55 páginas6ta Clase Post Trasplante RenalYoberzon Ccayhuari Aguirre100% (1)
- Enfermedad Renal Crónica Manejo OdontologicoDocumento7 páginasEnfermedad Renal Crónica Manejo OdontologicoSUSAN LUCINDA MEJIA TIPAZAún no hay calificaciones
- Lesion de Via BiliarDocumento43 páginasLesion de Via BiliarLuis Omar Cavero HuallancaAún no hay calificaciones
- Guias Clinicas Enfermeria en Transfusion SanguineaDocumento5 páginasGuias Clinicas Enfermeria en Transfusion SanguineaGery Solis100% (1)
- Rechazo Al Transplante Renal ModificadoDocumento26 páginasRechazo Al Transplante Renal ModificadoJulissa Poma CerronAún no hay calificaciones
- 68 Indicaciones Del Trasplante HepaticoDocumento8 páginas68 Indicaciones Del Trasplante HepaticoCarmen Elena CisnerosAún no hay calificaciones
- Sangre AutologaDocumento6 páginasSangre AutologaAlejandra Floriano BautistaAún no hay calificaciones
- Protocolo PBRDocumento4 páginasProtocolo PBRydelacruzAún no hay calificaciones
- CANALIZACION VIA CENTRALDocumento13 páginasCANALIZACION VIA CENTRALsofiapenafiel.96Aún no hay calificaciones
- Rechazo agudo trasplante renalDocumento26 páginasRechazo agudo trasplante renalJuan Carlos AlfaroAún no hay calificaciones
- SHOCKDocumento37 páginasSHOCKeva.sotelo6591Aún no hay calificaciones
- Neoplasias Benignas Malignas de Tejidos BlandosDocumento54 páginasNeoplasias Benignas Malignas de Tejidos Blandoseva.sotelo6591Aún no hay calificaciones
- Diabetes MellitusDocumento98 páginasDiabetes Mellituseva.sotelo6591Aún no hay calificaciones
- Diagnóstico y Tratamiento en Otorrinolaringología. Cirugía de Cabeza y Cuello, 4e Lesiones Laríngeas MalignasDocumento2 páginasDiagnóstico y Tratamiento en Otorrinolaringología. Cirugía de Cabeza y Cuello, 4e Lesiones Laríngeas Malignaseva.sotelo6591Aún no hay calificaciones
- La psicoanálisis en la polis: fundamentos, prácticas y clínicaDocumento10 páginasLa psicoanálisis en la polis: fundamentos, prácticas y clínicaconstanza romeroAún no hay calificaciones
- Mejorar La JustificacionDocumento2 páginasMejorar La JustificacionJOSE LUIS RAMIREZ LEONAún no hay calificaciones
- Berger NuevoDocumento4 páginasBerger NuevoNoraluz Torres MoralesAún no hay calificaciones
- Anamnesis PsicosomaticaDocumento18 páginasAnamnesis PsicosomaticaJennifer Flores GonzalesAún no hay calificaciones
- Registro Gestion Del Cambio ModeloDocumento2 páginasRegistro Gestion Del Cambio ModeloLibardo Moreno PAún no hay calificaciones
- Dispensacion 2021Documento11 páginasDispensacion 2021Edwin Muñoz TellezAún no hay calificaciones
- ?6o S3 Plan Tu Mejor Maestro 21-22Documento5 páginas?6o S3 Plan Tu Mejor Maestro 21-22Mnk GarcíaAún no hay calificaciones
- Plan de contingencia INTEPAVDocumento37 páginasPlan de contingencia INTEPAVGabriel AcostaAún no hay calificaciones
- Políticas de apoyo a la parentalidad positiva en EuropaDocumento12 páginasPolíticas de apoyo a la parentalidad positiva en EuropaJosué Román PucheAún no hay calificaciones
- El Músculo Bíceps DistalDocumento3 páginasEl Músculo Bíceps Distalsantos louis ore mendozaAún no hay calificaciones
- Plan de Mercadeo1Documento20 páginasPlan de Mercadeo1Helen Puerta100% (1)
- Informe Psicologico Test de La Persona Bajo La LluviaDocumento6 páginasInforme Psicologico Test de La Persona Bajo La LluviaRosa Sanca Mendoza100% (1)
- 2,4 D AminaDocumento17 páginas2,4 D AminaContacto EmpresarialAún no hay calificaciones
- Código Civil de Puerto Rico Ley Núm. 55-2020 1 de Junio de 2020Documento389 páginasCódigo Civil de Puerto Rico Ley Núm. 55-2020 1 de Junio de 2020La Isla OesteAún no hay calificaciones
- Convivencia FamiliarDocumento12 páginasConvivencia FamiliarEduardo Caro RituayAún no hay calificaciones
- Proyecto FinalDocumento7 páginasProyecto FinalReyes Hernández AlondraAún no hay calificaciones
- ARTICULO PSICOTRON (Lic. Luis Felipe Hernandez Gudiño)Documento14 páginasARTICULO PSICOTRON (Lic. Luis Felipe Hernandez Gudiño)Luis Felipe HernandezAún no hay calificaciones
- CV Donny Alexander Gonzalez Ramos PDFDocumento2 páginasCV Donny Alexander Gonzalez Ramos PDFDONNY ALEXANDER GONZALEZ RAMOSAún no hay calificaciones
- 2020 Ansiedad Rendimiento AcademicoDocumento49 páginas2020 Ansiedad Rendimiento AcademicoKathia Marcela Rocco UrzolaAún no hay calificaciones
- Ficha Tecnica Tritordeum Eco EspDocumento2 páginasFicha Tecnica Tritordeum Eco EspPau Balleste LopezAún no hay calificaciones
- BioquímicaDocumento6 páginasBioquímicauriel martinezAún no hay calificaciones
- Tarea 3 AptitudesDocumento6 páginasTarea 3 AptitudesGerineidy espinal la pazAún no hay calificaciones
- Presentación Social HIV FinalDocumento23 páginasPresentación Social HIV FinalEliana LioyAún no hay calificaciones
- LomloeDocumento25 páginasLomloeAntonioAún no hay calificaciones
- Sesion de Apresndizaje de CT 3° AB 4 de OCTUBREDocumento6 páginasSesion de Apresndizaje de CT 3° AB 4 de OCTUBREYliceo Gonzales ÑaupariAún no hay calificaciones
- El Secreto de Las Siete SemillasDocumento5 páginasEl Secreto de Las Siete SemillasPablo CuipalAún no hay calificaciones
- Cuadro de Analisis TVDocumento2 páginasCuadro de Analisis TVRossana AguirreAún no hay calificaciones
- 92268763220Documento2 páginas92268763220Neli OlveraAún no hay calificaciones
- Consideraciones Oclusales en Prótesis Sobre ImplantesDocumento9 páginasConsideraciones Oclusales en Prótesis Sobre ImplantesAndres ReyAún no hay calificaciones
- Taller Sobre Relaciones HumanasDocumento24 páginasTaller Sobre Relaciones Humanasmedinaaida100% (7)
- Fisiopatología de las enfermedades cardiovascularesDe EverandFisiopatología de las enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Muchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)De EverandMuchas Vidas, Muchos Sabios (Many Lives, Many Masters): (Many Lives, Many Masters)Calificación: 4 de 5 estrellas4/5 (475)
- Dieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasDe EverandDieta Para El Reflujo Biliar y Gastritis Alcalina - Incluye 20 Deliciosas Recetas Libres de Gluten y de Lácteos Para Tratar y Aliviar el Reflujo Biliar y Sus Molestos SíntomasCalificación: 4 de 5 estrellas4/5 (9)
- Prescripción de ejercico físico para la saludDe EverandPrescripción de ejercico físico para la saludCalificación: 5 de 5 estrellas5/5 (1)
- Neuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaDe EverandNeuroanatomía: Fundamentos de neuroanatomía estructural, funcional y clínicaCalificación: 4 de 5 estrellas4/5 (16)
- Terapia cognitiva: Conceptos básicos y profundizaciónDe EverandTerapia cognitiva: Conceptos básicos y profundizaciónCalificación: 5 de 5 estrellas5/5 (1)
- La metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceDe EverandLa metamedicina. Cada síntoma es un mensaje: La curación a tu alcanceCalificación: 5 de 5 estrellas5/5 (8)
- El libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)De EverandEl libro conciso de la punción seca: Manual del terapeuta para las aplicaciones en los puntos gatillo miofasciales (Color)Calificación: 3 de 5 estrellas3/5 (2)
- Sistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)De EverandSistema nervioso y osteopatía: Nervios periféricos, meninges craneales y espinales, y sistema nervioso vegetativo (Color)Calificación: 5 de 5 estrellas5/5 (9)
- TDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosDe EverandTDAH en Adultos. Cómo Reconocer y Tratar a un Adulto con TDAH en 30 Fáciles PasosCalificación: 4 de 5 estrellas4/5 (8)
- Psiconeuroinmunología para la práctica clínicaDe EverandPsiconeuroinmunología para la práctica clínicaCalificación: 5 de 5 estrellas5/5 (4)
- Genética general: Libro de textoDe EverandGenética general: Libro de textoCalificación: 4.5 de 5 estrellas4.5/5 (11)
- La Dieta Mediterránea Para Principiantes, Guía Paso A Paso Con Recetas Para Comer Mejor Y Bajar De PesoDe EverandLa Dieta Mediterránea Para Principiantes, Guía Paso A Paso Con Recetas Para Comer Mejor Y Bajar De PesoCalificación: 5 de 5 estrellas5/5 (2)
- Sana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónDe EverandSana tu Cuerpo, Calma tu Mente: Desintoxicar Hígado, Intestino Permeable, Salud Hormonal, Curación Emocional, Relajación, Ansiedad y Sanidad mental, Atención Plena, Psicoterapia y NutriciónCalificación: 5 de 5 estrellas5/5 (4)
- Psicoterapia breve con niños y adolescentesDe EverandPsicoterapia breve con niños y adolescentesCalificación: 4.5 de 5 estrellas4.5/5 (15)
- GuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisDe EverandGuíaBurros Análisis clínicos: Todo lo que necesitas saber para entender tus análisisCalificación: 4 de 5 estrellas4/5 (9)
- La cocina ayurvédica: Recetas para la salud y el bienestarDe EverandLa cocina ayurvédica: Recetas para la salud y el bienestarCalificación: 5 de 5 estrellas5/5 (6)
- Psicópatas seriales: Un recorrido por su oscura e inquietante naturalezaDe EverandPsicópatas seriales: Un recorrido por su oscura e inquietante naturalezaCalificación: 4 de 5 estrellas4/5 (3)
- Gua Sha: Guía de autotratamiento completoDe EverandGua Sha: Guía de autotratamiento completoCalificación: 4.5 de 5 estrellas4.5/5 (11)
- Cómo curar la artritis: Curación natural de la artritis, la artrosis, la gota y la fibromialgiaDe EverandCómo curar la artritis: Curación natural de la artritis, la artrosis, la gota y la fibromialgiaCalificación: 5 de 5 estrellas5/5 (17)
- Cardiología y enfermedades cardiovascularesDe EverandCardiología y enfermedades cardiovascularesCalificación: 5 de 5 estrellas5/5 (1)
- Altas Dosis: Los efectos milagrosos de dosis extremadamente altas de vitamina D3. El gran secreto que la industria farmacéutica quiere ocultarle.De EverandAltas Dosis: Los efectos milagrosos de dosis extremadamente altas de vitamina D3. El gran secreto que la industria farmacéutica quiere ocultarle.Calificación: 5 de 5 estrellas5/5 (4)
- La acupuntura para prevenir y curar las enfermedadesDe EverandLa acupuntura para prevenir y curar las enfermedadesAún no hay calificaciones