Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Protocolo PCR
Protocolo PCR
Cargado por
ISIDORA FERRARI MARFULLTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Protocolo PCR
Protocolo PCR
Cargado por
ISIDORA FERRARI MARFULLCopyright:
Formatos disponibles
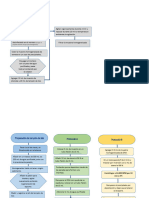
Protocolo Adision del etanol al tampón :
Reconstituir liofilizado
DNA/RNA Wash Buffer Reconstituir liofilizado Proteinasa K a 20 mg/ml con
(R1057) --> 96 ml de ADNasa I con Agua libre de Tampón de almacenamiento de
etanol al 100% (104 ml de DNasa/RNasa proteinasa K y mezclar por Agregue un volumen igual de
etanol al 95%) vortex. agua libre de nucleasas (no
I. Preparación del
Ya listo RNA Wash Buffer (R1058) E1009-A (250U), incluida) al Escudo de
tampón
--> 192 ml de etanol al añadir 275 μl agua D3001-2-20 (20 mg), ADN/ARN™ (1:1) y mezclar
100% (208 ml de etanol al E1009-AS (50U), añadir 1,04ml buffer bien.
95%) añadir 55 μl agua D3001-2-5 (5 mg),
DNA/RNA Wash Buffer añadir 0,26ml buffer
(R1057T) --> no requiere
etanol.
DNA/RNA Shield --> RNA
Lysis Buffer (1:1)
Eliminar los restos de Agregar ethanol 100% al
células --> centrifugar ≤ 500 partículas del tejido, sobrenadante (tomar 300μl
II. Preparación de la xg durante 1 min. Mezclar e incubar a 4° C centrifugue y transfiera el de muestra+ 300μl de etanol
muestra Suspender en RNA Lysis sobrenadante aclarado a un 100%)
Buffer tubo sin nucleasas. Mezclar bien
Muestras difíciles de lisar -->
homogenizar en ≥ 800 μl
DNA/RNA Shield
Trizol (red bottle) Descartar flujo continuo
2. ADNasa I4 tratamiento
- Lavar la columna con 400 μl
Tampón de lavado de ARN y 5.
1. 6.
centrífuga. descartar flujo continuo 400 μl RNA Wash
Transferir la 3. 4. Añadir 100 μl Agua
- En un tubo libre de nucleasas, Buffer. Centrifugar
muestra a un tubo Añadir 400 μl RNA Añadir 700 μl RNA libre de
III. Purificación de agregue 5 μl ADNasa I (1 U/μl)*, 75 durante 1 min.
de recogida con el Prep Buffer. Wash Buffer DNasa/RNasa y
ARN total μl DNA Digestion Buffer y mezclar Transferir a un tubo
filtro y centrifugar centrifugar.
- Incube la columna a temperatura libre de nucleasas
ambiente (20-30 °C) durante 15
minutos.
También podría gustarte
- Clase N°2 - Ejercicio ResueltoDocumento2 páginasClase N°2 - Ejercicio ResueltoMarcos SanabriaAún no hay calificaciones
- Simulacro San Marcos 2020 Ii Área A Ciencias de La SaludDocumento22 páginasSimulacro San Marcos 2020 Ii Área A Ciencias de La SaludIsabela GaviriaAún no hay calificaciones
- Extracción Del RNADocumento34 páginasExtracción Del RNALidiaAlejandraRiveraPonceAún no hay calificaciones
- Protocolo para La Extracción de ADN-RNA A Partir de Sangre TotalDocumento21 páginasProtocolo para La Extracción de ADN-RNA A Partir de Sangre TotalOSCAR LEONARDO BUITRAGO URIBEAún no hay calificaciones
- Aislamiento de ArnDocumento5 páginasAislamiento de ArnElizabeth Camila Paira SanchuAún no hay calificaciones
- Extracción DNA PATODocumento2 páginasExtracción DNA PATOPatricio HernándezAún no hay calificaciones
- Danagene Saliva Rna KitDocumento3 páginasDanagene Saliva Rna KitStela MarisAún no hay calificaciones
- Extracción de RNAmDocumento5 páginasExtracción de RNAmLaura Daiana AlcarazAún no hay calificaciones
- P4. Extracción de ARNDocumento6 páginasP4. Extracción de ARNPamelaAún no hay calificaciones
- Protocolo de Purificación de Rna Total para LevadurasDocumento1 páginaProtocolo de Purificación de Rna Total para LevadurassandraAún no hay calificaciones
- GATOLATEDocumento6 páginasGATOLATEnicositja_vangoh91Aún no hay calificaciones
- Extraccion de Adn CaseroDocumento76 páginasExtraccion de Adn CaseroSammir Chapa chayanAún no hay calificaciones
- Extracción Total Del ArnDocumento9 páginasExtracción Total Del ArnPatricia nava lopezAún no hay calificaciones
- Speedtools RNA Virus. Esp. Ed.11. Julio 18Documento9 páginasSpeedtools RNA Virus. Esp. Ed.11. Julio 18Israel Espinoza HernándezAún no hay calificaciones
- Practica 15Documento1 páginaPractica 15black princessAún no hay calificaciones
- LDH LíquidaDocumento1 páginaLDH LíquidaCarlos SalasAún no hay calificaciones
- Practica 2 DiagramasDocumento2 páginasPractica 2 DiagramasRojas Xicohtencatl David EduAún no hay calificaciones
- Protocolo de Extracción de ADNDocumento2 páginasProtocolo de Extracción de ADN40300000% (1)
- PURIFICACIÓNDocumento4 páginasPURIFICACIÓNMaria Fernanda Gonzalez CabarcasAún no hay calificaciones
- Nte Inen 2951Documento15 páginasNte Inen 2951Xavier Diego LopezAún no hay calificaciones
- Extraccion de ArnDocumento3 páginasExtraccion de ArnAamdreé UzAún no hay calificaciones
- Informe PCRDocumento7 páginasInforme PCRViviana HinestrozaAún no hay calificaciones
- TrizolDocumento67 páginasTrizolISABELSSBAún no hay calificaciones
- Tarea de AntocianinasDocumento4 páginasTarea de AntocianinasRenzo Alfaro AlvarezAún no hay calificaciones
- BioMolecular-Univ Ext MundialDocumento8 páginasBioMolecular-Univ Ext MundialJoaquin RodriguezAún no hay calificaciones
- Protocolo de Extracción de ARN Con Mini Kit RNasayDocumento4 páginasProtocolo de Extracción de ARN Con Mini Kit RNasaycarla bastAún no hay calificaciones
- Es MKDocumento3 páginasEs MKDe León Ramírez Ramiro EduardoAún no hay calificaciones
- A2 tT4 AccuBind ELISA 225 300 Rev 3. SpanishDocumento2 páginasA2 tT4 AccuBind ELISA 225 300 Rev 3. SpanishAlexander MatamorosAún no hay calificaciones
- Práctica 3Documento11 páginasPráctica 3JuLiethMiRellaLuqueMedinaAún no hay calificaciones
- Diagrama de Flujo HPLC. Rosales Ocampo Iván. 5QM2Documento1 páginaDiagrama de Flujo HPLC. Rosales Ocampo Iván. 5QM2IvanAún no hay calificaciones
- Cuadro ComparativoDocumento3 páginasCuadro ComparativoJoel LuceroAún no hay calificaciones
- Gpt/Alt U.V.: Metodo Cinetico Optimizado. Tecnica IfccDocumento2 páginasGpt/Alt U.V.: Metodo Cinetico Optimizado. Tecnica IfccRolly ScavengersAún no hay calificaciones
- Epa 3630 CDocumento8 páginasEpa 3630 CDelia AguilarAún no hay calificaciones
- Práctica 12 - Extracción de Adn A Partir de Un PezDocumento7 páginasPráctica 12 - Extracción de Adn A Partir de Un PezMariana BarreraAún no hay calificaciones
- Presentación Sobre Extracción de ADNDocumento18 páginasPresentación Sobre Extracción de ADNAnna OsakiAún no hay calificaciones
- Extraccion de RnaDocumento6 páginasExtraccion de RnaMaricielo Guerra JácoboAún no hay calificaciones
- Regulación Renal de SODIODocumento4 páginasRegulación Renal de SODIOJoselyn LindoAún no hay calificaciones
- Metodo de Gustincich CPZDocumento2 páginasMetodo de Gustincich CPZCarolinaAún no hay calificaciones
- Protocolo Ext DNA MLMP (2097)Documento3 páginasProtocolo Ext DNA MLMP (2097)Juan BarajasAún no hay calificaciones
- Manual de Kit QiAamp Extracción de ADNDocumento13 páginasManual de Kit QiAamp Extracción de ADNLupita FigueroaAún no hay calificaciones
- 1L. Extracción de ADN de Sangre HumanaDocumento4 páginas1L. Extracción de ADN de Sangre Humanaendrivall 432Aún no hay calificaciones
- Aljanabi-Diagrama de FlujoDocumento3 páginasAljanabi-Diagrama de FlujoKenia PantojaAún no hay calificaciones
- Extraccion Del DNA Vegetal PracticaDocumento6 páginasExtraccion Del DNA Vegetal PracticaJonathan IslasAún no hay calificaciones
- Acidos BiliaresDocumento2 páginasAcidos BiliaresVictorRojasAún no hay calificaciones
- Amilasa405aa Liquida SPDocumento9 páginasAmilasa405aa Liquida SPAaron castroAún no hay calificaciones
- Aislamiento de Arn en LevadurasDocumento2 páginasAislamiento de Arn en LevadurasNatalyPomaPerez100% (1)
- Amilasa405aa Liquida SPDocumento9 páginasAmilasa405aa Liquida SPricardolandivarAún no hay calificaciones
- PRACTICA Extraccion Arn TrizolDocumento6 páginasPRACTICA Extraccion Arn TrizolDaniel TorresAún no hay calificaciones
- Extraccion de ADNDocumento2 páginasExtraccion de ADNAlberto DavalosAún no hay calificaciones
- Practica 4 - Extraccion de Arn de LevaduraDocumento8 páginasPractica 4 - Extraccion de Arn de LevaduraMegevi Geldres33% (3)
- Aislamiento y Cuantificación de Dna GenómicoDocumento2 páginasAislamiento y Cuantificación de Dna GenómicoAndreaAún no hay calificaciones
- Extracción ADN Hoja - ClásicoDocumento2 páginasExtracción ADN Hoja - ClásicoIgnacioAún no hay calificaciones
- EjemploDocumento8 páginasEjemploMaira Sofia Palacios ValenciaAún no hay calificaciones
- Wizard-Genomic-Dna-Purification-Kit-Quick-Protocol TraducidoDocumento4 páginasWizard-Genomic-Dna-Purification-Kit-Quick-Protocol TraducidoMonica Lozano (Monilotov)Aún no hay calificaciones
- Protocolo de Extraccion de RNADocumento3 páginasProtocolo de Extraccion de RNACesar Javier Cruz GalindoAún no hay calificaciones
- UreaDocumento2 páginasUreaUkeAún no hay calificaciones
- Informe BiotecnologiaDocumento3 páginasInforme BiotecnologiabrahianAún no hay calificaciones
- Extracción AdnDocumento1 páginaExtracción AdnAngelica CobosAún no hay calificaciones
- Extraccion de Dna GenómicoDocumento1 páginaExtraccion de Dna GenómicoKaren Garcia RuizAún no hay calificaciones
- Inmunodetección en Estado SólidoDocumento11 páginasInmunodetección en Estado SólidoCintya ChjAún no hay calificaciones
- Extracción de ADN en SalivaDocumento19 páginasExtracción de ADN en SalivaAndrea Rodriguez Gonzalez100% (1)
- Contexto de Producción Del Tunel PDFDocumento2 páginasContexto de Producción Del Tunel PDFFer NandaAún no hay calificaciones
- Formulario MatemáticoDocumento8 páginasFormulario MatemáticoDafne LeyvaAún no hay calificaciones
- Fase 3 - Aplicar La Primera Ley de La Termodinámica A SDocumento11 páginasFase 3 - Aplicar La Primera Ley de La Termodinámica A SYeimmy Julieth Cardenas MillanAún no hay calificaciones
- Actividad 7 SimulacionDocumento16 páginasActividad 7 Simulacionerika cuestaAún no hay calificaciones
- Acondicinamiento FisicoDocumento6 páginasAcondicinamiento FisicoAna MuñozAún no hay calificaciones
- Matrix de Ideas ParadigmasDocumento5 páginasMatrix de Ideas ParadigmasJose bermudez Diez CastellAún no hay calificaciones
- La Luna Por Beinsa DunoDocumento6 páginasLa Luna Por Beinsa DunoJOHN JAIRO ARANGO QUINTEROAún no hay calificaciones
- El Conocimiento Seún BersongDocumento8 páginasEl Conocimiento Seún BersongDaniela GraciaAún no hay calificaciones
- Procedimiento y Formatos de Informe de PasantíasDocumento14 páginasProcedimiento y Formatos de Informe de PasantíasAlternador AlternadoAún no hay calificaciones
- Composicion de La CanelaDocumento8 páginasComposicion de La CanelaDavid Zamora0% (1)
- Ciencia Tecnologia y SociedadDocumento4 páginasCiencia Tecnologia y SociedadcristinoAún no hay calificaciones
- Rectificadores y DiodosDocumento17 páginasRectificadores y DiodosFátima ChumbiaucaAún no hay calificaciones
- 12.7 Extracción A Continua Contracorriente en EtapasDocumento2 páginas12.7 Extracción A Continua Contracorriente en EtapasAnonymous SgKVjkq3100% (1)
- Proyecto Emprendedor. Plan de Mejora Manuel CheroDocumento24 páginasProyecto Emprendedor. Plan de Mejora Manuel CheroJUAN CARLOS ALVAREZ CALDERONAún no hay calificaciones
- Dobles TransgeneracionalesDocumento2 páginasDobles TransgeneracionalesPsicóloga Cecilia García RoblesAún no hay calificaciones
- Declaración de EquivalenciaDocumento4 páginasDeclaración de EquivalenciaBruno Vignati MarconeAún no hay calificaciones
- PLANIF. DE EXP. APREND. ARTIC. #6 - 1° AñoDocumento11 páginasPLANIF. DE EXP. APREND. ARTIC. #6 - 1° AñonormaAún no hay calificaciones
- Facultad de Ingeniería y ArquitecturaDocumento18 páginasFacultad de Ingeniería y ArquitecturaMIGUEL ANGEL ALIAGA MANRIQUEAún no hay calificaciones
- Proyecto de Metodologia 2Documento55 páginasProyecto de Metodologia 2Jefferson Racero100% (1)
- Taller 2Documento19 páginasTaller 2Lennin NuñezAún no hay calificaciones
- Taller 1 Alcantarillados y Acueductos 2da EntregaDocumento105 páginasTaller 1 Alcantarillados y Acueductos 2da EntregaTatiana VaronAún no hay calificaciones
- Taller U1 Clase 1 s2Documento10 páginasTaller U1 Clase 1 s2Alba TobarAún no hay calificaciones
- Evaluación Diagnostica 3ro Básico 2024Documento4 páginasEvaluación Diagnostica 3ro Básico 2024Amaya Borquez WallAún no hay calificaciones
- Tecnologias AlternativasDocumento3 páginasTecnologias AlternativasRigo OsorioAún no hay calificaciones
- Matriz de Riesgos Rancho MioDocumento50 páginasMatriz de Riesgos Rancho MioMiladys Miluska Jimenez MedinaAún no hay calificaciones
- Your Family 2020Documento7 páginasYour Family 2020santiago morantesAún no hay calificaciones
- Semana - 1. 9no 11-15 OctDocumento5 páginasSemana - 1. 9no 11-15 OctavillotaAún no hay calificaciones
- Potencial ElectricoDocumento14 páginasPotencial ElectricoJonathan RangelAún no hay calificaciones