Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Seminario. Hemostasia
Cargado por
arios_409594100%(1)100% encontró este documento útil (1 voto)
13 vistas10 páginasTítulo original
SEMINARIO. HEMOSTASIA
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
100%(1)100% encontró este documento útil (1 voto)
13 vistas10 páginasSeminario. Hemostasia
Cargado por
arios_409594Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 10
HEMOSTASIA
DEFINICION • Agregación plaquetaria: cuando las
Es el conjunto de mecanismos fisiológicos plaquetas son expuestas a alguno de los
que permiten mantener la sangre en forma fluida y agonistas que inician la activación (ADP,
evitar la pérdida de sangre ante una lesión TxA2, trombina, colágeno), comienzan a
vascular. expresar glicoproteína llb/llla en su
En este proceso intervienen los vasos superficie, que reconoce dos secuencias
sanguíneos y fenómenos de vasoconstricción, las presentes en el fibrinógeno y permite formar
estructuras de soporte, las plaquetas y su puentes entre plaquetas activadas.
interacción con los vasos a través del Factor von
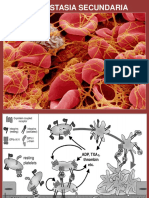
Willebrand, la cascada de coagulación con sus dos HEMOSTASIA SECUNDARIA: es el proceso
vías (extrínseca e intrínseca) que trasformará el de coagulación, tiene como finalidad la
tapón plaquetario en un coágulo estable. Este formación de un coágulo estable de fibrina. En
proceso está finamente regulado por sistemas este proceso participan: factores de la
anticoagulantes naturales que inactivan los coagulación, fosfolípidos plaquetarios y
factores activados; entre éstos, encontramos a la tisulares y el calcio.
antitrombina III que es uno de los principales
anticoagulantes, el sistema de la proteína C y S y • Factores de la coagulación: son proteínas
el inhibidor del factor tisular. Otro proceso plasmáticas solubles que interactúan en
importante es el de fibrinolisis, es decir la ruptura una serie de reacciones enzimáticas en
de los coágulos de fibrina para recanalizar el vaso cadena para transformar el fibrinógeno
y finalmente la reparación de éste. soluble del plasma en un coágulo de fibrina,
que se localiza en el sitio de ruptura
FASES DE LA HEMOSTASIA vascular.
HEMOSTASIA PRIMARIA: es la respuesta Los factores de la coagulación se pueden
inicial a la ruptura vascular, como consecuencia subdividir en los siguientes grupos:
de la acción del propio vaso sanguíneo y de las 1) Factores dependientes de la vitamina K:
plaquetas y comprende los siguientes tienen síntesis hepática, actuando como
fenómenos: coenzima la vitamina K. Estos son la
protrombina o factor II, VII, IX, X y las proteínas
• Contracción vascular: Se produce una C y S.
vasoconstricción local rápida, por 2) Factores sensibles a la trombina:
estimulación directa de los nervios Fibrinógeno o factor I, y los factores V, VIII y
simpáticos existentes en la pared de los XIII. Además activa la proteína C.
vasos. 3) Factores del sistema de contacto:
• Adhesión plaquetaria: las plaquetas se constituyen los primeros pasos de la
adhieren al colágeno subendotelial coagulación y son los factores XII, XI,
expuesto tras el traumatismo, a través de la quininógeno de alto peso molecular y
glucoproteína de membrana plaquetaria Ib, precalicreína.
y mediado por el factor von Willebrand
(Factor vW) sintetizado en el endotelio. Los factores de la coagulación son proteínas,
• Activación plaquetaria: sucede a medida fosfolípidos, lipoproteínas y calcio iónico. Estos
que las plaquetas se adhieren al endotelio factores han sido denominados por números
se activan, y ocurre: romanos de I a XIII, de acuerdo con el orden de su
o Cambio de forma. descubrimiento y no al orden en que intervienen en
o Liberación y oxidación del ácido el proceso o cascada de la coagulación. Los
araquidónico a través de la enzima factores circulan en la sangre en forma inactiva,
COX. como cimógenos, excepto el factor III (factor tisular,
o Reordenamiento de FT) que normalmente no está en el plasma sino
fosfolipoproteínas de membrana, que se expresa sobre la superficie de diversas
con capacidad de ligar el factor X y células, entre otras, monocitos, células endoteliales
activar la coagulación sanguínea. activadas y fibroblastos.
o Secreción de gránulos plaquetarios
(ADP, PDGF, Serotonina, calcio, Cuando un factor se activa, es decir, se
etc.) transforma en enzima, se le agrega la letra “a” a la
designación numérica. Existen varias excepciones covalentes, pero el factor XIIIa crea un coágulo
a esta terminología, el factor II (protrombina) en su estable.
forma activa se le conoce como trombina y cuando
el factor I (fibrinógeno) sufre proteólisis parcial por Vía extrínseca
la acción de trombina, se denomina fibrina, la cual La vía extrínseca comprende la participación
constituye el producto final de la cascada de la del factor VII (proteína plasmática) y el factor tisular
coagulación. El factor tisular y el calcio no son (cofactor), los cuales forman un complejo que se
cimógenos y no tienen forma activada. Los factores une a la superficie fosfolipídica por medio de
V y VIII circulan como procofactores y participan puentes de calcio.
como activadores no proteolíticos (cofactores) de El complejo FT-FVIIa activa el factor X a factor
enzimas, para ello deben activarse, Xa. A partir de la activación del Factor X la
denominándose Va y VIIIa. secuencia de reacciones es la misma que si la
activación del sistema se iniciara por la vía
• Cascada de la coagulación intrínseca.
Aunque la activación in vivo de la coagulación
ocurre en forma diferente a lo que, clásicamente, Hasta hace unos años atrás se describía que la
se ha conocido como vía intrínseca y vía cascada de la coagulación era iniciada por
extrínseca, esta forma de abordar el proceso de la activación de la vía intrínseca a través de los
coagulación es útil fundamentalmente para una factores de contacto; en la actualidad se sabe que
mejor comprensión de las pruebas de laboratorio. la cascada es iniciada a través de la vía extrínseca,
En la vía intrínseca participan los factores con activación del factor VII por el factor tisular y
«intrínsecos» de la sangre, y la vía extrínseca se que posteriormente se activan los factores de la vía
caracteriza por requerir una sustancia activadora intrínseca de la coagulación.
“extrínseca”, el factor tisular.
• Fibrinólisis.
Vía intrínseca La fibrinólisis es un proceso enzimático en el
La vía intrínseca se inicia con la activación del cual participan una serie de activadores e
factor XII sobre superficies con carga negativa inhibidores, los cuales regulan la conversión de la
como proteínas de la matriz, una de ellas es el proenzima circulante, plasminógeno, en la enzima
colágeno; en esta reacción interviene la calicreína activa, plasmina, la cual produce finalmente la lisis
y el cininógeno de alto peso molecular (HMWK) de la fibrina. Esta destrucción de la fibrina, da lugar
constituyendo el sistema de contacto. Una vez a los llamados productos de degradación de la
activado el factor XIIa cataliza la conversión del fibrina.
factor XI (cininógeno) a XIa y en presencia de
iones calcio el factor XIa activa al factor IX a IXa. Los componentes del sistema fibrinolítico son el
plasminógeno (Pg), los activadores del
El factor IXa junto al VIIIa se unen a fosfolípidos plasminógeno (tipo tisular y urokinasa), plasmina,
de membrana y en presencia de calcio forman el inhibidores de los activadores del plasminógeno 1 y
“complejo tenasa» que transforma el FX a FXa. A 2 (PAI-1 y PAI-2) y la α2 antiplasmina.
partir de la activación del FX ambas vías continúan
una vía común hasta la formación de fibrina. El La activación del plasminógeno tiene lugar
factor Xa se une al factor Va sobre la superficie de fundamentalmente por los llamados activadores
una membrana fosfolipídica en presencia de calcio, tisulares del plasminógeno (t-PA, de origen
generando el “complejo protrombinasa” que endotelial), y también por otros factores como el
convierte la protrombina en trombina. Al romperse factor XII activado, el sistema de las quininas y la
la protrombina se forma trombina y se libera un calicreína.
fragmento proteico de mayor tamaño que es el
fragmento 1+2 de la protrombina. ESTUDIO DE LA FUNCIÓN HEMOSTÁTICA
Entre las diferentes pruebas de laboratorio
El sustrato natural de la trombina es el para estudio de la función hemostásica, destacan:
fibrinógeno, al actuar la fibrina sobre él se generan
fibrinopéptidos A y B y los monómeros de fibrina Pruebas generales:
que posteriormente se polimerizan y forman un • Hemograma
coágulo de fibrina estable. Inicialmente los • Recuento de plaquetas: tener en cuenta que la
monómeros de fibrina se entrelazan por uniones no trombopenia es la causa más frecuente de
trastorno hemorrágico.
• Bioquímica. • Trombopoyesis ineficaz: enfermedad de
Wiskott-Aldrich, anemias megaloblásticas,
Hemostasia primaria: síndromes mielodisplásicos.
• Recuento de plaquetas
• Tiempo de hemorragia (una de sus variantes es b. Disminución de supervivencia
el denominado tiempo de Ivy): mide la actividad plaquetaria (trombopenias periféricas).
de la hemostasia primaria y, por tanto, se altera • Destrucción incrementada de plaquetas: la vida
en enfermedades del vaso sanguíneo, media plaquetaria normal es de alrededor de 10
trombopenias y enfermedades de la función días. La remoción acelerada de las plaquetas
plaquetaria. desde la circulación obedece a dos grandes
• Extensión de sangre periférica mecanismos: inmunológico, en el cual la
Hemostasia secundaria: destrucción plaquetaria es mediada por
• Tiempo de protrombina (PT, una de sus variantes anticuerpos y/o complejos inmunes, y
es el índice de Quick): mide la actividad en la mecanismo no inmunológico o por aumento de
coagulación extrínseca y sirve para el control de la consumo.
anticoagulación oral, ya que el primer factor que Algunas causas de un incremento en la
disminuye al actuar los anticoagulantes orales es el destrucción de éstas: fármacos, púrpura
factor VII. trombopénica idiopática, púrpura postransfusional,
• Tiempo de tromboplastina parcial activada (PTTa, púrpura inmunológica secundaria (sobre todo en el
tiempo de cefalinakaolin): mide la actividad de la LES y los linfomas), infección por VIH.
coagulación intrínseca y sirve para monitorizar el
tratamiento con heparina no fraccionada. • Púrpura trombopénica inducida por drogas: se
• Tiempo de trombina: mide la actividad del produce una destrucción periférica de
fibrinógeno. plaquetas, que ocasiona un incremento en la
formación de las mismas mediante un aumento
ALTERACIONES DE LA HEMOSTASIA del número de megacariocitos. Es la
ALTERACIONES DE LA HEMOSTASIA trombopenia habitual encontrada en los
PRIMARIA adultos. Como fármacos causantes de
• Cuantitativas trombopenia encontramos: heparina, etanol,
o Trombocitopenia quinidina, difenilhidantoína, sales de oro (estas
• Cualitativas dos últimas tienen una duración prolongada, a
o Enfermedad de Von Willebrand pesar de la suspensión del fármaco, ya que
o Enfermedad de Glanzmann estos fármacos tardan tiempo en eliminarse del
o Enfermedad De Bernard- Soulier organismo). Las tiacidas son la causa más
frecuente de trombopenia por fármacos.
• Cuantitativas El tratamiento consiste en la suspensión del
Trombocitopenia medicamento y si la trombopenia es severa, la
Se considera trombopenia la disminución del administración de esteroides.
número de plaquetas por debajo de • Hiperconsumo plaquetario: Púrpura
aproximadamente 100.000 plaquetas por milímetro trombopénica trombótica, coagulación
cúbico. Disminuciones inferiores a 50.000 intravascular diseminada, hemangioma
plaquetas por milímetro cúbico facilitan el sangrado cavernoso, síndrome hemolítico urémico,
postraumático, y por debajo de 20.000 plaquetas infecciones agudas.
se facilita la aparición del denominado sangrado • Secuestro Plaquetario: hiperesplenismo.
espontáneo.
• Cualitativas. Trombocitopatías
Etiopatogenia de la trombopenia Debe sospecharse una alteración de la función
a. Hipoproducción de Plaquetas plaquetaria cuando el tiempo de hemorragia se
(Trombopenias Centrales). encuentra prolongado y el número de plaquetas es
• Disminución en el número de megacariocitos: normal. Las trombocitopatías congénitas son
infiltración de la médula ósea, aplasia, trastornos infrecuentes, y dentro de los trastornos
enfermedad de Fanconi, síndrome TAR adquiridos de la función plaquetaria hay que
(trombopenia y ausencia de radio), trombopenia recordar a la uremia.
cíclica, rubéola congénita.
Clasificación funcional de las alteraciones
plaquetarias
• Participa en la agregación plaquetaria
Alteraciones en la adhesión • Es la proteína portadora del factor VIII
Hereditarias • Sindrome de de Bernard-
Soulier Formas clínicas
• Enfermedad de Von a) Congénitas.
Willebrand • Tipo I. Autosómica dominante. Disminución de
Adquiridas • Uremia la cantidad de factor vw, que se suele asociar a
• Enfermedad de Von disminución del factor VIII.
Willebrand adquirida • Tipo II. Defecto cualitativo (se sintetiza un factor
Alteraciones en la agregación vw que funciona de forma anormal). Suele ser
Hereditarias • Tromboastenia de Glanzmann un trastorno autosómico dominante.
• Afibrinogenemia • Tipo III. Se trata de un trastorno mixto
(cuantitativo y cualitativo), autosómico recesivo,
a diferencia de los anteriores. Es la forma más
Alteraciones en la liberación de gránulos grave.
Hereditarias • Albinismo óculo-cutáneo
• S. Chediak-Higashi b) Adquiridas.
• S. Plaquetas grises • Anticuerpos contra el factor vw en LES,
(deficiencia de gránulo α y β) gammapatías monoclonales, procesos
• Deficiencia aislada de gránulos linfoproliferativos o hipernefroma. La expresión
densos clínica más frecuente de esta enfermedad es el
Adquiridas • Circulación extracorpórea. sangrado ORL y las equimosis.
• Enfermedades
mielodisplásicas Manifestaciones clínicas
• Fármacos (AAS y otros • Laceraciones con hemorragias prolongadas
AINES) • Epistaxis
• Hemorragia de las encías
Alteraciones de la adhesión • Menorragia
Enfermedad de Bernard-Soulier: • Hemorragia posterior a intervenciones
Consiste en una alteración autosómica recesiva dentales
de las plaquetas para adherirse al endotelio • Hemorragia posterior a intervenciones
vascular, por ausencia de la glucoproteína Ib, que quirúrgicas
es el receptor de la membrana de la plaqueta para • Hemorragia posparto excesiva
el factor vw. • Hematomas musculares (EVW tipo 3)
Se caracteriza por la presencia de • Hemartrosis (EVW tipo 3)
trombocitopenia, macroplaquetas, tiempo de
sangría prolongado, y retracción del coágulo Tratamiento
normal. La sintomatología se centra en episodios 1. Para aumentar los niveles plasmáticos del
de hemorragia, fundamentalmente de localización FvW: administración de plasma,
cutáneomucosa, que se presentan desde la crioprecipitados o desmopresina.
infancia. Los más comunes son epistaxis (70%), 2. Los mejores candidatos para la desmopresina
equimosis espontáneas (58%), metrorragias (44%), son los que presentan la variante tipo I (0,3
gingivorragias (42%), y sangrados μg/kg vía EV o SC), pero siempre se debe
gastrointestinales (22%). probar su eficacia y controlar los niveles de
FvW porque desarrollan taquifilaxia.
Enfermedad de Von Willebrand 3. No es útil para las otras variantes e incluso
Es la diátesis hemorrágica hereditaria más puede empeorar el tipo II.
frecuente. La prevalencia en mujeres es
aproximadamente el doble de la documentada en Alteraciones de la agregación
varones. Se debe a anomalías cuantitativas y/o Enfermedad de Glanzmann
cualitativas del factor vw (sintetizado en el Es un trastorno autosómico recesivo con
endotelio y los megacariocitos y circula en plasma morfología plaquetaria normal. Se trata de un
ligada al factor VIII coagulante). fracaso de la agregación de una plaqueta con otra,
Papel del factor von willebrand en la por ausencia del complejo de membrana
hemostasia GPIIb/GPIIIa, que es el receptor para el
• Facilita la adhesión plaquetaria a la pared fibrinógeno.
del vaso sanguíneo lesionado
La naturaleza del sangrado incluye casi frecuentemente se les diagnostica cuando son
siempre púrpura, menorragia especialmente en la adultos.
menarquia, epistaxis y sangrado gingival. Con b) Hemofilia moderada (actividad del factor
menor frecuencia se produce también hematuria y entre 1-5%): las pequeñas cantidades de factor son
sangrado gastrointestinal, y son raros los casos de suficientes para proporcionar una cierta protección,
hemartrosis o hematomas en vísceras. de manera que las hemorragias espontáneas son
menos graves y menos frecuentes.
ALTERACIONES DE LA HEMOSTASIA c) Hemofilia severa (actividad del factor menor
SECUNDARIA que 1%): las hemorragias espontáneas son muy
• Alteraciones de la coagulación frecuentes y graves. Frecuentemente los enfermos
o Hemofilia A con hemofilia severa presentan alteraciones
o Hemofilia B importantes en las articulaciones como
o Deficiencias congénitas consecuencia de las repetidas hemorragias
o Trastornos congénitos protrombóticos articulares.
o Sindromes de CID
3. Según el patrón de herencia:
a) Recesivo ligado al sexo (hemofilias A y B).
Hemofilia b) Autosómico recesivo (hemofilia C).
Diátesis hemorrágicas de carácter hereditario
que obedecen al déficit o ausencia de factores de Hemofilia A
la coagulación de la sangre. Es una enfermedad También llamada hemofilia clásica. Se deben a
ligada al sexo ya que el gen del Factor VIII y el gen deficiencia del factor VIII de coagulación
del Factor IX que son los más frecuentemente Ocurre mayormente en hombres. Uno de cada
afectados están situados en el cromosoma sexual 10.000 varones nace con un déficit o defecto
X. funcional de la molécula del factor VIII.
Se estima que uno de cada 15.000 En casos raros, las mujeres portadoras
nacimientos esté afectado por la enfermedad; la estarán afectadas clínicamente si sus cromosomas
hemofilia A se produce en 1 de cada 6.000 recién X normales se encuentran inactivados de manera
nacidos vivos y la hemofilia B en 1 de cada 30.000. desproporcionada. Las mujeres también pueden
La hemofilia la transmiten las mujeres resultar afectadas si descienden de padre
(portadoras) y la padecen los hombres debido a la hemofílico y madre portadora.
dotación de dos cromosomas X (XX) de la mujer y
una dotación XY en el hombre. La transmisión es Hemofilia B
recesiva ya que puede que no aparezca en una También llamada enfermedad de Christmas.
generación siguiente (salto de generación). Ocurre por déficit del Factor IX en uno de cada
100.000 varones.La hemofilia A es entre 4 y 5
** Diátesis hemorrágica: condición del veces más frecuente que la B.
organismo congénita o adquirida que predispon a
sangrar de forma anómala, debido a una alteración Hemofilia C
de cualquiera de las 4 fases de que consta el Trastorno congénito de transmisión
mecanismo fisiológico de la hemostasia. Las autosómico recesivo incompleto ocasionado por el
diátesis hemorrágicas congénitas en cualquier de déficit de Factor XI, llamado también factor
las fases de la coagulación. antihemofílico, bien por disminución del factor o por
existencia de un factor estructuralmente anormal.
Clasificación: • Supone el 2-3% de todas las hemofilias.
1. Según el factor que está en déficit: • El cuadro clínico es idéntico al de la hemofilia A
a) Hemofilia A (déficit de Factor VIII o Factor y B.
antihemolítico A). • Las manifestaciones aparecen en el periodo
b) Hemofilia B (déficit de Factor IX o Factor neonatal, ya que el factor no atraviesa la
antihemolítico B o de Christmas). placenta, pero puede haber muchos recién
c) Hemofilia C (déficit de factor XI o nacidos asintomáticos.
antecedente tromboplastínico del plasma).
Manifestaciones clínicas:
2. De acuerdo con la severidad del defecto: Puede haber hemorragia en cualquier parte,
a) Hemofilia leve (actividad del factor mayor pero los sitios más comunes son:
que 5%): no presentan hemorragias espontáneas y • Las articulaciones (rodillas, tobillos, codos)
Las hemartrosis espontáneas son Otros sitios de hemorragia son:
características de la hemofilia. El comienzo de la • Sistema nervioso: hematoma subdural,
hemorragia se caracteriza por un hormigueo y una hemorragia subaracnoidea
sensación de calor en la articulación con posterior • Garganta: pueden ser el resultado de algunas
inflamación y dolor de la misma; a medida que infecciones, lesiones, inyecciones dentales o
evoluciona la hemorragia, la inflamación y el dolor cirugía, y pueden ocasionan inflamación, así
se incrementan hasta ocasionar la pérdida la como dificultad para tragar y respirar.
movilidad. • Ojos
• Espina dorsal
Sin un tratamiento adecuado y tras repetidas • Músculo psoas.
hemorragias en una misma articulación la • Mucosas: las más frecuentes son las epistaxis,
membrana sinovial sangrará más fácilmente cada gingivorragias, las secundarias a heridas por
vez y los restos de sangre que se van depositando mordedura de la lengua o a la caída de la
en la articulación van dañando los tejidos, se deja primera dentición.
de producir el líquido sinovial y el roce de los • La hematuria o sangre en la orina es común en
huesos ocasiona el deterioro parcial o total de la Hemofilia severa, aunque pocas veces es
articulación. Esta situación que puede llegar a una peligrosa.
discapacidad de mayor o menor grado de
severidad se conoce como artrosis o artropatía
hemofílica, que puede llegar a ser invalidante. La Diagnóstico:
articulación se torna rígida, dolorosa al moverla e Se puede pensar o sospechar en el
inestable. Se vuelve todavía más inestable a diagnóstico de hemofilia ante enfermos con
medida que los músculos que la rodean se hemorragias espontáneas o secundarias a
debilitan. traumatismos, especialmente si aparecen en las
Estas hemorragias se producen, primeras etapas de la vida o en el momento del
fundamentalmente, en: nacimiento.
o Rodilla: 44%
o Codo: 25% La evaluación detallada de los antecedentes
o Tobillo: 15% hemorrágicos del paciente y de su familia será una
o Hombro: 8% ayuda importante para orientar el correcto
o Cadera: 5% diagnóstico de hemofilia.
o Otras localizaciones: en 3% de los casos.
A continuación se lleva a cabo un análisis de
• Músculos: ocurre cuando los capilares de los sangre:
músculos se lesionan. Se producen 1. Tiempo parcial de tromboplastina activado
espontáneamente, por traumatismos directos o (PTTa): se encuentra prolongado. Cifras
por esguinces en ejercicios violentos. En una normales: 30-60 seg.
hemorragia muscular el músculo se torna rígido 2. Consumo de protrombina: acortado.
y dolorido. Se produce inflamación, calor y 3. Tiempo de coagulación: normal o
dolor al tacto, apareciendo moretones si es muy prolongado, el tiempo de hemorragia,
superficial y si por el contrario es muy profunda concentración de fibrinógeno y el tiempo de
podría producirse presión sobre nervios o protrombina son normales.
arterias causando hormigueo y 4. Determinación de los niveles del factor,
adormecimiento. El resultado final suele ser un hace el diagnóstico.
espasmo muscular. Las hemorragias
musculares suelen ocurrir en pantorrillas, Tratamiento
muslos y parte superior de los brazos. Para hemofilia A
• Administración de crioprecipitado o
• Aparato digestivo: son producidas por lesiones concentrado liofilizado.
digestivas diversas típicamente hemorrágicas: • Administración IV de concentrados de factor
hernia de hiato, ulcus, varices esofágicas, VIII.
tumores y enfermedades ulcerativas como la • Los concentrados utilizados de factores pueden
enfermedad de Crohn y la colitis ulcerosa. Se ser plasmáticos o recombinantes, ambos
ponen de manifiesto por la presencia de sometidos a procesos de inactivación viral.
hematemesis, melenas y rectorragias.
Para hemofilia B
• Plasma fresco • Neoplasias: fundamentalmente las leucemias
• Administración de factor IX por IV. agudas promielocíticas. Recordar la variedad
• Los concentrados de factor IX contienen varias de CID crónica en el resto de neoplasias.
proteínas, incluyendo factores de coagulación • Fenómenos autoinmunes.
activados que, al parecer, contribuyen al peligro • Traumas masivos.
de trombosis con su uso repetido. Por este
motivo, hay que tener cuidado al utilizarlos. Manifestaciones clínicas
Están determinadas muchas veces por la
Deficiencias congénitas de factores de condición desencadenante de la CID, en pacientes
coagulación críticamente enfermos.
Son poco frecuentes, cuando no se dispone de
concentrado de factor específico y se produce un Los signos más frecuentes son de tipo
sangrado importante la reposición se debe hacer hemorrágico, destacando el púrpura y petequias.
con plasma. En los pacientes sometidos a cirugía o trauma, el
sangrado de los sitios comprometidos y sitios de
Trastornos congénitos protrombóticos. punción es otro hallazgo frecuente.
Casi todos ellos son autosómicos dominantes.
Pueden ocasionarse procesos protrombóticos También puede manifestarse por trombosis de
primarios en las disfibrinogenemias, deficiencia de la microcirculación que afecta la función renal,
proteína C y S, deficiencia de antitrombina III, pulmones (síndrome de distress respiratorio del
factor V Leiden, hiperhomocisteinemia, exceso de adulto) y cerebro. Las lesiones necróticas de la piel
factores de coagulación e inhibidores de fibrinolisis pueden ser frecuentes y su manifestación más
y la alteración genética Protrombina. severa es la púrpura fulminante que se puede
observar en la meningococcemia.
La deficiencia de ATIII es el trastorno con
mayor riesgo relativo de trombosis. Estos estados Laboratorio
protrombóticos con frecuencia precisan de un • Trombopenia.
factor desencadenante adquirido (embarazo, • Prolongación de los tiempos de hemorragia,
puerperio, anovulatorios) para que se produzca el protrombina, tromboplastina parcial y trombina.
evento tromboembólico, que generalmente tiene • Descenso del fibrinógeno y de todos los
lugar en territorios venosos similares a los de la factores de la coagulación.
población general, aunque es típica su aparición en • Disminución de la antitrombina III (que se
localizaciones peculiares como las venas consume en un intento de frenar el exceso de
mesentéricas. coagulación).
• Incremento de PDF (productos de degradación
Coagulación intravascular diseminada de la fibrina) y fibrinopéptido A.
Definición:
La CID es una aceleración del proceso de Tratamiento
coagulación en la circulación dinámica, con la • Control de la causa: es uno de los elementos
utilización de los factores de coagulación, más importantes ya que la exposición
plaquetas y proteínas anticoagulantes. Las prolongada a agentes desencadenantes puede
consecuencias son un amplio depósito agravar la CID.
intravascular de fibrina que conduce a la • Terapia de reemplazo: El consumo de factores
obstrucción de microvasos ocasionando isquemia y de coagulación puede ser corregido con
necrosis de los tejidos, un estado hemorrágico crioprecipitados, concentrados de plaquetas y
generalizado y el desarrollo de anemia hemolítica. plasma fresco congelado. Esta terapia puede
Con activación secundaria de la fibrinólisis. reducir la tendencia al sangrado. La terapia con
plasma fresco o crioprecipitados, aporta tanto
Etiología. factores procoagulantes como anticoagulantes
• Infecciones, sobre todo sepsis por naturales.
gramnegativos. • Inhibir las proteasas de la coagulación: la
• Problemas obstétricos: retención de feto inhibición de la trombina es fundamental en el
muerto, embolismo de líquido amniótico, aborto tratamiento de la CID. Una de las formas de
séptico, toxemia del embarazo. inhibir las proteasas es con el uso de heparina,
sin embargo ésta puede agravar seriamente la
hemorragia de muchos pacientes.
µg/ml; intervalo de 0,35-1,29; norma: <0,50 µg/ml)
en los pacientes infectados por SARS-CoV-2 que
Introducción se recuperaron en comparación con la de los
pacientes que acabaron falleciendo a causa de la
La COVID-19 es una enfermedad provocada por el enfermedad (2,12 µg/ml; 0,77-5,27).9 En otro
nuevo coronavirus SARS-CoV-2.1,2 La mayoría de ensayo, los autores chinos señalaron que en los
los pacientes con COVID-19 presentan síntomas pacientes infectados por SARS-CoV-2 ingresados
de infección del aparato respiratorio. Algunos en la unidad de cuidados intensivos (UCI), la
casos progresan a una enfermedad sistémica de concentración mediana de dímero D fue superior
curso grave que se caracteriza por fiebre resistente (diferencia clínicamente relevante, 2,4 mg/l; 0,6-
a tratamiento, daño pulmonar agudo con síndrome 14,4) que en los pacientes infectados por SARS-
de dificultad respiratoria aguda (SDRA), fallo CoV-2 no ingresados en la UCI (0,5 mg/l; 0,3-0,8; p
multiorgánico (FMO), shock y una mortalidad = 0,0042).10 En un estudio de cohortes
elevada.3 retrospectivo de pacientes con COVID-19
hospitalizados, los autores chinos demostraron que
Gracias al seguimiento estrecho de los pacientes una concentración de dímero D >1 mg/l al ingresar
con COVID-19, se ha observado que muchos de en el hospital estuvo asociada a un riesgo de
ellos presentaban resultados anómalos en las muerte 18 veces mayor (IC 95 %: 2,6-128,6; p =
pruebas de coagulación sanguínea que recordaban 0,0033).11
a los de otras coagulopatías sistémicas, como la
coagulación intravascular diseminada (CID) o las Según las recomendaciones de la International
microangiopatías trombóticas (MAT).4 También ha Society on Thrombosis and Haemostasis (ISTH),
sido posible constatar con rapidez que, al mismo los pacientes infectados por SARS-CoV-2 con un
tiempo, la coagulopatía asociada a la COVID-19 incremento importante de la concentración de
posee características que la distinguen de las CID dímero D en sangre (definido como 3-4 veces
y las MAT.5 mayor que el límite superior de la normalidad)
deben hospitalizarse aunque no presenten otros
Otro hallazgo muy importante en los pacientes con síntomas de la infección.12
COVID-19 de curso grave es la tendencia a sufrir
complicaciones tromboembólicas en los sistemas Los autores chinos han señalado que el tiempo de
venoso y arterial.6 Principalmente se han protrombina (TP) medido al hospitalizar a los
subrayado las complicaciones trombóticas en la pacientes fue ligeramente mayor en los pacientes
circulación pulmonar, lo que se ha denominado con COVID-19 que acabaron falleciendo (15,6 s;
como coagulación intravascular pulmonar 14,4-16,3) que en los pacientes que sobrevivieron
o coagulopatía intravascular pulmonar.7 A su vez, (13,6 s; 13,0-14,3); intervalo de valores normales
esto ha suscitado preguntas sobre el papel del TP en este ensayo: 11,5-14,5 s.9 En el
potencial de los anticoagulantes y su dosificación momento de la hospitalización, el TP fue
óptima en la prevención y el tratamiento de los ligeramente superior en los pacientes ingresados
pacientes con COVID-19. en la UCI (12,2 s; 11,2-13,4) que en los pacientes
con COVID 19 que no necesitaron tratamiento en
En este artículo se resumen las observaciones la UCI (10,7; 9,8-12,1).10 Los expertos de la ISTH
sobre los trastornos de la hemostasia en la COVID- desaconsejan presentar los resultados de las
19. determinaciones del TP en forma de cociente
internacional normalizado (INR), dado que las
Parámetros de laboratorio de la hemostasia en diferencias sutiles en su magnitud se tornan
imperceptibles al convertir el TP en INR.12
los pacientes con COVID-19
Considerando los datos anteriores sobre el TP, la
La desviación de la norma más característica en ISTH recomienda determinar el TP en todos los
las pruebas de laboratorio de la hemostasia de los pacientes con COVID-19.12
pacientes con COVID-19 ingresados es la
concentración elevada del dímero D. En un ensayo Según los estudios publicados hasta la fecha,
realizado en China, se observó una concentración la trombocitopenia —definida como una
elevada de dímero D en 260 de los 560 (46 %) reducción del recuento plaquetario en sangre <100
enfermos con COVID-19.8 En otro ensayo chino, la 000/µl— solo se observa en un 5 % de los
concentración media de dímero D fue menor (0,61 pacientes infectados por SARS-CoV-2 en el
momento de la hospitalización.10 En un 70-95 % de pruebas recomendadas en los pacientes con
los pacientes con COVID-19 de curso clínico más COVID-19 tratados en el hospital.14,15
grave, el recuento de plaquetas fue de <150 000/µl.
El metaanálisis de 9 ensayos ha demostrado que el En otro ensayo también se determinó la actividad
recuento plaquetario es menor (diferencia de la antitrombina en los pacientes con COVID-
estadísticamente relevante) en las infecciones por 19.9 Los valores de este parámetro fueron menores
SARS-CoV-2 de curso clínico grave, y que la en los pacientes que acabaron falleciendo que en
reducción del número de plaquetas en sangre se los supervivientes, pero fue muy raro que bajara
correlaciona con un aumento de la mortalidad en del límite inferior de la normalidad. El tiempo de
los pacientes con COVID-19.13 trombina (TT) puede alargarse a medida que
incrementa la coagulopatía.
Por el momento, el papel de la trombocitopenia
como factor pronóstico en el curso de la COVID-19 Según las guías de la ISTH es necesario
no está claro. Sin embargo, la ISTH recomienda determinar la concentración inicial de dímero D, el
determinar el recuento de plaquetas de todos los TP y el recuento de plaquetas en todos los
pacientes con COVID-19 hospitalizados.12 pacientes contagiados por SARS-CoV-2, ya que
los resultados de estas pruebas pueden ayudar
La concentración media de fibrinógeno en las a decidir si la hospitalización es necesaria
personas infectadas por SARS-CoV-2 suele oscilar o no.12 Asimismo, pueden facilitar la evaluación
alrededor del límite superior de la normalidad, lo preliminar del riesgo de curso grave de la infección
que con más probabilidad se debe al proceso por SARS-CoV-2 y de muerte. Si los resultados
inflamatorio en curso. Sin embargo, muchos mostraran anomalías considerables, podría ser
pacientes con COVID-19 hospitalizados en centros necesario administrar anticoagulantes a pesar de
chinos presentaron una reducción repentina de la que no haya indicaciones clínicas concluyentes
concentración de fibrinógeno <1,0 g/l poco antes para su uso. Al interpretar los resultados de estas
de morir.9 pruebas de laboratorio, se deben considerar los
distintos factores de interferencia, como la
Los expertos de la ISTH no han apuntado a la anticoagulación crónica por indicaciones distintas
necesidad de determinar la concentración de a la COVID-19 o una enfermedad hepática crónica
fibrinógeno en todos los pacientes con COVID-19 con trastornos secundarios del sistema de
en el momento de la hospitalización.12 No obstante, coagulación.
como la prueba es fácil de realizar, su
disponibilidad es amplia y es útil en el posterior En los pacientes hospitalizados con COVID-19,
seguimiento del sistema hemostático durante la sobre todo en aquellos con infección de curso
hospitalización, muchos autores opinan que este grave, es imprescindible monitorizar
parámetro también se debería considerar a la hora sistemáticamente los parámetros de la hemostasia.
de evaluar la hemostasia de los pacientes La agudización de la trombocitopenia, el aumento
hospitalizados con COVID-19.14 de la concentración de dímero D, la prolongación
del TP y el empeoramiento de la
Otra prueba de laboratorio de la hemostasia de hipofibrinogenemia pueden indicar el desarrollo de
acceso generalizado es el tiempo de la CID. En un ensayo chino, un 71,4 % de los
tromboplastina parcial después de la pacientes con COVID-19 que fallecieron habían
activación (TTPa), que refleja el proceso de desarrollado CID, por tan solo un 0,6 % de los
coagulación dependiente de los factores de pacientes con COVID-19 que sobrevivieron.9
coagulación de la vía intrínseca (factores de
coagulación XII, XI, IX y VIII) y la vía común Tabla 1. Sistema de puntos para el diagnóstico
(factores de coagulación X, V, II y I). En el estudio de la CID aguda y la CIS
de Tang y cols., el TTPa fue más largo en el grupo Parámetro Puntos CID aguda CIS
de pacientes con COVID-19 que fallecieron que en Recuento 2 <50 000/µl <100
el grupo de supervivientes, aunque la diferencia no plaquetario 000/µl
fue estadísticamente importante.9 Los expertos de 1 ≥50 000/µl, ≥100
la ISTH no consideran que al APTT como una <100 000/µl 000/µl,
prueba que se deba realizar en todos los pacientes <150
hospitalizados con COVID-19.12 No obstante, en 000/µl
otros trabajos, el TTPa se incluye en la lista de
FDP/dímero D 3 Aumento –
significativo prolongado indica déficits de los factores de
2 Aumento – coagulación que se habían consumido para formar
indirecto los coágulos. La insuficiencia orgánica
Tiempo de 2 ≥6 s INR >1,4 concomitante (principalmente medular, hepática,
protrombina 1 ≥3 s, pero <6 INR >1,2, esplénica y renal) influye tanto en el curso clínico
prolongado s pero ≤1,4 de la CID como en la dinámica de los cambios en
los parámetros de laboratorio.
Fibrinógeno 1 <100 g/ml –
Escala SOFA 2 – ≤2
La idea de diferenciar la CIS se basa en la
modificada 1 – 1 convicción de los expertos, apoyada por resultados
(puntuación)
de ensayos clínicos, de que la administración de
Puntuación total de la CID ≥5 ≤4 anticoagulantes en la etapa de CIS puede influir
aguda o la CIS positivamente en el curso posterior de la
CID — coagulación intravascular diseminada, CIS enfermedad, mientras que las ventajas de añadir
— coagulopatía inducida por sepsis, FDP — anticoagulantes una vez se haya desarrollado la
productos de degradación de la fibrina, INR — CID aguda con insuficiencia multiorgánica
cociente internacional normalizado, SOFA — concomitante son, como mucho, dudosas.17 En
evaluación de fallo orgánico secuencial (incluye este sentido, conviene señalar cuatro cuestiones.
4 componentes: aparato respiratorio, sistema En primer lugar, los beneficios de administrar
cardiovascular, hígado y riñones) anticoagulantes en pacientes con sepsis que no
hayan desarrollado aún CIS son dudosos; en otras
palabras: el mejor momento para administrar la
anticoagulación parece ser cuando empieza
a desarrollarse la coagulopatía inducida por sepsis
Sepsis, CIS, CID (CIS), y no cuando solo haya sepsis o ya con una
CID aguda totalmente desarrollada. Por otro lado,
En el curso de todas las infecciones graves se se debe diferenciar la administración de
produce una activación secundaria de la anticoagulantes para prevenir la progresión de CIS
coagulación sanguínea. Se trata de una reacción a CID de la profilaxis de la enfermedad
defensiva típica del cuerpo, que "utiliza" el sistema tromboembólica venosa (ETV). La profilaxis
hemostático para detener la propagación de farmacológica de la ETV se debe considerar en
microorganismos. En situaciones extremas en las todos los pacientes hospitalizados por una
que la activación de la coagulación sanguínea se enfermedad aguda de medicina interna o que
descontrola y no responde a los mecanismos necesiten tratamiento en la UCI (la contraindicación
endógenos de anticoagulación, y la reacción más importante a la anticoagulación es el riesgo
inflamatoria aguda generalizada provoca un daño alto o la presencia de una hemorragia clínicamente
endotelial vascular extenso, como consecuencia de relevante). Además de la heparina no fraccionada
una infección grave se puede producir una (HNF) y de bajo peso molecular (HBPM), se están
coagulación intravascular diseminada aguda con probando otros fármacos para prevenir la
una isquemia tisular secundaria que conduce al progresión de CIS a CID, como la trombomodulina
desarrollo de una insuficiencia multiorgánica. La y la antitrombina.17 Sin embargo, cabe subrayar
etapa intermedia entre la activación de la que estos dos fármacos se utilizan con esta
coagulación en el curso de la infección y la CID indicación casi exclusivamente en Japón, mientras
aguda es la coagulopatía inducida por sepsis (CIS). que en Europa y Norteamérica siguen siendo más
En la tabla 1 se presenta el sistema de puntos para populares la HNF y la HBPM Por último, aunque en
el diagnóstico de la CID aguda y la CIS propuesto la prevención de la ETV se administren HNF y
por el Scientific and Standardization Committee on HBPM a dosis profilácticas, en la CIS se
Perioperative and Critical Care of the recomienda considerar la administración de
ISTH.16,17 Resumiendo lo más posible: la heparinas a dosis terapéuticas.17
trombocitopenia se debe a un secuestro
plaquetario en microcoágulos, el aumento de
concentración de dímero D apunta a un exceso de
fibrina polimerizada en el espacio intra- y
extravascular, la hipofibrinogenemia se produce
como consecuencia del gasto de fibrinógeno para
formar microcoágulos, y el tiempo de protrombina
También podría gustarte
- Seminario. HemostasiaDocumento7 páginasSeminario. HemostasiaNikol RodriguezAún no hay calificaciones
- Trastornos de La HemostasiaDocumento12 páginasTrastornos de La Hemostasiaarios_409594Aún no hay calificaciones
- Hemostasia clínica: fases, factores plasmáticos y coagulaciónDocumento8 páginasHemostasia clínica: fases, factores plasmáticos y coagulaciónlaura marina melero aanchezAún no hay calificaciones
- Hemostasia y CoagulaciónDocumento29 páginasHemostasia y CoagulaciónMendoza Rodríguez Danna MichelleAún no hay calificaciones
- Factores de Coagulación (Exposición)Documento26 páginasFactores de Coagulación (Exposición)Henry AlvaradoAún no hay calificaciones
- Trabajo CoagulacionDocumento17 páginasTrabajo CoagulacionmariluAún no hay calificaciones
- Fármacos Anticoagulantes, Tombolíticos y AntiplaquetariosDocumento13 páginasFármacos Anticoagulantes, Tombolíticos y AntiplaquetariosJaidaly Andreina Avila MedinaAún no hay calificaciones
- Factores coagulación procesoDocumento18 páginasFactores coagulación procesoFernando MedinaAún no hay calificaciones
- Presentacion. COAGULACION.2Documento20 páginasPresentacion. COAGULACION.2Janacua Figueroa DianaAún no hay calificaciones
- Vías y Factores de La CoagulaciónDocumento9 páginasVías y Factores de La CoagulaciónCalderón Vaca ChristianAún no hay calificaciones
- Fase PlasmáticaDocumento5 páginasFase PlasmáticaIgnacio Zahid Osuna SosaAún no hay calificaciones
- Hemostasia, Hemorragia Quirúrgica y TransfusiónDocumento12 páginasHemostasia, Hemorragia Quirúrgica y TransfusiónMario SalazarAún no hay calificaciones
- Cascada de Coagulación - Luis Fernando Guzmán GuzmánDocumento7 páginasCascada de Coagulación - Luis Fernando Guzmán GuzmánLuis Fernando Guzman GuzmanAún no hay calificaciones
- HemostasiaDocumento16 páginasHemostasiajhosfrannyramirez100% (1)
- Objetivos 9 y 10 Discu FisioDocumento4 páginasObjetivos 9 y 10 Discu FisioEric CalderónAún no hay calificaciones
- Hemostasia - SeminarioDocumento16 páginasHemostasia - SeminarioJose LaizaAún no hay calificaciones
- HEMOSTASIA - GUIA PRÁCTICADocumento18 páginasHEMOSTASIA - GUIA PRÁCTICAAlan J. GraciaAún no hay calificaciones
- Coagulacion Sanguinea-grupo Sanguineos 2Documento75 páginasCoagulacion Sanguinea-grupo Sanguineos 2heyitsadry2112Aún no hay calificaciones
- Monografia Cascada de Coagulacion PresentacionDocumento20 páginasMonografia Cascada de Coagulacion PresentacionJohnxito AjotaAún no hay calificaciones
- Hemostasia PDFDocumento11 páginasHemostasia PDFM Cristina Pg100% (1)
- CoagulaciónDocumento18 páginasCoagulaciónAnildibethAún no hay calificaciones
- Hemostasia y Trombosis AnatopatoDocumento10 páginasHemostasia y Trombosis Anatopatoss501100% (1)
- Practica de Homeostasia y CoagulaciónDocumento6 páginasPractica de Homeostasia y CoagulaciónnicolehurtadosAún no hay calificaciones
- Factor de CoagulaciónDocumento19 páginasFactor de CoagulaciónMario OliveraAún no hay calificaciones
- Guia de HematologiaDocumento54 páginasGuia de HematologiaSonia Itza SamaniegoAún no hay calificaciones
- 2 - HemostasiaDocumento31 páginas2 - Hemostasiacarelia2Aún no hay calificaciones
- Sistema de CoagulaciónDocumento11 páginasSistema de CoagulaciónCarolina TolosaAún no hay calificaciones
- La Cascada de CoagulaciónDocumento10 páginasLa Cascada de CoagulaciónCinthia Chalaco100% (1)
- Hemostasia, Coagulacion, Fibrinolisis y AnticougulantesDocumento15 páginasHemostasia, Coagulacion, Fibrinolisis y AnticougulantesEvelynn GarcíaAún no hay calificaciones
- Cascada de La CoagulacxiónDocumento5 páginasCascada de La Coagulacxióngabicita2002Aún no hay calificaciones
- Cascada EnzimaticaDocumento5 páginasCascada EnzimaticaDaniela VargasAún no hay calificaciones
- CoagulaciónDocumento21 páginasCoagulaciónYuderkis Moreno RamirezAún no hay calificaciones
- Práctica 4 Pruebas de CoágulaciónDocumento11 páginasPráctica 4 Pruebas de CoágulaciónSandy MoralesAún no hay calificaciones
- Mecanismos de La HemostasiaDocumento18 páginasMecanismos de La HemostasiaAndres PelayoAún no hay calificaciones
- HEMOSTASIADocumento13 páginasHEMOSTASIARAFAEL OLIVA100% (1)
- Fisiología de La CoagulacionDocumento7 páginasFisiología de La CoagulacionGaby GallegosAún no hay calificaciones
- httpseva.uca.edu.arpluginfile.php4320537mod_resourcecontent0Hemostasia20UCA.pdf 6Documento22 páginashttpseva.uca.edu.arpluginfile.php4320537mod_resourcecontent0Hemostasia20UCA.pdf 6Francesca R. BettucciAún no hay calificaciones
- Vías extrínseca e intrínseca de la coagulación (40Documento3 páginasVías extrínseca e intrínseca de la coagulación (40william ramosAún no hay calificaciones
- Coagulación - Wikipedia, La Enciclopedia LibreDocumento101 páginasCoagulación - Wikipedia, La Enciclopedia LibreLuisa LópezAún no hay calificaciones
- Pdfsrmacma 2017cmas172b PDFDocumento3 páginasPdfsrmacma 2017cmas172b PDFkzzb98wyfvAún no hay calificaciones
- Hemostasia SecundariaDocumento7 páginasHemostasia SecundariamairaAún no hay calificaciones
- TrazaDocumento12 páginasTrazaagelAún no hay calificaciones
- TAH05 ContenidosDocumento8 páginasTAH05 ContenidosLucy ÑaaAún no hay calificaciones
- Hemostasia SecundariaDocumento26 páginasHemostasia SecundariaMonserrat Duarte MunozAún no hay calificaciones
- Cascada de La Cuagulacion y Anemia - Irm GuamancelaDocumento10 páginasCascada de La Cuagulacion y Anemia - Irm GuamancelaCristian Geovanny GuamancelaAún no hay calificaciones
- T4 - Ciru - Hemostasia y Transfusion SanguineaDocumento14 páginasT4 - Ciru - Hemostasia y Transfusion SanguineaPablo Segales BautistaAún no hay calificaciones
- Diatesis HemorragicaDocumento9 páginasDiatesis HemorragicaAlexis M-cAún no hay calificaciones
- Función de Plaquetas y HemostasiaDocumento4 páginasFunción de Plaquetas y HemostasiaPaúl de Jesús Usquiano CastroAún no hay calificaciones
- HemostasiaDocumento2 páginasHemostasiaKarina Laura MastroleoAún no hay calificaciones
- CoagulaciónDocumento19 páginasCoagulaciónRazo MateoAún no hay calificaciones
- Tema 2: Alteraciones de La Hemostasia: Diátesis Hemorrágica Y Diátesis TrombóticaDocumento11 páginasTema 2: Alteraciones de La Hemostasia: Diátesis Hemorrágica Y Diátesis TrombóticaMarina Navarro SavallAún no hay calificaciones
- Cascada de La Coagulacion y Pruebas TP y TTPDocumento9 páginasCascada de La Coagulacion y Pruebas TP y TTPLiiz VazquezAún no hay calificaciones
- Expo Farmacología TVPDocumento8 páginasExpo Farmacología TVPIsabella NegreteAún no hay calificaciones
- Higado en Cascada de CoagulaciónDocumento26 páginasHigado en Cascada de CoagulaciónGemma Fernández100% (4)
- Definición y mecanismos de la hemostasiaDocumento11 páginasDefinición y mecanismos de la hemostasiaBetsabe Corpa AlegriaAún no hay calificaciones
- FIBRINOLITICOSDocumento32 páginasFIBRINOLITICOSElton Eduardo Martínez MartínezAún no hay calificaciones
- Factores de CoagulaciónDocumento7 páginasFactores de CoagulaciónErnesto DavidAún no hay calificaciones
- Fisiopatología de Los Trastornos de La Coagulación 2007Documento16 páginasFisiopatología de Los Trastornos de La Coagulación 2007api-3742102100% (5)
- Coagulación Para Todos: Medicina Para TodosDe EverandCoagulación Para Todos: Medicina Para TodosCalificación: 4.5 de 5 estrellas4.5/5 (3)
- Anemia Para Todos: Medicina Para TodosDe EverandAnemia Para Todos: Medicina Para TodosCalificación: 3 de 5 estrellas3/5 (1)
- Sindrome AnemicoDocumento10 páginasSindrome Anemicoarios_409594Aún no hay calificaciones
- Linfoproliferativo CompletoDocumento13 páginasLinfoproliferativo Completoarios_409594Aún no hay calificaciones
- Hematologia CuestionarioDocumento16 páginasHematologia Cuestionarioarios_409594Aún no hay calificaciones
- LinfoproliferativoDocumento25 páginasLinfoproliferativoarios_409594Aún no hay calificaciones
- ANEMIA Resumen.Documento12 páginasANEMIA Resumen.Egly TuarezAún no hay calificaciones
- Examen 2Documento1 páginaExamen 2arios_409594Aún no hay calificaciones
- Síndrome nefrótico: proteinuria, edema y alteracionesDocumento7 páginasSíndrome nefrótico: proteinuria, edema y alteracionesarios_409594Aún no hay calificaciones
- Aborto DeontologiaDocumento6 páginasAborto Deontologiaarios_409594Aún no hay calificaciones
- Tétanos NeonatalDocumento3 páginasTétanos Neonatalarios_409594Aún no hay calificaciones
- Escala de Coma de Glasgow pediátrica (ECGDocumento1 páginaEscala de Coma de Glasgow pediátrica (ECGarios_409594Aún no hay calificaciones
- Definiciones hematológicasDocumento4 páginasDefiniciones hematológicasarios_409594Aún no hay calificaciones
- Contenido de Examen Fisico de Abdomen y GenitalesDocumento1 páginaContenido de Examen Fisico de Abdomen y Genitalesarios_409594Aún no hay calificaciones
- Angina de PechoDocumento5 páginasAngina de Pechoestoysolo1829936Aún no hay calificaciones
- Omisión de TheDocumento2 páginasOmisión de TheDiego C.Aún no hay calificaciones
- Uso Del of en InglésDocumento10 páginasUso Del of en InglésDiego C.Aún no hay calificaciones
- Pruebas de HemostasiaDocumento38 páginasPruebas de Hemostasiasteve inga pomaAún no hay calificaciones
- preguntas-hematologiaDocumento28 páginaspreguntas-hematologiaMarioAún no hay calificaciones
- HemostasiaDocumento1 páginaHemostasiaKaren PérezAún no hay calificaciones
- Coagulopatias U 2Documento30 páginasCoagulopatias U 2ItzelGrpAún no hay calificaciones
- Curso y Operacion Del CoagDocumento40 páginasCurso y Operacion Del CoagajolotasoAún no hay calificaciones
- Hemofilia y Trastornos de La CoagulacionDocumento64 páginasHemofilia y Trastornos de La CoagulacionJessica AlegríaAún no hay calificaciones
- Plasma Control Normal CoagulaciónDocumento3 páginasPlasma Control Normal CoagulaciónJose Andrés Parra LealAún no hay calificaciones
- Nueva Cascada de La CoagulacionDocumento3 páginasNueva Cascada de La Coagulacionsusana1616Aún no hay calificaciones
- Hemostasia: Coagulación: Fases de La HemostasiaDocumento6 páginasHemostasia: Coagulación: Fases de La HemostasiaJoel E. GalíndezAún no hay calificaciones
- INFORME Recuento de Plaquetas y El Perfil de CoagulaciónDocumento11 páginasINFORME Recuento de Plaquetas y El Perfil de CoagulaciónHedén VegaAún no hay calificaciones
- Trombofilias Hereditarias.. El Perfil de PruebasDocumento7 páginasTrombofilias Hereditarias.. El Perfil de PruebasAngela MontañoAún no hay calificaciones
- Factores de CoagulaciónDocumento36 páginasFactores de CoagulaciónKaren Veronica Garzon SalazarAún no hay calificaciones
- Libro COAGULACIOìN-Cap01 Coagulacion y Modelo Celular CMMDocumento16 páginasLibro COAGULACIOìN-Cap01 Coagulacion y Modelo Celular CMMvaneyheAún no hay calificaciones
- Pruebas de CoagulaciónDocumento1 páginaPruebas de CoagulaciónAreli Yuliana GarcíaAún no hay calificaciones
- Interpretación CoagulacionDocumento13 páginasInterpretación CoagulacionAngie pissaAún no hay calificaciones
- TTP K BenkDocumento1 páginaTTP K BenkVanessa CornejoAún no hay calificaciones
- Cuestionario CoagulacionDocumento4 páginasCuestionario CoagulacionALEXANDER GONZALEZAún no hay calificaciones
- Hemofilia, PurpuraDocumento22 páginasHemofilia, PurpuraJessica Arenas DoblasAún no hay calificaciones
- CalicreínaDocumento12 páginasCalicreínaCinthya Merma CcanaAún no hay calificaciones
- Antígenos eritrocitarios: Grupos sanguíneos ABO y RhDocumento46 páginasAntígenos eritrocitarios: Grupos sanguíneos ABO y RhOscarAún no hay calificaciones
- Hemato Final PDFDocumento3 páginasHemato Final PDFSaid NiwdeAún no hay calificaciones
- Hemostasia Secundaria NC Feb 13Documento47 páginasHemostasia Secundaria NC Feb 13JosePallaresGarnica100% (1)
- HEMOSTASIADocumento35 páginasHEMOSTASIAmedun2009100% (4)
- Tiempo de ProtrombinaDocumento4 páginasTiempo de ProtrombinaPaola OrtegaAún no hay calificaciones
- Guia 15.2 Cuidado Enfermero Al Niño Con HemofiliaDocumento46 páginasGuia 15.2 Cuidado Enfermero Al Niño Con HemofiliaSindy RequejoAún no hay calificaciones
- Teoria Celular de La CoagulaciónDocumento17 páginasTeoria Celular de La CoagulaciónJenni Andrino VeAún no hay calificaciones
- Enfermedades Cualitativas de Las Plaquetas.Documento18 páginasEnfermedades Cualitativas de Las Plaquetas.guadalupe jacqueline aguilar perezAún no hay calificaciones
- TP TPT y FibrinogenoDocumento7 páginasTP TPT y FibrinogenoJorge Alejandro Saldivar NavaAún no hay calificaciones
- 4TO AC I GUIA 11 Retracción Del CoáguloDocumento2 páginas4TO AC I GUIA 11 Retracción Del CoáguloYadira JayaAún no hay calificaciones
- Coagulación SanguíneaDocumento42 páginasCoagulación SanguíneaSaira DurangoAún no hay calificaciones