Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Cushing Addison
Cargado por
vanessa0 calificaciones0% encontró este documento útil (0 votos)
16 vistas9 páginasTítulo original
CUSHING ADDISON
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
16 vistas9 páginasCushing Addison
Cargado por
vanessaCopyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 9
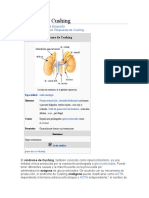
Enfermedad de Cushing
El síndrome de Cushing refleja una constelación de características clínicas que son
resultado de la exposición crónica al exceso de glucocorticoides de cualquier causa.
Clasificación
Hay dos tipos de síndrome de Cushing: el endógeno y el exógeno. El Cushing endógeno se
caracteriza por una producción de cortisol en exceso dentro del organismo, en tanto que el
Cushing exógeno se presenta como consecuencia de un factor externo al organismo,
usualmente el consumo de esteroides con función análoga a la del cortisol, como son los
esteroides que se utilizan para tratar enfermedades inflamatorias como el asma y la artritis
reumatoide; el Cushing exógeno es temporal y cede una vez se suspende la terapia con
esteroides. Por su parte, el síndrome de Cushing endógeno se puede clasificar a su vez en
dos formas principales:
1) La enfermedad puede ser dependiente de ACTH, causado principalmente por un
adenoma hipofisario corticotrofo, el cual representa el 80 al 85% de los casos. O por
la secreción ectópica de ACTH y en raras ocasiones, de hormona liberadora de
corticotropina (CRH) por tumores no hipofisarios como son el cáncer de pulmón de
células pequeñas, tumores carcinoides principalmente bronquiales, feocromocitoma
y otros. El término enfermedad de Cushing se refiere específicamente al síndrome
de Cushing ocasionado por un adenoma hipofisario corticotrofo.
2) La enfermedad puede ser independiente de ACTH, que corresponde al 15 o 20% de
casos restantes causado p. ej., adenoma corticosuprarrenal, carcinoma
corticosuprarrenal, hiperplasia suprarrenal nodular)
Epidemiología
En general, se considera que el síndrome de Cushing es una enfermedad poco común, que
se presenta con una incidencia de 1 a 2 por 100 000 habitantes por año. La enfermedad de
Cushing afecta con más frecuencia a las mujeres, con la excepción de los casos
prepuberales, donde es más común en jóvenes.
De manera global, la causa más común de síndrome de Cushing es el uso médico de
glucocorticoides para inmunodepresión o para el tratamiento de enfermedades
inflamatorias.
Etiología
Fisiopatología y Manifestaciones clínicas
En condiciones normales, neuronas de la porción parvocelular de los núcleos
paraventriculares del hipotálamo producen CRH, que actúa sobre los corticotropos de la
hipófisis anterior induciendo la liberación de la ACTH a partir de una molécula precursora
llamada proopiomelanocortina (POMC), de la cual también se deriva la hormona
estimulante de los melanocitos (MSH). La ACTH tiene una acción directa sobre la corteza
suprarrenal y estimula la producción de cortisol en la zona fasciculada y testosterona en la
zona reticular. Una vez liberado, el cortisol ejerce un efecto de retroalimentación negativa
en hipotálamo y en la hipófisis, permitiendo que se regulen las concentraciones hormonales
en la sangre.
En la enfermedad de Cushing acusada por un adenoma hipofisiario que produce ACTH en
exceso, hay hiperplasia de las suprarrenales y aumento en la producción de cortisol, el cual
suprime la liberación de CRH hipotalámica y la producción de ACTH por las células
hipofisiarias no tumorales.
En el síndrome de Cushing asociado a tumor ectópico, la neoplasia secreta ACTH en
grandes cantidades, estimulando la síntesis de cortisol y la hiperplasia adrenal, y se produce
un freno en la producción de CRH y de ACTH a nivel de hipotálamo e hipófisis,
respectivamente. En casos muy raros se produce CRH en vez de ACTH por parte del
tumor, causando estimulación directa de la hipófisis.
Los glucocorticoides afectan casi a todas las células del cuerpo y por lo tanto los signos de
exceso de cortisol impactan a múltiples sistemas fisiológicos con la regulación ascendente
de la gluconeogénesis, lipólisis y del catabolismo de las proteínas, lo que ocasiona las
características más prominentes.
Además, el exceso de la secreción de glucocorticoides sobrepasa la capacidad de 11β-
HSD2 para transformar con rapidez el cortisol a cortisona en el riñón, de este modo realiza
acciones mineralocorticoides, manifestadas como hipertensión diastólica, hipopotasemia y
edema. El exceso de glucocorticoides también interfiere con los sistemas regulatorios
centrales, ocasionando la supresión de gonadotropinas con el subsiguiente hipogonadismo y
amenorrea, así como la supresión del eje hipotálamo-hipófisis-tiroides, dando como
resultado disminución de la secreción de hormona estimulante de la tiroides (TSH, thyroid-
stimulating hormone).
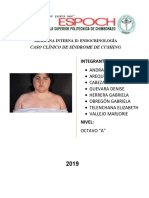
La mayor parte de los signos y síntomas clínicos observados en el síndrome de Cushing son
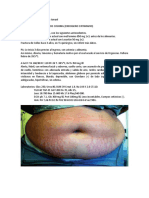
relativamente inespecíficos e incluyen características tales como obesidad (es la
característica más común, compromete cara, cuello, tronco y abdomen e internamente la
grasa del canal espinal y el mediastino. Las extremidades pueden encontrarse atróficas. El
exceso de tejido adiposo en la mejillas y la fosa temporal se manifiesta como cara de luna,
y en la zona dorsocervical como joroba de búfalo), diabetes, hipertensión diastólica,
hirsutismo y depresión, que se identifican con frecuencia en pacientes que no tienen
síndrome de Cushing. Por lo tanto, la valoración clínica minuciosa es un aspecto importante
de la valoración de los casos sospechosos. Se debe sospechar síndrome de Cushing cuando
en un mismo paciente se identifican varias características clínicas, en particular cuando se
encuentran características más específicas. Éstas incluyen fragilidad de la piel, con
hematomas fáciles y amplios (>1 cm), estrías violáceas y signos de miopatía proximal.
En el síndrome de secreción ectópica de ACTH, se pueden observar hiperpigmentación de
los nudillos, cicatrices o áreas de la piel expuestas al aumento de fricción y esto es
ocasionado por los efectos estimuladores del exceso de ACTH y otros productos del
desdoblamiento de la POMC sobre la producción de pigmentos de melanocitos.
El 75% de los pacientes tienen como complicación el síndrome metabólico, facilitado por la
estimulación de gluconeogénesis por el cortisol y la resistencia periférica a la insulina
asociada a la obesidad.
Los pacientes con síndrome de Cushing pueden estar en peligro de trombosis venosa
profunda, con incremento en el riesgo de embolia pulmonar por el estado de
hipercoagulación asociado con el síndrome de Cushing.
La mayoría de los pacientes también experimenta síntomas psiquiátricos, generalmente en
la forma de ansiedad o depresión, sin embargo también pueden presentarse psicosis
depresiva o paranoide aguda.
Diagnóstico
El primer paso más importante en el tratamiento de pacientes con sospecha de síndrome de
Cushing es establecer el diagnóstico correcto. La mayor parte de los errores en la
valoración clínica, que conducen a estudios de imagen o a cirugías innecesarias, se deben a
que no se sigue el protocolo diagnóstico
Este protocolo requiere establecer el diagnóstico de síndrome de Cushing más allá de
cualquier duda antes de emplear cualquier prueba para el diagnóstico diferencial de la
enfermedad. En un principio, después de excluir el uso de glucocorticoides exógenos como
la causa de los signos y síntomas clínicos, los casos sospechosos deben de ser valorados si
existen múltiples características progresivas de síndrome de Cushing, en particular
características con un valor de discriminación potencialmente elevado. En los pacientes con
síndrome de Cushing está indicado realizar estudios para descartar tumoraciones
suprarrenales incidentales
Se puede considerar como confirmado el diagnóstico de síndrome de Cushing cuando los
resultados de varias pruebas son compatibles con dicho trastorno. Estas pruebas pueden
incluir el incremento en la excreción de cortisol libre en orina de 24 h en tres muestras
separadas, la falla en la supresión adecuada del cortisol matutino después de una exposición
de toda la noche a dexametasona y la evidencia de la pérdida de la secreción del cortisol
diurno con elevadas concentraciones a la media noche, el momento de la menor secreción
fisiológica
Se deben excluir los factores que afectan potencialmente el resultado de estas pruebas
diagnósticas, tales como la recolección incompleta de la orina de 24 horas o la
desactivación rápida de la dexametasona a causa del consumo simultáneo de fármacos que
inducen al CYP3A4 (p. ej., antiepilépticos y rifampicina). El consumo simultáneo de
anticonceptivos orales que incrementa la CBG y por lo tanto el cortisol total, puede
ocasionar falla en la prueba de supresión con dexametasona. Si se tienen dudas, la prueba
debe ser repetida después de 4 a 6 semanas de haber suspendido la administración de
estrógenos
Tratamiento
El síndrome de Cushing manifiesto se asocia con un mal pronóstico si no se trata. En la
enfermedad independiente de ACTH, el tratamiento consiste en la extirpación quirúrgica
del tumor suprarrenal. Para tumores más pequeños, se puede utilizar un acceso de mínima
invasión, mientras que para tumores más grandes y en aquellos que se sospeche
malignidad, se prefiere un acceso abierto
La metirapona y el cetoconazol son los fármacos orales con eficacia establecida en el
síndrome de Cushing. La metirapona inhibe la biosíntesis de cortisol a nivel de la 11β-
hidroxilasa, mientras que el cetoconazol (un antimicótico) inhibe los pasos iniciales de la
esteroidogénesis. Las dosis iniciales típicas son 500 mg tres veces al día para metirapona
(dosis máxima, 6 g) y 200 mg tres veces al día para cetoconazol (dosis máxima, 1 200 mg).
El mitotano, un derivado del insecticida o,p´DDD, es un fármaco suprarrenolítico que
también es eficaz para reducir el cortisol. Por su perfil de efectos secundarios, se utiliza con
más frecuencia en el contexto del carcinoma suprarrenal, pero el tratamiento con dosis
bajas (500- 1 000 mg por día) también se ha utilizado en el síndrome de Cushing benigno.
En casos graves de exceso de cortisol, se puede utilizar etomidato para disminuir el cortisol.
Éste se administra en goteo IV continuo en dosis bajas no anestésicas.
Después de la extirpación exitosa de un tumor productor de cortisol o ACTH, el eje HPA
permanecerá suprimido. Por lo tanto, es necesario iniciar la sustitución con hidrocortisona
al momento de la cirugía y disminuirla lentamente después de la recuperación, para permitir
la adaptación fisiológica a las concentraciones normales de cortisol. Dependiendo del grado
y de la duración del exceso de cortisol, el eje HPA puede necesitar de muchos meses o
incluso años para recuperar su función normal.
Enfermedad de Addison
La enfermedad de Addison es un proceso de evolución lenta y progresiva, causado por la
oferta insuficiente de hormonas corticosuprarrenales a las demandas habituales del
organismo, que tiene su origen en la destrucción bilateral de la corteza suprarrenal.
La corteza suprarrenal posee una reserva funcional tal, que la sintomatología no comienza a
aparecer hasta la pérdida de un 90% o más del tejido adrenal. A partir de ahí, se inicia un
cuadro clínico larvado, salpicado por episodios intercurrentes llamados “crisis
addisonianas”, que no expresan sino la incapacidad de una glándula, ya en precario, para
satisfacer las necesidades periféricas ante situaciones de estrés, y que abandonada a su
propia evolución, pueden conducir a la muerte
Epidemiología
Tiene una incidencia de 0,83 por 100.000, con una prevalencia de 4-6 por 100.000. A
principios de siglo la etiología más frecuente era la tuberculosa; en la actualidad es la de
origen idiopático (70%), con una edad media de comienzo entre los 30-80 años y de 2 a 3
veces más frecuente en el sexo femenino.
Etiología
Fisiopatología y Manifestaciones Clínicas
1. Déficit de glucocorticoides.
—Síntomas físicos. La no existencia de niveles mínimos de cortisol evita que se realice el
feed-back hipófiso-hipotalámico, con lo que aumentará la producción de CRH-ACTH. Por
cada molécula de ACTH que se escinde de su precursor hipofisario, la pro-
opiomelanocortina, se produce otra molécula de b-lipotropina, que contiene una secuencia
melanocito estimulante, que junto a la ACTH, son responsables de la hiperpigmentación de
la piel y mucosas tan características de la enfermedad.
Por otro lado, el déficit de cortisol disminuye la gluconeogénesis, produciendo
hipoglucemia, astenia y fatigabilidad muscular. Aparece además hiporexia, con tendencia a
la ingesta de productos salados y a la hipodipsia, náuseas sin vómitos, hipo, eructos y
dolores abdominales, que en las crisis addisonianas pueden incluso remedar al abdomen
agudo. Puede haber diarrea, pero también son frecuentes la hipomotilidad y el
estreñimiento. En general, la mayoría de los síntomas del déficit glucocorticoideo son
inespecíficos y su aparición es insidiosa.
—Síntomas psíquicos. Están descritos fatiga mental, irritabilidad, inquietud, insomnio,
trastornos depresivos, e incluso a veces bipolares.
2. Déficit de mineralocorticoides.
A medida que se va destruyendo la zona glomerular, los niveles de renina plasmática y
angiotensina II, aumentan con el fin de mantener una secreción normal de aldosterona,
hasta que finalmente el grado de destrucción es tal que produce un déficit en la secreción de
mineralocorticoides. Entonces, la pérdida de sodio y agua por el hipoaldosteronismo
reinante, crea una situación de hipovolemia caracterizada por hipotensión arterial. La
hipotensión ortostática es más marcada en la insuficiencia suprarrenal primaria que en la
secundaria, y es el resultado de un descenso en la expresión de los receptores
catecolamínicos vasculares.
También aparecen síncope, taquicardia, palpitaciones, vértigo y avidez por la sal. En reposo
el pulso es normal, pero mínimos esfuerzos o emociones desencadenan taquicardias
desproporcionadas. El fallo cardíaco es inusual.
3. Déficit de andrógenos.
A la depleción de andrógenos se debe la pérdida del vello axilar y pubiano y la caída del
cabello, la oligomenorrea y la inhibición de la líbido en ambos sexos.
4. Otros síntomas.
Son infrecuentes, pero están descritos, la paraplejía espástica, la parálisis simétrica
ascendente, las calcificaciones del cartílago auricular y el signo de Rogoff (dolor en el
ángulo costovertebral).
Estudios complementarios/diagnóstico
1. Datos de laboratorio.
Lo más llamativo en el recuento celular, es una anemia normocítica y normocrómica.
En el Addison de naturaleza autoinmune, asociado a SPA II puede haber anemia
macrocítica por anticuerpos frente a células parietales y déficit de absorción de B12.
También aparece eosinofilia en un 8-10% de los pacientes y VSG elevada (5). Todos
estas alteraciones hematológicas revierten espontáneamente al corregir el trastorno
subyacente. El hipocortisolismo origina hipoglucemia. El hipoaldosteronismo produce
eliminación de sodio y agua y retención de potasio. En un 10-20% de los pacientes se
ha objetivado hipercalcemia
2. Estudio hormonal.
Existe una elevación característica de la ACTH (mayor de 50 pg/ml) como respuesta
hipofisaria a unos niveles de cortisol prácticamente imperceptibles (menores a 5 mg/dl),
aunque en las formas iniciales la cifra puede ser normal. Los 17-cetosteroides y 17-
hidroxicorticoesteroides están disminuidos en orina (menos de 3 mg/día). Están
descritas cinco pruebas de estimulación en el diagnóstico de la enfermedad de Addison,
pero tan sólo podemos considerar de utilidad a dos de ellas:
—Test de estimulación rápida con ACTH. Es útil pero no diagnóstico, en el sentido de
que una respuesta negativa al cortisol puede ser un Addison, pero también una
insuficiencia suprarrenal de origen hipofisario, que ha empezado a hacer atrofia
secundaria de la glándula.
—Test de estimulación prolongada con ACTH (3 días). Combinado con el anterior se
aproxima mucho al diagnóstico de la enfermedad, ya que, tras tres días de estimulación,
en el caso del Addison no se modifica la respuesta, pero sí en el caso de la atrofia de la
glándula, por insuficiencia de origen hipotalámico, en el que se evidencia un ascenso
paulatino de cortisol plasmático en los tres días
3. Diagnóstico inmunológico.
La determinación de anticuerpos antiadrenales en pacientes asintomáticos indica riesgo
de padecer la enfermedad. Unos niveles altos de ACTH con cortisol normal pudieran
expresar una resistencia corticoadrenal en las primeras fases de la enfermedad
autoinmune. El test estándar para detectar anticuerpos frente a la corteza adrenal (ACA)
es la inmunofluorescencia indirecta, con una sensibilidad del 70% y una especificidad
muy elevada en pacientes con adrenalitis autoinmune (4,5), más aún en pacientes con
Addison en el seno de un SPA II.
4. Electrocardiograma.
Las más frecuentes alteraciones electrocardiográficas son ondas T planas o invertidas,
bradicardia sinusal, alargamiento del QT y bajo voltaje. Aparece bloqueo AV de primer
grado en el 20% de los pacientes
Tratamiento
El tratamiento de la enfermedad de Addison consiste en la sustitución hormonal de los
glucocorticoides y mineralocorticoides que no se sintetizan. No debemos olvidar
aumentar las dosis de glucocorticoides de manera profiláctica ante situaciones de estrés,
como son infecciones, partos, cirugías, etc. para evitar las crisis addisonianas. El
tratamiento se realizará en pacientes sintomáticos, no en aquéllos en los que tan sólo se
aprecian anormalidades hormonales.
El fármaco de elección para el tratamiento sustitutivo del déficit hormonal es la
hidrocortisona o la cortisona, que presentan un efecto dual, tanto glucocorticoide como
mineralocorticoide. La dosis de mantenimiento es de 20-25 mg/día de hidrocortisona y
25-35 mg/día de cortisona, no olvidando la forma de administración fraccionada: 2/3
por la mañana y 1/3 por la tarde, emulando su ciclo circadiano. Pero la dosis se debe
reducir paulatinamente a la mínima capaz de mantener al paciente asintomático (sin
reducción de la fuerza física, etc.), con objeto de evitar los efectos adversos originados
por el uso de corticoides.
La alternativa terapéutica similar en resultados es la asociación de dexametasona (2,5-
7,5 mg/día) o de prednisona (0,25-0,75 mg/día) con un mineralocorticoide, por ejemplo
la fludrocortisona a dosis de 100 mg/día, pero que puede oscilar entre 50-200 mg/día
(0,05-0,1 mg/día)
También podría gustarte
- Síndrome de Cushing WikipediaDocumento5 páginasSíndrome de Cushing WikipediawinderAún no hay calificaciones
- Síndrome de CushingDocumento5 páginasSíndrome de CushingEstefania AlcalaAún no hay calificaciones
- Sindrome de CushingDocumento7 páginasSindrome de CushingGustavo Alejandro Castro100% (1)
- Monografía Sindrome de CushingDocumento15 páginasMonografía Sindrome de CushingAngélicaAún no hay calificaciones
- Sindrome de Cushing. 2020Documento10 páginasSindrome de Cushing. 2020Jeyson López100% (2)
- CushingDocumento20 páginasCushingAntonio SaavedraAún no hay calificaciones
- Enfermedad de CushingDocumento3 páginasEnfermedad de CushingAngelAdanCastilloAún no hay calificaciones
- Síndrome de CushingDocumento51 páginasSíndrome de CushingDiana SofíaAún no hay calificaciones
- Síndrome de CushingDocumento4 páginasSíndrome de CushingValentina Gelves CardenasAún no hay calificaciones
- Sindrome de CushingDocumento4 páginasSindrome de CushingRuperto FloresAún no hay calificaciones
- Sindrome de CushingDocumento5 páginasSindrome de CushingAriel Siervo de DiosAún no hay calificaciones
- Enfermedades de La Glándula Suprarrenal (Carlos Hernández)Documento12 páginasEnfermedades de La Glándula Suprarrenal (Carlos Hernández)Victor MonsalveAún no hay calificaciones
- Síndrome de Cushing PDFDocumento4 páginasSíndrome de Cushing PDFYENIRETH MILENA QUIROZ ARIASAún no hay calificaciones
- Enfermedad de Cushing: causas, síntomas y diagnósticoDocumento9 páginasEnfermedad de Cushing: causas, síntomas y diagnósticoChina Vane BCAún no hay calificaciones
- Síndrome de CushingDocumento27 páginasSíndrome de CushingAlexandra Michaelis D Break100% (1)
- SX de CushingDocumento6 páginasSX de CushingOrianny Quijada MolinaAún no hay calificaciones
- El Sindrome de CushingDocumento9 páginasEl Sindrome de CushingGrecia Vera VallejosAún no hay calificaciones
- HipercortisolismoDocumento6 páginasHipercortisolismoPatsy ParedesAún no hay calificaciones
- Sindrome EveDocumento3 páginasSindrome EvejulioAún no hay calificaciones
- Sindrome de CushingDocumento6 páginasSindrome de CushingGuada Romero ChoqueAún no hay calificaciones
- Todo Lo Que Necesitas Saber Sobre El Síndrome o Enfermedad de CushingDocumento6 páginasTodo Lo Que Necesitas Saber Sobre El Síndrome o Enfermedad de Cushingwilson nicolasAún no hay calificaciones
- Expo SuprarrenalDocumento41 páginasExpo SuprarrenalmaoldiAún no hay calificaciones
- Sindrome de Cushing y Enfermedad de AddisonDocumento8 páginasSindrome de Cushing y Enfermedad de AddisonReina PerezAún no hay calificaciones
- CushingDocumento8 páginasCushingjanny RomeroAún no hay calificaciones
- Causas y Fisiopatología Del Síndrome de Cushing - UpToDateDocumento11 páginasCausas y Fisiopatología Del Síndrome de Cushing - UpToDateJuan GamarraAún no hay calificaciones
- Sindrome de Cushing ListoDocumento12 páginasSindrome de Cushing ListoLuis Antequera BelloAún no hay calificaciones
- Cushing ImpppDocumento12 páginasCushing ImpppTP LissethAún no hay calificaciones
- Sindrome de CushingDocumento13 páginasSindrome de CushingJhansReáteguiAún no hay calificaciones
- Gushing MedicinaDocumento6 páginasGushing MedicinaYussef Rivas AlvarezAún no hay calificaciones
- Sindrome de CushingDocumento17 páginasSindrome de CushingMaricarmen Bleis UcAún no hay calificaciones
- Síndrome de CushingDocumento27 páginasSíndrome de CushingEvelin SuárezAún no hay calificaciones
- Wa0002.Documento9 páginasWa0002.megiamolinajhostynAún no hay calificaciones
- Glandula SuprarrenalDocumento12 páginasGlandula SuprarrenalShara MejiaAún no hay calificaciones
- Clase 8 - Síndrome de CushingDocumento17 páginasClase 8 - Síndrome de CushingManuela Martinez MaceiraAún no hay calificaciones
- Síndrome de Cushing: causas, síntomas, diagnóstico y tratamientoDocumento5 páginasSíndrome de Cushing: causas, síntomas, diagnóstico y tratamientoKarinaHernandezAún no hay calificaciones
- Enfermedades de las glándulas suprarrenalesDocumento54 páginasEnfermedades de las glándulas suprarrenalesAguilar Camacho Ramses AlexisAún no hay calificaciones
- 2a Caso Clinico 20178Documento10 páginas2a Caso Clinico 20178Yuri CorderoAún no hay calificaciones
- Sindrome de CushingDocumento6 páginasSindrome de CushingLiz GarciaAún no hay calificaciones
- Causas y Fisiopatología Del Síndrome de Cushing: Lynnette K. Nieman, MDDocumento22 páginasCausas y Fisiopatología Del Síndrome de Cushing: Lynnette K. Nieman, MDGuardito PequeñoAún no hay calificaciones
- Sindrome de CushingDocumento8 páginasSindrome de Cushingyesenia.sincheAún no hay calificaciones
- Sindrome de CushingDocumento35 páginasSindrome de CushingmarcelitovalnietAún no hay calificaciones
- Caso Clinico Sindrome de Cushing EndogenoDocumento13 páginasCaso Clinico Sindrome de Cushing EndogenoGerman GuadarramaAún no hay calificaciones
- Fisiología de La Enfermedad de CushingDocumento6 páginasFisiología de La Enfermedad de CushingMaría B.Aún no hay calificaciones
- SX CushingDocumento8 páginasSX CushingBrandom Bautista RamirezAún no hay calificaciones
- Síndrome de CushingDocumento8 páginasSíndrome de CushingArmando IrurzoAún no hay calificaciones
- Insuficiencia Adrenal o Enfermedad de AddisonDocumento2 páginasInsuficiencia Adrenal o Enfermedad de AddisonAna Luisa Del RosarioAún no hay calificaciones
- Síndrome de CushingDocumento8 páginasSíndrome de CushingnataliaAún no hay calificaciones
- 02.026 Hiperfunción de La Corteza Suprarrenal Síndrome de CushingDocumento11 páginas02.026 Hiperfunción de La Corteza Suprarrenal Síndrome de CushingGustavo AraujoAún no hay calificaciones
- Sindrome de CushingDocumento8 páginasSindrome de CushingJesus Alberto Martinez GutierrezAún no hay calificaciones
- Fisiología PrácticaDocumento10 páginasFisiología PrácticajoseAún no hay calificaciones
- FSP Glándula SuprarrenalDocumento39 páginasFSP Glándula SuprarrenalNeil Alex Flores ApazaAún no hay calificaciones
- Síndrome de Cushing: Caso clínico de paciente con aumento de peso y tamaño de caraDocumento22 páginasSíndrome de Cushing: Caso clínico de paciente con aumento de peso y tamaño de caraDiana ArequipaAún no hay calificaciones
- Síndrome de Cushing y Enfermedad de AddisonDocumento8 páginasSíndrome de Cushing y Enfermedad de AddisonMatias Z.Aún no hay calificaciones
- Fisiopatologia de Los GlucocorticoidesDocumento5 páginasFisiopatologia de Los GlucocorticoidesMónica CalviñoAún no hay calificaciones
- Síndrome de Cushing - LecturioDocumento18 páginasSíndrome de Cushing - LecturioCLAUDIA BELEN LIZARRAGA SANCHEZAún no hay calificaciones
- Hipercortisolismo e Insuficiencia SuprarrenalDocumento6 páginasHipercortisolismo e Insuficiencia SuprarrenalMontserrat GonzalezAún no hay calificaciones
- Sindrome de Cushing RRDocumento8 páginasSindrome de Cushing RRIzabethel VargasAún no hay calificaciones
- Sindrome de Cushing DX y TtoDocumento19 páginasSindrome de Cushing DX y TtoJuan Andrés MoraAún no hay calificaciones
- Seminario Glándula Suprarrenal - MadeDocumento3 páginasSeminario Glándula Suprarrenal - MadeSelene ferrerAún no hay calificaciones
- UNSM Matemática Discreta silaboDocumento3 páginasUNSM Matemática Discreta silaboItalo QuirozAún no hay calificaciones
- ¿De Qué Nos Van A PerdonarDocumento2 páginas¿De Qué Nos Van A PerdonarderzuuuAún no hay calificaciones
- LaPazArmadaDocumento13 páginasLaPazArmadamiguelAún no hay calificaciones
- Códigos de ContralorDocumento20 páginasCódigos de ContralorAdrian BerdunAún no hay calificaciones
- La fé bíblica (EmunahDocumento9 páginasLa fé bíblica (EmunahUrfiles Perez PerezAún no hay calificaciones
- AnfíbolDocumento4 páginasAnfíbolPatricioAún no hay calificaciones
- La Arquitectura Del Período GuzmancistaDocumento2 páginasLa Arquitectura Del Período GuzmancistaDarrenPorras67% (3)
- 2.2 Módulo 4 - Cómo Finalizar Un DiscursoDocumento8 páginas2.2 Módulo 4 - Cómo Finalizar Un DiscursoLuis Miguel CurielAún no hay calificaciones
- Dependencias Federales (Nva. Esparta) PDFDocumento63 páginasDependencias Federales (Nva. Esparta) PDFGabriel Gómez100% (1)
- Preterito Pluscuamperfecto IndicativoDocumento4 páginasPreterito Pluscuamperfecto Indicativocr_carlosAún no hay calificaciones
- Lectura N°01Documento3 páginasLectura N°01iZzilAún no hay calificaciones
- Ritual Bendicion y Dedicación AltarDocumento12 páginasRitual Bendicion y Dedicación AltarDarlyn BA50% (2)
- Relactancia 1Documento5 páginasRelactancia 1Danny MurciaAún no hay calificaciones
- Daniel Ruzo - SemblanzaDocumento64 páginasDaniel Ruzo - SemblanzaokinreportAún no hay calificaciones
- Socialización ExternaDocumento6 páginasSocialización ExternaNicolas SuasnavasAún no hay calificaciones
- Cálculo I PDFDocumento5 páginasCálculo I PDFginotrucheliAún no hay calificaciones
- PROGRAMAS Escuelas de Catequistas Parroquiales PDFDocumento16 páginasPROGRAMAS Escuelas de Catequistas Parroquiales PDFIlegorriaAún no hay calificaciones
- Apreciacion Musical 2Documento2 páginasApreciacion Musical 2Emmanuel EscobarAún no hay calificaciones
- Que Es Un Facturador MedicoDocumento14 páginasQue Es Un Facturador MedicoNitza I. Cortes Vazquez100% (1)
- Informe de Visita Tecnica 207-20 SMCV 2020-03-06 RFP2004318Documento13 páginasInforme de Visita Tecnica 207-20 SMCV 2020-03-06 RFP2004318fernando quispe cornejoAún no hay calificaciones
- Spsu-868 Ejercicio U015Documento4 páginasSpsu-868 Ejercicio U015Jesus Alvarado100% (1)
- Orestes Ferrara - Una Mirada Sobre Tres SiglosDocumento22 páginasOrestes Ferrara - Una Mirada Sobre Tres SiglosTeddy MouraAún no hay calificaciones
- Prueba Evaluación Diagnostica CCSS 2° GradoDocumento5 páginasPrueba Evaluación Diagnostica CCSS 2° GradoReginalda Silva dazaAún no hay calificaciones
- 90 Lecciones de Algebra PDFDocumento527 páginas90 Lecciones de Algebra PDFLuis Enrique Bermudez100% (1)
- Una Neurona Aislada No EsDocumento18 páginasUna Neurona Aislada No EsYessenia Parra MontañoAún no hay calificaciones
- Vida en La TundraDocumento24 páginasVida en La TundraSandro Larry Mamani Isidro100% (1)
- Taller #1 Glosario Ambiental Sopa de LetrasDocumento2 páginasTaller #1 Glosario Ambiental Sopa de LetrasValeria0% (2)
- Grupo 12 - Informe N°6Documento10 páginasGrupo 12 - Informe N°6ElvixWTFAún no hay calificaciones
- Nueva EconomiaDocumento18 páginasNueva EconomiaSara GarciaAún no hay calificaciones
- Mapa Conceptual, 5 Consejos para Dejar de Postergar - Viviana MejiaDocumento1 páginaMapa Conceptual, 5 Consejos para Dejar de Postergar - Viviana MejiaVIVIANAAún no hay calificaciones