Documentos de Académico
Documentos de Profesional
Documentos de Cultura
G9 - Cinética - 27 - 7 - 20
Cargado por
josTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
G9 - Cinética - 27 - 7 - 20
Cargado por
josCopyright:
Formatos disponibles
QUÍMICA – 63.01/83.
01-2020
G9. CINÉTICA QUÍMICA
GLOSARIO DE TERMINOS
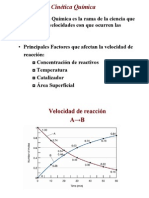
Cinética: estudia la velocidad de las reacciones químicas y el efecto que produce sobre ella la forma en que se
produce.
Velocidad de reacción: variación en la concentración o presión parcial de reactivos (disminución) o productos
(aumento) en un cierto intervalo de tiempo.
Velocidad instantánea: pendiente de la recta tangente a la curva de concentración vs tiempo, en un determinado
momento.
Ley de velocidad diferencial: expresión matemática que indica la dependencia de la velocidad de reacción con
respecto a la concentración o presión parcial. Es posible expresarla como el producto de una constante
(constante de velocidad) y las concentraciones (o presiones parciales) de los reactivos elevadas a ciertos
exponentes (órdenes).
Leyes integradas de velocidad: expresión matemática que muestra la dependencia de las concentraciones con
respecto al tiempo. Se pueden obtener por integración de la Ley de velocidad diferencial.
Orden de reacción: exponentes a los que se encuentran elevadas las concentraciones de reactivos en la Ley de
Velocidad. Suelen ser números enteros o la mitad de un entero. Su determinación es experimental y no
necesariamente coinciden con los coeficientes estequiométricos de la reacción general. Cada reactivo tiene su
orden y la suma de ellos corresponde al orden global de la reacción.
Tiempo de vida medio: tiempo requerido para que la concentración de un reactivo disminuya a la mitad de su
valor inicial.
Energía de activación: energía mínima o umbral necesaria (superior a la de los reactivos y productos) para que
se produzca la reacción.
Catalizador: sustancia que acelera una reacción química modificando el mecanismo de reacción por disminución
de la energía de activación. No aparece en la ley de velocidad de la reacción. Muchos metales u óxidos actúan
como catalizadores heterogéneos. Ciertas proteínas llamadas enzimas actúan como catalizadores biológicos.
Mecanismo de reacción: proceso por el cual se lleva a cabo una reacción química. Algunas reacciones se
producen en un sólo paso (mecanismo de paso elemental). Otras pueden ocurrir por sucesión de dos o más
etapas elementales (mecanismo de pasos múltiples). La determinación del mecanismo por el cual transcurre
una reacción es experimental.
Intermediario de reacción: sustancia que se origina en algún paso intermedio del mecanismo pero no es ni un
reactivo ni un producto, sino que se genera y se consume durante la reacción. Figura en el mecanismo pero no
en la reacción global.
Molecularidad: número de moléculas implicadas en un proceso elemental. En los procesos elementales
molecularidad y orden coinciden.
RESÚMEN DE FÓRMULAS
G9. CINÉTICA QUÍMICA Página 1 de 6
QUÍMICA – 63.01/83.01-2020
Dada la reacción: 𝑎𝐴 + 𝑏𝐵 → 𝑐𝐶
̅̅̅):
Velocidad única media (𝒗 𝒓
1 ∆[𝐶] 1 ∆[𝐴] 1 ∆[𝐵]
𝑣̅𝑟 = =− =−
𝑐 ∆𝑡 𝑎 ∆𝑡 𝑏 ∆𝑡
Velocidad Instantánea (vr):
1 𝑑[𝐶] 1 𝑑[𝐴] 1 𝑑[𝐵]
𝑣𝑟 = =− =−
𝑐 𝑑𝑡 𝑎 𝑑𝑡 𝑏 𝑑𝑡
Ecuación Cinética de la Velocidad:
vr = k. [A]α . [B]β
a, b, c = coeficientes estequiométricos
α = orden de la reacción respecto a A ; β = orden de reacción respecto a B
α + β = orden reacción global
k = constante de velocidad de reacción. Dependencia de la velocidad de reacción con la temperatura y los
mecanismos de la reacción.
IMPORTANTE: el orden de reacción NO necesariamente coincide con el coeficiente estequiométrico, siempre
es EXPERIMENTAL.
Para una reacción del tipo: A→productos
Orden CERO Orden UNO Orden DOS
Ecuación de
V=k [A]0 =k V=k [A]1 V=k [A]2
velocidad
Ecuación [ A]= [ A]0–k t ln[ A]t= ln[ A]0-k t 1/[ A]t= 1/[ A]0 + kt
integrada
Tiempo de
t1/2 =[ A]0 /(2k) t1/2 = ln(2)/k t1/2 =1/(k [ A]0)
vida medio
Ecuación empírica de Arrhenius: dependencia de la constante de velocidad con la temperatura.
k= A . e -Ea/RT ó ln k= lnA – Ea / RT
k = constante de velocidad de reacción. Dependencia de la velocidad de reacción con la temperatura y los
mecanismos de la reacción.
A= factor de frecuencia
G9. CINÉTICA QUÍMICA Página 2 de 6
QUÍMICA – 63.01/83.01-2020
Ea= Energía de Activación
R= constante de los gases
T= Temperatura
EJERCICIOS
1) Escriba las expresiones de velocidad para las siguientes reacciones en términos de la desaparición de los
reactivos y aparición de productos. ¿Cuáles son sus unidades? ¿Qué relación tienen las mismas con la velocidad
promedio de la reacción?
a)𝐻2 (𝑔) + 𝐼2 (𝑔) → 2𝐻𝐼 (𝑔)
b)2𝐻2 (𝑔) + 𝑂2 (𝑔) → 2𝐻2 𝑂(𝑔)
c)5𝐵𝑟 − (𝑎𝑐) + 𝐵𝑟𝑂3− (𝑎𝑐) + 6𝐻 + (𝑎𝑐) → 3𝐵𝑟2 (𝑎𝑐) + 3𝐻2 𝑂(𝑙)
2) Grafique cualitativamente:
a) para una reacción de orden cero: velocidad vs tiempo y concentración de reactivos vs tiempo
b) para una reacción de orden uno: velocidad vs concentración de reactivos, concentración de reactivos vs
tiempo y logaritmo de concentración de reactivos vs tiempo.
c) para una reacción de orden dos: velocidad vs concentración de reactivos, concentración de reactivos vs
tiempo y la inversa de la concentración de reactivos vs tiempo.
3) Considere la reacción: 𝑁2 (𝑔) + 3𝐻2 (𝑔) → 2𝑁𝐻3 (𝑔)
Suponga que en un momento en particular, durante la reacción, el hidrógeno molecular está reaccionando a la
velocidad de 0,074 M/s.
a)¿Cuál es la velocidad a la que está formando el amoníaco?
b) ¿Cuál es la velocidad a la que está reaccionando el nitrógeno molecular?
4) El 35,5% de cierta reacción 𝐴 → 𝑃𝑟𝑜𝑑𝑢𝑐𝑡𝑜𝑠 de primer orden se lleva a cabo en 4,90 minutos a 25ºC. ¿Cuánto
vale k?
Rta: k = 0,0896 min-1
5) La siguiente reacción 𝑃𝐶𝑙3 (𝑔) + 𝐶𝑙2 (𝑔) → 𝑃𝐶𝑙5 (𝑔) a 200ºC es de orden parcial igual a 1 para cada uno de los
reactivos. Si la reacción se realiza en un recipiente cerrado previamente evacuado a partir de concentraciones
iniciales 0,01 M para ambos reactivos, señalar cómo afectará la velocidad inicial cada uno de los siguientes
cambios. En todos los casos justifique incluyendo las expresiones matemáticas correspondientes:
a) Se produce la reacción a 300ºC.
b) Se duplica la concentración inicial de Cl2, manteniendo la concentración de PCl3 constante, a 200ºC.
c) Se duplican ambas concentraciones iniciales a 200ºC.
d) Se agrega una sustancia que permaneciendo químicamente inalterada al final del proceso, aumenta la
energía de activación.
6) Dada la siguiente reacción: 2𝑁2 𝑂5 (𝑔) → 4𝑁𝑂2 (𝑔) + 𝑂2 (𝑔) y sabiendo que a 318K la constante de velocidad
específica es 5,1.10-4 s-1 .
a) Escriba la ecuación cinética.
b) Calcule el tiempo de vida media del N2O5.
Rta: t1/2 = 679,56 s
G9. CINÉTICA QUÍMICA Página 3 de 6
QUÍMICA – 63.01/83.01-2020
7) La velocidad promedio de la reacción: 𝑁2 (𝑔) + 3𝐻2 (𝑔) → 2𝑁𝐻3 (𝑔)en un período determinado se informa
como 1.15 mmol de NH3 . L-1 h -1
a) ¿Cuál es la velocidad promedio en el mismo período respecto a la desaparición de H 2?
b) ¿Cuál es la velocidad única promedio?
8) Para la reacción𝐴(𝑔) → 𝐵(𝑔), sabiendo que a 25ºC y partiendo de una concentración inicial de A igual a 1M,
el t1/2 es de 80 min; y que partiendo de [A]0 = 5M a la misma temperatura, el t1/2 es el mismo. Calcule cuál será la
concentración de A después de 10 minutos cuando la reacción se produce a 100ºC, partiendo de [A] 0 = 2M.Dato:
Ea = 50 KJ/mol
Rta: [A] = 0,0135 M
9) Dada la reacción:2𝑁𝑂(𝑔) + 𝑂2 (𝑔) → 2𝑁𝑂2 (𝑔) a T= cte, se obtuvieron los siguientes datos experimentales:
Experiencia Nº [NO]0 [O2]0 Vel. De desaparición de NO [M/s]
1 0,02 0,01 1,5.10-4
2 0,04 0,01 6.10-4
3 0,02 0,04 6.10-4
a) Determine los órdenes parciales respecto a NO y O2 y el orden total.
b) Determine k.
Rta: Orden respecto a NO: 2
Orden respecto a O2: 1
Orden total: 3
k = 38 M-2 s-1
10)La reacción2𝐴 + 3𝐵 → 𝐶es de primer orden con respecto a A y a B. Cuando las concentraciones iniciales son
[A]=1,6x10-2M y [B]=2,4x10-3M, la velocidad es de 4,1 x10-3M/s. Calcule la constante de velocidad de la reacción.
11)Los datos de la descomposición de N2O5 a 25ºC son
T (min) Concentración de N2O5 (mol x L -1 )
0 15.0 x 10-3
200 9.6 x 10-3
400 6.2 x 10-3
600 4.0 x 10-3
800 2.5 x 10-3
1000 1.6 x 10-3
a) Determine con los datos el orden de la reacción.
b) Halle el valor de la constante de la reacción.
12)Para la reacción: 2𝑁𝑂(𝑔) + 𝑂2 (𝑔) → 2𝑁𝑂2 (𝑔) cuando se duplica la concentración de NO, la velocidad de la
reacción aumenta por un factor de 4. Cuando el O2 y el NO duplican las concentraciones, la velocidad aumenta
por un factor de 8. ¿Cuáles son:
a) Los órdenes de los reactivos.
b) El orden global de la reacción.
c) Las unidades de k, si la velocidad se expresa en moles.L-1.s-1
G9. CINÉTICA QUÍMICA Página 4 de 6
QUÍMICA – 63.01/83.01-2020
13) Determine cuánto tiempo se insume para que la concentración de A disminuya al 1 % de su valor inicial, en
la reacción:
𝐴 → 𝑃𝑟𝑜𝑑𝑢𝑐𝑡𝑜𝑠 con k=1.0 s-1
14) Escriba la ecuación cinética para el consumo de los iones persulfato respecto a cada uno de los reactivos en
la siguiente reacción:
𝑆2 𝑂82− (𝑎𝑐) + 3𝐼 − (𝑎𝑐) → 2𝑆𝑂42− (𝑎𝑐) + 𝐼3− (𝑎𝑐)
Determine el valor de k, dados los siguientes datos:
Experimento Concentración inicial mol/L Velocidad inicial
S2O82- I- mol S2O82- L-1 s-1
1 0,15 0,21 1,14
2 0,22 0,21 1,7
3 0,22 0,12 0,98
15) Escriba la ecuación cinética y determine el valor de k para la reacción entre el monóxido de carbono y el cloro
gas para producir el cloruro de carbonilo, sustancia altamente tóxica, dados los siguientes datos obtenidos a una
determinada temperatura. (Uno de los órdenes no es un número entero, para estos casos es mejor utilizar
logaritmo)
Experimento 𝐶𝑂(𝑔) + 𝐶𝑙2 (𝑔) → 𝐶𝑂𝐶𝑙2 (𝑔)
Experimento Concentración inicial mol/L Velocidad inicial de CO
CO Cl2 mol L-1 s-1
1 0,12 0,20 0,121
2 0,20 0,10 0,241
3 0,10 0,30 0,682
v = k.[A]1/2.[B]
Indique cuál de las siguientes afirmaciones son falsas o verdaderas y justificar:
a) Si la concentración de B se reduce a la mitad, la velocidad de reacción se reduce a la mitad.
b) El orden total de la reacción es 1,5.
c) Si las concentraciones molares de A y B se duplican, la velocidad de la reacción no se modifica.
d) La constante de velocidad de reacción k, siempre es la misma a cualquier temperatura.
16) En la siguiente tabla se da la variación de la velocidad de la constante de velocidad con la temperatura para
la reacción de primer orden:
2𝑁2 𝑂5 (𝑔) → 2𝑁2 𝑂4 (𝑔) + 𝑂2 (𝑔)
Determine gráficamente la energía de activación y el factor de frecuencia.
T (K) K (s-1 )
273 7,87 x10³
298 3,46 x 105
318 4,98 x 106
G9. CINÉTICA QUÍMICA Página 5 de 6
QUÍMICA – 63.01/83.01-2020
338 4,87 x 107
17) Indique cómo variara la velocidad de una determinada reacción (aumenta, disminuye o no cambia) si ocurren
los siguientes cambios:
a) aumenta la Ea
b) aumenta la temperatura
c) disminuye la probabilidad de choques efectivos entre las moléculas de reactivos.
d) se agrega un catalizador
e) se produce un intermediario de reacción.
18) El NO (g) cataliza la descomposición del N 2O, a través del mecanismo siguiente:
𝑁𝑂(𝑔) + 𝑁2 𝑂(𝑔) → 𝑁2 (𝑔) + 𝑁𝑂2 (𝑔)
2𝑁𝑂2 (𝑔) → 2𝑁𝑂(𝑔) + 𝑂2 (𝑔)
a)¿Por qué el NO (g) se considera un catalizador y no un intermediario?
b)¿Cuál es la ecuación química para la reacción global?
c)Si el primer paso del mecanismo es el paso más lento, ¿cuál es la ecuación de velocidad para esta reacción?
19) Los datos en la tabla corresponden a la reacción a 580 K:
2𝐻𝐼(𝑔) → 𝐻2 (𝑔) + 𝐼2 (𝑔)
t (seg) Concentración de HI (mol x L -1 )
0 1.000
1000 0.112
2000 0.061
3000 0.041
4000 0.031
a) Grafique de una manera adecuada para determinar el orden de la reacción.
b) A partir del gráfico determine la constante de velocidad,
c) Exprese la ecuación de velocidad de la reacción.
20) La semivida para la descomposición de primer orden de A es 355 s, ¿Cuánto tiempo transcurrirá para que la
concentración de A disminuya a:
a) un cuarto,
b) 15% de su valor original,
c) un noveno de su concentración inicial?
G9. CINÉTICA QUÍMICA Página 6 de 6
También podría gustarte
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Examenes Quimica BasicaDocumento266 páginasExamenes Quimica BasicaPao Colls100% (15)
- Cosmética Dermatológica PDFDocumento121 páginasCosmética Dermatológica PDFJorge Luis Meléndez Castañeda100% (3)
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- Cinética QuímicaDocumento65 páginasCinética QuímicaJhon Jaime AmayaAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Cinetica Quimica AvanzadaDocumento18 páginasCinetica Quimica AvanzadaCesar MontezaAún no hay calificaciones
- Modelamiento y casos especiales de la cinética química heterogéneaDe EverandModelamiento y casos especiales de la cinética química heterogéneaCalificación: 3 de 5 estrellas3/5 (1)
- Unidad 2 Cinética QuímicaDocumento72 páginasUnidad 2 Cinética QuímicaSendy GarciaAún no hay calificaciones
- Actividades de Cinética Química (1) - 1Documento16 páginasActividades de Cinética Química (1) - 1Yisel AviAún no hay calificaciones
- Trabajo Hechos de TransitoDocumento19 páginasTrabajo Hechos de TransitocasiqueAún no hay calificaciones
- Quimica Ejercicios Resueltos Soluciones Cinetica Quimica SelectividadDocumento26 páginasQuimica Ejercicios Resueltos Soluciones Cinetica Quimica SelectividadLuisa Rubio VillarrealAún no hay calificaciones
- 2Bt. Examen CinéticaDocumento4 páginas2Bt. Examen CinéticarwapetAún no hay calificaciones
- Catálisis: Fundamentos IntroductoriosDocumento25 páginasCatálisis: Fundamentos IntroductoriosGreysi N. Moreno CedeñoAún no hay calificaciones
- Cinética Química: Velocidad de Reacción, Ecuaciones y Factores que InfluyenDocumento172 páginasCinética Química: Velocidad de Reacción, Ecuaciones y Factores que InfluyenHugo Fredy Quinonez BarretoAún no hay calificaciones
- Cinética Química - Fisico-QuimicaDocumento54 páginasCinética Química - Fisico-QuimicaAngel Palma100% (3)
- Unidad 4. Cinética QuímicaDocumento60 páginasUnidad 4. Cinética Químicabillybastidas2Aún no hay calificaciones
- Tarea - 3 - Alejandro - Piraneque - Grupo - 201604 - 1Documento10 páginasTarea - 3 - Alejandro - Piraneque - Grupo - 201604 - 1alejandro piranequeAún no hay calificaciones
- Apuntes Ingenieria de Reactores I 5iv2Documento66 páginasApuntes Ingenieria de Reactores I 5iv2Yang-li Wong OntiverosAún no hay calificaciones
- Tema 11Documento18 páginasTema 11Stf ChenAún no hay calificaciones
- Cinetica Quimica-GeneralidadesDocumento27 páginasCinetica Quimica-GeneralidadesEdgar Esteban Espinoza CabreraAún no hay calificaciones
- Ud. 4 Cinética QuímicaDocumento8 páginasUd. 4 Cinética Químicajosmar bernalAún no hay calificaciones
- Seminario Cinetica Quimica - 2022Documento14 páginasSeminario Cinetica Quimica - 2022Alex Del Piero Torrejon SuarezAún no hay calificaciones
- Efecto de La Temperatura Sobre La Velocidad de Reacción PDFDocumento5 páginasEfecto de La Temperatura Sobre La Velocidad de Reacción PDFEstefany TapiaAún no hay calificaciones
- Asp. Cineticos de Las Reac. QuimicasDocumento6 páginasAsp. Cineticos de Las Reac. QuimicasMARCOS ALAMOAún no hay calificaciones
- Cinética Química Qumica 4Documento10 páginasCinética Química Qumica 4Janice VillatoroAún no hay calificaciones
- Semana 11 - San Marcos - Nov - 2019 PDFDocumento29 páginasSemana 11 - San Marcos - Nov - 2019 PDFYudScarpAún no hay calificaciones
- 5-UTP-Cinetica QuimicaDocumento46 páginas5-UTP-Cinetica QuimicaRicardo Isidro Huaranga100% (1)
- Cinética Química-2019-IIDocumento27 páginasCinética Química-2019-IIWRETAún no hay calificaciones
- Acetato de Etilo Por Conductividad ElectricaDocumento12 páginasAcetato de Etilo Por Conductividad ElectricaMartin Hector Garcia HernandezAún no hay calificaciones
- 2 - 2ºbachillerato - Ejercicios - CINÉTICA QUÍMICA - (2022 - 2023)Documento4 páginas2 - 2ºbachillerato - Ejercicios - CINÉTICA QUÍMICA - (2022 - 2023)Izan De PablosAún no hay calificaciones
- Introducciona Cinetica QuimicaDocumento71 páginasIntroducciona Cinetica QuimicaLeonardo Abad PonceAún no hay calificaciones
- 6.1 Cinética QuímicaDocumento44 páginas6.1 Cinética QuímicaYazmin Valverde RodriguezAún no hay calificaciones
- 01 - Problemas de Cinetica Quimica-EnunciadosDocumento14 páginas01 - Problemas de Cinetica Quimica-Enunciadospablo100% (1)
- Actividades Resueltas Cinética Química 2021-22Documento8 páginasActividades Resueltas Cinética Química 2021-22ChuchoAún no hay calificaciones
- Cinetica QuimicaDocumento21 páginasCinetica QuimicaAnthony Alexandere VivancoAún no hay calificaciones
- Ejercicios CinéticaDocumento3 páginasEjercicios CinéticaRafa Echevarria AceñaAún no hay calificaciones
- T1.DiagnósticoQC ArantxaYaniraRuizPadillaDocumento16 páginasT1.DiagnósticoQC ArantxaYaniraRuizPadillaJose Jair Bonilla Cuevas100% (1)
- 2QCineticaER 1Documento10 páginas2QCineticaER 1littlegloAún no hay calificaciones
- Cap 14. CineticaDocumento60 páginasCap 14. CineticageiselAún no hay calificaciones
- Tarea4.Operaciones UnitariasDocumento45 páginasTarea4.Operaciones UnitariasCielo Calderon GarciaAún no hay calificaciones
- Cinetica Quimica 2020Documento39 páginasCinetica Quimica 2020Elias CordobaAún no hay calificaciones
- Cinética QuímicaDocumento15 páginasCinética QuímicaEugenioblogAún no hay calificaciones
- Quimica General Cinetica QuimicaDocumento31 páginasQuimica General Cinetica QuimicaFederico David FloresAún no hay calificaciones
- cinetica-quimicaDocumento30 páginascinetica-quimicaSandra JiménezAún no hay calificaciones
- Taller Cinética Química - Química IIDocumento2 páginasTaller Cinética Química - Química IIStephany Moreno LopezAún no hay calificaciones
- Practica Reactores 1Documento2 páginasPractica Reactores 1daina aguirre bazanAún no hay calificaciones
- Problemario 1aDocumento3 páginasProblemario 1aEDHER DAVID GUADALUPE ABREGOAún no hay calificaciones
- Reacciones químicas de orden y energía de activaciónDocumento25 páginasReacciones químicas de orden y energía de activaciónDennzel Jassaf Ramirez RojasAún no hay calificaciones
- Cinética Química PDFDocumento45 páginasCinética Química PDFYury BeltranAún no hay calificaciones
- Cinética química: Velocidad de reacciónDocumento32 páginasCinética química: Velocidad de reaccióncamila posadaAún no hay calificaciones
- Cálculo Ecn Veloc X Método Velocidades InicialesDocumento21 páginasCálculo Ecn Veloc X Método Velocidades Inicialeswilsoncdt69Aún no hay calificaciones
- S9Cinética para CBC - JBDocumento31 páginasS9Cinética para CBC - JBstebDCAún no hay calificaciones
- Semana 10 QG - VDocumento55 páginasSemana 10 QG - V20211803Aún no hay calificaciones
- CINETICA QUIMICA DefinitivaDocumento31 páginasCINETICA QUIMICA DefinitivaJioriver VallejoAún no hay calificaciones
- Cinética QuímicaDocumento7 páginasCinética QuímicaCristian Gastón MonzónAún no hay calificaciones
- Objetivos y Fundamentos Cinetica QuimicaDocumento5 páginasObjetivos y Fundamentos Cinetica QuimicaROJAS CARRANZA ADIR JOSUETAún no hay calificaciones
- Tema 5 - QuimicaDocumento74 páginasTema 5 - QuimicartAún no hay calificaciones
- A3-Brayan AguilarDocumento9 páginasA3-Brayan AguilarBrayan AguilarAún no hay calificaciones
- Resoluciones QG2 2021Documento172 páginasResoluciones QG2 2021Leo CarrizoAún no hay calificaciones
- Temas de CinéticaDocumento50 páginasTemas de CinéticaAnfer MarreroAún no hay calificaciones
- Semana 1 Diseño de ReactoresDocumento35 páginasSemana 1 Diseño de ReactoresPablo PonteAún no hay calificaciones
- Final B - Sociologia Nievas - 2014 - CBC - UBADocumento1 páginaFinal B - Sociologia Nievas - 2014 - CBC - UBAjosAún no hay calificaciones
- UBA - CBC - Sociologia - Examen Final - Cat Nievas - 2009Documento2 páginasUBA - CBC - Sociologia - Examen Final - Cat Nievas - 2009josAún no hay calificaciones
- Durkheim Weber Elias Marx examen final Sociología UBA CBCDocumento1 páginaDurkheim Weber Elias Marx examen final Sociología UBA CBCjosAún no hay calificaciones
- UBA - CBC - Sociologia - Examen Final - Cat Nievas - 2010Documento1 páginaUBA - CBC - Sociologia - Examen Final - Cat Nievas - 2010josAún no hay calificaciones
- Resumen Sociologia CompletoDocumento28 páginasResumen Sociologia CompletojosAún no hay calificaciones
- CamScanner 06-02-2022 13.21Documento8 páginasCamScanner 06-02-2022 13.21josAún no hay calificaciones
- Jorge Saborido - Historia de La Unión Soviética Cap 4 y 5Documento12 páginasJorge Saborido - Historia de La Unión Soviética Cap 4 y 5josAún no hay calificaciones
- Conceptos Básicos de Extracción Por Solventes Orgánicos y Electro Obtención en La Mineria Del CobreDocumento45 páginasConceptos Básicos de Extracción Por Solventes Orgánicos y Electro Obtención en La Mineria Del CobreJaime Alberto Rodriguez OlivaresAún no hay calificaciones
- Química y MateriaDocumento58 páginasQuímica y MateriaOscar Eduardo Herrera VeraAún no hay calificaciones
- PDocumento41 páginasPMaria Cristina Salazar DuarteAún no hay calificaciones
- Reacciones químicas y estequiometríaDocumento5 páginasReacciones químicas y estequiometríaMichael CortezAún no hay calificaciones
- Elaboracion Del VinoDocumento5 páginasElaboracion Del VinoPaul ZapataAún no hay calificaciones
- Componente Virtual Quimica OrganicaDocumento38 páginasComponente Virtual Quimica Organicaleidy BenitezAún no hay calificaciones
- Practica 7 EnzimasDocumento9 páginasPractica 7 EnzimasNayletAún no hay calificaciones
- Actividades para El Desarrollo de La Uc Química Tema 2Documento36 páginasActividades para El Desarrollo de La Uc Química Tema 2AlexanderAún no hay calificaciones
- 10 Guía Balanceo de Ecuaciones Químicas.Documento2 páginas10 Guía Balanceo de Ecuaciones Químicas.Liliana HernándezAún no hay calificaciones
- Balanceo de ecuaciones químicasDocumento4 páginasBalanceo de ecuaciones químicasVICTOR PEÑAAún no hay calificaciones
- Apuntes, EstequiometriaDocumento7 páginasApuntes, EstequiometriaAndrea HernandezAún no hay calificaciones
- El Acetato de Metilo Se Produce Mediante Ia Reacción de Esterificacion en Fase Liquida de Ácido AcéticoDocumento3 páginasEl Acetato de Metilo Se Produce Mediante Ia Reacción de Esterificacion en Fase Liquida de Ácido AcéticoKarolina BarreraAún no hay calificaciones
- Informe de Propiedades Físicas y QuímicasDocumento20 páginasInforme de Propiedades Físicas y QuímicasJosè MirandaAún no hay calificaciones
- Obtención de benzhidrol por reducción de benzofenonaDocumento14 páginasObtención de benzhidrol por reducción de benzofenonaAreli CastilloAún no hay calificaciones
- Programación Aula 2 Bto EdebéDocumento67 páginasProgramación Aula 2 Bto EdebéLewoskiAún no hay calificaciones
- TALLER 6-Equilibrio QuimicoDocumento8 páginasTALLER 6-Equilibrio QuimicoAlejandra Garcia RuizAún no hay calificaciones
- Diseño y Construcción de Un Reactor Tipo Batch Universidad Internacional SEK PDFDocumento118 páginasDiseño y Construcción de Un Reactor Tipo Batch Universidad Internacional SEK PDFJunior Daygoro Navarro IpanaqueAún no hay calificaciones
- Cuestionario PolímerosDocumento1 páginaCuestionario PolímerosmonicardenAún no hay calificaciones
- Sintesis - de - Anhidrido Ftalico Por Medio de Intercambio AnhidridoDocumento5 páginasSintesis - de - Anhidrido Ftalico Por Medio de Intercambio AnhidridoAndrea Hernández Carreño0% (1)
- Actividades Previas Eq1 P3Documento19 páginasActividades Previas Eq1 P3Mitzi De la Rosa HerreraAún no hay calificaciones
- Laboratorio de OrganicaDocumento16 páginasLaboratorio de Organicamaria alabarranAún no hay calificaciones
- Almacenamiento y manipulación de pinturas y solventesDocumento7 páginasAlmacenamiento y manipulación de pinturas y solventesBenjamin Neciosup PaucarAún no hay calificaciones
- Informe 6 Oxidos y BasesDocumento5 páginasInforme 6 Oxidos y BasesCarol RamirezAún no hay calificaciones
- Analítica 2Documento9 páginasAnalítica 2Deider Jr LinaresAún no hay calificaciones
- Guia 3 Reacciones Químicas en El AmbienteDocumento6 páginasGuia 3 Reacciones Químicas en El AmbienteSantiago MartínezAún no hay calificaciones
- Reporte 5 Reacciones, Version LigeraDocumento18 páginasReporte 5 Reacciones, Version LigeraAlejandro GarciaAún no hay calificaciones