Documentos de Académico
Documentos de Profesional
Documentos de Cultura
P3 BioMol Extracción ADN
Cargado por
Andrea Sebya BDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
P3 BioMol Extracción ADN
Cargado por
Andrea Sebya BCopyright:
Formatos disponibles
FPROFE: Familia Sanitaria, CFR Pontevedra 2017-18.
Biología Molecular
Práctica 3. Extracción de ADN, purificación y cuantificación
P3A: Extracción de ADN de saliva. Método de precipitación salina
DANAGENE saliva kit (BioTed, cod. 603.4)
P3B: Extracción de ADN de sangre. Método de columna de absorción
DANAGENE spin blood DNA kit (BioTed, cod. 606.1)
Fundamento
Los ácidos nucleicos son macromoléculas poliméricas encargadas de almacenar,
transmitir y expresar la información genética de los seres vivos. Estas
biomoléculas se encuentran en todos los seres vivos bajo dos fórmulas:
El ácido desoxirribonucleico (ADN) que contiene la información genética y
hereditaria de un organismo y se controla su transmisión a la descendencia.
El ácido ribonucleico (ARN) que se encarga de la expresión del ADN mediante
la síntesis de proteínas.
La estructura del ADN es una larga cadena de monómeros (nucleóticos) con una
estructura secundaria de doble hélice complementaria que contienen la
información genética codificada por la secuencia de sólo 4 bases [A: Adenina, T:
Timina, C: Citosina y G: Guanina] (figura 1). El flujo de la información genética
(transmisión y expresión) a partir de los genes del ADN es unidireccional y se
recoge en el dogma central de la biología (figura 2).
La secuencia de ADN de un ser vivo es muy especifica y conservada lo que
permite identificar un organismo por técnicas moleculares como PCR o
secuenciación a partir de la extracción de ADN de sus restos biológicos .
La extracción de ADN se puede realizar a partir de cualquier célula o tejido de un
ser vivo. El ADN esta confinado en el interior de las células principalmente en el
núcleo de la célula o en órganos citoplasmáticos como mitocondrias o
cloroplastos protegidos por membranas. Para tener acceso al DNA se debe
vencer las barreras que constituyen las membranas y paredes en su caso.
La extracción de ADN permite exponer esta molécula a diversos reactivos y
enzimas para realizar diferentes técnicas de diagnostico y la purificación
permite eliminar sustancias y elementos que pueden interferir en los análisis.
En la práctica realizamos la extracción de ADN genómico a partir de 2 muestras
biológicas: células de la mucosa bucal (incluidas en la saliva) y de la sangre.
Cualquier protocolo técnico se divide en 3 fases:
1. Pretratamiento de la muestra
2. Extracción del ADN
3. Purificación del ADN
Relator: José Ramón Vidal Juviño 1
Actividade do PFPFP do Ensino Medio. Práctica 3
Figura 1. Estructura del ADN: Cromosoma vs cromatina
Figura 2. Flujo de la información genética: ADN-RNA-Proteína-Carácter
2 Relator: José Ramón Vidal Juviño
FPROFE: Familia Sanitaria, CFR Pontevedra 2017-18. Biología Molecular
P3A: Extracción de ADN de saliva. Método de precipitación salina
DANAgene saliva kit (BioTed, cod. 603.4)
Equipos y materiales de laboratorio
1. Microtubos estériles tipo Eppendorf de 1,5 mL y gradillas
2. Tubos de centrífuga estériles de 15 o 50 mL y gradillas (opcional)
3. Baño de agua a 37ºC
4. Vortex
5. Microcentrífuga
6. Rotores de centrífuga para tubos de 1,5 mL y 15 o 50 mL (opcional)
7. Juego de micropipetas (P1000, P200, P20, P10)
8. Puntas de pipeta con filtro.
9. Tiras de papel absorbente estéril.
10. Cronómetro
11. Equipo de electroforesis (Ver práctica de electroforesis)
Cubeta de electroforesis con plataforma y peines
Fuente de electroforesis
12. Transiluminador
Reactivos necesarios
1. DANAgene Saliva Kit
Tampón de lisis (incubar a 37ºC para disolver el posible precipitado)
Tampón precipitación de proteínas
Tampón de hidratación
Proteinasa K (20mg/mL)
RNasa (10mg/mL)
2. Isopropanol
3. Etanol 70%
4. Agarosa (Ver práctica de electroforesis)
5. Tampón de electroforesis (TAE)
6. Colorante de DNA tipo Dana Blue 0,1% (BioTed)
6. Marcador de peso molecular
7. Tampón de carga de DNA en pocillo de gel de agarosa
8. Hielo picado
Muestra
Saliva directa, aproximadamente 600 µL
Relator: José Ramón Vidal Juviño 3
Actividade do PFPFP do Ensino Medio. Práctica 3
Pasos secuenciales en la extracción de ADN de saliva por el procedimiento de
purificación por precipitación de proteínas con altas concentraciones de sales.
4 Relator: José Ramón Vidal Juviño
FPROFE: Familia Sanitaria, CFR Pontevedra 2017-18. Biología Molecular
Protocolo (duración: 3 + 1 horas)
Recogida de muestra de saliva
1. Se debe lavar la boca y esperar 30 min antes de recoger 600 µL de saliva en
un tubo Eppendorf con la ayuda de una punta de pipeta truncada de 1 mL.
Ojo: La muestra de saliva se puede almacenar a 4ºC hasta unas 2 horas antes
de su procesamiento.
Lisis celular
2. Centrifugar 600 µL de saliva durante 90 seg a 13-16.000 x g. Eliminar el
sobrenadante con una pipeta de 1 mL sin dañar el pellet visible de células.
3. Añadir en el siguiente orden 600 µL de Tampón de lisis, 5 µL de Proteinasa K
y finalmente 5 µL de RNasa. Resuspender mediante pipeta para disgregar el
pellet de células.
4. Incubar a 37ºC durante 30-60 min para lisar las células. Aplicar vortex a las
muestras cada 10-15 min durante el periodo de incubación.
Precipitación de proteínas
5. Dejar enfriar las muestras 10 min a 4ºC (aconsejable en hielo picado).
6. Añadir 200 µL de Tampón de precipitación de proteínas al lisado celular.
7. Vortex a máxima velocidad durante 20-30 seg.
8. Centrifugar a 13-16.000 x g durante 5 min. y se debe apreciar un
precipitado correspondiente a los fragmentos celulares.
Ojo: Si se observan partículas flotando, incubar 5 min en hielo y volver a
centrifugar de nuevo.
Precipitación de DNA
9. Traspasar el sobrenadante que contiene el DNA a un tubo Eppendorf nuevo
que contiene 600 µL de isopropanol.
10. Mezclar unas 50 veces por inversión.
11. Centrifugar a 13-16.000 x g durante 2 min. Se debe observar un pellet
blanco que corresponde al DNA.
12. Eliminar el sobrenadante y secar el tubo brevemente con tiras de papel
absorbente.
13. Añadir 600 µL de etanol 70% para lavar el DNA.
14. Centrifugar a 13-16.000 x g durante 1 min. Eliminar cuidadosamente el
sobrenadante sin tocar el pellet de DNA.
Ojo: En este paso el pellet de DNA se despega fácilmente de la pared de tubo
por lo que el sobrenadante se debe eliminar con mucho cuidado. Se puede volver
a centrifugar brevemente para recoger las últimas gotas de etanol residual.
Relator: José Ramón Vidal Juviño 5
Actividade do PFPFP do Ensino Medio. Práctica 3
15. Invertir el tubo Eppendorf en un papel absorvente y dejar secar durante
unos 5-10 min.
Ojo: El tubo se puede dejar secar abierto en el interior de una campana de flujo
laminar durante unos 5-10 min.
Hidratación de DNA
16. Añadir 250-500 µL de agua estéril o Tampón de hidratación y vortex con
los dedos durante unos 1-2 min.
17. Incubar a 50ºC durante 1 h con agitaciones con los dedos cada 10-15 min
para ayudar a la rehidratación del DNA.
Ojo: Se puede dejar hidratar durante toda la noche a temperatura ambiente.
18. Conservar a 2-5ºC (nevera) para su utilización en los próximos días para
PCR o digestión. Para almacenajes más largos conservar a -20 o -80ºC.
Cuantificación de DNA
19. La cantidad de DNA genómico obtenida se puede cuantificar mediante
espectrofotómetro, pico-nanodrop o por separación electroforética en geles de
agarosa (Ver protocolo).
Observaciones
El ADN obtenido (genómico + mitocondrial) se puede utilizar para amplificación
(PCR), digestiones (enzimas de restricción), separación (electroforesis),
transferencia (blotting) e hibridación con sondas específicas.
Tiempo estimado de la práctica 3 horas + 1 hora
Revisión de material y reactivos 10 min.
Desarrollo del protocolo 2 h 50 min.
[Opcional] cuantificación del DNA vía:
Pico-nanodrop: 2 min.
Espectrofotómetro: 10 min.
Electroforesis: 60 min (Permite ver también la integridad del DNA).
Ojo: Requiere tener preparado algún material previamente.
6 Relator: José Ramón Vidal Juviño
FPROFE: Familia Sanitaria, CFR Pontevedra 2017-18. Biología Molecular
P3B: Extracción de ADN de sangre. Método de columna de absorción
DANAGENE spin blood DNA kit (BioTed, cod. 606.1)
Equipos y materiales de laboratorio
1. Microtubos estériles tipo Eppendorf de 1,5 mL y gradillas para tubos de 1,5 mL
2. Juego de micropipetas (P1000, P200, P50, P10)
3. Puntas de pipeta con filtro (P1000, P200, P50, P10)
4. Estufa o baño de agua a 70ºC
5. Vortex
6. Microcentrífuga
7. Rotores de centrífuga para tubos de 1,5 mL
8. Cronómetro
Componentes de Blood DNA kit
Tampones de lisis RBC
Tampón de lisis de tejidos
Tampón de lisis/unión
Proteinasa K (liofilizado) y tampón de la proteinasa (PB)
Tampón de desinhibición
Tampón de lavado
Tampón de elución
Columnas de sílica retención DNA
Tubos colectores
Reactivos necesarios
1. Etanol 96%
2. Isopropanol
Muestra
Sangre periférica, aproximadamente 200 µL
Relator: José Ramón Vidal Juviño 7
Actividade do PFPFP do Ensino Medio. Práctica 3
Figura: Secuencia en la extracción y purificación de DNA a partir de sangre
utilizando columnas de adsorción de sílica.
Preparaciones preliminares
La proteinasa K en solución. Reconstituir el vial liofilizado añadiendo 1,3 mL
de tampón de proteinasa o Agua libre de nucleasas. Almacenar a -20ºC y
descongelar antes de su uso.
Verificar que el Tampón de lisis/unión no tiene precipitados debido a baja
Tª. Si es necesario, disolver los precipitados calentando la solución a 37ºC
Añadir 10 ml de Etanol 100 % al Tampón de Desinhibición. Mantener el envase
bien cerrado para evitar la evaporación del etanol.
Añadir 40 ml de Etanol 100 % al Tampón de Lavado. Mantener el envase bien
cerrado para evitar la evaporación del etanol.
Preparar un incubador o baño de agua a 70ºC.
Pre-calentar el Tampón de Elución a 70ºC.
8 Relator: José Ramón Vidal Juviño
FPROFE: Familia Sanitaria, CFR Pontevedra 2017-18. Biología Molecular
Protocolo (duración 2 horas)
Recogida de muestra de sangre periférica
1. Extraer aprox. 300 µL de sangre total y utilizar directamente.
Ojo: La sangre se puede extraer con anterioridad y conservar a 4ºC. Para utilizar
en el protocolo se debe llevar a temperatura ambiente (TA aprox. 20ºC) y evitar
que tenga coágulos o precipitados.
Lisis celular
2. Añadir en un tubo Eppendorf (1,5 mL) 25 µL de Proteinasa K y 300 µL de
sangre y agitar con dedo índice.
Ojo: Si la muestra de sangre no es fresca o presenta coágulos se debe incubar la
sangre con la proteinasa hasta 30 min.
3. Añadir 300 µL de Tampón de lisis/unión, mezclar vigorosamente con vortex
durante 15 seg.
4. Incubar a 70ºC durante 15 min.
Ojo: Durante la incubación el lisado debe tomar un color amarronado.
Preparación de columnas y unión de DNA a membrana
5. Añadir al lisado (paso 4) 300 µL de etanol (96%) y mezclar vigorosamente
con vortex.
6. Montar una columna de sílica en un tubo colector por cada muestra a analizar
sobre una gradilla.
7. Cargar la mitad de lisado (315 µL) en la columna y centrifuga a 10.000 rpm
durante 1 min. Elimina el tubo colector.
8. Repite el punto 7 con la otra mitad del lisado.
9. Colocar la columna nuevamente en un tubo colector y añadir 500 µL de
Tampón de Desinhibición. Centrifugar a 12.000 rpm durante 1 min y eliminar
el líquido.
Ojo: Centrifugar de nuevo a mayor velocidad (15.000 rpm) si toda la muestra
no paso por la columna .
Relator: José Ramón Vidal Juviño 9
Actividade do PFPFP do Ensino Medio. Práctica 3
Lavados y secado de la membrana de sílica
10. Añadir 500 µL de Tampón de Lavado en el reservorio de la columna y
centrifugar a 14.000 rpm durante 1 min. Descartar el filtrado y colocar la
columna de nuevo en el tubo colector.
11. Añadir de nuevo 500 µL de Tampón de lavado en la columna y centrifugar a
14.000 rpm durante 1 min. Descartar el filtrado y colocar la columna de
nuevo en el tubo colector.
12. Centrifugar de nuevo la columna a máxima velocidad (14.000 rpm) durante
2 min para eliminar el etanol residual
Elución del DNA
13. Transferir la columna a un microtubo Eppendorf de 1,5 mL y añadir sobre la
membrana de la columna 100 µL de Tampón de Elución precalentado a
70ºC. Incubar 1 min a TA.
14. Centrifugar a máxima velocidad (14.000 rpm) durante 1 min para recuperar
el DNA genómico puro.
Ojo: Para recuperar la mayor parte del DNA de la columna (incrementar el
rendimiento) u obtener una solución con mayor concentración de DNA es posible
aplicar diferentes modificaciones en el protocolo:
- Realizar una segunda elución con 100 µL de tampón de elución.
- Realizar una segunda elución con los 100 µL de elución inicial.
- Realizar una primera elución con 50 µL de tampón elución, incubar 3 min y
centrifugar. Realizar una segunda elución con los 50 µL de tampón restantes
Cuantificación de DNA
La cantidad de DNA genómico obtenida se puede cuantificar mediante
espectrofotómetro, pico-nanodrop o por separación electroforética en geles de
agarosa utilizando un marcador de peso molecular que permita la cuantificación
como el ladder Lambda–Hind III (Ver protocolo de electroforesis).
Observaciones
El ADN obtenido (genómico + mitocondrial) se puede utilizar para amplificación
(PCR), digestiones (enzimas de restricción), separación (electroforesis),
transferencia (blotting) e hibridación con sondas específicas.
Tiempo estimado de la práctica 1 hora + 1 hora: 2 horas
Revisión de práctica, material y reactivos: 30 min.
Extracción de la muestra de sangre para 8 grupos:30 min.
Protocolo de extracción de DNA de sangre: 60 min.
10 Relator: José Ramón Vidal Juviño
También podría gustarte
- Guía práctica para técnico superior de laboratorio de diagnóstico clínico y biomédicoDe EverandGuía práctica para técnico superior de laboratorio de diagnóstico clínico y biomédicoCalificación: 4.5 de 5 estrellas4.5/5 (10)
- Informe Laboratorio 8910-2Documento39 páginasInforme Laboratorio 8910-2josue riveraAún no hay calificaciones
- Extracción Filamentosos-1Documento10 páginasExtracción Filamentosos-1DaNnaGArciaAún no hay calificaciones
- Proceso CLEARDocumento3 páginasProceso CLEARroyAún no hay calificaciones
- Grupo 1 - Ope III - Secado Por AtomizaciónDocumento30 páginasGrupo 1 - Ope III - Secado Por AtomizaciónErick Isaac CalleAún no hay calificaciones
- Extracción ADN BIOCEL PDFDocumento7 páginasExtracción ADN BIOCEL PDFBrenda PalaciosAún no hay calificaciones
- EXTRACCIÓN DE ADN y ELECTROFORESISDocumento6 páginasEXTRACCIÓN DE ADN y ELECTROFORESISwei_duranAún no hay calificaciones
- GRUPO4 Laboratorio ExtracciónADNDocumento13 páginasGRUPO4 Laboratorio ExtracciónADNJoami WayAún no hay calificaciones
- Practica 1 Extraccion de ADN2018 1Documento4 páginasPractica 1 Extraccion de ADN2018 1DANTE JAVIER RODRIGUEZ HERRANAún no hay calificaciones
- Practica No 3 Extraccion de ArnDocumento10 páginasPractica No 3 Extraccion de ArnBianca Buck67% (3)
- Práctica 6 Aislamiento y Purificacion de ARN Total de MamiferoDocumento5 páginasPráctica 6 Aislamiento y Purificacion de ARN Total de MamiferoFranklin Joel Eche PoloAún no hay calificaciones
- Practica No 2 Extraccion de AdnDocumento8 páginasPractica No 2 Extraccion de AdnDavis BernardoAún no hay calificaciones
- Bcym Informe 1 Fase 2Documento7 páginasBcym Informe 1 Fase 2anag huarachaAún no hay calificaciones
- Pruebas de Aislamiento de ADN y Evaluación de Su CalidadDocumento34 páginasPruebas de Aislamiento de ADN y Evaluación de Su Calidadcristian david londoño riverAún no hay calificaciones
- Extraccion Del Adn PDFDocumento21 páginasExtraccion Del Adn PDFKelly Gomez CocaAún no hay calificaciones
- Fla 23 Guia Unifica Laboratori 4Documento4 páginasFla 23 Guia Unifica Laboratori 4kimberly katherine quiroga lealAún no hay calificaciones
- ADN: Extracción, PCR y electroforesisDocumento14 páginasADN: Extracción, PCR y electroforesisNicoll Guillen Aquino100% (4)
- Guia 4 Extraccion de DnaDocumento4 páginasGuia 4 Extraccion de DnaYorfan Eduardo Guerrero SanchezAún no hay calificaciones
- Extraccion Del AdnDocumento10 páginasExtraccion Del AdnDylan TeránAún no hay calificaciones
- PRÃ CTICA 3 Extraccion ADN SangreDocumento3 páginasPRÃ CTICA 3 Extraccion ADN SangreSuelen NunesAún no hay calificaciones
- Práctica 1 Extracción de ADNDocumento6 páginasPráctica 1 Extracción de ADNbriarius50% (2)
- Practica 2Documento7 páginasPractica 2AlexSanchezAún no hay calificaciones
- Informe de Práctica #2 Purificación de Ácidos Nucleicos (DNA) en Diferentes Células.Documento10 páginasInforme de Práctica #2 Purificación de Ácidos Nucleicos (DNA) en Diferentes Células.Lina Paola Marin RosalesAún no hay calificaciones
- Tarea 1. Extracción de Acidos Nucleicos (ADN y ARN)Documento4 páginasTarea 1. Extracción de Acidos Nucleicos (ADN y ARN)Teresa QuinteroAún no hay calificaciones
- Informe de Laboratorio n1Documento11 páginasInforme de Laboratorio n1Oscar Cáceres NovoaAún no hay calificaciones
- Práctica Extracción DNA y PCRDocumento10 páginasPráctica Extracción DNA y PCRpaumolledoAún no hay calificaciones
- Reporte 1. Extracción de ADNDocumento13 páginasReporte 1. Extracción de ADNElizabethAún no hay calificaciones
- Henry Salazar: Junio 19, 2007Documento14 páginasHenry Salazar: Junio 19, 2007HenrySalazarLazoMDAún no hay calificaciones
- Laboratorio No 2 Extraccion de AdnDocumento8 páginasLaboratorio No 2 Extraccion de AdnKarly Ayala Carrillo100% (1)
- Adn en Medicina LegalDocumento7 páginasAdn en Medicina LegalAna ReyesAún no hay calificaciones
- Informe Del Laboratorio de Extracción de ADN UDESDocumento15 páginasInforme Del Laboratorio de Extracción de ADN UDESJosé HairAún no hay calificaciones
- Informe de Practica IIDocumento3 páginasInforme de Practica IIJorge Chaiña ValeroAún no hay calificaciones
- ADN Práctica-1 (2018)Documento5 páginasADN Práctica-1 (2018)BryanAlexanderAún no hay calificaciones
- Extraccion de Adn A Partir de Sangre Periferica 1Documento4 páginasExtraccion de Adn A Partir de Sangre Periferica 1PamelaaGaytan100% (1)
- Informe L Extraccion de ADN L Liliana PautaDocumento4 páginasInforme L Extraccion de ADN L Liliana PautaJhOn OrtizAún no hay calificaciones
- Práctica 04 - Lisado de Plaquetas PDFDocumento2 páginasPráctica 04 - Lisado de Plaquetas PDFFiorella OlazarAún no hay calificaciones
- Extracción ADN Salting-outDocumento2 páginasExtracción ADN Salting-outCristina MartínezAún no hay calificaciones
- Extraccion de Adn BIOLOGIADocumento11 páginasExtraccion de Adn BIOLOGIAGermán Agustín Espinosa GonzálezAún no hay calificaciones
- Informe 1 Biotec TerminadoDocumento15 páginasInforme 1 Biotec TerminadoMackrino'z MkzAún no hay calificaciones
- Practica No 3 LBMDocumento3 páginasPractica No 3 LBMAna PadillaAún no hay calificaciones
- Propuesta de Taller para CongresoDocumento5 páginasPropuesta de Taller para CongresoangelicaAún no hay calificaciones
- Práctica No. 10 Extracción de ADNDocumento5 páginasPráctica No. 10 Extracción de ADNJhonnyer ValenciaAún no hay calificaciones
- BIOMOLÉCULAS: ADN, ARN y proteínasDocumento11 páginasBIOMOLÉCULAS: ADN, ARN y proteínasJULIÁN ALFREDO GARCÍA GUERRAAún no hay calificaciones
- Cuaderno de Prácticas 2 Evaluación PDFDocumento10 páginasCuaderno de Prácticas 2 Evaluación PDFdesireeAún no hay calificaciones
- Ing Gen P2Documento3 páginasIng Gen P2luis david carrasco rabanalAún no hay calificaciones
- Práctica de Fenol CloroformoDocumento3 páginasPráctica de Fenol CloroformoDanerys PayaresAún no hay calificaciones
- PRACTICA Extraccion Arn TrizolDocumento6 páginasPRACTICA Extraccion Arn TrizolDaniel TorresAún no hay calificaciones
- EjemploDocumento8 páginasEjemploMaira Sofia Palacios ValenciaAún no hay calificaciones
- Práctica #5 - Extracción de Ácidos NucleicosDocumento18 páginasPráctica #5 - Extracción de Ácidos NucleicosNICOLD CACERES HIDALGOAún no hay calificaciones
- Guia de Laboratorio Extraccion DnaDocumento18 páginasGuia de Laboratorio Extraccion DnaAndru ZerepAún no hay calificaciones
- Equipo 2 Práctica 7 Extracción ADNDocumento12 páginasEquipo 2 Práctica 7 Extracción ADNMilagros NuñezAún no hay calificaciones
- P13 Aislamiento de DNA BacterianoDocumento5 páginasP13 Aislamiento de DNA BacterianoCARLOS DANIEL POLANCO DIAZAún no hay calificaciones
- Guia de Prácticas Del Curso de Genética MicrobianaDocumento11 páginasGuia de Prácticas Del Curso de Genética MicrobianaAlmendra Astete FarfánAún no hay calificaciones
- Practica 5Documento6 páginasPractica 5yaelAún no hay calificaciones
- Practica No 7 LBMDocumento5 páginasPractica No 7 LBMAna PadillaAún no hay calificaciones
- Extracción de ADNDocumento5 páginasExtracción de ADNYennyUrrutia0% (1)
- Práctica 3 Aislamiento de ADN de Levadura Mediante Fenol CloroformoDocumento5 páginasPráctica 3 Aislamiento de ADN de Levadura Mediante Fenol CloroformoFranklin Joel Eche PoloAún no hay calificaciones
- Informe de Laboratorio 5-T Pinargote PDFDocumento7 páginasInforme de Laboratorio 5-T Pinargote PDFtania pinargoteAún no hay calificaciones
- Laboratorio No 4 Extraccion de Arn PDFDocumento10 páginasLaboratorio No 4 Extraccion de Arn PDFsonia eliana chozo mestanzaAún no hay calificaciones
- Reporte de Practica Extraccion y Cuantificacion de ADNDocumento10 páginasReporte de Practica Extraccion y Cuantificacion de ADNCESAR DAVID CONRADI CARPIOAún no hay calificaciones
- Practica 3 Lgmc.biologia MolecularDocumento11 páginasPractica 3 Lgmc.biologia Molecularnmbsf2fthjAún no hay calificaciones
- Extracción de ADN a partir de salivaDocumento3 páginasExtracción de ADN a partir de salivaMar LetrasAún no hay calificaciones
- BI-09D-24 (P - Bioelementos - Agua y Sales Minerales) FM - A1 ,... XXXDocumento3 páginasBI-09D-24 (P - Bioelementos - Agua y Sales Minerales) FM - A1 ,... XXXDavid Alva AlbaAún no hay calificaciones
- PRECIPITACIONDocumento16 páginasPRECIPITACIONMilagros ApazaAún no hay calificaciones
- CiclosDocumento9 páginasCiclosatilio martinezAún no hay calificaciones
- Empresas Que Elaboran Hornos Metalúrgicos IndustrialesDocumento2 páginasEmpresas Que Elaboran Hornos Metalúrgicos IndustrialesAnderson Mantari GarciaAún no hay calificaciones
- Integración y Regulación Metabólica: Dra. Gisela Pita Rodríguez Profesor AuxiliarDocumento42 páginasIntegración y Regulación Metabólica: Dra. Gisela Pita Rodríguez Profesor AuxiliarLilianEstherRuizGonzalezAún no hay calificaciones
- Practica Calificada 1 Geologia SD CGT Agosto 2022 30584 (Yuli Rosariaponce Mamani)Documento3 páginasPractica Calificada 1 Geologia SD CGT Agosto 2022 30584 (Yuli Rosariaponce Mamani)YULI PONCEAún no hay calificaciones
- ALDEHÍDOSDocumento5 páginasALDEHÍDOSNandoAún no hay calificaciones
- Riesgos del gas grisú en minas de carbónDocumento4 páginasRiesgos del gas grisú en minas de carbónIngrid FletcherAún no hay calificaciones
- Permanganato de PotasioDocumento3 páginasPermanganato de PotasioApolinario Ayala Juan CarlosAún no hay calificaciones
- Calor y Temperatura en Arquitectura: Conceptos BásicosDocumento30 páginasCalor y Temperatura en Arquitectura: Conceptos BásicosKaren AcostaAún no hay calificaciones
- GENETICA Microbiana. IVDocumento45 páginasGENETICA Microbiana. IV306_duenas_arturoAún no hay calificaciones
- Equipo No 5 Practica 2.Documento12 páginasEquipo No 5 Practica 2.Mayra Virginia Aguilar GuzmanAún no hay calificaciones
- Practica 8 Tratamiento TermicoDocumento13 páginasPractica 8 Tratamiento TermicoAlan HernándezAún no hay calificaciones
- Tratabajo de TratamientoDocumento5 páginasTratabajo de TratamientoNancy QuispeAún no hay calificaciones
- ContinueDocumento2 páginasContinueBoescu SimonaAún no hay calificaciones
- Metagenomica MarinaDocumento16 páginasMetagenomica MarinaEduardo Perez Hdz.Aún no hay calificaciones
- Infografia EspectofotometroDocumento2 páginasInfografia EspectofotometroEmili BetancourtAún no hay calificaciones
- Actividad N°1Documento24 páginasActividad N°1nisadeAún no hay calificaciones
- Practica 2 Propiedades de Hidrocarburos SaturadosDocumento9 páginasPractica 2 Propiedades de Hidrocarburos SaturadosAna Luisa Esparza GalvanAún no hay calificaciones
- OiDocumento31 páginasOimauricio llanosAún no hay calificaciones
- Informe de Trabajo de Titulación: Escuela Superior Politécnica Agropecuaria de Manabí Manuel Félix LópezDocumento49 páginasInforme de Trabajo de Titulación: Escuela Superior Politécnica Agropecuaria de Manabí Manuel Félix LópezAdrian AlonsoAún no hay calificaciones
- Akcela Premium Anti-Freeze 4LTSDocumento6 páginasAkcela Premium Anti-Freeze 4LTSVeronica CamargoAún no hay calificaciones
- Análisis de alimentosDocumento2 páginasAnálisis de alimentosAna ArizalAún no hay calificaciones
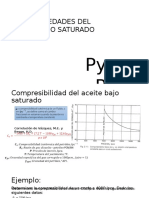
- Propiedades Del Aceite Bajo SaturadoDocumento11 páginasPropiedades Del Aceite Bajo SaturadoFernando XCAún no hay calificaciones
- Biotecnología y BioinformáticaDocumento50 páginasBiotecnología y BioinformáticaJoanAún no hay calificaciones
- DETERMINACION DE CENIZAS Informe Por TerminarDocumento4 páginasDETERMINACION DE CENIZAS Informe Por TerminarJhoan Aguilar CrisolesAún no hay calificaciones
- Pirolisis Cataltica de Pebdacarbono e HidrocarburosDocumento7 páginasPirolisis Cataltica de Pebdacarbono e HidrocarburosMely's Dbk GuevaraAún no hay calificaciones
- Esteres PDFDocumento26 páginasEsteres PDFLarry CapijaAún no hay calificaciones