Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Nefropatía Por Pérdida de Proteínas
Cargado por
Andres Quispe zapata0 calificaciones0% encontró este documento útil (0 votos)
16 vistas9 páginasEs un resumen de un artículo
Derechos de autor
© © All Rights Reserved
Formatos disponibles
DOCX, PDF, TXT o lea en línea desde Scribd
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoEs un resumen de un artículo
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
0 calificaciones0% encontró este documento útil (0 votos)
16 vistas9 páginasNefropatía Por Pérdida de Proteínas
Cargado por
Andres Quispe zapataEs un resumen de un artículo
Copyright:
© All Rights Reserved
Formatos disponibles
Descargue como DOCX, PDF, TXT o lea en línea desde Scribd
Está en la página 1de 9
Nefropatía por pérdida de proteínas
La proteinuria es un hallazgo frecuente a través del análisis de orina en
animales con enfermedad del tracto urinario. La detección de pequeñas
cantidades de proteína en la orina puede indicar una enfermedad glomerular
temprana o la presencia de otros procesos patológicos. La enfermedad
glomerular es una causa común de insuficiencia e insuficiencia renal.4 Las
nefropatías perdedoras de proteínas (PLN) pueden ser una manifestación
clínica de enfermedades sistémicas. La detección temprana puede llevar a la
identificación y tratamiento de un proceso patológico subyacente, retrasando
así, pero raramente deteniendo, el desarrollo de proteinuria cuando el
glomérulo ha sido dañado.
FISIOPATOLOGÍA
La proteinuria es causada por uno de tres procesos básicos.
• Preglomerular (es decir, fiebre, hipotermia, ejercicio intenso, congestión
venosa)
o Las causas de la proteinuria preglomerular suelen dar lugar a una
proteinuria leve y transitoria, y la mayoría de estas causas suelen
descartarse con una anamnesis y un examen físico completos. Otras
proteínas, como la hemoglobina y la mioglobina, se filtran libremente a
través del glomérulo y pueden estar presentes en la orina. Estas proteínas
hacen que la orina permanezca roja después de la centrifugación
• Glomerular
o Para que la proteinuria sea glomerular, tiene que haber daño a los
glomérulos, más comúnmente por glomerulonefritis o amiloidosis.
• Postglomerular (es decir, hemorragia o inflamación del tracto urogenital,
falta de reabsorción tubular)
o Las causas posglomerulares son más comúnmente el resultado de cistitis,
metritis, prostatitis o neoplasia y generalmente involucran sedimento
inflamatorio concurrente o hematuria. La otra posibilidad de proteinuria
posglomerular es la falta de reabsorción. Puede haber una pequeña
cantidad de proteína en el ultrafiltrado, pero los túbulos normales
degradan y reabsorben esta proteína.7 La pérdida de electrolitos y glucosa
con la glucosamia normal puede indicar un trastorno tubular renal que
puede acompañar a la proteinuria (síndrome similar a Fanconi).
Las células mesangiales son componentes importantes del glomérulo. Estas
células están ubicadas entre dos capilares vecinos y tienen un papel
contráctil, influyendo en la tasa de filtración glomerular (TFG). Las células
mesangiales también juegan un papel importante en la perpetuación de la
respuesta inmune a la glomerulonefritis.
Algunas sustancias vasoactivas y citocinas (p. Ej., Endotelinas,
angiotensina II, vasopresina, noradrenalina, factor activador de
plaquetas, tromboxano A2, histamina) pueden provocar la contracción
de las células mesangiales, lo que reduce la TFG.
Otros, como el péptido natriurético auricular, la dopamina y el cAMP,
provocan la relajación de las células mesangiales.
Las células mesangiales también pueden activar los linfocitos T, que
pueden perpetuar aún más el proceso de la enfermedad al reclutar
otras células inmunes. Las prostaglandinas (PG) y los tromboxanos
desempeñan un papel en la patogenia local de la glomerulonefritis y son
focos de tratamientos potenciales.
Algunas PG (es decir, PGE y prostaciclina) son beneficiosas porque inhiben la
función plaquetaria; causar relajación de las células mesangiales, lo que
resulta en vasodilatación; y tienen un efecto antiinflamatorio en los riñones.
Por el contrario, los tromboxanos tienden a inducir la activación plaquetaria,
son quimiotácticos para los neutrófilos y causan contracción y
vasoconstricción de las células mesangiales, además de interferir con la
fagocitosis mesangial de los complejos inmunitarios, lo que posiblemente
conduzca a una disminución de la TFG.
Las causas de la glomerulonefritis se pueden dividir en dos categorías:
• Glomerulonefritis primaria (idiopática): no se identifica ninguna
enfermedad concurrente.
• Glomerulonefritis secundaria: el daño al glomérulo es el resultado de una
enfermedad sistémica identificada. Las causas de la glomerulonefritis
secundaria en perros y gatos incluyen muchas enfermedades infecciosas,
afecciones inflamatorias, neoplasias, herencia, ciertos fármacos y
endocrinopatías (Tabla 1).
En enfermedades inmunomediadas (secundarias a agentes infecciosos, daño
de órganos / tejidos), los complejos antígeno-anticuerpo dentro de los
glomérulos conducen a la activación del complemento con infiltración de
neutrófilos, linfocitos T y macrófagos.Se produce una mayor destrucción
secundaria a la agregación plaquetaria, la activación de la cascada de
coagulación y la formación de fibrina. El glomérulo responde a esta agresión
liberando citocinas y factores de crecimiento adicionales, lo que conduce a la
proliferación de células mesangiales, producción de matriz mesangial,
adhesión de células inflamatorias, aumento de la permeabilidad vascular,
coagulación intraglomerular y deposición de fibrina.
El daño al glomérulo ocurre cuando los complejos inmunes o amiloide,
respectivamente, se depositan en las paredes capilares del glomérulo. Los
complejos antígeno-anticuerpo pueden estar circulando en la sangre y
posteriormente depositarse en el glomérulo, o el antígeno se incrusta dentro de
la pared capilar glomerular y el anticuerpo se une al antígeno in situ. Una vez
que ocurre este daño glomerular, la permeabilidad selectiva se pierde y la
proteína ingresa al ultrafiltrado en los túbulos renales. Las propias proteínas
aumentan el procesamiento lisosómico de la proteína, que es tóxica para las
células epiteliales tubulares.
Como resultado, los lisosomas se hinchan y se rompen, lo que da como
resultado una lesión tubulointersticial, fibrosis y eventual pérdida de la
nefrona. Los cilindros de proteínas también contribuyen a la pérdida de
nefronas al obstruir el túbulo.
Los cilindros hialinos o de proteínas detectados mediante análisis de orina
pueden sugerir una pérdida excesiva de proteínas con enfermedad glomerular.
La hiperfiltración con aumento de la presión hidráulica de las nefronas
restantes puede dañar los glomérulos menos afectados y empeorar la
proteinuria. Si alguna porción de la nefrona se daña de manera irreversible, se
perderá toda la nefrona. Una vez que se pierde más del 66% al 75% de la
función de la nefrona, se desarrolla azoemia renal. Algunos perros con PLN
conservan la capacidad de concentrar la orina con azotemia glomerular
concurrente. El grado de proteinuria puede disminuir con el tiempo a medida
que se pierden las nefronas. Sin embargo, no se debe suponer que esto
indique que la enfermedad glomerular y el PLN están mejorando.
En un estudio, se demostró que la amiloidosis es una de las causas más
comunes de enfermedades glomerulares en perros y representa el 23% de los
perros con enfermedad glomerular. La amiloidosis es el resultado de la
deposición de un fragmento de un reactivo de fase aguda, el amiloide A. El tipo
más común de amiloidosis en perros es secundaria o reactiva. En la
amiloidosis reactiva, el hígado sintetiza el amiloide A sérico en respuesta a una
lesión tisular. La inflamación crónica puede resultar en un aumento
prolongado de la concentración sérica de amiloide A, lo que lleva al desarrollo
de amiloidosis reactiva, aunque pueden estar involucrados otros factores (p.
Ej., Hereditarios, ambientales). En este mismo estudio, se determinó que un
proceso patológico subyacente estaba causando amiloidosis en solo el 32% de
los casos. Los beagles, collies y perros Walker pueden tener un mayor riesgo
de amiloidosis. La amiloidosis familiar es una causa poco común de
amiloidosis y puede ocurrir en beagles, raposeros ingleses, shar-peis y gatos
abisinios. Con la amiloidosis renal en shar-peis y abisinios, el amiloide se
deposita principalmente en la médula renal; por tanto, la proteinuria puede no
ser tan marcada. La amiloidosis primaria o asociada a inmunoglobulina
implica el depósito de fragmentos de cadena ligera de inmunoglobulina en el
tejido y es poco común en perros y gatos. La amiloidosis, en general, es poco
común en gatos.
HISTORIA Y EXAMEN FÍSICO
Los signos clínicos de PLN dependen de la gravedad de la enfermedad
glomerular.
Por ejemplo, un animal puede tener pérdida de peso y un pelaje descuidado y
sin brillo o parecer clínicamente normal y tener un resultado positivo en la
prueba de microalbuminuria. Algunos animales pueden mostrar
predominantemente signos clínicos de una enfermedad subyacente asociada.
En las últimas etapas del proceso de la enfermedad, estos animales pueden
tener anomalías más obvias, como anorexia, vómitos, diarrea, poliuria,
polidipsia y anemia, como se observa típicamente con insuficiencia renal
descompensada. Algunos perros con PLN conservan la capacidad de
concentrar la orina con azoemia renal concurrente, asumiendo que no hay
azotemia pre o posrenal. Esto se conoce como desequilibrio glomerulotubular,
en el que la tasa de filtración glomerular disminuye, lo que produce azotemia
renal, pero los túbulos aún pueden concentrar la orina. Por tanto, la presencia
de una muestra de orina concentrada no descarta la posibilidad de una
enfermedad glomerular significativa. Los animales con PLN grave también
pueden presentar signos clínicos compatibles con el síndrome nefrótico, que se
caracteriza por una proteinuria marcada, que produce hipoalbuminemia,
hipercolesterolemia (es decir, aumento de la producción hepática en respuesta
a una presión oncótica baja) y ascitis o edema. El síndrome nefrótico se
observa en casos graves de proteinuria y es más típico de amiloidosis y
nefropatía membranosa.
En pacientes con proteinuria significativa se pueden observar
tromboembolismo, hiperlipidemia e hipertensión. La proteína antitrombolítica
antitrombina III tiene aproximadamente el mismo tamaño que la albúmina. La
pérdida de antitrombina III, junto con otros factores, contribuye a la
propensión a que ocurra tromboembolismo. Se ha demostrado que la actividad
de la antitrombina III es anormal si los niveles de albúmina sérica están por
debajo de 1.8 mg / dl.
La vasculopatía glomerular cutánea y renal, también conocida como pudrición
de Alabama, ocurre en galgos de carreras adultos jóvenes, que generalmente
se presentan con úlceras cutáneas bien delimitadas principalmente en las
extremidades. Algunos perros pueden desarrollar proteinuria y azotemia. Se
desconoce la causa de la vasculopatía glomerular cutánea y renal, y la
presencia de azotemia parece tener un peor pronóstico.
DIAGNÓSTICO
El diagnóstico de PLN es bastante sencillo y se basa en la proteinuria sin
sedimento activo ni hematuria. Dado que la mayor parte de la creatinina se
excreta después de entrar en los túbulos renales, proporciona una buena
estimación de la TFG. Por lo tanto, si los niveles de creatinina en orina se
comparan con la cantidad de proteína en la orina mediante una relación
proteína: creatinina en orina, se puede cuantificar la cantidad de proteinuria.
Los resultados de la relación proteína: creatinina en orina se correlacionan
bastante estrechamente con una medición de 24 horas de la excreción de
proteínas en la orina.
Una relación proteína: creatinina en orina de menos de 0,4 a 0,5 es normal
en perros y gatos. Un valor superior a 1 debe motivar una evaluación
diagnóstica exhaustiva. La muestra de orina debe obtenerse mediante
cistocentesis para minimizar la contaminación del tracto urogenital. La
microalbuminuria indica que el nivel o la cantidad de albúmina perdida, en
lugar del tamaño molecular (es decir, <69 kD) de la molécula perdida, está por
debajo del nivel mínimo detectado por los análisis de orina de uso común.
Ciertos ELISA para microalbuminuria canina y felina detectan niveles de
albúmina (no otras proteínas) de 1 a 30 mg / dl en orina. Se ha demostrado
que la microalbuminuria ocurre antes de los aumentos en la relación proteína:
creatinina en orina. Actualmente existen dos pruebas disponibles
comercialmente para microalbuminuria (es decir, ERD-Screen Orine Test,
Heska Corp .; VetTest Urine P: C Ratio, IDEXX). En un estudio, 24 una tira
reactiva humana semicuantitativa comercial (Clinitek Microalbumin, Bayer
Corp.) para microalbuminuria demostró ser poco confiable para detectar
microalbuminuria en perros. En los gatos, la prueba de orina ERD-Screen
parece tener una sensibilidad del 95% y una especificidad superior al 99%.
Se necesitan más estudios para determinar la importancia de la
microalbuminuria en gatos como una correlación con la proteinuria y la
progresión de la enfermedad renal. Aunque se pueden usar tiras de orina
convencionales no fabricadas específicamente para detectar albúmina canina
y felina, estas son semicuantitativas y tienen un número sustancial de
resultados falsos positivos y falsos negativos en comparación con los ELISA
específicos de especie. Las tiras de orina detectan y miden valores de albúmina
de 30 mg / dl9 o más, mientras que la prueba de turbidez con ácido
sulfosalicílico se puede utilizar para confirmar la presencia de proteinuria
(valores ≥5 mg / dl). La prueba de turbidez del ácido sulfosalicílico es capaz de
detectar otras proteínas, como las proteínas de Tamm-Horsfall y Bence Jones.
La concentración de orina y el pH también deben evaluarse al interpretar estas
pruebas.5 Un resultado de 3+ en una prueba de turbidez con ácido
sulfosalicílico es más significativo en una muestra de orina isostenúrica que
en una muestra altamente concentrada. Pueden producirse resultados
inexactos en la orina que es muy alcalina, diluida o turbia.
Una base de datos mínima para animales con proteinuria debe incluir un
hemograma, un perfil bioquímico del suero y un análisis de orina con cultivo y
pruebas de sensibilidad. Debido a que la PLN es a menudo una secuela de una
enfermedad sistémica, se debe hacer un intento agresivo para identificar una
causa subyacente (Tabla 1). Las imágenes de diagnóstico deben incluir una
radiografía del tórax y el abdomen, así como una ecografía abdominal. Se
deben realizar pruebas serológicas para enfermedades infecciosas y procesos
inflamatorios específicos de la ubicación geográfica. Puede justificarse la
consideración de enfermedades inmunomediadas y la detección adecuada (es
decir, prueba de anticuerpos antinucleares, prueba de Coombs directa,
inmunoelectroforesis). La monitorización sistémica de la presión arterial es
fundamental. Un examen físico cuidadoso es esencial para identificar
problemas potenciales como enfermedad periodontal o masas cutáneas o
rectales que pueden estar causando estimulación antigénica crónica (por
ejemplo, dermatitis, parasitismo, enfermedad inflamatoria intestinal).
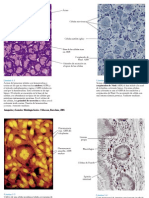
Un diagnóstico definitivo requiere un examen histológico con microscopía
inmunofluorescente y microscopía electrónica de los glomérulos de una
biopsia de la corteza renal. Debe evitarse la médula renal porque se asocia con
una mayor incidencia de complicaciones, como hemorragia. Las biopsias
pueden sugerir la causa subyacente de la enfermedad glomerular y permitir
que el veterinario instituya un plan de tratamiento más dirigido. Algunos de
los tipos histológicos de glomerulopatías son amiloidosis, glomerulonefritis
membranoproliferativa, nefropatía membranosa, glomerulonefritis
proliferativa, nefritis hereditaria, enfermedad de cambios mínimos y
glomeruloesclerosis. Se debe tener cuidado al seleccionar a los pacientes para
la biopsia renal, y los médicos también deben ser evaluados al interpretar
estas pruebas.5 Un resultado de 3+ de una prueba de turbidez con ácido
sulfosalicílico es más significativo en una muestra de orina isostenúrica que
en una muestra altamente concentrada. Pueden producirse resultados
inexactos en la orina que es muy alcalina, diluida o turbia.
Una base de datos mínima para animales con proteinuria debe incluir un
hemograma, un perfil bioquímico del suero y un análisis de orina con cultivo y
pruebas de sensibilidad. Debido a que la PLN es a menudo una secuela de una
enfermedad sistémica, se debe hacer un intento agresivo para identificar una
causa subyacente (Tabla 1). Las imágenes de diagnóstico deben incluir una
radiografía del tórax y el abdomen, así como una ecografía abdominal. Se
deben realizar pruebas serológicas para enfermedades infecciosas y procesos
inflamatorios específicos de la ubicación geográfica. Puede justificarse la
consideración de enfermedades inmunomediadas y la detección adecuada (es
decir, prueba de anticuerpos antinucleares, prueba de Coombs directa,
inmunoelectroforesis). La monitorización sistémica de la presión arterial es
fundamental. Un examen físico cuidadoso es esencial para identificar
problemas potenciales como enfermedad periodontal o masas cutáneas o
rectales que pueden estar causando estimulación antigénica crónica (por
ejemplo, dermatitis, parasitismo, enfermedad inflamatoria intestinal). sopesar
el riesgo frente al beneficio para cada paciente; Se recomienda
encarecidamente una prueba de coagulación antes de la biopsia.
La cuestión principal que debe abordarse para justificar el riesgo es si los
hallazgos histopatológicos alterarían sustancialmente el plan de tratamiento
del paciente. Las biopsias renales no están justificadas para animales que ya
tienen insuficiencia renal. Los métodos para obtener tejido e interpretar la
histopatología no se discuten aquí (consulte “Glomerulonefritis en perros y
gatos: diagnóstico y tratamiento” en la edición de septiembre de 2001 del
Compendio).
TRATAMIENTO
El tratamiento de las glomerulopatías siempre debe dirigirse a tratar el
proceso de enfermedad sistémica subyacente cuando se identifica, tratar
sintomáticamente la azotemia cuando está presente y disminuir la cantidad de
proteína perdida. Las proporciones seriadas de proteína: creatinina en orina
son esenciales para controlar las tendencias con la respuesta al tratamiento o
la progresión de la enfermedad. El tratamiento de la azoemia puede incluir
mantener un estado de hidratación normal, mejorar los signos
gastrointestinales secundarios al síndrome urémico, cambios en la dieta y
terapia para alteraciones ácido-base, anomalías electrolíticas, presión arterial
sistémica y endocrinopatías resultantes de enfermedad renal. Los tratamientos
adicionales de PLN (vea el cuadro en esta página) pueden incluir inhibidores
de la enzima convertidora de angiotensina (ECA), aspirina en dosis bajas, una
dieta baja en proteínas y ácidos grasos poliinsaturados omega-3 (PUFA). Las
terapias específicas para la amiloidosis han demostrado ser ineficaces. Si la
amiloidosis se diagnostica antes de la insuficiencia renal, especialmente en
shar-peis, la colchicina puede ser útil (consulte el recuadro de la página 693).
La colchicina reduce la liberación de la proteína amiloide A sérica de los
hepatocitos y puede reducir un mediador llamado factor potenciador de
amiloide. Se ha informado de un éxito anecdótico con dimetilsulfóxido, que se
cree que ayuda al actuar como antiinflamatorio tanto en el hígado como en los
riñones (ver recuadro en la página 693).
Se ha demostrado que los inhibidores de la ECA, como el maleato de enalapril,
disminuyen significativamente la cantidad de proteinuria al causar
vasodilatación de las arteriolas renales, principalmente la arteriola eferente.
Esto reduce la presión hidráulica a través del glomérulo; por lo tanto, se
“expulsa” menos proteína del glomérulo hacia el ultrafiltrado en el túbulo.
Enalapril puede tener efectos beneficiosos adicionales:
• Reducir la pérdida de heparán sulfato glomerular (ayuda a mantener la carga
negativa)
• Disminución del tamaño de los poros endoteliales de los capilares
glomerulares
• Mejora del metabolismo de las lipoproteínas
• Ralentización del crecimiento y la proliferación mesangial glomerular
• Inhibir la degradación de la bradicinina
La dosis inicial habitual de enalapril es de 0,5 mg / kg / día. Si la relación
proteína: creatinina en orina no disminuye en 2 a 4 semanas, la frecuencia de
la dosis debe aumentarse a cada 12 horas. Cuando se reciben inhibidores de
la ECA, se debe controlar a los pacientes para detectar un posible deterioro del
estado renal, como un aumento de la azotemia; por lo tanto, las
concentraciones basales de nitrógeno ureico en sangre y creatinina deben
obtenerse antes de la terapia y repetirse dentro de los 7 días.5 Los pacientes
que no pueden tolerar los inhibidores de la ECA a menudo tienen un apetito
disminuido. Enalapril se elimina predominantemente por los riñones y se
sugiere una dosis reducida de enalapril en un 33% para perros y gatos con
insuficiencia renal leve (es decir, azotemia). Por el contrario, los perros con
insuficiencia renal pueden eliminar adecuadamente el benazepril,
posiblemente convirtiéndolo en una mejor elección de inhibidor de la ECA en
animales, especialmente gatos, con insuficiencia renal; sin embargo, ninguno
puede resultar eficaz en gatos con proteinuria secundaria a hipertensión
sistémica.
La terapia con aspirina está dirigida a disminuir la agregación plaquetaria y
puede disminuir la probabilidad de tromboembolismo.5 A dosis normales, la
aspirina bloquea la vía de la ciclooxigenasa, incluida la producción de
tromboxano y PG. En una dosis mucho más baja de 0.5
mg / kg cada 12-24 h (cada 48 h para gatos), la aspirina bloquea
irreversiblemente la producción de tromboxano por las plaquetas sin
disminuir los efectos beneficiosos de la producción de PGI2 (es decir,
prostaciclina) .13,14,21 Al bloquear la producción de tromboxano, los efectos
adversos de los tromboxanos, como La agregación plaquetaria dentro del
glomérulo y la contracción de las células mesangiales que desaceleran la TFG
disminuyen12-14. En el futuro, las modalidades de tratamiento alternativas
pueden incluir inhibidores de la tromboxano sintasa, que han demostrado ser
prometedores para disminuir la cantidad de proteinuria en perros con
glomerulonefritis inducida experimentalmente.5, 12 A través de efectos
renoprotectores y al reducir la hipertrigliceridemia y disminuir la presión
arterial sistémica en humanos, los AGPI omega-3 también han demostrado ser
beneficiosos en la enfermedad renal crónica.14,34 Las dietas renales
comerciales para perros generalmente contienen una proporción más alta de
AGPI omega-3 y también tienen el beneficio de la restricción de fósforo, sodio y
proteínas.14 Disminuir la cantidad de proteína en la dieta puede disminuir la
cantidad nt de proteinuria y es un componente importante del tratamiento.21
El uso de fármacos inmunosupresores para tratar la glomerulonefritis es
controvertido. Los fármacos inmunosupresores están indicados si la causa que
provoca la enfermedad glomerular es el resultado de una inflamación crónica o
una enfermedad inmunomediada. En realidad, la prednisolona puede inducir
enfermedad glomerular y aumentar la proteinuria.18,35,36 Si se utilizan
corticosteroides, deben administrarse con precaución, incluida la
monitorización seriada juiciosa de la relación proteína: creatinina en orina
para detectar valores crecientes. Ciertos tipos de glomerulonefritis,
identificados solo mediante histopatología (p. Ej., Nefropatía membranosa
primaria de la enfermedad de cambios mínimos), han mostrado una mejoría
con los esteroides.14 Se ha demostrado que la ciclosporina no ofrece ningún
beneficio, pero se necesitan estudios futuros con respecto al uso de fármacos
inmunosupresores en el tratamiento diversas enfermedades glomerulares.3
PRONÓSTICO
El pronóstico para los pacientes con PLN es variable y depende de la gravedad
y extensión de la enfermedad renal y de cualquier enfermedad sistémica
subyacente, así como de la respuesta al tratamiento.6 Si hay azotemia en el
momento del diagnóstico, el tiempo promedio hasta la muerte de los perros es
menos de 3 meses18. Los indicadores de mal pronóstico en humanos incluyen
azotemia concurrente, proteinuria grave, hipertensión sistémica y lesiones
tubulointersticiales marcadas; esto probablemente también sea cierto en los
animales.14
También podría gustarte
- SD Nefrotico y Nefritico MIDocumento8 páginasSD Nefrotico y Nefritico MIluxe.parfum2022Aún no hay calificaciones
- Absorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleDe EverandAbsorción con filtro BK como terapia eficaz en el riñón del mieloma múltipleAún no hay calificaciones
- Tema 10 ProteinasDocumento4 páginasTema 10 Proteinasmass_mofiAún no hay calificaciones
- Síndrome NefróticoDocumento32 páginasSíndrome Nefróticopediatría ucsgAún no hay calificaciones
- Errores innatos en el metabolismo: Un abordaje integral del diagnóstico al tratamientoDe EverandErrores innatos en el metabolismo: Un abordaje integral del diagnóstico al tratamientoAún no hay calificaciones
- Valor Normal: Proteínas Totales 6 A 8 G/D Albumina 3 A 5 G/D Globulina Entre 2 y 4 G/DDocumento13 páginasValor Normal: Proteínas Totales 6 A 8 G/D Albumina 3 A 5 G/D Globulina Entre 2 y 4 G/DSorany RamirezAún no hay calificaciones
- Bases Anatomopatológicas De La Enfermedad Quirúrgica: Tomo IDe EverandBases Anatomopatológicas De La Enfermedad Quirúrgica: Tomo IAún no hay calificaciones
- GlomerulopatiasDocumento26 páginasGlomerulopatiasGuillermo DonadoAún no hay calificaciones
- Fisiopatología RenalDocumento4 páginasFisiopatología RenalBelen Coila VillanuevaAún no hay calificaciones
- Fármacología básica para el odontólogo: Conocimientos básicos odontológicos, #1De EverandFármacología básica para el odontólogo: Conocimientos básicos odontológicos, #1Calificación: 5 de 5 estrellas5/5 (4)
- Sindrome NefriticoDocumento3 páginasSindrome Nefriticovaleriam10Aún no hay calificaciones
- SX Nefritico Etc 2023Documento64 páginasSX Nefritico Etc 2023Maria Luiza silveira santosAún no hay calificaciones
- Comprendiendo El Alzhéimer: 7 mitos y verdades que debes conocerDe EverandComprendiendo El Alzhéimer: 7 mitos y verdades que debes conocerCalificación: 5 de 5 estrellas5/5 (1)
- Glomerulonefritis Hgenrique Cabrera 1226370070155679 8Documento33 páginasGlomerulonefritis Hgenrique Cabrera 1226370070155679 8FERNANDO ARAUZ JUSTINIANOAún no hay calificaciones
- Ensayo Sindrome NefroticoDocumento3 páginasEnsayo Sindrome NefroticoNoveno A 2023Aún no hay calificaciones
- Riñón y Sistema ColectorDocumento32 páginasRiñón y Sistema ColectorIndira BonolaAún no hay calificaciones
- GlomerulopatiasDocumento10 páginasGlomerulopatiasValeria LondoñoAún no hay calificaciones
- 35 Enfermedades GlomerularesDocumento29 páginas35 Enfermedades GlomerularesCarlos Alberto GAún no hay calificaciones
- Guia Fisiopatologia 1-UasdDocumento12 páginasGuia Fisiopatologia 1-UasdtiffanyAún no hay calificaciones
- GlomerulopatiasDocumento5 páginasGlomerulopatiasCynthia Arizanca CallataAún no hay calificaciones
- GLOMERULONEFRITISDocumento7 páginasGLOMERULONEFRITISAngel MejiaAún no hay calificaciones
- Sindromes Nefrotico y NefriticoDocumento5 páginasSindromes Nefrotico y NefriticoLulu MendíaAún no hay calificaciones
- Sindrome NefroticoDocumento3 páginasSindrome NefroticoAthina Borches MujicaAún no hay calificaciones
- Síndrome NefríticoDocumento8 páginasSíndrome Nefríticoleurys107Aún no hay calificaciones
- Síndrome NefríticoDocumento7 páginasSíndrome NefríticoLaura MorilloAún no hay calificaciones
- Insuficiencia Renal AgudaDocumento5 páginasInsuficiencia Renal Agudasoroheder vera castilloAún no hay calificaciones
- Sindrome NefriticoDocumento5 páginasSindrome NefriticoSonia RamonAún no hay calificaciones
- Actualizacion Síndrome Nefrítico 2014Documento9 páginasActualizacion Síndrome Nefrítico 2014Ivette Espinoza100% (3)
- Ensayo Síndrome NefróticoDocumento3 páginasEnsayo Síndrome NefróticoNatalia GarciaAún no hay calificaciones
- Tema 3Documento6 páginasTema 3JAMACHI CHAMBI CELMAR RUDDYAún no hay calificaciones
- Enfermedades GlomerularesDocumento10 páginasEnfermedades GlomerularesShara MejiaAún no hay calificaciones
- Sindrome Nefrotico PDFDocumento7 páginasSindrome Nefrotico PDFMiguel GarciaAún no hay calificaciones
- Síndrome Nefrítico y NefróticoDocumento12 páginasSíndrome Nefrítico y NefróticoGermán Guzmán CaroAún no hay calificaciones
- Resumen Doctora BlancoDocumento121 páginasResumen Doctora BlancoJuanPAún no hay calificaciones
- ProteinuriaDocumento6 páginasProteinuriaNaara LópezAún no hay calificaciones
- Síndrome Nefrótico - NefríticoDocumento5 páginasSíndrome Nefrótico - NefríticoWendy Analy OchoaAún no hay calificaciones
- Amiloidosis RenalDocumento8 páginasAmiloidosis RenalRodrigoAprendeBienAún no hay calificaciones
- Síndrome NefróticoDocumento12 páginasSíndrome NefróticoALIAGA DAZA DANIELAún no hay calificaciones
- Tema 4Documento5 páginasTema 4JAMACHI CHAMBI CELMAR RUDDYAún no hay calificaciones
- SX Nefritico SemiologíaDocumento15 páginasSX Nefritico SemiologíaxeronlerouxAún no hay calificaciones
- Cuestionario GlomerulopatiasDocumento13 páginasCuestionario GlomerulopatiasNicolle SosaAún no hay calificaciones
- Endotoxemia en EquinosDocumento7 páginasEndotoxemia en EquinosEmanuel Sanchez Santiago33% (3)
- Hiperproteinemias e HipoproteinemiasDocumento4 páginasHiperproteinemias e HipoproteinemiasErick Liñan AlarconAún no hay calificaciones
- Renal FisiopatologiaDocumento29 páginasRenal FisiopatologiaFABIANA ANDREA TERÁN ENRÍQUEZAún no hay calificaciones
- Articulo Sindrome NefroticoDocumento5 páginasArticulo Sindrome NefroticoKristelle HernandezAún no hay calificaciones
- Glomerulopatías 66 1Documento17 páginasGlomerulopatías 66 1Bertin RomeroAún no hay calificaciones
- Sindrome NefriticoDocumento4 páginasSindrome NefriticoEdwin TravelsAún no hay calificaciones
- Trabajo Grupo 3Documento11 páginasTrabajo Grupo 3luisAún no hay calificaciones
- Preguntas Debate Sobre Causas PrimariasDocumento5 páginasPreguntas Debate Sobre Causas PrimariasYsania RamirezAún no hay calificaciones
- GLOMERULONEFRITISDocumento4 páginasGLOMERULONEFRITISSLENDY DAYANNA GIL AYALAAún no hay calificaciones
- Articulo 4 Sindrome NefroticoDocumento11 páginasArticulo 4 Sindrome NefroticoJair Willman Ayala RamosAún no hay calificaciones
- RenalDocumento5 páginasRenalhildanysAún no hay calificaciones
- Edema RenalDocumento10 páginasEdema RenalYessHdez100% (1)
- Síndrome Nefrítico PediatríaDocumento4 páginasSíndrome Nefrítico PediatríaGregoryAún no hay calificaciones
- Resumos RenalDocumento113 páginasResumos RenalalvaroAún no hay calificaciones
- TAREA 2 PropeDocumento6 páginasTAREA 2 PropedaelAún no hay calificaciones
- Skin of Fish - En.esDocumento15 páginasSkin of Fish - En.esAndres Quispe zapataAún no hay calificaciones
- DolorDocumento1 páginaDolorAndres Quispe zapataAún no hay calificaciones
- DolorDocumento1 páginaDolorAndres Quispe zapataAún no hay calificaciones
- FarmacologiaDocumento20 páginasFarmacologiaPaula YanethAún no hay calificaciones
- 2009 Grupos y Acciones FarmacológicosDocumento12 páginas2009 Grupos y Acciones Farmacológicosehtoledoc212783% (6)
- Examen Practico Unidad II BDocumento3 páginasExamen Practico Unidad II BAndres Quispe zapataAún no hay calificaciones
- Jamon InglésDocumento10 páginasJamon InglésAndres Quispe zapataAún no hay calificaciones
- Historia Natural de La EnfermedadDocumento6 páginasHistoria Natural de La EnfermedadAndres Quispe zapataAún no hay calificaciones
- Programa Educativo Ester BarriosDocumento61 páginasPrograma Educativo Ester BarriosCali MendizabalAún no hay calificaciones
- Sindrome Nefrotico y NefriticoDocumento2 páginasSindrome Nefrotico y NefriticoYamil BurgosAún no hay calificaciones
- Asignatura: Terapéutica Y Cuidados Paliativos Ciclo: V Semestre Academico: 2021-1Documento201 páginasAsignatura: Terapéutica Y Cuidados Paliativos Ciclo: V Semestre Academico: 2021-1The goyos Aranda TrigosoAún no hay calificaciones
- Análisis Bioquímico 2Documento124 páginasAnálisis Bioquímico 2Talulah GoshAún no hay calificaciones
- RIÑÓNDocumento7 páginasRIÑÓNParker GreenAún no hay calificaciones
- Mapa Conceptual Capitulo 4Documento8 páginasMapa Conceptual Capitulo 4Juan CaizaAún no hay calificaciones
- InsufrenalDocumento42 páginasInsufrenalEDITH NATERAAún no hay calificaciones
- Silabo UcvDocumento10 páginasSilabo UcvFRANCISCO MARCIAL CUEVA DONAYREAún no hay calificaciones
- Anatomia Del Higado, Riñones y Glandulas SuprarrenalDocumento9 páginasAnatomia Del Higado, Riñones y Glandulas Suprarrenalosmary valeraAún no hay calificaciones
- Funcion Renal en El Adulto MayorDocumento7 páginasFuncion Renal en El Adulto MayorjosewalAún no hay calificaciones
- Sistema Urinario Alumnos SubrayadoDocumento14 páginasSistema Urinario Alumnos SubrayadoAdriana TenorioAún no hay calificaciones
- Aparato Urinario TortoraDocumento70 páginasAparato Urinario TortoraStefany PertuzAún no hay calificaciones
- Examen de Fisiologia Renal RamDocumento2 páginasExamen de Fisiologia Renal RamSanchezramses614Aún no hay calificaciones
- Fisiologia RenalDocumento8 páginasFisiologia RenalVitor LópezAún no hay calificaciones
- SX Nefrotico y Nefritico para ProyectarDocumento31 páginasSX Nefrotico y Nefritico para ProyectarSalvador CancheAún no hay calificaciones
- LaminasDocumento65 páginasLaminasMisc LázaroAún no hay calificaciones
- Examen Integrador de HistologíaDocumento16 páginasExamen Integrador de Histologíalaura verdiAún no hay calificaciones
- Abp - Renal FinalDocumento2 páginasAbp - Renal FinalKarolay Fiestas PaicoAún no hay calificaciones
- Anatomia Del Sistema Urinario y Renal PDFDocumento42 páginasAnatomia Del Sistema Urinario y Renal PDFManuela GonzalezAún no hay calificaciones
- Acumulaciones IntracelularesDocumento3 páginasAcumulaciones IntracelularesJhordhanny Cabrera VillafañaAún no hay calificaciones
- Resumen Básico de Sistema RenalDocumento4 páginasResumen Básico de Sistema RenalSebi JinichAún no hay calificaciones
- Dietoterapia en Patología Renales ML 2017 4 OctubreDocumento100 páginasDietoterapia en Patología Renales ML 2017 4 OctubreArnold Barra100% (1)
- 45555Documento16 páginas45555Sonia RamonAún no hay calificaciones
- 3 Parcial AnatoDocumento5 páginas3 Parcial AnatoKarly Ayala CarrilloAún no hay calificaciones
- Guia FisioDocumento24 páginasGuia FisioEdher ArturoAún no hay calificaciones
- Guia de PracticaDocumento22 páginasGuia de PracticaJessica Alarcon Fernandez100% (3)
- Aparato UrinarioDocumento26 páginasAparato UrinarioBELEN SANCHEZ VASQUEZAún no hay calificaciones
- Liquidos Corp - Circulacion RenalDocumento38 páginasLiquidos Corp - Circulacion RenalMarta CasasAún no hay calificaciones
- CAPITULOSDocumento17 páginasCAPITULOSDhayana MendozaAún no hay calificaciones
- Notas Nefrología, 2020Documento50 páginasNotas Nefrología, 2020PauFlorastAún no hay calificaciones