Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Capitulo 3 Inflamacion y Reparacion
Capitulo 3 Inflamacion y Reparacion
Cargado por
María De Los Angeles Vitterí EdenTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Capitulo 3 Inflamacion y Reparacion
Capitulo 3 Inflamacion y Reparacion
Cargado por
María De Los Angeles Vitterí EdenCopyright:
Formatos disponibles
lOMoARcPSD|3839408
Capitulo 3- InflamaciÓn Y ReparaciÓn
Fisiopatología Médica General (Universidad de Pamplona)
StuDocu no está patrocinado ni avalado por ningún colegio o universidad.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
CAPITULO 3- INFLAMACION Y REPARACION
PERSPECTIVA GENERAL DE LA INFLAMACION: DEFINICIONES Y CARACTERISTICAS GENERALES
La inflamación es la respuesta de los tejidos vascularizados a las infecciones y al daño tisular. Esto provoca que
células y moléculas defensoras pasen de la circulación al lugar donde son necesarias con el fin de eliminar los agentes
causantes de la agresión. La inflamación sirve para eliminar la causa de la lesión celular y de sus consecuencias. Los
mediadores de la defensa se encuentran los leucocitos fagocitos, anticuerpos y proteínas del complemento, los
cuales circulan normalmente en la sangre y tejidos, por eso es que pasan rápidamente a cualquier parte del cuerpo. Sin
inflamación, las infecciones no se controlarían, las heridas no cicatrizarían y los tejidos lesionados quedarían
ulcerados. Además de las células inflamatorias, los componentes de la inmunidad innata comprenden otras células como
los linfocitos citoliticos naturales, las células dendríticas, células epiteliales, componentes solubles como las
proteínas del complemento. Todos estos componentes de la inmunidad innata conforman la primera línea de respuesta
ante la infección y también eliminan células dañadas y cuerpos extraños.
Proceso de inflamación:
1. El agente responsable, ubicado en los tejidos extravasculares, es reconocido por células y moléculas del
anfitrión.
2. Los leucocitos y proteínas plasmáticas son reclutados llegando a la ubicación donde está el agresor.
3. Los leucocitos y proteínas son activados y actúan juntos para destruir y eliminar al agresor.
4. La reacción es controlado y concluida
5. El tejido dañado es recuperado
Propiedades fundamentales de la respuesta inflamatoria:
• Componentes de la respuesta inflamatoria: Los principales componentes en los tejidos son los vasos
sanguíneos y los leucocitos (Fig. 3-1). Los vasos sanguíneos se dilatan para ralentizar el flujo y aumentando la
permeabilidad para que determinadas proteínas circulen hacia el sitio de infección. Los leucocitos ya reclutados se
activan y adquieren la capacidad de ingerir y destruir microbios, células muertas, cuerpos extraños y materiales no
deseados.
• Consecuencias nocivas de la inflamación: la reacción inflamatoria va
acompañada de daño de tejido y se asocian a signos y síntomas (dolor y deterioro
funcional) estas reacciones ocurren espontáneamente y disminuyan a medida que la
inflamación se reduce causando una afectación leve. Por otro lado, hay muchas
enfermedades en las que la reacción inflamatoria no se orienta de forma adecuada
(enfermedades autoinmunes), en estos casos la reacción inflamatoria protectora, se
convierte en causa de enfermedad. En medicina clínica se presta gran atención a las
consecuencias lesivas de la inflamación (Tabla 3.1). La inflamación se ve implicada en
una amplia variedad de enfermedades que se consideran esencialmente metabólicas,
degenerativas como la diabetes tipo 2, Alzheimer y el cáncer.
• Inflamación local y sistémica: la inflamación se centra en la reacción tisular, que
es una respuesta local a una infección o a una lesión localizada. Aunque estas reacciones
locales tienen ciertas manifestaciones sistémicas como la fiebre que la mayoría de
veces se queda aislada en el sitio de la infección o lesión. En situaciones poco
frecuentes, como determinadas infecciones bacterianas diseminadas, la reacción
inflamatoria es sistémica, esto se denomina sepsis.
• Mediadores de la inflamación: las reacciones vasculares y celulares son desencadenadas por factores solubles,
producidos por diversas células o proteínas plasmáticas y son generadas en respuesta al estímulo inflamatorio.
Los microbios, las células necróticas y la hipoxia pueden inducir a la elaboración de mediadores
inflamatorios. Estos mediadores inician y amplifica la respuesta inflamatoria y determinan su gravedad, y
manifestaciones clínicas y patológicas.
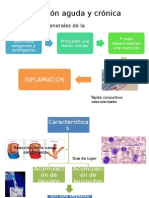
• Inflamación aguda y crónica: (tabla 3-2)
- inflamación aguda, es la respuesta inicial a las infecciones, produce una leve lesión tisular se desarrolla en
minutos u horas y su duración es de pocos días. Sus principales características son el edema y la migración de
leucocitos (neutrófilos principalmente). Conforma la inmunidad innata. Si la respuesta no erradica el estímulo,
la reacción puede evolucionar pasando a la inflamación crónica.
- inflamación crónica, es de duración más prolongada y se asocia a la destrucción de tejidos y la presencia
de linfocitos y macrófagos, proliferación de vasos sanguíneos y depósito de tejido conjuntivo. Conforma la
inmunidad adaptativa
• Conclusión de la inflamación e inicio de la reparación tisular: la inflamación concluye cuando el agente
responsable es eliminado. La reacción va disminuyendo porque los mediadores se degradan y se disipan y los
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
leucocitos tienen ciclos vitales cortos en los tejidos; además los mecanismos antiinflamatorios se activan para
controlar la respuesta y evitar que se cause daño excesivo en el anfitrión. Luego se activa la reparación tisular, en
el que el tejido dañado se remplaza mediante la regeneración de las células supervivientes y la cicatrización.
HITOS HISTORICOS
Las características clínicas de la inflamación fueron descritas en un papiro egipcio en el 3000 a. C. Celso en el siglo I d. C
enumero los signos de la inflamación: rubor (eritema), tumor (hinchazón), calor y dolor que son característicos de la
inflamación aguda. Un quinto signo, la perdida de función (functio laesa) fue añadido por Virchow en el XIX. En 1793
Hunter observó que la inflamación no es una enfermedad sino una respuesta estereotipada que ejerce un efecto saludable
en el anfitrión. En 1889 Metchinkoff descubrió que el propósito de la inflamación era llevar células fagocíticas a la zona
lesionada para englobar las bacterias invasoras. Sir Thomas Lewis descubrió que sustancias químicas como la histamina
median los cambios vasculares de la inflamación.
CAUSAS DE LA INFLAMACION
• Infecciones: Bacterias, virus, hongos, parásitos y toxinas microbianas son las causas más frecuentes y más
importantes de la inflamación. Cada uno genera diversa respuesta inflamatoria que va desde inflamación aguda
leve, provocando una lesión leve o sin lesión hasta reacciones sistémicas graves que son potencialmente mortales
o reacciones crónicas prolongadas que producen grandes daños tisulares.
• Necrosis tisular: Induce inflamación con independencia de la causa de la muerte celular, que puede ser isquemia,
traumatismo o agresión física y química. Diversas moléculas liberadas por las células necróticas provocan
inflamación.
• Cuerpos extraños: Causan inflamación por sí mismo o por producir una lesión tisular traumática o por transportar
microorganismos. Algunas sustancias endógenas son nocivas si se acumulan en los tejidos, como los
cristales de urato (causa gota), cristales de colesterol (aterosclerosis) y lípidos (obesidad).
• Reacciones inmunitarias: El sistema inmunitario daña los tejidos de la persona afectada. Puede dirigirse contra
los autoantígenos dando lugar a enfermedades autoinmunes o puede ser reacciones anómalas como las alergias.
Dado que el estímulo generador no se puede eliminar, las reacciones son persistentes y se asocian a inflamación
crónica. La inflamación es provocada por citosinas producidas por los LT y otras células del sistema
inmunitario.
RECONOCIMIENTO DE MICROBIOS Y CELULAS DAÑADAS
El reconocimiento del agente es el primer paso para la inflamación. Las células y los receptores que desempeñan la función
de reconocimiento han evolucionado para adaptarse a los patógenos y de este modo poder responder de una mejor
manera. Diversos receptores celulares y proteínas circulantes son capaces de reconocer los microbios y productos
causantes de potencial daño celular, estimulando la inflamación.
• Receptores microbianos de las células: las células expresan receptores en su membrana plasmática (para
microrganismos extracelulares), los Endosomas para microbios ingeridos y el citosol para microbios
intracelulares. Todo esto permite que la célula identifique invasores. Los receptores se expresan en células
epiteliales, células dendríticas, macrófagos y otros leucocitos. Los receptores estimulan la producción de
moléculas implicadas en la inflamación como las moléculas de adhesión de células endoteliales y citocinas.
• Sensores de lesión tisular: los receptores citosólicos reconocen moléculas liberadas o alteradas como
consecuencia del daño celular, moléculas como el ácido úrico (producto de la degradación del ADN), ATP
(producido por mitocondrias dañadas), concentraciones reducidas de K intracelular (perdida de iones por lesión de
la membrana plasmática), ADN, cuando es liberado al citoplasma y no queda secuestrado en los núcleos. Estos
receptores activan el inflamasoma que induce a la producción de IL-1, la cual recluta leucocitos y así producir la
inflamación. El inflamasoma también se ve implicado en reacciones inflamatorias ante cristales de urato (causante
de gota), lípidos (obesidad), cristales de colesterol (aterosclerosis), depósitos de amiloide en el cerebro
(Alzheimer).
• Otros receptores celulares implicados en la inflamación: algunos leucocitos expresan receptores Fc de los
anticuerpos y las proteínas del complemento. Estos receptores reconocen microorganismos recubiertos por
anticuerpos y complemento (opsonización) y fomentan la ingestión y destrucción de microorganismos como
la inflamación.
• Proteínas circulantes: el complemento reacciona contra microbios y produce mediadores de inflamación. La
lectina de unión a manosa, reconoce los azucares y favorece la ingestión de los microbios y activa el
complemento, la colectina también ayuda al combate contra microrganismos.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
INFLAMACION AGUDA
Tiene tres componentes principales:
1. Dilatación de pequeños vasos -> aumenta el flujo sanguíneo
2. Aumento de la permeabilidad de la microvasculatura -> permite el paso de proteínas plasmáticas y leucocitos al
foco de infección
3. Migración de los leucocitos desde la microcirculación -> para eliminar el agente causal
Cuando una persona se enfrenta a un microorganismo infeccioso, los fagocitos intentan erradicarlo, simultáneamente los
fagocitos y células centinela de los tejidos reconocen la presencia de sustancias anómalas y liberan citocinas, mensajeros
lipídicos y otros mediadores inflamatorios.
REACCIONES DE LOS VASOS SANGUINEOS EN LA INFLAMACION AGUDA
Las reacciones consisten en cambios del flujo sanguíneo y la permeabilidad de los vasos y de este modo facilitar el
movimiento de las proteínas plasmáticas y leucocitos del torrente sanguíneo al foco de la infección. El paso de líquido,
proteínas y células sanguíneas del sistema vascular al tejido intersticial o cavidad corporal se conoce como exudación
(figura. 3-2).
Un exudado es un líquido extravascular con altas concentraciones de proteínas y abundantes restos celulares. Su
presencia implica aumento de la permeabilidad de los vasos sanguíneos pequeños, estimulado por lesión tisular y
por una reacción inflamatoria.
Un transudado es un líquido con un bajo contenido de proteínas (principalmente albumina), poco material celular y baja
densidad. Consta de un ultrafiltrado del plasma producido por un desequilibrio osmótico o hidrostático a través de la pared
vascular, sin aumento de la permeabilidad de los vasos.
El edema es la presencia de un exceso de líquido en el espacio intersticial o cavidades serosas (puede ser un exudado o
un transudado)
El pus es un exudado inflamatorio purulento, rico en leucocitos (sobre todo neutrófilos), células muertas y microbios
CAMBIOS EN EL FLUJO Y CALIBRE DE LOS VASOS
Los cambios se inician después de la lesión y son los siguientes:
➢ La vasodilatación es inducida por acción de varios mediadores, sobre todo la histamina, sobre el musculo liso
vascular. Es una de los primeros cambios de la inflamación aguda. Primero afecta arteriolas y luego abre nuevos
lechos capilares, lo que aumenta el flujo que causa calor y enrojecimiento (eritema).
➢ Aumento de la permeabilidad de la microvasculatura y de este modo liberar un líquido rico en proteínas al tejido
extravascular.
➢ La pérdida de líquido y la vasodilatación producen un flujo sanguíneo lento, aumento de la concentración de
eritrocitos en los pequeños vasos y un aumento de la viscosidad sanguínea, todo esto produce un estancamiento
de los eritrocitos en los pequeños vasos, denominada estasis y se observa congestión vascular y enrojecimiento
localizado del tejido afectado.
➢ Los leucocitos sanguíneos, principalmente neutrófilos, se acumulan en el endotelio vascular. A su vez las células
endoteliales se activan por mediadores producidos en los sitios de infección y lesión tisular y expresan moléculas
de adhesión. Luego de adherirse al endotelio, los leucocitos migran hacia los tejidos intersticiales.
AUMENTO DE LA PERMEABILIDAD VASCULAR (EXTRAVASACION VASCULAR)
Varios mecanismos son responsables del aumento de la permeabilidad de las vénulas poscapilares, esto es característico
de la inflamación aguda (FIGURA 3.3)
➢ La contracción de las células endoteliales produce un incremento de los espacios interendoteliales y de este modo
se produce la extravasación vascular. Esto es inducido por la histamina, bradicinina, leucotrienos y otros
mediadores químicos. Se denomina respuesta transitoria inmediata puesto que tiene lugar después de la
exposición al mediador y dura ente 15 a 30 min, aunque en formas leves de lesión (quemadura, radiación o rayos
UV) la extravasación vascular comienza con un retraso entre 2 y 12 h y puede durar desde horas hasta días. Esta
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
extravasación prolongada retardada se debe a la contracción de las células
endoteliales o a la lesión endotelial leve, por ejemplo, las quemaduras solares de
aparición tardía.
➢ Lesión endotelial, que induce necrosis celular y desprendimiento, el
daño del endotelio se produce en lesiones graves como quemaduras o por
microbios. Los neutrófilos que se adhieren al endotelio durante la inflamación,
pueden también lesionar las células endoteliales. Esta extravasación comienza
inmediatamente después de la lesión y dura unas horas hasta que los vasos son
reparados.
➢ El incremento del transporte de líquidos y proteínas a través de la
célula endotelial se denomina TRANSCITOSIS. Se cree que este proceso afecta
a canales intracelulares que son estimulados por el factor de crecimiento endotelial
vascular (VEGF), que favorecen a la extravasación vascular.
RESPUESTA DE LOS VASOS Y GANGLIOS LINFATICOS
Los vasos linfáticos participan en la lesión aguda. Los ganglios linfáticos filtran y
limpian los líquidos extravasculares. En inflamación el flujo linfático aumenta y ayuda
a drenar el líquido de edema que se acumula por el aumento de la permeabilidad
vascular, además de drenar el líquido, leucocitos y restos celulares como microbios
pasan a la linfa. Los vasos linfáticos proliferan durante la inflamación. En ocasiones,
los vasos linfáticos experimentan inflamación secundaria (linfagitis), que también
afecta los ganglios (linfadenitis). Los vasos linfáticos pueden aumentar de tamaño
por hiperplasia de los folículos linfáticos y por mayor número de linfocitos y
macrófagos, todos estos cambios se denominan linfadenitis inflamatoria
RECLUTAMIENTO DE LEUCOCITOS PARA LOS SITIOS DE INFLAMACIÓN
Los cambios en el flujo sanguíneo y la permeabilidad vascular van seguidos por un flujo de entrada de leucocitos en los
tejidos. Los principales leucocitos en la inflamación son los que pueden fagocitar, como los neutrófilos y macrófagos, que
destruyen microorganismos, tejido necrótico y sustancias extrañas, también producen factores de crecimiento. A veces
cuando los leucocitos se activan intensamente generan lesión tisular y prolongan la inflamación.
El paso de leucocitos de la luz del vaso a los tejidos esta mediado y controlado por moléculas de adhesión y citocinas
llamadas quimiocinas. Etapas del proceso (Figura 3.4):
1. En la luz: marginación, rodamiento y adhesión al endotelio. En su estado normal el endotelio vascular no adhiere
células circulantes e impide su paso, en la inflamación el endotelio fija leucocitos para que pasen al tejido.
2. Migración a través del endotelio y la pared vascular.
3. Migración en los tejidos hacia el estímulo quimiotáctico.
ADHESION AL ENDOTELIO
En el flujo sanguíneo normal, los eritrocitos quedan en el medio del vaso, desplazando a los leucocitos a la pared. Durante
la inflamación el flujo sanguíneo se ralentiza (estasis), las condiciones hemodinámicas cambian (la tensión de cizallamiento
de la pared disminuye) y aumenta el número de leucocitos que se desplazan a la pared, este proceso se denomina
marginación. Luego los leucocitos se adhieren de manera transitoria al endotelio y se vuelven a unir, proceso llamado
rodamiento. Por ultimo las células quedan en reposo y se adhieren con firmeza, esta fijación es mediada por moléculas
de adhesión cuya expresión es incrementada por citocinas. Estas citocinas son secretadas por células centinela en
respuesta a microbios.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
Las dos principales moléculas de adhesión son las selectinas y las integrinas, expresadas en leucocitos y células
endoteliales.
▪ Las interacciones de rodamiento iniciales son mediadas por las selectinas, de las que hay tres tipos; las que se
expresan en leucocitos (L), otra en el endotelio (E) y otro en plaquetas y endotelio (P). Los ligandos de las selectinas
son oligosacáridos sialilados unidos a esqueletos de glucoproteínas similares a la mucina. La expresión de
selectinas y sus ligandos es regulada por citocinas producidas en respuesta a la infección y la lesión. Los
macrófagos, mastocitos tisulares y células endoteliales que hallan células muertas o microbios secretan citocinas
como el TNF, IL-1 y quimiocinas. El TNF y la IL-1 actúan sobre las células endoteliales de las vénulas poscapilares
adyacentes a la infección e inducen la expresión coordinada de numerosas moléculas de adhesión. Luego de 2
horas las células endoteliales comienzan a expresar selectina E y ligando de selectina L, por otro lado, la histamina
y trombina estimulan la redistribución desde reservas intracelulares normales en gránulos de células endoteliales
(llamado cuerpos de Weibel-Palade) hasta la superficie celular. Los leucocitos expresan selectina L en las puntas
de sus microvellosidades y ligandos para selectinas E y P que se unen al complemento. De este modo se generan
reacciones de baja afinidad y de este modo se produce el rodamiento.
▪ El rodamiento disminuye el movimiento de los leucocitos y les permite unirse firmemente al endotelio. Esta
adhesión es mediada por las integrinas. El TNF y la IL-1 inducen expresión endotelial de ligandos para las
integrinas, sobre todo dela VCAM-1 y VLA-4 1 y de moléculas de adhesión intercelular 1, como la ICAM-1, 2
LFA-1 y Mac-1. Las quimiocinas que se producen en el lugar de lesión se unen a los proteoglucanos celulares
endoteliales y son desplegados en la superficie endotelial. Estas quimiocinas se unen a los leucocitos en
rodamiento para activarlos. Esta unión produce la conversión de VLA-1 y LFA1 en los leucocitos, pasando a un
estado de alta afinidad. La combinación de ligandos de integrinas en el endotelio indicada por las citocinas y el
aumento de afinidad de las integrinas de los leucocitos fija el leucocito al endotelio, después el leucocito reorganiza
su citoesqueleto y se expande por la superficie endotelial.
MIGRACION DE LEUCOCITOS A TRAVES DEL ENDOTELIO
El siguiente paso es conocido como migración. Tiene lugar en las vénulas poscapilares. Las quimiocinas actúan sobre los
leucocitos adherentes y estimulan a las celulas para que migren por los espacios interendoteliales a favor de un gradiente
de concentracion química. Las moléculas de adhesion que están en las uniones intercelulares entre las celulas endoteliales
que ayudan a la migración de leucocitos son de la superfamilia de las inmunoglobulinas llaado CD31 o PECAM-1. Tras
atravesar el endotelio, los leucocitos perforan la membrana basal, secretando colagenasas y penetran el tejido
extravascular.
QUIMIOTAXIA DE LOS LEUCOCITOS
Los leucocitos, después de salir de la circulación, se desplazan hacia el sitio de la lesión mediante la quimiotaxia, que es
el movimiento a lo largo de un gradiente químico.
Agentes quimiotácticos:
• Sustancias exógenas: Productos bacterianos, péptidos que poseen un a.a terminal N-formilmetionina y ciertos
lípidos.
• Sustancias endógenas: Mediadores químicos como citocinas, en especial la familia de las quimiocinas (IL-8);
componentes del sistema del complemento (C5a); y metabolitos del ácido araquidónico (leucotrieno B4
(LTB4)).
Todos estos agentes se unen a siete receptores transmembrana específicos, acoplados a la proteína G, en los leucocitos.
Estos receptores envían señales que activan segundos mensajeros, que aumentan el calcio citosólico y activan Guanosina
trifosfatasas de la familia Rac/Rho/cdc42 y cinasas. Estas señales aumentan la cantidad de actina polimeriza en el frente
de avance de la célula e inducen localización de filamentos de miosina en la parte posterior. El leucocito se desplaza
extendiendo filopodios que tiran de la parte posterior de la célula hacía delante, y así migra hacia el estímulo inflamatorio.
La naturaleza del infiltrado leucocítico varía según la duración de la respuesta inflamatoria y del tipo de estímulo. En la
inflamación aguda predominan los neutrófilos en el infiltrado inflamatorio durante las primeras 6-24h y se sustituyen por
monocitos en las 24-48h. Esto se debe a que los neutrófilos son más numerosos que otros leucocitos en sangre, responden
más rápido a las quimiocinas y se fijan con mayor firmeza a las moléculas de adhesión de las células endoteliales (selectina
P y E). Tras penetrar los tejidos, los neutrófilos tienen una vida corta (de 24-48h) a diferencia de los monocitos que
sobreviven más tiempo y proliferan en los tejidos, siendo la población dominante en reacciones inflamatorias prolongadas.
Pero hay excepciones: en algunas infecciones causadas por bacterias del género Pseudomonas los neutrófilos predominan
varios días, en infecciones víricas llegan primero los linfocitos, en reacciones de hipersensibilidad predominan los linfocitos
activados, macrófagos y células plasmáticas, y en reacciones alérgicas los eosinófilos.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
Después de que los leucocitos han sido reclutados para actuar en el sitio de infección o muerte celular, han de ser activados
para que cumplan sus funciones:
1. Reconocer agentes causales por medio de los TLR u otros receptores.
2. Activan leucocitos para la fagocitosis y destruir agentes causales.
FAGOCITOSIS Y ELIMINACIÓN DEL AGENTE CAUSAL
El reconocimiento de microbios o células muertas induce la
activación leucocítica (FIGURA 3.7), la cual se produce
mediante vías de señalización originadas en los leucocitos,
dando lugar a un aumento de Ca2+ citosólico y activación de
enzimas (proteínas cinasa C y fosfolipasa A2). Las respuestas
funcionales más importantes para la destrucción de microbios
y otros agresores son la fagocitosis y la muerte intracelular.
FAGOCITOSIS
Se da mediante tres pasos (FIGURA 3.8): 1) Reconocimiento
y fijación de la partícula que va a ser ingerida por el leucocito.
2) Atrapamiento y formación de vacuola fagocítica o
fagosoma. 3) Destrucción y degradación del material
ingerido.
RECEPTORES FAGOCÍTICOS. Se fijan a los microbios y los
ingieren.
• Receptor de manosa de los macrófagos: Es una lectina
que se une a los residuos terminales de manosa y fucosa de
glucoproteínas y glucolípidos, los cuales se encuentran en las
moléculas de las paredes celulares microbianas (en los
mamíferos terminan en ácido siálico o N-acetilgalactosamina). Así estos receptores reconocen los microbios y no
las células del anfitrión.
• Receptores barredores o depuradores: Moléculas que fijan y median la endocitosis de partículas de lipoproteínas
de baja densidad (LDL) oxidadas o acetiladas que no interactúan con el receptor LDL convencional. Los receptores
depuradores de los macrófagos se unen a varios microorganismos y a partículas de LDL modificado. Las integrinas
de los macrófagos (como la Mac-1, CD11b/CD18) se unen a microbios para fagocitarlos.
• Receptores de diversas opsoninas: Las opsoninas mejoran la eficacia de la fagocitosis. Entre ellas están los
anticuerpos IgG, el producto de la degradación de C3b del complemento y ciertas lectinas plasmáticas.
ATRAPAMIENTO
La partícula se une a los receptores de los fagocitos, después extensiones del citoplasma (seudópodos) la envuelven
formando una vesícula (fagosoma), que rodea a la partícula. Luego, el fagosoma se fusiona con un gránulo lisosómico,
liberando el contenido del gránulo hacia el fagolisosoma y también lo libera al espacio extracelular.
Las señales iniciadas por los receptores generan cambios en la membrana y en el citoesqueleto. La fagocitosis depende
de la polimerización de filamentos de actina.
DESTRUCCIÓN INTRACELULAR DE MICROBIOS Y RESIDUOS
La muerte de los microbios la causan especies reactivas o intermediarios de oxígeno (ERO) y especies reactivas del
nitrógeno derivadas del NO, que destruyen los residuos fagocitados. Estos mecanismos destructivos están almacenados
en los lisosomas, a los que son llevados los materiales fagocitados. Y hay sustancias nocivas que son segregadas por
citoplasma y núcleo para evitar un daño en el fagocito mientras realiza su función.
Especies reactivas del O2. Las ERO se producen por el ensamblaje y activación de NADPH oxidasa (fagocito oxidasa),
que oxida el NADPH y reduce el oxígeno a anión superóxido (O2-). En los neutrófilos esta reacción se da por una activación
de señales: estallido respiratorio u oxidativo. La fagocito oxidasa, complejo enzimático, posee 7 proteínas. Tras un
estímulo de activación, los componentes proteínicos citosólicos se translocan a la membrana fagosómica, donde se
ensamblan y forman el complejo enzimático. Las ERO se producen en el lisosoma y el fagolisosoma, actuando contra las
partículas ingeridas sin hacer daño al anfitrión. O2- pasa a H2O2 por dismutación espontánea. H2O2 por sí solo no ataca al
microbio, por lo que actúa la enzima mieloperoxidasa (MPO) de los neutrófilos, que en presencia de un haluro (Cl-) convierte
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
el H2O2 en hipoclorito (OCl2-, antimicrobiano). El hipoclorito destruye microorganismos por halogenación (el haluro se une
covalentemente a los componentes celulares) u oxidación de proteínas y lípidos (peroxidación lipídica). H2O2 se convierte
también en -OH, otro agente destructor.
Los radicales derivados del O2 se liberan al medio extracelular desde los leucocitos tras exposición a microbios,
quimiocinas, complejos Ag-Ac, o un ataque fagocítico. Las ERO ocasionan lesión celular por inflamación.
El suero, los líquidos tisulares y las células del anfitrión poseen mecanismos antioxidantes que protegen frente los radicales
derivados del O2. Entre estos antioxidantes están:
1. Enzima superóxido dismutasa
2. Enzima catalasa, inhibe la toxicidad del H2O2.
3. La glutatión peroxidasa, desintoxicante del H2O2.
4. La ceruloplasmina, proteína sérica con cobre.
5. Fracción libre del hierro de la transferrina sérica.
Óxido nítrico. Gas soluble producido a partir de arginina por acción del óxido nítrico sintasa (NOS) que participa en la
muerte microbiana. Hay 3 tipos de NOS: endotelial (eNOS), neuronal (nNOS) e inducible (iNOS). Las dos primeras se
expresan intrínsecamente y el NO que producen mantiene el tono vascular y actúa como neurotransmisor,
respectivamente. iNOS participa en la muerte microbiana, es inducida cuando los macrófagos y neutrófilos son activados
por citocinas (INF ) o por productos microbianos. En macrófagos, el NO reacciona con el superóxido generando un radical
libre derivado del nitrógeno peroxinitrito (ONOO-), los cuales tacan y dañan lípidos, proteínas y ácidos nucleicos de
microbios y células del anfitrión.
El NO también relaja el músculo liso vascular y favorece la vasodilatación.
Enzimas lisosómicas y otras proteínas de los lisosomas. Los neutrófilos y monocitos contienen gránulos lisosómicos
que causan muerte microbiana y que al ser liberado su contenido causan lesión celular. Los neutrófilos tienes 2 tipos de
gránulos: a) los menores, específicos (o secundarios), contienen lisozima, colagenasa, gelatinasa, lactoferrina, activador
del plasminógeno, histaminasa y fosfatasa alcalina. b) los mayores, azurófilos (o primarios), contienen mieloperoxidasa,
factores bactericidas (lisozima, defensinas), hidrolasas ácidas y proteasas neutras (elastasa, catepsina G, colagenasas
inespecíficas, proteinasa 3). Los dos tipos se funden con vacuolas fagocíticas o su contenido pasa al espacio extracelular.
Cada enzima tiene funciones diferentes: las proteasas ácidas degradan bacterias y residuos en los fagolisosomas,
acidificados por las bombas de protones, las proteasas neutras degradan componentes extracelulares como colágeno,
membrana basal, fibrina, elastina y cartílago, dando lugar a destrucción de tejidos, descomponen las proteínas C3 y C5
del complemento formando anafilotoxinas y liberando un péptido similar a la cinina, a partir de cininógeno. La neutrófilo
elastasa degrada factores de virulencia las bacterias y así combate infecciones bacterianas. Los macrófagos también
contienen hidrolasas ácidas, colagenasa, elastasa, fosfolipasa y activador del plasminógeno.
Estas enzimas al causar efectos destructivos, si no se regulan, incrementan la inflamación dañando tejidos. Por eso se
regulan por un sistema de antiproteasas presente en suero y líquidos tisulares, entre ellas está la α1-antitripsina que inhibe
la neutrófilo elastasa. Con una carencia de estos inhibidores da lugar a una acción continua de las proteasas leucocíticas,
como en pacientes carentes de la α1-antitripsina. La α2-macroglobulina es otra antiproteasa.
Los gránulos microbicidas contienen: Defensinas, péptidos granulares ricos en arginina catiónica que son tóxicos para los
microbios; Catelicidinas, proteínas antimicrobianas presentes en neutrófilos u otras células; Lisozima, hidroliza el enlace
murámico-N-acetilglucosamina, presente en el revestimiento glucopeptídico de las bacterias; Lactoferrina, proteína de
unión al hierro de gránulos específicos, y la proteína básica principal, proteína catiónica de los eosinófilos con actividad
bactericida limitada y citotóxica para varios parásitos.
TRAMPAS EXTRACELULARES DE NEUTRÓFILOS (TEN)
Son redes fibrilares extracelulares que aportan una elevada [ ] de sustancias antimicrobianas en los sitios de infección y
evitan la diseminación de los microorganismos al atraparlos en las fibrillas. Son producidos por neutrófilos en respuesta a
patógenos infecciosos (bacterias, hongos) y a mediadores inflamatorios (quimiocinas, citocinas [Interferones], proteínas
del complemento y ERO). Estas trampas son un entramado viscoso de cromatina nuclear que fija y concentra proteínas
granulares (péptidos y enzimas antimicrobianos). La TEN también se detectan en la sangre durante la sepsis y su formación
depende de la activación plaquetaria. La cromatina nuclear de las TEN incluye histonas y DNA, es fuente de antígenos
nucleares en enfermedades autoinmunitarias sistémicas (lupus, personas que reaccionan contra su propio DNA y
nucleoproteínas).
LESIÓN TISULAR MEDIADA POR LEUCOCITOS
Circunstancias:
• Defensa contra las infecciones cuando los tejidos adyacentes sufren un daño colateral. En infecciones difíciles de
erradicar (tuberculosis, enfermedades víricas), la respuesta prolongada del anfitrión empeora la patología en lugar
de los propios microbios.
• Cuando la respuesta inflamatoria actúa inadecuadamente contra los propios tejidos, como en las enfermedades
autoinmunitarias.
• Cuando el anfitrión experimenta una reacción excesiva contra sustancias ambientales inofensivas (enfermedades
alérgicas y asma).
Los mecanismos mediantes los cuales los leucocitos dañan los tejidos, al activarse, no diferencian entre agresor y anfitrión,
como los de la defensa antimicrobiana. Durante la activación y fagocitosis, neutrófilos y macrófagos producen en el
fagolisosoma sustancias microbicidas (ERO, NO y enzimas lisosómicas), liberadas también al espacio extracelular. Estas
sustancias pueden dañar las células normales y el epitelio vascular. Si no se regulo o es inadecuadamente dirigido contra
los tejidos del anfitrión, el propio infiltrado leucocítico se convierte en el agresor, como ocurre en ciertas enfermedades
agudas o crónicas (Tabla 3-1).
Los contenidos de los gránulos lisosómicos son secretados por los leucocitos el medio extracelular por varios mecanismos.
Si los fagocitos encuentran materiales que no los digieren fácilmente (inmunocomplejos en superficies lisas no móviles
como en la membrana basal glomerular), o la incapacidad de encapsularlos e ingerirlos (fagocitosis frustrada) desencadena
la activación y liberación de grandes cantidades de enzimas lisosómicas al medio extracelular. Fagocitar cristales de urato
puede dañar la membrana del fagolisosoma, lo que también provoca la liberación del contenido.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
Otras respuestas funcionales de los leucocitos activados
Los leucocitos, en especial macrófagos, producen citocinas, que pueden amplificar o limitar las reacciones inflamatorias;
factores de crecimiento, que estimulan la proliferación de células endoteliales y fibroblastos y la síntesis del colágeno, y
enzimas que remodelan tejidos conjuntivos. Por lo que estos macrófagos son esenciales en la inflamación crónica y la
reparación de los tejidos, cuando la inflamación aguda ha remitido.
En la inflamación aguda también actúan neutrófilos y macrófagos, linfocitos T. En especial por la producción de la citocina
IL-17 (llamada células TH17), la cual induce secreción de quimiocinas que reclutan leucocitos. En ausencia de esta, la
persona es sensible a infecciones fúngicas y bacterianas, se desarrollan abscesos cutáneos fríos, sin calor ni
enrojecimiento (característica de la inflamación aguda).
TERMINACIÓN DE LA RESPUESTA INFLAMATORIA AGUDA
Se necesitan de controles estrictos que minimicen los daños. La inflamación remite
cuando se han eliminado los agentes causales, ya que los mediadores de la inflamación
se producen rápidamente mientras el estímulo persiste, son de vida corta y se degradan
después de ser liberados. Los neutrófilos tienen semividas cortas en los tejidos y mueren
por apoptosis pocas horas después de salir del torrente sanguíneo. A medida que la
inflamación se desarrolla se emiten señales de detención que ponen fin de forma activa
a la reacción. Estos mecanismos de terminación se dan por el cambio del tipo de
metabolito del ácido araquidónico producido (los leucotrienos proinflamatorios se
reemplazan por lipoxinas antiinflamatorias), y la liberación de citocinas antiinflamatorias
(TGF- y la IL-10) por los macrófagos y otras células. Los impulsos nerviosos
(colinérgicos, de descarga) también son mecanismos de control que inhiben la
producción de TNF en los macrófagos.
MEDIADORES DE LA INFLAMACIÓN
Son sustancias que inician y regulan las reacciones inflamatorias. Propiedades y principios generales de su producción y
sus efectos:
• Los mediadores más importantes de la inflamación aguda son las aminas vasoactivas, productos lipídicos
(prostaglandinas y leucotrienos), citocinas (quimiocinas) y productos de la activación del complemento.
• Los mediadores son secretados por células o producidos por proteínas plasmáticas. Los mediadores
derivados de células están almacenados en gránulos intracelulares y son secretados por exocitosis granular
(histamina de los gránulos de los mastocitos) o sintetizados ex novo (prostaglandinas y leucotrienos, citocinas) en
respuesta a un estímulo. Los principales tipos celulares que producen mediadores de la inflamación aguda son los
macrófagos, células dendríticas y mastocitos, pero también se puede dar en plaquetas, neutrófilos, células
endoteliales y la mayoría de epitelios. Los mediadores derivados del plasma (proteínas del complemento) se
producen más que todo en hígado, y en la circulación están en su forma inactiva por lo que deben activarse por
proteólisis.
• Los mediadores solo son producidos en respuesta a diversos estímulos. Entre los que están los productos y
sustancias microbianos liberados por las células necróticas. Algunos de estos estímulos ponen en funcionamiento
los receptores y vías de transmisión de señales para la secreción de mediadores (los de los mastocitos en
respuesta a la lesión celular o irritación mecánica). El requisito inicial para que se dé la inflamación es que se active
cuando y donde es necesario.
• La mayoría de los mediadores son de vida breve. Se degradan rápido, son inactivados por enzimas o depurados
o inhibidos. El sistema de comprobaciones y balances regulas las acciones de los mediadores (es intrínseco).
• Un mediador puede estimular la liberación de otros. Ej: los productos de activación del complemento estimulan
la liberación de histamina, el TNF actúa sobre células endoteliales para producir la IL-1 y quimiocinas. Estas
cascadas sirven para amplificar o contrarrestar la acción inicial de un mediador.
Mediadores más importantes de la inflamación aguda
Aminas vasoactivas: histamina y serotonina
Son almacenadas como moléculas preformadas en las células y son los primeros mediadores liberados en la inflamación.
La fuente más abundante de histamina son los mastocitos, presentes en tejido conjuntivo adyacente a vasos. También se
encuentra en basófilos y plaquetas sanguíneos. La histamina se almacena en gránulos en los mastocitos y se libera en
respuesta a estímulos:
1. Lesión física por traumatismo, frío o calor.
2. Unión de Ac a los mastocitos induciendo reacciones de hipersensibilidad (alérgicas).
3. Productos del complemento: anafilotoxinas (C3a y C5a).
Los dos últimos se unen a receptores específicos de los mastocitos desencadenando vías de señalización que
conducen a la desgranulación.
Los leucocitos, se cree, secretan proteínas liberadoras de histamina. Los neuropéptidos (sustancia P) y las citocinas (IL-1
y IL-8) estimulan la liberación de histamina.
La histamina causa dilatación de arteriolas y aumenta la permeabilidad de las vénulas. Es el principal mediador de
la fase transitoria inmediata del incremento de la permeabilidad vascular, formando hendiduras interendoteliales en las
vénulas. Su efecto vasoactivo esta mediado por unión a receptores (receptores H2) en las células endoteliales
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
microvasculares. En el caso de los fármacos antihistamínicos (tratan reacciones inflamatorias) son antagonistas de
receptores H2, que se une a ellos bloqueándolos. La histamina causa contracción de ciertos músculos lisos.
La serotonina (5-hidroxitriptamina) es un mediador vasoactivo preformado presente en plaquetas y ciertas células
neuroendocrinas (tubo digestivo). Actúa como neurotransmisor en el tubo digestivo. Y es vasoconstrictora.
METABOLITOS DEL ÁCIDO ARAQUIDÓNICO (AA)
Los mediadores lipídicos prostaglandinas y leucotrienos,
producidos por el AA estimulan las reacciones vasculares y
celulares en la inflamación aguda. El AA es un ácido graso
poliinsaturado de 20 C, obtenido en la dieta o por
conversión del ácido graso linoleico. Al estar esterificado
forma parte de los fosfolípidos de membrana. Estímulos
mecánicos, químicos, físicos y otros mediadores (C5a)
liberan AA de estos fosfolípidos mediante fosfolipasas
celulares (fosfolipasa A2). Al activarse la fosfolipasa A2, se
envían señales: aumentando el Ca2+ citoplásmico y activa
cinasas en respuesta a estímulos externos. Los
mediadores derivados del AA: eicosanoides, se sintetizan
por dos tipos de enzimas: las ciclooxigenasas (generan
prostaglandinas) y las lipooxigenasas (producen
leucotrienos y lipoxinas). Los eicosanoides se unen a
receptores acoplados a proteínas G mediando las fases de
la inflamación. (TABLA 3-5).
PROSTAGLANDINAS (PG)
Son producidas por mastocitos, macrófagos, células endoteliales. Participan en reacciones vasculares y sistémicas de la
inflamación. Son generadas por las ciclooxigenasas: COX-1 y COX-2. La COX-1 se produce debido a estímulos
inflamatorios y participa en la homeostasis en tejidos (equilibrio de líquidos y electrólitos en riñones, citoprotección en el
tubo digestivo). La COX-2 es inducida por estímulos inflamatorios y genera prostaglandinas, pero su contenido es bajo en
los tejidos. Las prostaglandinas se dividen en series según su característica estructural, y se codifican con letras (PGD,
PDE, PGF, PCC y PCH) y un subíndice numérico, que indica el número de dobles enlaces del compuesto. Las de la
inflamación son PGE2, PGD2, PGF2a, PGI2 (prostaciclina) y TxA2 (tromboxano A2), y derivan de la acción de una enzima
específica sobre un producto intermedio de la vía. Como las plaquetas contienen la enzima tromboxano sintasa, TxA2 es
el principal producto en estas células. El TxA2, agregante plaquetario y vasoconstrictor, como es inestable, se convierte
rápidamente en su forma inactiva, TxB2.
El epitelio vascular carece de tromboxano sintasa, pero expresa prostaciclina sintasa, la cual produce prostaciclina (PGI2)
y su producto final estable, PGF1a. La prostaciclina es un vasodilatador e inhibe la agregación plaquetaria. Un desequilibrio
tromboxano-prostaciclina es un episodio inicial para la formación de trombos en vasos sanguíneos coronarios y cerebrales.
La PGD2 es la principal prostaglandina producida por los mastocitos, que junto PGE2, causa vasodilatación y aumenta la
permeabilidad de las vénulas poscapilares, favoreciendo un edema. La PGF2a, estimula la contracción uterina y la del
músculo liso bronquial y las arteriolas menores. La PGD2 es quimiotáctica para los neutrófilos.
Las prostaglandinas intervienen en la patogenia del dolor y la fiebre en la inflamación. La PGE2, es hiperalgésica e induce
hipersensibilidad cutánea ante estímulos dolorosos (inyección de concentraciones subóptimas de histamina y bradicinina),
y está implicada en la fiebre inducida por citocinas durante las infecciones.
LEUCOTRIENOS
Son producidos por leucocitos y mastocitos, gracias a la lipooxigenasa. Participan en reacciones del músculo vascular y
liso, y en reclutamiento leucocítico. Hay tres tipos de lipooxigenasas, siendo la 5-lipooxigenasa predominante en neutrófilos.
Esta convierte el AA en ácido 5-hidroxieicosatetraenoico, quimiotáctico para los neutrófilos y precursor de leucotrienos.
El LB4 es un quimiotáctico y activador de neutrófilos, que induce agregación y adhesión de células al endotelio vascular,
producción de ERO y liberación de enzimas lisosómicas. Los leucotrienos que contienen cisteinilo (LTC4, LTD4 y LTE4)
hacen vasoconstricción, broncoespasmo (asma) y aumento de la permeabilidad de las vénulas.
LIPOXINAS
Se originan del AA por la vía de la lipooxigenasa y reducen la inflamación inhibiendo el reclutamiento de leucocitos. Inhiben
la quimiotaxia y la adhesión al endotelio de los neutrófilos. Para su biosíntesis transcelular necesita de dos poblaciones
celulares. Los leucocitos, en especial neutrófilos, producen intermediarios en la síntesis de lipoxinas, que son convertidos
en lipoxinas por la interacción de plaquetas y leucocitos.
INHIBIDORES FARMACOLÓGICOS DE PROSTAGLANDINAS Y LEUCOTRIENOS
Algunos antiinflamatorios:
• Inhibidores de la ciclooxigenasa: El ácido acetilsalicílico y otros antiinflamatorios no esteroideos (AINE), como
el ibuprofeno. Estos inhiben la COX-1, la COX-2 y la síntesis de prostaglandinas (de ahí su eficacia contra el dolor
y la fiebre). El ácido acetilsalicílico actúa acetilando e inactivando de forma irreversible las ciclooxigenasas.
Los inhibidores selectivos de la COX-2 son de gran interés, ya que la COX-1 es responsable de la producción de
prostaglandinas implicadas en la inflamación y en las funciones homeostáticas, mientras que la COX-2 produce
prostaglandinas que solo intervienen en reacciones inflamatorias. Evitando así, los efectos secundarios de los
inhibidores no selectivos, como el desarrollo de úlcera gástrica. Por otro lado, pueden aumentar el riesgo de
episodios cardiovasculares y cerebrovasculares, debido a que afectan la producción de prostaciclina (vasodilatador
e inhibidor de la agregación plaquetaria) por las células endoteliales, y mantienen intacta la producción de TxA2
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
(mediador de la agregación plaquetaria y la vasoconstricción) por COX-1, en plaquetas. Favoreciendo la acción
del tromboxano, lo que aumenta la tendencia a trombosis vascular, por lo que debe utilizarse en personas que no
tienen factores de riesgo vascular.
• Inhibidores de la lipooxigenasa. La 5-lipooxigenasa no se ve afectada por los AINE. Medicamentos que inhiben
la producción de leucotrienos, como zileutón, son útiles en el tratamiento del asma.
• Corticoesteroides: Son antiinflamatorios de amplio espectro, que reducen la transcripción de genes codificadores
de COX-2, fosfolipasa A2, citocinas proinflamatorias (IL-1 y TNF) e iNOS.
• Antagonistas de receptores de leucotrienos: Bloquean estos receptores y evitan la acción de los leucotrienos.
También son útiles para tratar el asma (como montelukast).
Incremento del consumo de aceite de pescado, ya que los ácidos grasos poliinsaturados de este aceite son malos sustratos
para la transformación en metabolitos activos en las vías de la ciclooxigenasa y lipooxigenasa, pero son buenos sustratos
para la producción de productos lipídicos antiinflamatorios.
CITOCINAS Y QUIMIOCINAS
Las citocinas son proteínas producidas por células como linfocitos, macrófagos, células dendríticas activadas, células del
tejido endotelial, epitelial y conjuntivo, que median y regulan las reacciones inmunitarias e inflamatorias.
FACTOR DE NECROSIS TUMORAL (TNF) E
INTERLEUCINA L (IL- L)
El TNF y lL-l desempeñan funciones en el reclutamiento
de los leucocitos, favoreciendo su adhesión al endotelio
y su migración a través de los vasos. Son producidas
por macrófagos y células dendríticas activadas; el TNF
también se genera a partir de linfocitos T y mastocitos,
y la IL-l en algunas células epiteliales.
La secreción de TNF e IL-l puede ser promovida por
productos microbianos, inmunocomplejos, cuerpos
extraños, lesión física y otros estímulos inflamatorios. La
producción de TNF es inducida por señales transmitidas
a través de TLR u otros sensores microbianos, en tanto
que la síntesis de lL-l es estimulada por las mismas
señales, si bien la generación de la forma activa de esta citocina depende del inflamasoma.
Las acciones de TNF y IL-l influyen en las reacciones infamatorias locales y sistémicas (FIGURA 3.11)
Las funciones principales de estas citocinas son:
• Activación endotelial. TNF y lL-l actúan sobre el endotelio induciendo cambios: aumento de la expresión de
moléculas de adhesión endotelial, sobre todo selectinas E y P, y ligandos para las integrinas leucocíticas; mayor
producción de mediadores, como otras citocinas y quimiocinas, factores de crecimiento y eicosanoides, y un
incremento de la actividad procoagulante del endotelio.
• Activación de leucocitos y otras células.
TNF aumenta respuesta de neutrófilos a otros estímulos (endotoxinas bacterianas) y estimula la actividad
bactericida de macrófagos (por inducción de la producción de NO).
lL-l activa síntesis de colágeno por fibroblastos y estimula la proliferación de células sinovíales y otras células
mesenquimatosas. Favorece las respuestas a TH17 e induce inflamación aguda.
• Respuesta de fase aguda sistémica.
IL-l y TNF (así como la lL-6) generan respuestas de fase aguda sistémicas asociadas a infección o lesión, como
fiebre. También intervienen en el sindrome de sepsis, asociado a una infección bacteriana diseminada.
El TNF regula el equilibrio energético, favoreciendo la movilización de lípidos y proteínas e inhibiendo el apetito.
La producción continuada de TNF contribuye al desarrollo de caquexia, estado patológico caracterízado por la
pérdida de peso y la anorexia propias de ciertas infecciones crónicas y neoplasias.
Los Antagonistas del TNF se han demostrado sensiblemente eficaces en el tratamiento de enfermedades
inflamatorias crónicas, en particular de la artritis reumatoide y también de la psoriasis y ciertas enfermedades
inflamatorias intestinales. Una de las complicaciones de este tratamiento es que los pacientes se hacen sensibles a las
infecciones bacterianas, como consecuencia de la escasa capacidad de los macrófagos para destruir microbios
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
intracelulaies. Aunque muchas de las acciones del TNF y la lL-l parecen solaparse, los antagonistas de la lL-l son menos
eficaces. El bloqueo de cualquiera de las dos citocinas no repercute en el pronóstico de la sepsis.
QUIMIOCINAS
Familia de proteínas pequeñas (8 a 10 kDa) que actúan como quimiotácticas para tipos específicos de leucocitos.
Se han identificado hasta 40 quimiocinas y 20 receptores de las mismas. Se clasifican en cuatro grandes grupos, según la
disposición de los residuos de cisteína (C):
• Las quimiocinas C-X-C tienen un residuo de aminoácidos que separa los dos primeros de los cuatro residuos de cisteína
conservados. Actúan principalmente sobre los neutrófilos. La lL-8, es secretada por macrófagos activados, células
endoteliales y otras células, y causa activación y quimiotaxia de los neutrófilos, con actividad limitada sobre monocitos y
eosinófilos. Los inductores más significativos son los productos microbianos y otras citocinas, sobre todo IL-1 y TNF.
• Las quimiocínas C-C tienen los dos primeros residuos de cisteína conservados adyacentes. Entre ellas se cuentan la
proteína quimiotáctica de monocitos (MCP-1), eotaxina, proteína inflamatoria de macrófagos la (MIP-I α) y la químiocina
RANTES (expresada y secretada por linfocitos T normales). Estas quimiocinas atraen a monocitos, eosinófilos, basófilos y
linfocitos. No son quimiotácticos tan potentes para los neutrófilos. Aunque la mayoría de las quimiocinas de ésta clase
ejercen acciones solapadas, la eotaxina recluta selectivamente eosinófilos.
• Las quimiocinas C carecen del primero y el tercero de los residuos de cisteína conservados. Las de este tipo (línfotactina)
son relativamente específicas de los linfocitos.
• Las quimiocinas CXC contienen tres aminoácidos entre las dos cisteínas. El único integrante conocido de esta clase es
la fractalquina, que presenta dos formas: una proteína de unión a superficie celular inducida en las células endoteliales por
citocinas inflamatorias que favorecen la adhesión firme a monocitos y linfocitos T, y una forma soluble, derivada por
proteólisis de la proteína de unión a membrana, que tiene una potente actividad quimiotáctica para las mismas células.
Las quimiocinas median su actividad uniéndose a siete receptores transmembrana unidos a la proteína G. Tales receptores
(CXCR o CCR, para los receptores de quimiocinas C-X-C o C-C) suelen presentar solapamiento de las especificidades de
los ligandos, y los leucocitos suelen expresar más de un tipo de receptor. Ciertos receptores de quimiocinas (CXCR-4,
CCR-5) actúan como correceptores de una glucoproteína de cubierta vírica del virus de la inmunodeficiencia adquirida
(VIH), causante del sida, y se relacionan con la unión al virus y con su penetración en las células.
Las quimiocinas pueden desplegarse en concentraciones elevadas, fijadas a los proteoglucanos en la superficie de las
células endoteliales, y en la matriz extracelular. Desempeñan dos funciones principales:
• En la inflamación aguda. Las quimiocínas ínflamatorias son aquellas cuya producción es inducida por microbios
y otros estímulos. Favorecen la fijación de leucocitos al endotelio, actuando sobre los leucocitos a fin de aumentar
la afinidad de las integrinas, y estimulan la migración (quimiotaxia) de los leucocitos en los tejidos hacia el sitio de
infección o daño tisular.
• Mantenimiento de la arquitectura tisular. Algunas quimiocinas producidas de manera inespecifica en los tejidos,
reciben, en ocasiones, el nombre de quimiocinas homeostáticas, organizan varios tipos celulares en diferentes
regiones anatómims de tejidos, como los linfocitos T y B en áreas aisladas del bazo y los ganglios linfáticos.
Otras citocinas en la inflamación aguda
Dos citocinas que han sido de interés son la lL-6, producida por macrófagos y otras células, que participa en reacciones
locales y sistémicas, y la lL-17, generada principalmente por linfocitos T, que favorece el reclutamiento de neutrófilos. Los
antagonistas de ambas han exhibido una gran eficacia en el tratamiento de enfermedades inflamatorias.
Los interferones de tipo I, cuya función normal es inhibir la replicación vírica, intervienen en algunas de las manifestaciones
sistémicas de la inflamación.
Las citocinas desempeñan igualmente papeles destacados en la inflamación crónica
SISTEMA DEL COMPLEMENTO
Es un conjunto de proteínas solubles y receptores de membrana que funcionan en defensa del anfitrión contra los
microbios y en reacciones inflamatorias patológicas. Consta de más de 20 proteínas, algunas de estas se designan
con una numeración de C1 a C9. El sistema actúa en la inmunidad, tanto innata como adaptativa, como defensa contra los
patógenos microbianos. En el proceso de activación del complemento se generan varios productos de degradación de las
proteínas del complemento, que causan un aumento de la permeabilidad vascular, quimiotaxia y opsonización.
Las proteínas del complemento están presentes en
formas inactivas en el plasma; muchas de ellas son
activadas para convertirse en enzimas proteolíticas
que degradan, a su vez, otras proteínas del
complemento, constituyendo una cascada
enzimática capaz de experimentar una enorme
amplificación. El paso esencial en la activación del
complemento es la proteólisis del tercer
componente, C3, el más abundante. La escisión
de C3 se puede producir por una de las tres vias
siguientes:
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
• La vía clásica, desencadenada por la fijación de C1 a un anticuerpo (IgM o lgG) que se ha combinado con
antígeno.
• La vía alternativa, que puede ser puesta en marcha por moléculas superficiales microbianas (endotoxina o LPS),
polísacáridos complejos, veneno de cobra y otras sustancias, en ausencia de anticuerpos.
• La vía de la lectina en la que la lectina de unión a manosa plasmática se une a hidratos de carbono sobre los
microbios y activa directamente el componente C1.
Las tres vías de activación del complemento determinan la formación de una enzima activa designada como C3
convertasa, que divide el componente C3 en dos fragmentos funcionalmente diferenciados, C3a y C3b. C3a es
liberado y C3b se une covalentemente a la célula o molécula en la que el complemento está siendo activado. A
continuación, más C3b se une a los fragmentos previamente generados para formar C5 convertasa, que se escínde a su
vez, liberando el componente C5a y dejando el C5b fijado a la superficie de la célula.
El C5b se une a los últimos componentes de la cascada (CG-C9), culminando con la formación del complejo de ataque a
la membrana (MAC, compuesto por múltiples moléculas de C9).
El sistema del complemento tiene tres funciones principales (FIGURA 3.12):
• Inflamación. C3a, C5a y, en menor medida, C4a son productos de escisión de los componentes del complemento,
que estimulan la liberación de histamina por los mastocitos y, aumentan la permeabilidad vascular y causan
vasodilatación. Se denominan anafilotoxinas, ya que ejercen efectos similares a los de los mediadores mastocíticos
implicados en la reacción de anafilaxia. C5a es quimiotáctico para neutrófilos, monocitos, eosinófilos y basófilos.
Además, el componente C5a activa la vía de la lipooxigenasa del metabolismo del AA en neutrófilos y monocitos,
generando posterior liberación de mediadores inflamatorios.
• Opsonización y fagocitosis. El componente C3b y su producto de degradación C3bi (C3b inactivo), cuando se
unen a la pared celular microbiana, actúan como opsoninas y favorecen la fagocitosis por parte de neutrófilos y
macrófagos, que cargan los receptores de superficie celular para los fragmentos del complemento.
• Lisis celular. El depósito de MAC sobre las células hace que estas sean permeables al agua o los iones, con la
consiguiente muerte (lisis) de las mismas. Esta función del complemento es importante, sobre todo, para la muerte
de microbios con paredes celulares delgadas, como las bacterias del género Neisseria, y la carencia de
componentes terminales del complemento predispone a padecer infecciones por este microorganismo.
La activación del complemento es estrechamente controlada por proteínas reguladoras asociadas a células y
circulantes. Distintas proteínas reguladoras inhiben la producción de fragmentos del complemento activos, o eliminan los
fragmentos que se depositan sobre las células. Estos reguladores son expresados en las células normales del anfitrión y.
por tanto, son designados para evitar que los tejidos sanos resulten lesionados en sitios de activación del complemento.
Las proteínas reguladoras se ven a veces superadas cuando grandes cantidades de complemento se depositan en las
células y tejidos del anfitrión, como sucede en las enfermedades autoinmunitarias, en las que las personas afectadas
producen anticuerpos fijadores del complemento contra los antígenos de sus propias células y tejidos. Las más importantes
de estas proteínas reguladoras son:
• El inhibidor C1 (INH C1) bloquea la activación de C1, la primera proteína de la vía clásica del complemento. La
carencia hereditaria de este inhibidor causa angiodema hereditario.
• El factor acelerador de la degradación (DAP) y el CD59 son dos proteínas unidas a membranas plasmáticas
por un anclaje glucofosfatidilo (CPI). El DAF evita la formación de C3 convertasas y el CD59 inhibe la del complejo
de ataque a la membrana. La deficiencia adquirida de la enzima que crea los anclajes GPI induce carencia de
estos reguladores y un exceso de activación del complemento y de lisis de eritrocitos (sensibles a la lisis celular
mediada por el complemento) en la enfermedad conocida como hemoglobinuria paroxística nocturna (HPN).
• Otras proteínas reguladoras del complemento degradan por proteólisis sus componentes activos.
El sistema del complemento contribuye al desarrollo de enfermedad de diversas maneras. La activación del complemento,
por parte de anticuerpos o de complejos antígeno-anticuerpo depositados en células y tejidos del anfitrión, es un importante
mecanismo de lesión celular y tisular. La carencia hereditaria de proteínas del complemento aumenta la sensibilidad a las
infecciones y las deficiencias de proteinas reguladoras inducen distintos trastornos, como degeneración macular o
síndrome hemolítico urémico, secundarios a una activación excesiva del complemento.
Otros mediadores de la inflamación
Factor activador de plaquetas (PAF)
Es un mediador derivado de fosfolípidos que fue descubierto como factor causante de la agregación de plaquetas, aunque
actualmente se sabe que ejerce múltiples efectos inflamatorios. Una amplia diversidad de tipos celulares, que incluye a las
propias plaquetas, además de basófilos, mastocitos, neutrófilos, macrófagos y células endoteliales, pueden elaborar PAF,
tanto secretado como unido a células. Junto con la agregación plaquetaria, el PAF induce vasoconstricción y
roncoconstricción, y, en concentraciones bajas, genera vasodilatación y aumento de la permeabilidad venular. En la década
de los noventa se suscitó gran interés por el PAF como mediador de la inflamación, aunque los ensayos con antagonistas
de éste factor para tratar diversas enfermedades inflamatorias resultaron desalentadores.
Productos de la coagulación
Estudios pusieron de manifiesto que la inhibición de la coagulación reducía la reacción inflamatoria originada por algunos
microbios, lo que llevó a pensar que la coagulación y la inflamación estaban vinculadas. Este planteamiento se vio
reformado por el descubrimiento de los receptores activados por proteasas (PAR), que son activados por la trombina, y
son expresados en plaquetas y leucocitos. Es probable que la principal función de los PAR se centre en la activación de
las plaquetas durante la coagulación. De hecho, es dificil disociar la coagulación y la inflamación, ya que las formas de
lesión tisular que dan lugar a coagulación también inducen inflamación, y esta produce cambios en las células endoteliales
que incrementan la probabilidad de coagulación anómala (trombosis).
Cininas
Son péptidos vasoactivos derivados de proteínas plasmáticas llamadas cininógenos, por acción de proteasas específicas
conocidas como calicreínas. La enzima calicreína descompone un precursor de la glucoproteína plasmática, el cininógeno
de alto peso molecular, para producir bradicinina.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
La bradicinina aumenta la permeabilidad vascular e induce contracción del músculo liso, dilatación vascular y
dolor cuando se inyecta en la piel, efectos similares a los de la histamina. La acción de la bradicinina es de corta duración,
ya que es rápidamente inactivada por una cininasa. La bradicinina interviene como mediador en ciertas formas de reacción
alérgica, como la anafilaxia.
Neuropéptidos
Son secretados por nervios sensitivos y por diversos leucocitos, y pueden intervenir en el inicio y regulación de las
respuestas inflamatorias. Estos pequeños péptidos, como la sustancia P y la neurocinina A, se producen en los sistemas
nerviosos central y periférico. Las fibras nerviosas que contienen sustancia P son abundantes en el pulmón y tubo digestivo.
Dicha sustancia desempeña numerosas funciones biológicas, como la transmisión de señales dolorosas, la regulación de
la presión arterial, la estimulación de la secreción hormonal por parte de las células endocrinas y el incremento de la
permeabilidad vascular.
PATRONES MORFOLÓGICOS DE LA INFLAMACIÓN AGUDA
Los rasgos morfológicos característicos de las reacciones de inflamación aguda son la dilatación de pequeños vasos
sanguíneos y la acumulación de leucocitos y líquidos en el tejido extravascular. No obstante, patrones morfológicos
especiales se superponen con frecuencia a estos rasgos generales, dependiendo de la gravedad de la reacción, de su
causa específica, y del tejido y la localización afectados. La importancia del reconocimiento de los patrones macro- y
microscópicos es que ofrecen pistas útiles sobre la causa subyacente.
INFLAMACIÓN SEROSA
Se caracteriza por exudación de líquido con bajo contenido de células en los espacios creados por la lesión celular o
en las cavidades corporales revestidas por el peritoneo, la pleura o el pericardio. Habitualmente, en la inflamación serosa,
el líquido no está infectado por organismos destructivos y no contiene grandes cantidades de leucocitos. En las cavidades
corporales, el líquido puede proceder del plasma (por incremento de la permeabilidad vascular) o de secreciones de células
mesoteliales (por irritación local). La acumulación de líquido en estas cavidades se denomina derrame, si bien los derrames
se registran también en trastornos no inflamatorios, como sucede en el flujo de salida de sangre reducido en la insuficiencia
cardíaca, o en la disminución de las concentraciones de proteínas plasmáticas en algunas afecciones renales y hepáticas.
Las ampollas cutáneas que se forman por quemadura o por infección vírica se deben a acumulación de líquido seroso en
la epidermis dañada, o inmediatamente por debajo de ella. (FIGURA 3.13 VER EN EL LIBRO)
INFLAMACIÓN FIBRINOSA
Al ser mayor el aumento de la permeabilidad vascular, las moléculas grandes, corno el fibrinógeno, salen del torrente
circulatorio, formándose fibrina, que se deposita en el espacio extracelular. Cuando la extravasación vascular es
importante o cuando hay un estímulo procoagulante, se desarrolla un exudado fibrinoso, característico de la
inflamación en el revestimiento de cavidades corporales como meninges, pericardio y pleura. Desde el punto de vista
histológico, la fibrina aparece como una red eosinófila de fibras o, en ocasiones, como un coágulo amorfo. Es posible que
los exudados fibrinosos sean disueltos por fibrinólisis y erradicados por macrófagos. Si la fibrina no se elimina, con el
tiempo estimula el desarrollo hacia el interior de fibroblastos y vasos sanguíneos, y lleva a la consiguiente formación de
cicatriz. La conversión del exudado fibrinoso en tejido cicatricial (organización) en el pericardio produce un engrosamiento
fibroso opaco de este y del epicardio en el área de exudación, y, cuando la fibrosis es extensa, obstrucción del espacio
pericárdico. (FIGURA 3.14 VER EN EL LIBRO)
INFLAMACIÓN PURULENTA (SUPURATIVA), ABSCESO
Se caracteriza por la producción de pus, un exudado formado por neutrófilos, residuos licuados de células
necróticas y líquido de edema. La causa más frecuente) es la infección por bacterias que causan necrosis tisular por
licuefacción, como los estafilococos que son bacterias piógenas (productoras de pus). Un ejemplo común de inflamación
supurativa aguda es la apendicitis aguda. Los abscesos son acumulaciones localizadas de tejido inflamatorio
purulento, causadas por supuración alojada en un tejido, órgano o espacio delimitado. Se producen por diseminación de
bacterias piógenas en un tejido. Los abscesos tienen una región central, que aparece como una masa de leucocitos
necróticos y células tisulares. En torno a este foco necrótico suele haber un área de neutrófilos preservados y, fuera de
ella, se observan dilatación vascular y proliferación parenquimatosa y fibroblástica, indicativas de inflamación crónica y
reparación. Con el tiempo, los abscesos pueden quedar rodeados por una pared y ser reemplazados por tejido conjuntivo.
(FIGURA 3.15 VER EN EL LIBRO)
ÚLCERAS
Es un defecto o excavación local en la superficie de un órgano o tejido, inducido por esfacelación
(desprendimiento) de tejido necrótico inflamado. Solo se produce cuando la necrosis tisular y la inflamación están
presentes en una superficie o cerca de ella. Es más frecuente: 1) en las mucosas de boca, estómago, intestino o vías
genitourinarias, y 2) en piel y tejido subcutáneo de las extremidades inferiores, en personas de edad avanzada con
trastornos circulatorios que predisponen a necrosis isquémica extensa. Ejemplos característicos son las úlceras pépticas
de estómago o duodeno, en las que coexisten inflamaciones aguda y crónica. Durante la fase aguda hay una intensa
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
infiltración de polimorfonucleares y dilatación vascular en los bordes de la anomalía. Al hacerse crónica la lesión, los bordes
y la base de la úlcera desarrollan proliferación fibroblástica, cicatrización y acumulación de linfocitos, macrófagos y células
plasmáticas. (FIGURA 3.16 VER EN EL LIBRO)
EVOLUCIÓN DE LA INFLAMACIÓN AGUDA
Aunque numerosas variables pueden modificar el proceso básico de la inflamación (naturaleza e intensidad de la lesión,
localización y tejidos afectados, y la respuesta del anfitrión), todos los procesos inflamatorios agudos evolucionan de una
de las tres formas siguientes:
• Resolución completa. Una vez que se ha conseguido
eliminar el agente causal, todas las reacciones
inflamatorias deberían concluir con el restablecimiento
del estado normal en la localización de la inflamación
aguda. Esto se denomina resolución o remisión, y es la
evolución habitual cuando la lesión es limitada, de
duración corta, o cuando hay escasa destrucción de
tejido y las células parenquimatosas dañadas pueden
regenerarse. La resolución conlleva la eliminación de
residuos celulares y microbios a cargo de macrófagos, y
la reabsorción del líquido de edema por los vasos
linfáticos.
• Curación por reposición de tejido conjuntivo
(cicatrización, o fibrosis). Se observa tras una
destrucción sustancial de tejido, cuando la lesión
inflamatoria afecta a tejidos que no son capaces de regenerarse o cuando hay abundante exudación de fibrina en
tejidos o cavidades serosas (pleura, peritoneo), que no es posible eliminar adecuadamente. En todas estas
situaciones, el tejido conjuntivo crece en el área de lesión o exudado, convirtiéndose en una masa de tejido fibroso,
en un proceso conocido como organización.
• Progresión de la respuesta a inflamación crónica. La transición del proceso agudo al crónico tiene lugar cuando la
respuesta inflamatoria aguda no puede remitir, por persistencia del agente lesivo o por alguna interferencia en la
curación.
RESUMEN DE LA INFLAMACIÓN AGUDA
Cuando un anfitrión se enfrenta a un agente lesivo, como un microorganismo infeccioso o células muertas, los fagocitos
presentes en todos los tejidos intentan eliminarlo. Al mismo tiempo, los fagocitos y otras células del anfitrión reaccionan a
la presencia de la sustancia extraña liberando citocinas, mensajeros lipídicos y otros mediadores de la inflamación. Algunos
de ellos actúan sobre los vasos sanguíneos pequeños de áreas próximas y favorecen la extravasación del plasma y el
reclutamiento de leucocitos circulantes para dirigirlos hacia el sitio en el que se localiza el agente causal. Los leucocitos
reclutados son activados por el agente lesivo y por mediadores producidos a nivel local, y los leucocitos activados intentan
eliminar el agresor mediante fagocitosis. Una vez eliminado el agente causal y activados los mecanismos antiinflamatorios,
el proceso remite y el anfitrión recupera su estado de salud normal. Si el agente no es eliminado con prontitud, el resultado
puede ser una inflamación crónica.
Las reacciones vasculares y celulares son responsables de los signos y síntomas generados por la respuesta
inflamatoria. El aumento del flujo sanguíneo dirigido al área lesionada y la mayor permeabilidad vascular provocan la
acumulación de líquido extravascular rico en proteínas plasmáticas, denominada edema. El enrojecimiento (rubor), el calor
y la tumefacción (tumor) de la inflamación aguda son causados por el mayor flujo sanguíneo y el edema. Los leucocitos
circulantes, entre los que inicialmente predominan los neutrófilos, se fijan al endotelio por medio de moléculas de adhesión,
atraviesan el endotelio y migran a la localización de la lesión, bajo la influencia de agentes quimiotácticos. Los leucocitos
activados por el agente causal y por los mediadores endógenos pueden liberar metabolitos tóxicos y proteasas al medio
extracelular, provocando daño tisular. Durante la lesión, y en parte como consecuencia de la liberación de prostaglandinas,
neuropéptidos y citocinas, uno de los síntomas locales es el dolor.
INFLAMACIÓN CRÓNICA
Es una respuesta de duración prolongada (semanas o meses) en la que la inflamación, la lesión de los tejidos y
los intentos de reparación coexisten, con combinaciones variables. Puede suceder a la inflamación aguda, como ya
se ha indicado, o presentarse de forma gradual, como respuesta progresiva de bajo nivel, sin manifestaciones de reacción
aguda previa.
CAUSAS DE INFLAMACIÓN CRÓNICA
La inflamación crónica se presenta en los siguientes contextos:
• Infecciones persistentes por microorganismos difíciles de erradicar, como micobacterias o ciertos virus, hongos
y parásitos. Estos organismos a veces provocan una reacción llamada de hipersensibilidad retardada. La respuesta
inflamatoria en ocasiones adopta un patrón específico denominado reacción granulomatosa. En otros casos, la
inflamación aguda no resuelta evoluciona a inflamación crónica, como sucede en infecciones bacterianas agudas
del pulmón que progresan hasta formar un absceso pulmonar crónico.
• Enfermedades por hipersensibilidad. La inflamación crónica desempeña un importante papel en un grupo de
enfermedades que son causadas por activación excesiva e inapropiada del sistema inmunitario. En determinadas
condiciones, las reacciones inmunitarias se desarrollan contra los propios tejidos de la persona, causando
enfermedades autoinmunitarias. En estas, los autoantígenos inducen una reacción inmunitaria autoperpetuada que
da lugar a lesión tisular e inflamación crónicas (artritis reumatoide y esclerosis múltiple). En otros casos, la
inflamación crónica es consecuencia de respuestas inmunitarias no reguladas contra microbios, como sucede en
la enfermedad inflamatoria intestinal. Las respuestas inmunitarias contra sustancias ambientales normales generan
enfermedades alérgicas, como el asma bronquial. Estas patologías pueden mostrar patrones morfológicos mixtos,
con inflamación aguda y crónica, ya que se caracterizan por brotes inflamatorios repetidos. En las fases tardías
predomina, a veces, la fibrosis.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
• Exposición prolongada a agentes potencialmente tóxicos, exógenos o endógenos. Una sustancia exógena
son las partículas de sílice, material inerte no degradable, que, cuando se inhala durante períodos prolongados,
causa silicosis. La ateroesclerosis se considera un proceso inflamatorio crónico de la pared arterial inducido por
producción excesiva y depósito en los tejidos de colesterol endógeno y otros lípidos.
• Ciertas formas de inflamación crónica pueden ser importantes en la patogenia de enfermedades que,
habitualmente, no se consideran trastornos inflamatorios. Entre ellas se cuentan patologías degenerativas, como
la enfermedad de Alzheimer, el síndrome metabólico y la diabetes de tipo 2 asociada al mismo, y ciertos cánceres
en los que las reacciones inflamatorias favorecen el desarrollo tumoral. La función de la inflamación en estas
alteraciones se trata en los capítulos correspondientes a cada una de ellas.
CARACTERISTICAS MORFOLÓGICAS
La inflamación crónica se caracteriza por:
• Infiltración por células mononucleares, como macrófagos, linfocitos y células plasmáticas. (FIGURA. 3-18 VER
EN EL LIBRO)
• Destrucción de los tejidos, inducida por el agente causal persistente o por células inflamatorias.
• Intentos de curación mediante reposición del tejido conjuntivo dañado, desarrollada mediante angiogenia
(proliferación de pequeños vasos sanguíneos) y fibrosis.
CÉLULAS Y MEDIADORES DE LA INFLAMACIÓN CRÓNICA
La combinación de infiltración de leucocitos, lesión tisular y fibrosis que caracteriza a la inflamación crónica es
consecuencia de activación local de varios tipos celulares y de la producción de mediadores.
PAPEL DE LO MACRÓFAGOS
-Células predominantes en la mayoría de reacciones inflamatorias.
-Contribuyen a la reacción secretando citocinas y factores de crecimiento que destruyen los agentes invasores y tejidos
extraños y a su vez activan otras células como Linfocitos T.
-Son fagocitos especializados que actúan como filtros de partículas, microbios y células senescentes.
-Funcionan como células efectoras que eliminan los microorganismos en las respuestas inmunitarias celular y humoral.
Los macrófagos son células tisulares derivadas de células madre hematopoyéticas de médula ósea y de células
progenitoras del saco vitelino y el hígado fetal durante el desarrollo inicial. FIGURA. 3.19
-Están distribuidos en la mayoría de los tejidos conjuntivos. Como en órganos específicos tales como:
• El hígado (donde se denominan células de Kupffer) Estas células configuran el
• El bazo y los ganglios linfáticos (donde se llaman histiocitos sinusales) sistema mononuclear fagocítico
• El sistema nervioso central (células microgliales) o sistema reticuloendotelial
• Los pulmones (macrófagos alveolares).
Los precursores de la médula ósea dan lugar a monocitos, que pasan a la sangre, migran a varios tejidos y se diferencian
para formar macrófagos.
-La semivida de los monocitos es de 1 día, mientras que los macrófagos pueden sobrevivir meses o años.
En las reacciones inflamatorias, los monocitos comienzan a migrar al tejido extravascular y en unas 48 h pueden ser el tipo
celular predominante. La extravación de monocitos es regulada por moléculas de adhesión y mediadores químicos con
propiedades quimio-tácticas y activadoras.
Hay dos vías principales de activación de macrófagos. FIGURA. 3.20:
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
LA ACTIVACIÓN DE MACRÓFAGOS CLÁSICA LA ACTIVACIÓN DE MACRÓFAGOS ALTERNATIVA
Es inducida por: Es inducida por citocinas distintas del IFN-y, como la IL-4
-Productos microbianos como las endotoxinas, que se y la IL-13, producidas por linfocitos T y otras células.
vinculan a los TLR y otros sensores
-Por señales derivadas de linfocitos T, como la de la Estos macrófagos no son microbicidas de manera activa,
citocina IFN-y en respuestas inmunitarias. y las citocinas pueden inhibir la vía de activación clásica.
-Por sustancias extrañas (cristales y materia en
partículas). -Su función: Es la reparación de los tejidos
Los macrófagos activados por la vía clásica (llamados -Estas células secretan: factores de crecimiento que
M1): favorecen la Angiogenia, activan los fibroblastos y
estimulan la síntesis de colágeno.
-Producen NO y ERO
-Aumentan las enzimas lisosómicas, las cuales mejoran
su capacidad para inducir la muerte de los organismos
ingeridos, a la vez que secretan citocinas estimuladoras
de la inflamación.
-Son importantes en la defensa del anfitrión contra
microbios y en numerosas reacciones inflamatorias.
En respuesta a los estímulos lesivos, la primera vía de activación es la clásica, que destruye los agentes causales; mientras
que la segunda vía es la alternativa, que inicia la reparación tisular.
Los productos de los macrófagos activados eliminan agentes lesivos, como los microbios, e inician el proceso de
reparación, aunque también son responsables de buena parte de las lesiones tisulares en la inflamación crónica.
Los macrófagos, como los neutrófilos, ingieren y eliminan microbios y tejidos muertos.
Los macrófagos inician el proceso de reparación de tejidos, y participan en la formación de cicatriz y fibrosis.
Los macrófagos secretan mediadores de la inflamación, como citocínas (TNF, IL-1, quimiocinas y otros) y
eicosanoides, por lo que son esenciales para las reacciones inflamatorias.
Los macrófagos exponen antígenos a los linfocitos T y responden a señales de ellos, estableciendo un asa de
retroalimentación para la defensa contra numerosos microbios, mediante respuestas inmunitarias mediadas por
células.
Cuando los macrófagos se activan de forma inapropiada o en exceso causa una considerable destrucción de tejidos signos
identificativos de la inflamación crónica. Cuando el agente irritante es eliminado, los macrófagos terminan por desaparecer
(muriendo o pasando a los vasos y ganglios linfáticos). En otras, su acumulación persiste, por su continuado reclutamiento
a partir de la circulación y por proliferación local en el sitio de inflamación.
PAPEL DE LOS LINFOCITOS
Los microbios y otros antígenos ambientales activan los linfocitos T y B, que amplifican y propagan la inflamación
crónica.
-Estos actúan como mediadores de la actividad adaptativa, que aporta defensa contra los patógenos infecciosos
-Están presentes a veces en la inflamación crónica y, cuando se activan, esta tiende a ser persistente y grave (como la
inflamación granulomatosa.)
Los linfocitos T y B estimulados por antígenos (efectores y de memoria) utilizan moléculas de adhesión (selectinas,
integrinas y sus ligandos) y las quimiocinas para migrar a los sitios de inflamación.
Las citocinas derivadas de los macrófagos activados (TNF, IL-1 y quimiocinas), fomentan el reclutamiento de leucocitos,
importantes para la persistencia de la respuesta inflamatoria.
En virtud de su capacidad para secretar citocinas, los linfocitos T CD4+ favorecen la inflamación e influyen en la
naturaleza de la reacción inflamatoria. Hay tres subgrupos de linfocitos T CD4+ que secretan distintos tipos de citocinas
y generan diferentes tipos de inflamación:
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
• Las células TH1 producen la citocina IFN-7, que activa los macrófagos por la vía clásica. Intervienen en la defensa
contra numerosos tipos de bacterias y virus y en las enfermedades autoinmunitarias, al igual que las células TH17
• Las células TH2 secretan IL-4, IL-5 e IL-13, que reclutan y activan eosinófilos y son responsables de la vía
alternativa de activación de macrófagos. Estas son importantes en la defensa contra los parásitos helmintos y en
la inflamación alérgica.
• Las células TH17 secretan IL-17 y otras citocinas, que inducen secreción de las quimiocinas responsables del
reclutamiento de neutrófilos (y monocitos) en la reacción.
Los linfocitos y los macrófagos interactúan de manera bidireccional, y estas interacciones desempeñan un papel
importante en la propagación de la inflamación crónica (figura. 3-21). Los macrófagos exponen antígenos a los linfocitos
T, expresan moléculas de membrana (coestimuladoras) y producen citocinas (IL-12 y otras), que estimulan las respuestas
de los linfocitos T. Los linfocitos T activados producen citocinas, que reclutan y activan macrófagos, promoviendo mayor
presentación de antígenos y secreción de citocinas. Todo eso aporta energía para el mantenimiento de la inflamación.
Los linfocitos B activados y las células plasmáticas productoras de anticuerpos están a menudo presentes en los
focos de inflamación crónica.
En algunas reacciones inflamatorias crónicas, los linfocitos, células presentadoras de antígeno y células plasmáticas
acumulados se agregan conjuntamente para formar tejidos linfáticos que se asemejan a ganglios linfáticos. Estos son los
llamados órganos linfoides terciarios. Este tipo de organogenia linfoide se suele encontrar en la membrana sinovial de
pacientes con artritis reumatoide de larga evolución y en la glándula tiroides de pacientes con tiroiditis de Hashimoto.
Otras células en la inflamación crónica
• Los eosinófilos son abundantes en las reacciones inmunitarias mediadas por IgE y en las infecciones parasitarias
(VER FIGURA 3.22 en el libro)
-Presentan gránulos que contienen la proteína básica principal, una proteína altamente catiónica que es tóxica para los
parásitos, pero que también causa lisis de células epiteliales en mamíferos. Por lo que son útiles en el control de infecciones
parasitarias, aunque también contribuyen al desarrollo de lesión tisular en reacciones inmunitarias (como las alergias).
• Los mastocitos se distribuyen ampliamente en los tejidos conjuntivos y participan en reacciones inflamatorias
agudas y crónicas.
-En su superficie expresan el receptor (FceRI), que se une a la porción Fc del anticuerpo IgE. En las reacciones de
hipersensibilidad inmediata, los anticuerpos IgE ligados a los receptores para Fc de las células reconocen específicamente
un antígeno, y las células se des-granulan y liberan mediadores, como histamina y prostaglandinas. Este tipo de
respuesta se produce durante las reacciones alérgicas frente a alimentos, venenos de insectos o fármacos,
Los Mastocitos también están presentes en reacciones de inflamación crónica y, como secretan múltiples citocinas,
favorecen las reacciones inflamatorias en diferentes situaciones.
• Los neutrófilos se consideran característicos de la inflamación aguda.
-Son importantes en las lesiones crónicas causadas a nivel pulmonar por el consumo de tabaco y otros estímulos
irritantes. Esta pauta de inflamación se designa como aguda sobre crónica.
INFLAMACIÓN GRANULOMATOSA
Es una forma de inflamación crónica caracterizada por cúmulos de macrófagos activados, a menudo con linfocitos
T, y a veces asociada a necrosis central.
-La formación de granulomas es un intento por parte de la célula de contener a un agente causal que sea difícil de erradicar.
Se caracteriza por presentar una intensa activación de linfocitos T, que conduce a activación de macrófagos, inductora de
lesión en tejidos normales. Los macrófagos activados pueden desarrollar un abundante citoplasma y comenzar a
asemejarse a células epiteliales (células epitelioides). Algunos macrófagos se fusionan y forman células gigantes
multinucleadas.
Hay dos tipos de granulomas, de diferente patogenia:
• Los granulomas de cuerpo extraño son causados por cuerpos extraños inertes, en ausencia de reacciones
inmunitarias mediadas por linfocitos T.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
-Se suelen formar en torno a materiales como talco (asociado al consumo de drogas por vía intravenosa), suturas u
otras fibras.
-Son tan grandes como para impedir la fagocitosis por parte de un macrófago y no estimulan una respuesta inflamatoria
o inmunitaria específica. Las células epitelioides y gigantes se yuxtaponen a la superficie del cuerpo extraño.
• Los granulomas inmunitarios son causados por diversos agentes, capaces de inducir una respuesta inmunitaria
persistente mediada por linfocitos T, que da lugar a granulomas generalmente cuando el agente inductor (un
microbio persistente o un autoantígeno), es difícil de erradicar. En tales respuestas, los macrófagos activan los
linfocitos T para producir citocinas, como la lL-2, que, a su vez, activa otros linfocitos T, perpetuando la respuesta,
o el IFN-y que activa macrófagos.
Los granulomas son propios de ciertos estados patológicas específicos. Tabla 3.8. Las citocinas derivadas de los linfocitos
T son responsables de la activación crónica de macrófagos y de la formación de granulomas.
MORFOLOGIA
En las preparaciones de hematoxilina y eosina (figura. 3-23), los macrófagos activados en los granulomas presentan un
citoplasma granular rosado con bordes celulares no diferenciados, y se les llama células epitelioides.
Los agregados de macrófagos epitelioides aparecen rodeados por una corona de linfocitos. Los granulomas más antiguos pueden
tener un contorno de fibroblastos y tejido conjuntivo. Algunas veces en los granulomas se encuentran células gigantes
multinucleadas, llamadas células gigantes de Langhans. Estas constan de una gran masa de citoplasma con numerosos núcleos
y derivan de la fusión de múltiples macrófagos activados.
En los granulomas asociados a ciertos organismos infecciosos (como Mycobacterium tuberculosis), una combinación de hipoxia
y lesión mediada por radicales libres genera una zona central de necrosis (necrosis caseosa). Al microscopio, el material necrótico
aparece como un conjunto de residuos granulares eosinófilos amorfos y des-estructurado, con pérdida completa de los detalles
celulares.
EFECTOS SISTEMATICOS DE LA INFLAMACIÓN
La inflamación se asocia a reacciones sistémicas inducidas por citocinas, que, en conjunto, conforman la llamada respuesta
de fase aguda.
Las manifestaciones sistémicas de la inflamación aguda corresponden a las reacciones frente a las citocinas cuya
producción es estimulada por productos bacterianos, como los LPS, y por otros estímulos inflamatorios.
-Las citocinas TNF, los interferones de tipo I, IL-1 e IL-6 son importantes mediadores de la reacción de fase aguda.
La respuesta de fase aguda consiste en diversas alteraciones patológicas:
• La fiebre, caracterizada por una elevación de la temperatura corporal (de 1 a 4 °C). Es una de las manifestaciones
más destacadas de la respuesta de fase aguda, especialmente cuando la inflamación se asocia a infección.
-Los Pirógenos son las sustancias inductoras de fiebre. El aumento de la temperatura corporal es causado por:
prostaglandinas producidas en las células vasculares y perivasculares del hipotálamo. Productos bacterianos, como
los LPS (pirógenos exógenos), estimulan los leucocitos para que liberen citocinas como la 1L-1 y el TNF (pirógenos
endósenos), que incrementan la producción de las enzimas que convierten el AA en prostaglandinas (ciclooxigenasas).
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
En el hipotálamo, las prostaglandinas (la PGE2), estimulan la producción de neurotransmisores, que reconfiguran el
punto de ajuste de la temperatura al alza.
- Los AINE, incluido el ácido acetilsalicílico, reducen la fiebre, inhibiendo la síntesis de prostaglandinas.
• Las proteínas de fase aguda son proteínas plasmáticas. Entre ellas tenemos: La proteína C reactiva (CRP), el
fibrinógeno y la proteína amiloide A sérica (SAA). Son sintetizadas en el hígado (hepatocitos) y es estimulada por
citocinas, especialmente IL-6 (para la CRP y el fibrinógeno), e IL-1 o TNF (para SAA):
LA CRP Y LA SAA EL FIBRINÓGENO
Se unen a las paredes de las células microbianas, Se une a los eritrocitos y forman pilas, que sedimentan
pudiendo actuar como opsoninas y fijando el más rápidamente por gravedad que los eritrocitos
complemento. A su vez, se fijan a la cromatina, lo cual aislados.
ayuda a eliminar los núcleos de las células necróticas -Esta es la base para medir la velocidad de
sedimentación eritrocítica, una prueba sencilla que
evalúa la respuesta inflamatoria a cualquier estímulo
Las [ ] séricas elevadas de CRP son posibles indicadores de aumento del riesgo de infarto de miocardio en pacientes con
enfermedad arterial coronaria.
El péptido regulador del hierro hepcidina, incrementa su producción en la respuesta de fase aguda. Las [ ] plasmáticas de
hepcidina elevadas de forma crónica reducen la disponibilidad de hierro y son responsables de la anemia asocia-da a la
inflamación crónica
• La leucocitosis, frecuente en las reacciones inflamatorias provocadas por una infección bacteriana.
-El recuento de leucocitos suele ascender hasta 15.000 o 20.000 células/ ml, e inclusive hasta entre 40.000 y 100.000
células/ml. Estas elevaciones extremas se llaman reacciones leucemoides.
-Se produce por:
-La aceleración de la liberación de células a partir de la reserva posmitótica de la médula ósea (causada por citocinas,
como IL-1 y TNF). Se asocia a elevación del número de neutrófilos inmaduros en sangre, lo que se conoce como
desviación ala izquierda.
-La infección prolongada también da lugar a proliferación de precursores en la médula ósea, por aumento de la
producción de factores estimulantes de colonias. Es decir, la producción de leucocitos en la médula ósea aumenta
para compensar la pérdida de estas células en la reacción inflamatoria.
-Infecciones bacterianas que inducen una elevación del recuento sanguíneo de neutrófilos (neutrofilia). Infecciones
víricas, como la mononucleosis infecciosa, la parotiditis y la rubéola, condicionan un aumento absoluto del número de
linfocitos (linfocitosis).
-Las alergias e infestaciones parasitarias que incrementan el número absoluto de eosinófilos (eosinofilia).
Determinadas infecciones (fiebre tifoidea y algunas infecciones víricas, por rickettsias o por proto-zoos) se asocian, en
cambio, a una disminución del número de leucocitos circulantes (leucopenia).
• Otras manifestaciones de la respuesta de fase aguda son: el aumento del pulso y la presión arterial; reducción
de la sudoración, principalmente por redireccionamiento del flujo del lecho vascular cutáneo a lechos más
profundos, a fin de minimizar la pérdida de calor; escalofríos intensos; temblores por sensación de frío, anorexia,
somnolencia y malestar general.
• En las infecciones bacterianas graves (sepsis), las bacterias y sus productos en la sangre estimula la producción
de ingentes cantidades de diversas citocinas, sobre todo TNF e IL-1. Las altas [ ] de citocinas en sangre generan
varias manifestaciones como: coagulación intravascular diseminada, shock hipotensivo y trastornos metabólicos
como resistencia a la insulina e hiperglucemia. Esta triada clínica se conoce como SHOCK SÉPTICO.
La inflamación insuficiente es responsable de una mayor sensibilidad a las infecciones.
-Causa: es la carencia de leucocitos secundaria a la sustitución de la médula ósea por leucemias y tumores metastásicos,
a la depresión de la médula ósea por tratamientos contra el cáncer y al rechazo del injerto.
REPARACIÓN DE TEJIDOS
PERSPECTIVA GENERAL DE LA REPARACIÓN DE TEJIDOS
La reparación o la cicatrización, es el restablecimiento de la arquitectura y la función tisulares tras una lesión. La reparación
se relaciona con los tejidos parenquimatosos y conjuntivos, mientras que la cicatrización se relaciona con los epitelios
superficiales.
La respuesta inflamatoria a los microbios y los tejidos lesionados no solo sirve para eliminar estos agentes perjudiciales,
sino que también pone en funcionamiento el proceso de reparación.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
La reparación de tejidos dañados tiene lugar a través de 2 tipos de reacciones,
(FIGURA 3.24):
• La regeneración por proliferación de células residuales (no lesionadas) y la
maduración de células madre adultas (o tisulares)
• El depósito de tejido conjuntivo para formar una cicatriz:
• Regeneración. Es la capacidad de algunos tejidos de reemplazar los
componentes dañados y de recuperar el estado normal.
Se produce por:
-La proliferación de las células que han sobrevivido a la lesión y que mantienen la
capacidad de proliferar, por ejemplo, en la rápida división del epitelio de la piel o el
intestino y en ciertos órganos parenquimatosos, como el hígado.
-La función de las células madre adultas que contribuyen a la restauración de los
tejidos dañados. Sin embargo, esta capacidad es limitada en mamíferos a la hora de reparar.
• Depósito de tejido conjuntivo (formación de cicatriz). Sucede cuando los tejidos lesionados no son capaces
de restablecerse por completo, o si las estructuras de soporte del tejido están gravemente dañadas.
-La reparación se da por aposición de tejido conjuntivo (fibroso), que puede dar lugar a formación de una cicatriz
fibrosa; que ofrece suficiente estabilidad estructural, para que el tejido lesionado pueda funcionar.
El término fibrosis hace referencia al depósito extenso de colágeno que se registra en pulmones, hígado, riñón y otros
órganos, como consecuencia de la inflamación crónica o, en el miocardio, tras una necrosis isquémica extensa (infarto).
Tanto la regeneración como la formación de cicatriz contribuyen en distintos grados a la reparación final. Los dos procesos
conllevan proliferación de diferentes células y estrechas interacciones entre las células y la MEC.
REGENERACIÓN DE CÉLULAS Y TEJIDOS
La regeneración de células y tejidos lesionados implica proliferación celular, promovida por factores de crecimiento y
estrechamente dependiente de la integridad de la matriz extracelular y del desarrollo de células maduras a partir de células
madre.
Proliferación celular: señales y mecanismos de control
Durante la reparación tisular proliferan distintos tipos de células, tales como:
▪ Los residuos del tejido lesionado, que intentan recuperar su estructura normal.
▪ Las células endoteliales vasculares, que crean nuevos vasos para los nutrientes necesarios para el proceso de
reparación
▪ Los Fibroblastos, que son fuentes de tejido fibroso que forma la cicatriz para rellenar los defectos que no se puedan
corregir por regeneración.
Los tejidos tienen una capacidad regenerativa intrínseca. Por lo que, los tejidos del cuerpo se dividen en 3 grupos:
• Tejidos lábiles (en continua división). Las células de estos tejidos se destruyen y se reponen continuamente por
medio de: la maduración a partir de células madre adultas y por la proliferación de células maduras.
-Entre las células lábiles están: las hematopoyéticas de la médula ósea y los epitelios superficiales, (los epitelios
escamosos de piel, cavidad oral, vagina y cuello uterino; los epitelios cúbicos de los conductos que drenan los órganos
exocrinos (p. ej., glándulas salivales, páncreas, vías biliares); el epitelio cilíndrico de tubo digestivo, útero y trompas de
Falopio, y el epitelio de transición de las vías urinarias). Estos tejidos se pueden regenerar fácilmente, si preserva la
reserva de células madre.
• Tejidos estables. Las células están en reposo (en la fase Go del ciclo celular) y presentan una mínima actividad
proliferativa en estado normal.
-Pero son capaces de dividirse en respuesta a lesión o pérdida de masa tisular. Su proliferación es importante en la
cicatrización de heridas.
-Las células estables conforman: el parénquima de la mayoría de los órganos sólidos, como hígado, riñón y páncreas.
También incluyen células endoteliales, fibroblastos y células de músculo liso. En los hepáticos, los tejidos estables
tienen una capacidad de regeneración limitada tras una lesión.
• Tejidos permanentes. Las células de estos tejidos están diferenciadas terminalmente y no son proliferativas
en la vida posnatal. Por ejemplo, las neuronas y de las células de músculo cardíaco. En consecuencia, las lesiones
de cerebro o corazón son irreversibles y originan una cicatriz. En algunas áreas del cerebro adulto se registran
replicación y diferenciación limitadas de células madre. El músculo esquelético se suele clasificar como tejido
permanente. En los tejidos permanentes, la reparación predominante es la formación de cicatriz.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
La proliferación celular es una de las vías de la regeneración, y las células madre contribuyen al desarrollo de este proceso.
La proliferación celular es regida por señales aportadas por factores de crecimiento y procedentes de la matriz
extracelular.
-Los factores de crecimiento se fijan a las proteínas de la MEC y son liberados en concentraciones altas; activando vías de
señalización para inducir la producción de proteínas participantes en la conducción de las células a lo largo del ciclo celular
y otras que liberan bloques en dicho ciclo (puntos de control). Las principales fuentes de estos son los macrófagos activados
por la lesión tisular, y a veces por las células epiteliales y del estroma.
Además de responder a los factores de crecimiento, las células utilizan integrinas para unirse a las pro-teínas de la MEC,
y las señales emitidas por dichas integrinas pueden estimular también la proliferación celular. En el proceso de
regeneración, la proliferación de células residuales se ve complementada por el desarrollo de células maduras
formadas a partir de células madre.
Mecanismos de regeneración de tejidos
La importancia de la regeneración de tejidos lesionados depende de los tipos de tejidos y la gravedad de la lesión.
• En tejidos lábiles, (los epitelios del tubo digestivo y la piel), las células lesionadas son rápidamente reemplazadas,
gracias a la proliferación de células residuales y diferenciación de células madre adultas, siempre que la membrana
basal subyacente esté intacta.
-La pérdida de células sanguíneas es corregida por proliferación de células madre hematopoyéticas en la médula ósea,
proceso dirigido por factores de crecimiento: factores estimuladores de colonias (CSF), originados como respuesta al
escaso número de células de la sangre.
• La regeneración tisular puede tener lugar en órganos parenquimatosos con poblaciones celulares estables (El
páncreas, las glándulas suprarrenales, el tiroides y los pulmones tienen cierta capacidad regenerativa). La
extirpación quirúrgica de un riñón genera en el riñón remanente una respuesta compensatoria (una hipertrofia
como hiperplasia de las células de los conductos proximales).
Tener en cuenta que: El restablecimiento de la estructura tisular normal solo se produce cuando el tejido residual está
estructuralmente intacto; PERO, si todo el tejido está dañado por infección o inflamación, la regeneración es incompleta y
va acompañada de cicatrización. Por ejemplo, la destrucción extensa del hígado, con colapso del entramado de fibras de
reticulina, como sucede en el absceso hepático, da lugar a formación de cicatriz, aunque el resto de las células hepáticas
tengan capacidad para regenerarse.
Regeneración hepática
El hígado humano tiene una gran capacidad de regeneración, tal como se
aprecia en su crecimiento tras una hepatectomia parcial, efectuada para
resecar un tumor o para un trasplante de donante vivo.
La regeneración del hígado tiene lugar por medio de 2 mecanismos
principales: la proliferación de los hepatocitos remanentes y la
repoblación a partir de células progenitoras.
• PROLIFERACIÓN DE HEPATOCITOS TRAS UNA HEPATECTOMIA PARCIAL
La proliferación de hepatocitos en el hígado en regeneración es estimulada por las acciones combinadas de las eliminas y
de los factores de crecimiento polipeptídicos.
El proceso se desarrolla en diferentes etapas (FIGURA 3.25):
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
• REGENERACIÓN HEPÁTICA A PARTIR DE CÉLULAS PROGENITORAS. Sucede cuando la capacidad
proliferativa de los hepatocitos está deteriorada, como tras una lesión o inflamación hepática crónica, las células
progenitoras del hígado contribuyen a la repoblación.
REPARACION POR DEPÓSITO DE TEJIDO CONJUNTIVO
Cuando la reparación no puede realizarse solo mediante regeneración, es posible proceder a reponer las células
lesionadas con tejido conjuntivo, dando lugar a la formación de una cicatriz, o combinar la regeneración de algunas
células residuales y formación de cicatriz. La formación de la cicatriz parchea el tejido, más que restaurarlo. El término
se usa con mayor frecuencia en cicatrización de heridas de piel, aunque también se emplea en la susticion de células
parenquimatosas en cualquier tejido de colágeno, como ocurre en el infarto de miocardio.
Pasos en la formación de cicatriz
• La angiogenia es la formación de nuevos vasos sanguíneos que aportan los
nutrientes y el oxígeno necesarios para el proceso de reparación. Estos vasos
nuevos son permeables, debido a las uniones interendoteliales incompletas y a que
el VEGF (Factor de Crecimiento que Regula la Angiogenia) incrementa la
permeabilidad vascular. Esta es, en parte, la CAUSA de edema en las heridas que
están cicatrizando.
• Formación de tejido de granulación. La migración y proliferación de fibroblastos
y el depósito de tejido conjuntivo laxo, junto con los vasos y los leucocitos
entremezclados, forma el tejido de granulación (el que se observa debajo de una
costra; rosada, blanca y granular). Histológicamente, hay proliferación de
fibroblastos y nuevos capilares en una matriz extracelular laxa con células
inflamatorias mezcladas, como macrófagos. Fig. 3-27A. VER LIBRO. El tejido de
granulación invade el sitio de lesión, y la cantidad que se forma depende del defecto
del tejido creado por la herida y de la intensidad de la inflamación.
• Remodelación del tejido conjuntivo. La maduración y remodelación de tejido
conjuntivo genera una cicatriz fibrosa estable. La cantidad de tejido conjuntivo
aumenta en el tejido de granulación, formando por último la cicatriz.
Los macrófagos desempeñan un papel esencial en la reparación, eliminando
los agentes causales y el tejido muerto, aportando factores de crecimiento
para la proliferación de las distintas células y secretando citocinas, que
estimulan la proliferación de fibroblastos y las síntesis y depósito de tejido
conjuntivo. Los macrófagos implicados son del tipo activado alternativamente (M2).
Los macrófagos activados de forma clásica predominan durante la inflamación e
intervienen en la eliminación de microbios y tejidos muertos, son gradualmente
reemplazados por macrófagos activados por la vía alterna, que ponen fin a la
inflamación e inducen a la reparación.
La reparación comienza en un plazo de 24h desde la lesión con migración de
fibroblastos e inducción de proliferación de fibroblastos y células endoteliales. Transcurridos entre 3 y 5 días, el tejido de
granulación especializado característico de la cicatrización se hace aparente.
ANGIOGENIA
La angiogenia es el proceso de desarrollo de nuevos vasos sanguíneos a partir de los existentes. Es esencial en la
cicatrización en los sitios de lesión, en el desarrollo de circulaciones colaterales en localizaciones de isquemia y en el
aumento de tamaño de tumores. Sigue los siguientes pasos:
• Vasodilatación en respuesta al óxido nítrico y aumento de la permeabilidad
inducido por el factor de crecimiento endotelial.
• Separación de los pericitos de la superficie abluminal y degradación de la
membrana basal para permitir la formación de brotes vasculares.
• Migración de células endoteliales hacia el área de la lesión tisular.
• Proliferación de células endoteliales inmediatamente por detrás del borde anterior
(punta) de las células que migran.
• Remodelación en tubos capilares.
• Reclutamiento de células periendoteliales (pericitos para capilares pequeños y
células de músculo liso para vasos mayores) a fin de formar el vaso maduro.
• Supresión de la proliferación y la migración endotelial, y depósito de la membrana
basal.
(¿Qué es un pericito? Son células contráctiles que se envuelven alrededor de las
células endoteliales de los capilares y vénulas en todo el cuerpo.)
El proceso de angiogenia afecta a varias vías de señalización interacciones célula-
célula, proteínas de la MEC y enzimas tisulares.
• Factores de crecimiento.
Factor de crecimiento endotelial vascular (VEGF), principalmente VEGF-A, estimulan
la migración y proliferación de células endoteliales, iniciando el proceso de formación de
brotes capilares en la angiogenia. Estos factores favorecen la vasodilatación,
estimulando la producción de NO, y contribuyen a la formación de la luz vascular.
Los factores de crecimiento de fibroblastos (FGF), principalmente FGF-2, estimulan
la proliferación de células endoteliales. Además, favorecen la migración de macrófagos
y fibroblastos al área dañada y favorecen la migración de células epiteliales para cubrir las heridas epidérmicas.
Las angiopoyetinas 1 y 2, son factores de crecimiento que intervienen en la angiogenia y en la maduración
estructural de los nuevos vasos. Los vasos de nueva formación necesitan ser estabilizados mediante
reclutamiento de pericitos y células de músculo liso y por depósito de tejido conjuntivo. La Ang 1 interactúa con
un receptor de tirosina cinasa, llamado Tie2, en Las células endoteliales. Los factores de crecimiento PDGF y
TGF-13 intervienen en el proceso de estabilización: el PDGF recluta células de músculo liso y el TGF-13 inhibe la
proliferación y migración endoteliales y potencia la producción de proteínas de MEC.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
• Vía de señalización Notch. Por intercomunicación con el VEGF, regula la formación de brotes y la ramificación
de nuevos vasos asegurándose que haya adecuada irrigación en la fase de cicatrización.
• Las proteínas de MEC participan en el proceso de formación de brotes de vasos en la angiogenia, por medio de
interacciones con los receptores de integrinas en las células endoteliales, y aportando la infraestructura para el
crecimiento vascular.
• Las enzimas presentes en las MEC, en especial en las metaloproteinasas de matriz (MMP), degradan la MEC, al
fin de permitir la remodelación y la extensión de los conductos vasculares.
DEPOSITO DE TEJIDO CONJUNTIVO
La aposición de tejido conjuntivo se produce en dos fases: 1) migración de fibroblastos al sitio de lesión y
proliferación de los mismos en él, y 2) depósito de proteínas de MEC producidas por estas células. Estos procesos
son regidos por citocinas y factores de crecimiento producidos a nivel local, como PSGF, FGF-2 y TGF- B que contribuyen
a la proliferación y activación de fibroblastos. La principal fuente de estos factores son los macrófagos activados de forma
alternativa (M2), los sitios de inflamación son ricos en mastocitos y en un medio quimiotáctico apropiado es posible que
haya linfocitos.
El factor transformador del crecimiento B (TCF-B) es la citocina más importante en la síntesis y depósito de
proteínas de tejido conjuntivo. Es producido por la mayoría de las células del tejido de granulación, incluidos los
macrófagos activados por la vía alternativa. Las concentraciones de TGF-B en los tejidos son reguladas por:
- la activación postranscripcional de TGF-B latente.
- la velocidad de secreción de la molécula activa
- factores de la MEC, en especial las integrinas, que aumentan o disminuyen la actividad del TGF-B.
El TGF-B estimula:
- la migración y proliferación de fibroblastos.
- incrementa la síntesis de colágeno y fibronectina
- atenúa la degradación de MEC, por inhibición de metaloproteinasas.
El TGF-B también está implicado en el desarrollo de fibrosis en el pulmón, el hígado y los riñones por inflamación crónica.
El TGF-B es una citocina antiinflarnatoria, que sirve para limitar y poner fin a las respuestas inflamatorias, inhibiendo la
proliferación de linfocitos y la actividad de otros leucocitos.
Al final, EL TEJIDO DE GRANULACIÓN EVOLUCIONA HASTA FORMAR UNA CICATRIZ COMPUESTA POR
FIBROBLASTOS FUSIFORMES, EN BUENA PARTE INACTIVOS, COLÁGENO DENSO, FRAGMENTOS DE TEJIDO
ELÁSTICO Y OTROS COMPONENTES DE LA MEC. (FIG 3.27B)
A medida que la cicatriz madura, se presenta una progresiva regresión vascular, que con el tiempo transforma el tejido de
granulación, altamente vascularizado, en una cicatriz color claro, en buena parte avascular. Algunos de los fibroblastos
adquieren rasgos de células de musculo liso, como la presencia de filamentos de actina y reciben el nombre de
miofibroblastos, que con el tiempo contribuyen a la contracción de la cicatriz.
REMODELACIÓN DEL TEJIDO CONJUNTIVO
El resultado del proceso de reparación se ve influido por el equilibrio entre síntesis y degradación de las proteínas
de la MEC. Después de depositarse, el tejido conjuntivo de la cicatriz continúa siendo modificado y remodelado. La
degradación de colágenos y otros componentes de la MEC es llevado a cabo por una familia de metaloproteinasas de
matriz (MMP), así llamadas debido a que dependen de iones metálicos para desarrollar su actividad. Las MMP incluyen:
- colagenasas intersticiales, que descomponen el colágeno fibrilar (MMP-1, -2 y -3).
- gelatinasas (MMP-2 y -9), que degradan el colágeno amorfo.
- fibronectina, y estromelisinas (MMP-3, -10 y -11), que degradan diversos constituyentes de la MEC, como
proteoglucanos, larninina, fibronectina y colágeno amorfo.
Las MMP son producidas por diversos tipos celulares (fibroblastos, macrófagos,
neutrófilos, células sinoviales y algunas células epiteliales), y su síntesis y secreción
es regulada por factores de crecimiento, citocinas y otros agentes. Son generadas
como precursores inactivos (cimógenos) que deben ser activados, función de la que
se encargan las proteasas (p. ej., plasmina), presentes solo en sitios de lesión.
Además, las colagenasas activadas pueden ser rápidamente inhibidas por
inhibidores tisulares de las metaloproteinasas (TIMP) específicos, producidos por la
mayoría de las células mesenquirnatosas. Así pues, durante la formación de la
cicatriz, las MMP son activadas a fin de remodelar la MEC depositada y, a
continuación, su actividad es interrumpida por los TIMP. Una familia de estas, las
ADAM, están ancladas a la membrana y degradan y liberan dominios extracelulares
de citocinas y factores de crecimiento.
FACTORES QUE INFLUYEN EN LA REPARACIÓN TISULAR
Las variables que modifican la cicatrización pueden ser extrínsecas o intrínsecas, y sistémicas o locales:
• La infección es una de las causas clínicamente más importantes del retraso de la cicatrización; prolonga la
inflamación y puede incrementar el alcance de la lesión tisular a nivel local.
• La diabetes es una de las principales causas sistémicas de cicatrización anómala.
• El estado nutricional como la carencia de proteínas, por ejemplo, la Vitamina C, inhibe la síntesis de colágeno y
retrasa la cicatrización.
• Los glucocorticoides (esteroides) tienen efectos antiinflamatorios y su administración puede debilitar la cicatriz,
por inhibición de la producción de TGF-B y disminución de fibrosis.
• Factores mecánicos, como el aumento de presión a nivel local causa que los bordes de la herida se separen.
• Mala perfusión, por ateroesclerosis, diabetes u obstrucción del drenaje venoso.
• Presencia de cuerpos extraños.
• El tipo y alcance de la lesión afecta la reparación. El restablecimiento completo se da en tejidos de células
estables y lábiles, y, aun así, las lesiones extensas probablemente experimentan regeneración tisular incompleta
y perdida de función, al menos parcial.
• La localización de la lesión y el carácter del tejido lesionado son importantes. La inflamación desarrollada en
espacios tisulares produce abundantes exudados. La reparación se lleva a cabo, en ocasiones, por digestión del
exudado, iniciada por las enzimas proteolíticas de los leucocitos y la reabsorción del exudado licuado. Este proceso
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
se denomina resolución, o remisión, y en él, en ausencia de necrosis celular, la arquitectura tisular normal suele
restablecerse. No obstante, en acumulaciones grandes, el exudado experimenta un proceso de organización: el
tejido de granulación crece en el exudado y, finalmente, se forma una cicatriz fibrosa.
EJEMPLOS CLÍNICOS SELECCIONADOS DE REPARACION DE TEJIDOS Y FIBROSIS
CICATRIZACIÓN DE HERIDAS CUTÁNEAS
Comprende regeneración epitelial como formación de cicatriz de tejido conjuntivo. En función de la naturaleza y el tamaño
de la herida, se dice que su cicatrización tiene lugar por primera o segunda intecnción.
Cicatrización por primera intención.
Cuando la lesión afecta solo a la capa epitelial, el principal mecanismo de reparación es la regeneración epitelial,
también llamada unión primaria o cicatrización por primera intención. El EJEMPLO mas simple es la cicatrización de
una incisión quirúrgica limpia no infectada aproximada mediante suturas quirúrgicas. La incisión solo causa una
discontinuidad en la memb basal epitelial y muerte de pocas células del tejido epitelial y conjuntivo. (VER FIG. 3-29 LIBRO)
LA REPARACIÓN CONSTA DE TRES PROCESOS INTERCONECTADOS: INFLAMACIÓN, PROLIFERACIÓN DE
CÉLULAS EPITELIALES Y DE OTROS TIPOS, Y MADURACIÓN DE LA CICATRIZ DE TEJIDO CONJUNTIVO.
• Las heridas inducen la activación de las vías de coagulación, que determina la formación de un coagulo. Además
de eritrocitos atrapados, el coagulo contiene fibrina, fibronectina y proteínas del complemento. Dicho coagulo sirve
para detener la hemorragia y actúa como soporte para las células que migran, que son atraídas por citocinas,
factores de crecimiento y quimiocinas liberados en la zona. La liberación de VEGF induce permeabilidad vascular
aumentada y edema. Al producirse la deshidratación de la superficie externa del coágulo, se forma una costra que
cubre la herida.
• En un plazo de 24h se observan neutrófilos en el borde de la incisión, migrando hacia el coágulo de la fibrina.
Estas células liberan enzimas proteolíticas que eliminan residuos. Y las células basales del borde comienzan a
experimentar mayor mitosis.
Entre las 24 y 48h, las células epiteliales de ambos bordes ya han comenzado a migrar y proliferan a lo lardo de
la dermis. Las células se encuentran en la línea media, formando una capa epitelial que cierra la herida.
• En torno al día 3, los neutrófilos han sido reemplazados por macrófagos, y el tejido glandular invade
progresivamente el espacio de incisión. Los macrófagos son componente esencial ya que:
- Eliminan residuos, fibrina y otros materiales extraños.
- Favorecen la angiogenia y el depósito de MEC.
Ya se comienza a evidenciar las fibras de colágeno. Y la proliferación de células epiteliales continua, formándose
una cubierta de grosor similar ala epidermis.
• En torno al día 5, la neovascularización alcanza el máximo, cuando el tejido de granulación llena el espacio de
incisión. La permeabilidad de estos vasos permite el paso de proteínas y líquido plasmático al espacio extracelular.
Por eso, el nuevo tejido de granulación es edematoso.
La migración de fibroblastos al sitio de lesión es impulsada por quimiocinas, TNF, PDGF, TGF-13 y FGF. Su
posterior proliferación es desencadenada por múltiples factores de crecimiento, entre ellos PDGF, EGF, TGF-~ y
FGF, y por las citocinas lL-1 y TNF. Los macrófagos son las principales fuentes de estos factores, que también son
originados por otras células inflamatorias y plaquetas. Los fibroblastos producen proteínas de MEC, y las fibrillas
de colágeno se hacen más abundantes y comienzan a establecer puentes en la incisión. La epidermis recupera su
grosor normal a medida que la diferenciación de las células superficiales crea una arquitectura epidérmica madura
con queratinización superficial.
• Durante la segunda semana, hay acumulación de colágeno y proliferación de fibroblastos, por lo que comienza el
proceso de blanqueamiento. El infiltrado leucocítico, el edema y la vascularización aumentada se ven
sustancialmente reducidos.
• Hacia el final del primer mes, consta de tejido conjuntivo desprovisto de células inflamatorias y cubierto de
epidermis bastante normal. Sin embargo, los anejos dérmicos destruidos en la línea de incisión se pierden
definitivamente. La resistencia a la tracción de la herida aumenta con el tiempo.
Cicatrización por segunda intención.
Cuando la pérdida de células o tejidos es más extensa, como en heridas grandes, abscesos, úlcera o necrosis
isquémica (infarto) en órganos parenquimatosos, el proceso de reparación combina regeneración y cicatrización.
También llamada unión secundaria. (Ver fig. 3-30 LIBRO), la reacción inflamatoria es más intensa, se desarrolla abundante
tejido de granulación y se registra acumulación de MEC, formación de una cicatriz grande y contracción de la herida por
acción de miofibroblastos.
La cicatrización secundaria se distingue de la primaria en varios aspectos:
- Hay mayor pérdida de tejido.
- El coagulo de fibrina es mayor.
- En la zona lesionada hay más exudado y residuos necróticos.
- La inflamación es más intensa, debido a que al ser mayor la falta de tejido, es necesario eliminar más volumen de
residuos necróticos, exudados y fibrina.
- Se forman mayores cantidades de tejidos de granulación, a fin de llenar los espacios vacíos.
- Al principio se forma una matriz provisional que contiene fibrina, plasma, fibronectina y colágeno de tipoIII; no
obstante, hacia las 2 semanas, esta es reemplazada por otra matriz, compuesta fundamentalmente por colágeno
de tipo I. En última instancia, el entramado original de tejido de granulación se convierte en una cicatriz avascular,
de color claro e integrado por fibroblastos fusiformes, colágeno denso, fragmentos de tejido elástico u otros
componentes de la MEC. Hacia el final del primer mes, la cicatriz está formada por tejido conjuntivo acelular
desprovisto de infiltrado inflamatorio, cubierto de epidermis intacta.
- Se produce contracción que ayuda a cerrar la herida, disminuyendo la separación entre los bordes dérmicos y la
superficie de la herida. Esta contracción se da gracias a los miofibroblastos, que tienen estructuras similares
funcionales al músculo liso contráctil. A las 6 semanas, los defectos cutáneos grandes pueden reducirse hasta un
5 o un 10% de su tamaño original.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
lOMoARcPSD|3839408
Resistencia de la herida.
Una herida sutura tiene el 70% de la fuerza de una piel normal. Cuando la sutura se retira queda con una resitencia del
10% de la piel no lesionada, aunque aumenta con rapidez durante las 4 semanas siguientes. La recuperación de resistencia
a la tensión se da gracias al incremento en la síntesis de colágeno, superior a su degradación durante los dos primeros
meses de cicatrización. En general, la resistencia de la herida alcanza el 70-80% de su nivel normal a los 3 meses.
FIBROSIS DE ÓRGANOS PARENQUIMATOSOS
El depósito de colágeno es parte de la cicatrización normal de la herida. El término fibrosis hace referencia al exceso de
depósito de colágeno y otros componentes de la MEC en un tejido.
Los mecanismos básicos de la fibrosis son los mismos que los de la formación de cicatriz en la piel durante la reparación
tisular. La fibrosis es un proceso patológico inducido por estímulos lesivos
persistentes, como infecciones o reacciones inflamatorias crónicas, y se suele
asociar a pérdida de tejido (fig. 3-31). A menudo causa disfunción orgánica
sustanciaI e incluso insuficiencia de los órganos afectados.
Como ya se ha apuntado, la principal citocina implicada en la fibrosis es el
TGF-B. El mecanismo que conduce a su muerte celular por necrosis o
apoptosis y la producción de especies reactivas del oxígeno parecen ser
importantes desencadenantes de esa activación, con independencia del
tejido. De manera similar, las células que producen colágeno bajo
estimulación de TGF-B varían dependiendo de los tejidos. En la mayoría de
los órganos, como el pulmón y el riñón, los miofibroblastos son la principal
fuente de colágeno, aunque en la cirrosis hepática, los mayores productores
de colágeno son las células estrelladas.
Entre los trastornos fibróticos se cuentan diversas enfermedades crónicas y
debilitantes, como cirrosis hepática, esclerosis sistémica (esclerodermia),
patologías fibrosantes de pulmón (fibrosis pulmonar idiopática, neumoconiosis
y fibrosis pulmonar inducida por fármacos o radiación), nefropatías terminales
y pericarditis constrictiva.
ANOMALIAS EN LA REPARACIÓN DE LOS TEJIDOS
• La formación inadecuada de tejido de granulación o de cicatriz da
lugar a dos tipos de complicaciones: dehiscencia de la herida y úlceras.
La deshiscencia se da sobre todo en cirugías abdominales por aumento de
presión abdominal. Las heridas se ulceran como consecuencia de una
vascularización inapropiada en la cicatrización. Las heridas que no cicatrizan
también son propias de áreas sin sensibilidad.
• La formación excesiva de componentes que participan en el proceso
de reparación da lugar, a veces, a cicatrices hipertróficas y queloídes. La
acumulación de cantidades excesivas de colágeno da lugar, a veces, a una
cicatriz elevada llamada cicatriz hipertrofica; cuando el tejido cicatricial crece más allá de los límites de la herida
original y no se contrae, se denomina queloide (VER FIG. 3-32 LIBRO).
• La granulación exuberante, es la formación de cantidades excesivas de tejido de granulación, que protruye por
encima del nivel de la piel circundante y bloquea la reepitelización. El exceso de granulación ha de ser eliminado
mediante cauterización o escisión quirúrgica, a fin de permitir el restablecimiento de la continuidad del epitelio.
Estas neoplasias, llamadas desmoides o fibrometosis agresivas, están en el límite de tumores benignos y
malignos.
• El exceso de contracción da lugar a una contractura y deforma la herida. Se asocian sobre todo a las palmas de
manos y pies, y en la cara anterior del tórax.
Descargado por María Vitterí Eden (maria.enero.24@hotmail.com)
También podría gustarte
- Reparación de Tejidos - RobbinsDocumento14 páginasReparación de Tejidos - RobbinsGerson OrellanaAún no hay calificaciones
- Resumen Neoplasias Robbins 8Documento27 páginasResumen Neoplasias Robbins 8Fernando Ceron81% (21)
- Resumen Patología Capítulo 4Documento17 páginasResumen Patología Capítulo 4Oscar AlfaroAún no hay calificaciones
- Clasificación PRRDocumento3 páginasClasificación PRRFernando Sanchez MorenoAún no hay calificaciones
- Resumen Capitulo Inmunología RobbinsDocumento17 páginasResumen Capitulo Inmunología RobbinsLaura Galvis33% (3)
- Inflamación y ReparaciónDocumento74 páginasInflamación y ReparaciónOscar CáceresAún no hay calificaciones
- Resumen Inflamacion RobbinsDocumento8 páginasResumen Inflamacion RobbinsAbraham Díaz100% (2)
- Capítulo 3 - Resumen - RobbinsDocumento19 páginasCapítulo 3 - Resumen - RobbinsJulián Martínez50% (2)
- Capitulo 2 - RobbinsDocumento18 páginasCapitulo 2 - RobbinsYanina Pdv90% (10)
- Monografia InflamacionDocumento27 páginasMonografia InflamacionJudithGonzálesInga100% (2)
- Manual de Diseccion Humana - Shearer PDFDocumento329 páginasManual de Diseccion Humana - Shearer PDFPaulina Michelle Suárez88% (8)
- Xavi VerdaguerDocumento6 páginasXavi VerdaguerRaül Vañó BeneytoAún no hay calificaciones
- Importancia Clinica de La Farmacologia de Los Receptores y Sistema Nervioso AutonomoDocumento17 páginasImportancia Clinica de La Farmacologia de Los Receptores y Sistema Nervioso AutonomoArturo Praeli100% (1)
- Autacoides y Antihistaminicos UVMDocumento79 páginasAutacoides y Antihistaminicos UVMIsabelLópez100% (2)
- CAP 4 Libro de Patología ResumenDocumento44 páginasCAP 4 Libro de Patología ResumenYanitza IbarraAún no hay calificaciones
- Inmunoglobulinopatías GenéticaDocumento17 páginasInmunoglobulinopatías GenéticaAxl Aurelio Mozqueda AyalaAún no hay calificaciones
- 4) Inflamación y FagocitosisDocumento1 página4) Inflamación y FagocitosisGabriel Castillo100% (2)
- Robbins Resumen Vasos SanguineosDocumento3 páginasRobbins Resumen Vasos SanguineosJack DevlinAún no hay calificaciones
- Resumen RobbinsDocumento236 páginasResumen RobbinsAmi AyanAún no hay calificaciones
- Hipermutacion SomaticaDocumento2 páginasHipermutacion SomaticaIvan Moya50% (2)
- Inmunidad InnataDocumento56 páginasInmunidad InnataMelody Maza67% (3)
- Artritis Idiopatica JuvenilDocumento24 páginasArtritis Idiopatica JuvenilEdwin HinojosaAún no hay calificaciones
- Patrones-morfologicos-Inflamacion Aguda y CronicaDocumento51 páginasPatrones-morfologicos-Inflamacion Aguda y Cronicajacobo55100% (4)
- Sistema Del ComplementoDocumento5 páginasSistema Del ComplementoLuis Castellanos100% (2)
- Fisiopatología InflamaciónDocumento44 páginasFisiopatología InflamaciónAnonymous G1YUYVQ100% (1)
- InflamaciónDocumento9 páginasInflamaciónJosé Gabriel Quiroga Villagra100% (1)
- Cicatrizacion y Reparacion - Robbins - ResumenDocumento19 páginasCicatrizacion y Reparacion - Robbins - ResumenPaula Andrea Garcés Quitumbo100% (1)
- Caso Clinico 2 - Inflamación Aguda y CrónicaDocumento3 páginasCaso Clinico 2 - Inflamación Aguda y Crónicathais liechye100% (1)
- Guía Patología Robbins.Documento11 páginasGuía Patología Robbins.Lucya Lu100% (10)
- Respuesta Metabolica Al Trauma DefinitivaDocumento64 páginasRespuesta Metabolica Al Trauma DefinitivaRomelia Glez GaxiolaAún no hay calificaciones
- Cicatrización 1Documento16 páginasCicatrización 1Meiby Meneses100% (1)
- Inflamación Aguda y CrónicaDocumento23 páginasInflamación Aguda y CrónicaLUZ CLARISSA RODRIGUEZ GUTIERREZ100% (1)
- Mediadores de La InflamacionDocumento2 páginasMediadores de La InflamacionYamilé SerranoAún no hay calificaciones
- Mediadores Quimicos de La InflamaciónDocumento32 páginasMediadores Quimicos de La InflamaciónfabioAún no hay calificaciones
- Infeccion Por ChancroideDocumento24 páginasInfeccion Por ChancroideClau TomAún no hay calificaciones
- Guia Practica Patología I 2019-IiDocumento73 páginasGuia Practica Patología I 2019-IiYakelin VillanuevaAún no hay calificaciones
- LeucocitosDocumento6 páginasLeucocitosGas GCAún no hay calificaciones
- Mediadores Químicos de La Inflamación - 1Documento31 páginasMediadores Químicos de La Inflamación - 1Alfonsoalonso283% (12)
- ResumenInmunología. Capítulo 6 Robbins & CottranDocumento11 páginasResumenInmunología. Capítulo 6 Robbins & CottranRicardo Soto90% (48)
- Linfocitos BDocumento20 páginasLinfocitos BCelsa OspinoAún no hay calificaciones
- NEOPLASIASDocumento17 páginasNEOPLASIASManuel Magaña100% (1)
- INFLAMACIÓNDocumento23 páginasINFLAMACIÓNJose De Los Reyes100% (1)
- APOPTOSISDocumento23 páginasAPOPTOSISLina Paola EscobarAún no hay calificaciones
- Estallido RespiratorioDocumento20 páginasEstallido RespiratorioGibran Padrón GuzmánAún no hay calificaciones
- Inmunidad Adquirida PDFDocumento59 páginasInmunidad Adquirida PDFCarolaMeloRojasAún no hay calificaciones
- Inflamacion y Reparacion - Patologia - RobbinsDocumento14 páginasInflamacion y Reparacion - Patologia - Robbinslidia chambi zelaAún no hay calificaciones
- Neoplasias Cap 7 Pág 265 RobbinsDocumento2 páginasNeoplasias Cap 7 Pág 265 RobbinsMet Lu100% (2)
- RinovirusDocumento13 páginasRinovirusMichelleMaciasAún no hay calificaciones
- Materiales de SuturaDocumento40 páginasMateriales de SuturaFrancisco Eduardo Lopez Tenorio100% (1)
- Inflamacion Aguda y CronicaDocumento48 páginasInflamacion Aguda y CronicaCindy PumaderaAún no hay calificaciones
- Inmunidad Innata I 2017Documento50 páginasInmunidad Innata I 2017Camila Díaz100% (2)
- Reacción de ArthusDocumento6 páginasReacción de ArthusGloria María100% (2)
- Aspectos Clínicos de La NeoplasiaDocumento7 páginasAspectos Clínicos de La NeoplasiaGustavo Adalid Ortega AguilarAún no hay calificaciones
- Reacciones de Hipersensibilidad ExpoDocumento15 páginasReacciones de Hipersensibilidad ExpoElizabeth GuerraAún no hay calificaciones
- HEMOPTISISDocumento20 páginasHEMOPTISISJuan Enrique EspinozaAún no hay calificaciones
- Resumen PatologiaDocumento37 páginasResumen PatologiaDANIELA GARCIA VALENCIAAún no hay calificaciones
- Capitulo 3 InflamacionDocumento22 páginasCapitulo 3 InflamacionNini Sierra GutierrezAún no hay calificaciones
- Resumen Patología Semana 3Documento11 páginasResumen Patología Semana 3Odalys PilacuanAún no hay calificaciones
- Semana 5Documento29 páginasSemana 5LASTRES MENESES JAIR ALEXANDREAún no hay calificaciones
- Perspectiva General de La InflamaciónDocumento12 páginasPerspectiva General de La Inflamaciónvanessahernandez2009Aún no hay calificaciones
- Cap 3 - Inflamación y ReparaciónDocumento15 páginasCap 3 - Inflamación y ReparaciónMicaela Alanis Godoy GrazianoAún no hay calificaciones
- Inflamacioìn y Reparacioìn (Patologica)Documento13 páginasInflamacioìn y Reparacioìn (Patologica)Annery PaulinoAún no hay calificaciones
- Inflamación Aguda y CrónicaDocumento44 páginasInflamación Aguda y CrónicaVioleta ChitayAún no hay calificaciones
- Inflamacion y ReparacionDocumento109 páginasInflamacion y Reparacioncristian MARTINEZAún no hay calificaciones
- Insuficiencia Respiratoria AgudaDocumento3 páginasInsuficiencia Respiratoria AgudaCristianCriolloAún no hay calificaciones
- Determinantes EstructuralesDocumento1 páginaDeterminantes EstructuralesCristianCriolloAún no hay calificaciones
- 50 Dosis CorrectasDocumento60 páginas50 Dosis CorrectasCristianCriollo100% (1)
- Reclutamiento de Leucocitos para Los SitDocumento4 páginasReclutamiento de Leucocitos para Los SitCristianCriolloAún no hay calificaciones
- Lipolisis y BetaoxidacionDocumento7 páginasLipolisis y BetaoxidacionCristianCriolloAún no hay calificaciones
- ToxicologiaDocumento4 páginasToxicologiaDavid Montaño SuarezAún no hay calificaciones
- Carne de Cerdo y Salud - Hans Heinrich ReckewegDocumento22 páginasCarne de Cerdo y Salud - Hans Heinrich ReckewegAlejandro GenoveseAún no hay calificaciones
- Comunicacion CelularDocumento10 páginasComunicacion Celulardidier_disappearAún no hay calificaciones
- Hipersensibilidad Tipo 1Documento3 páginasHipersensibilidad Tipo 1wilmar andradeAún no hay calificaciones
- Farmacologia de AntiulcerososDocumento12 páginasFarmacologia de AntiulcerososValentina GradosAún no hay calificaciones
- Bioquimica LKDocumento24 páginasBioquimica LKTeobaldoAún no hay calificaciones
- PIA Equipo 20 Choque Anafiláctico PDFDocumento14 páginasPIA Equipo 20 Choque Anafiláctico PDFSÓCRATES VILLAREALAún no hay calificaciones
- Examen FDocumento2 páginasExamen F202207080Aún no hay calificaciones
- Sistema RespiratorioDocumento53 páginasSistema RespiratorioVanessa Ruiz RuizAún no hay calificaciones
- Tema 5. Metabolismo de Los Aa Por Perdida Del Grupo CarboxiloDocumento58 páginasTema 5. Metabolismo de Los Aa Por Perdida Del Grupo CarboxiloElvia RodríguezAún no hay calificaciones
- Introducción Practica 7 SimuladaDocumento3 páginasIntroducción Practica 7 SimuladaKarina GF0% (1)
- Apunte Lucas 1 ERA - TerapeuticaDocumento29 páginasApunte Lucas 1 ERA - TerapeuticaJuan PirizAún no hay calificaciones
- Bases Científicas Del Masaje Como TerapiaDocumento28 páginasBases Científicas Del Masaje Como TerapiajcordovaAún no hay calificaciones
- Practica3-Histamina y AntihistaminicoDocumento7 páginasPractica3-Histamina y AntihistaminicoYajaira GonzalesAún no hay calificaciones
- Antihistaminicos S4Documento3 páginasAntihistaminicos S4Valeria Alexandra Urteaga TerronesAún no hay calificaciones
- Ganodema Lucidum El Hongo de La InmortalidadDocumento40 páginasGanodema Lucidum El Hongo de La InmortalidadFélix Alexei Alvarado SotolongoAún no hay calificaciones
- Aculiadura Por Escorpión y ApismoDocumento7 páginasAculiadura Por Escorpión y ApismoGenesis MAún no hay calificaciones
- Aminas en La IndustriaDocumento8 páginasAminas en La IndustriaCinthia Benavente50% (2)
- NeurotransmisoresDocumento44 páginasNeurotransmisoresLeidys Diana Requena100% (1)
- Unidad 5 Analgesia y Anestesia Del Paciente CríticoDocumento40 páginasUnidad 5 Analgesia y Anestesia Del Paciente CríticoMajo HenjesAún no hay calificaciones
- Autacoides (Resumen Completo)Documento5 páginasAutacoides (Resumen Completo)Emmanuel Orozco RuizAún no hay calificaciones
- Patologias de La Secrecion GastricaDocumento34 páginasPatologias de La Secrecion GastricaLeonardo GiraldoAún no hay calificaciones
- El Analisis de Histamina en El Pescado Por Que Es Necesario - SiggoDocumento8 páginasEl Analisis de Histamina en El Pescado Por Que Es Necesario - SiggoWilliamAún no hay calificaciones
- Segundo Parcial AnestesiologíaDocumento318 páginasSegundo Parcial AnestesiologíaEmily MezaAún no hay calificaciones
- Antihistaminicos H-1Documento27 páginasAntihistaminicos H-1Miguel Machaca Flores (QuimioFarma)Aún no hay calificaciones
- Refrianex: Paracetamol-Pseudoefedrina-BromhexinaDocumento6 páginasRefrianex: Paracetamol-Pseudoefedrina-BromhexinaMaria Veronica BerteroAún no hay calificaciones
- Fisiopatologia y Manejo Del Dolor en Cancer 1.en - EsDocumento8 páginasFisiopatologia y Manejo Del Dolor en Cancer 1.en - Esluufer19Aún no hay calificaciones