0% encontró este documento útil (0 votos)
263 vistas15 páginasCafeina Metodos
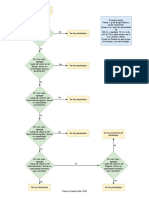
Este documento presenta un informe de práctica de laboratorio sobre la determinación analítica de la cafeína en diferentes productos comerciales mediante espectroscopía UV-Visible. El objetivo es utilizar técnicas de extracción y espectroscopía para determinar el contenido de cafeína en café, té y cacao. Se incluye información sobre el café, la composición y tipos de cafeína, así como sus propiedades químicas y fisiológicas.
Cargado por
Sandra Lizbeth AltamiranoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd
0% encontró este documento útil (0 votos)
263 vistas15 páginasCafeina Metodos
Este documento presenta un informe de práctica de laboratorio sobre la determinación analítica de la cafeína en diferentes productos comerciales mediante espectroscopía UV-Visible. El objetivo es utilizar técnicas de extracción y espectroscopía para determinar el contenido de cafeína en café, té y cacao. Se incluye información sobre el café, la composición y tipos de cafeína, así como sus propiedades químicas y fisiológicas.
Cargado por
Sandra Lizbeth AltamiranoDerechos de autor
© © All Rights Reserved
Nos tomamos en serio los derechos de los contenidos. Si sospechas que se trata de tu contenido, reclámalo aquí.
Formatos disponibles
Descarga como DOCX, PDF, TXT o lee en línea desde Scribd