Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Fenol Agua
Cargado por
Caleb Juárez ReyesTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Fenol Agua
Cargado por
Caleb Juárez ReyesCopyright:
Formatos disponibles
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2010
Trabajo Prctico N 3
- Sistema de Lquidos Parcialmente Miscibles: Fenol-AguaObjetivo: Estudiar el comportamiento de un sistema de lquidos parcialmente miscibles, a presin constante. Determinar la temperatura y la composicin crtica del sistema. Consideraciones Generales
La regla de las fases establece
V =CF +2
Donde
V es la varianza o grados de libertad: es el nmero mnimo de variables intensivas independientes
necesario para especificar el estado de un sistema en equilibrio; F es el nmero de fases. Fase es toda porcin homognea de un sistema en equilibrio que presenta lmites fsicos definidos;
C es el nmero de componentes: es el menor nmero de especies qumicamente independientes
necesario para describir la composicin de cada fase de un sistema en equilibrio. Como el nmero mnimo de grados de libertad es cero, el nmero mximo de fases Fmx = C + 2 . Si el sistema es de dos componentes independientes resulta Fmx = 4 . Por otra parte el nmero mnimo de fases es Fmin = 1 , con lo que resulta Vmax = 3 . Estas variables son la temperatura ( T ), la presin ( p ) y la concentracin o la composicin ( c o x ). La representacin del comportamiento del sistema debe hacerse entonces en un sistema de tres ejes coordenados que pueden corresponder respectivamente a presin, temperatura y composicin. Sin embargo, si una de las variables anteriores se mantiene constante, se simplifica la representacin que puede hacerse entonces en el plano. Estas representaciones se llaman Diagramas de Fases. Por ejemplo, puede representarse el comportamiento del sistema de varias formas: T = f ( c ) a p = cte o p = f (c ) a T = cte o p = f (T ) a composicin constante, entre otras. De acuerdo a la regla de las fases, un lquido puro en contacto con su vapor constituye un sistema univariante. Sin embargo, si se agrega una cantidad pequea de una segunda sustancia, capaz de disolverse en la primera, dar lugar a la formacin de un sistema bivariante, pues el nmero de componentes es 2 y el nmero de fases tambin (la solucin lquida homognea y el vapor en equilibrio con ella). A temperatura constante, la presin del sistema es una funcin de la composicin. Si el segundo componente es un lquido parcialmente soluble en el mismo y se agrega en cantidades crecientes, la solucin resultante permanecer homognea y su composicin y presin se modificarn continuamente hasta que la concentracin alcance un valor definido a partir del cual la sustancia no continuar disolvindose y esto dar lugar a la formacin de dos fases lquidas. Dado que en el sistema, a partir de ese momento, hay tres fases presentes -dos lquidos y un vapor- el sistema pasa de bivariante a univariante. A una temperatura dada, la concentracin de los componentes en las dos fases lquidas, como as tambin la presin de vapor, tendrn valores definidos. Las dos fases lquidas pueden ser consideradas, la una como una solucin del componente 1 en el componente 2 y la otra como solucin del componente 2 en el componente 1. Si la temperatura se mantiene constante, el sistema constituido por dos fases lquidas tiene una presin de vapor definida, y el agregado de uno de los componentes modificar solamente las cantidades relativas de las fases lquidas presentes. Cuando la temperatura cambia, la composicin de las dos soluciones tambin lo hace, y este hecho dar lugar a la obtencin de dos curvas de solubilidad, una mostrando la solubilidad del componente 1 en el 2 y la otra del 2 en el 1. Dado que la formacin de las soluciones est acompaada con cambios trmicos, la solubilidad puede aumentar o disminuir con el incremento de la temperatura. Las dos soluciones que a una temperatura dada coexisten en equilibrio, se denominan soluciones conjugadas. El Sistema Fenol-Agua Cuando el fenol se agrega al agua a temperatura ambiente, se obtiene una solucin homognea de fenol en agua, hasta alcanzar una concentracin de un 8%, a partir de la cual una adicin posterior de fenol es causa de la formacin de la segunda fase, conjugada de la primera y que consiste en una cantidad muy pequea de agua disuelta en fenol. 12
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2010
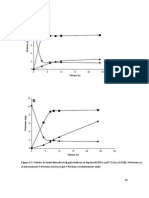
Si la temperatura se eleva, se alcanza un valor al cual la segunda fase desaparece, pero por agregado posterior de soluto (fenol) a esa nueva temperatura T, se obtienen otra vez dos fases conjugadas y nuevamente ser necesario aumentar la temperatura para que las fases sean miscibles. Anotando las temperaturas de miscibilidad y las cantidades de fenol agregado sobre una cantidad conocida de agua, se obtiene la curva de solubilidad de fenol en agua. Se puede comprobar que, cuando la temperatura es mayor que 66 C el fenol es soluble en agua en todas proporciones, mientras que por debajo de esa temperatura, existe una zona de concentracin y temperatura a la cual aparecen las dos fases conjugadas. Por otro lado, se puede obtener una curva de solubilidad de agua en fenol, si se agregan cantidades conocidas de agua sobre una cantidad determinada de fenol y se miden las temperaturas a las cuales se producen las correspondientes miscibilidades de las fases conjugadas. Existe un punto, en el cual las dos curvas son comunes, es decir que la solucin de fenol en agua tiene la misma composicin que la solucin de agua en fenol. A este punto se lo denomina punto crtico o de codisolucin y la temperatura a la cual ocurre, se le nombra como temperatura crtica o de codisolucin. La composicin puede tambin denominarse concentracin crtica. Un diagrama tpico se muestra en la figura 1c. En la figura 1b se muestra un ejemplo con temperatura de codisolucin inferior (trietilamina y agua) y en la figura 1a, un sistema que presenta ambos tipos de temperatura (nicotina y agua).
65 210
18.5 61
H2O Fig. 1a
Nicotina
H2O
Trietilamina Fig. 1b
H2O Fig. 1c
Fenol
Teniendo en cuenta que la presin tiene poca influencia sobre el equilibrio de las fases lquidas conjugadas, puede prescindirse de ella como variable, prescindiendo al mismo tiempo de la fase vapor con lo cual no se altera el nmero de grados de libertad del sistema. Las temperaturas de miscibilidad corresponderan en este caso a equilibrios de fases condensadas a presiones que no son las que corresponden al verdadero equilibrio con la presencia de la fase vapor.
Experiencia
Se arma el aparato de acuerdo a la Figura 2. Se pesan 5 g de fenol al centigramo y se coloca en el tubo A, el cual va provisto de un termmetro a la dcima de grado y de un agitador. Se calienta el tubo A colocado dentro del C que acta como camisa. Es conveniente que la temperatura del bao sea alrededor de 15 C superior a las temperaturas que se indican en la tabla I para cada determinacin. Se agrega al tubo A un volumen conocido de agua, tal como se indica en la Tabla I y agitando se calienta el sistema, hasta que alcance una temperatura a la cual desaparece la turbidez de la mezcla. Se lee rpidamente esa temperatura. Se saca el tubo A y se deja enfriar lentamente y agitando hasta que vuelva a aparecer turbidez por la aparicin de las dos fases conjugadas. Se lee nuevamente la temperatura. Las dos medidas no deben diferir en 0.2C, para que la determinacin sea buena. Si para volmenes menores que 2.5 ml esa diferencia es mayor que el valor indicado, se deber tomar la T medida durante el enfriamiento. 13
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2010
Fig. 2. Diseo Experimental. Tabla I. Curva de miscibilidad aproximada del sistema fenol-agua. ml de agua agregada en c/medida 2.5 0.5 0.5 2.5 4.0 5.0 10.0 15.0 ml totales de agua agregados 2.5 3.0 3.5 6.0 10.0 15.0 25.0 40.0 66.6 % 62.5 % 55.6 % 45.4 % 33.3 % 25.0 % 16.7 % 11.1 % % fenol Temperatura (C) de miscibilidad aproximada 45 50 60 65 65 65 60 45
Actividades Previas a la Realizacin del Trabajo Prctico Cuestionario Previo
Antes de concurrir al TP, debe resolver el siguiente cuestionario. Para ello, recurra a sus apuntes y libros del curso de Qumica General. (1) Qu entiende por sistema abierto o cerrado? (2) Qu forma adquiere la regla de las fases cuando se aplica a un sistema abierto? (3) Cules sern las razones moleculares que determinan que dos lquidos sean parcialmente miscibles?
Grficos
14
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2010
Para la realizacin de las actividades en el laboratorio, deben traerse los siguientes grficos. Recuerde escribir el ttulo de cada eje y las unidades correspondientes. Si va a realiza los grficos en forma manual, utilice papel milimetrado. En caso de realizar los grficos con algn programa informtico, asegrese de imprimir tambin la grilla, de manera equivalente a un papel milimetrado. Grfico 1. (T vs % fenol) Represente los datos temperatura de miscibilidad en funcin de los porcentajes de fenol de las fases conjugadas dado en la Tabla II. Tabla II. Datos extrados de International Critical Tables, vol III, pg. 389 (1928). LI y LII son los % de fenol en cada una de las fases, m indica metaestable y Q slido B2A, donde B es fenol. T (C) 1,66 m,Q 10 m 12.2 Q 15 20 25 30 35 LI 7.3 7.7 7.8 7.95 8.2 8.45 8.75 9.1 LII 75.2 73.85 73.5 73.0 72.1 71.05 69.9 68.5 T(C) 40 45 50 55 60 65 66 LI 9.6 10.45 11.8 13.8 16.8 23.9 34.0 LII 66.8 65.0 62.6 59.2 55.1 45.8 34.0
15
Fisicoqumica CIBEX
Gua de Trabajos Prcticos 2010
Informe del Trabajo Prctico Ttulo del Trabajo Prctico: Sistema Fenol- Agua Nombre:____________________________________________________ Turno:_________________________Comisin:______________________ Fecha:_________________________ Objetivo:_______________________________________________________________ Ecuaciones y Leyes empleadas:
Medidas Experimentales
(1) Complete la siguiente tabla con los datos experimentales Masa de fenol:
Tabla III: Datos relativos a la preparacin del sistema utilizado en el trabajo prctico
ml de H2O en cada agregado ml totales de H2O agregados % de fenol t/C leda por calentamiento t/C leda por enfriamiento t/oC de miscibilidad
(2) Represente los datos de la Tabla III en el Grfico 1, construido con datos de bibliografa.
A) Cuestiones Relacionadas al Trabajo Prctico.
(I) (II) Enuncie la regla de la palanca para un sistema como el estudiado en el TP. Resuelva el Problema 11 del Seminario 1.
B) Grficos.
En el informe debe incluirse el grfico 1, en el que deben marcarse los puntos experimentales.
C) Discusin.
Discuta brevemente los resultados del Trabajo Prctico.
Bibliografa Especial
FINDLAY, A. The phase rule and its applications, Dover (1945).
16
También podría gustarte
- Psicometría. Principios básicos y protocolos experimentales diversosDe EverandPsicometría. Principios básicos y protocolos experimentales diversosAún no hay calificaciones
- Práctica 3 FenolDocumento7 páginasPráctica 3 FenolEduardo Ruiz LopezAún no hay calificaciones
- Preguntas LaboratorioDocumento7 páginasPreguntas LaboratorioMonica OramasAún no hay calificaciones
- Practica No 1Documento15 páginasPractica No 1Osiris Zeraju RevoredaAún no hay calificaciones
- Practica 7 CineticaDocumento6 páginasPractica 7 CineticaPoncho Malagón100% (1)
- Informe Descomposición Del Peróxido de HidrógenoDocumento4 páginasInforme Descomposición Del Peróxido de HidrógenoISABELA SOLARTE CASTILLOAún no hay calificaciones
- Presion de VaporDocumento1 páginaPresion de VaporJosé Alejandro Valencia AlcaldeAún no hay calificaciones
- Practica 6 Capacidades CalorificasDocumento5 páginasPractica 6 Capacidades CalorificasDomingo GuerraAún no hay calificaciones
- Equilibrio Solido PracticaDocumento10 páginasEquilibrio Solido PracticaFrancisco Madrigal Meraz100% (1)
- Informe 4 FQII - Factor de Van T HoffDocumento13 páginasInforme 4 FQII - Factor de Van T HoffLeonardo SerranoAún no hay calificaciones
- ElectroquimicaDocumento12 páginasElectroquimicaMario FlorencioAún no hay calificaciones
- Aplicaciones de La Electrosintesis de Compuestos Organicos e InorganicosDocumento2 páginasAplicaciones de La Electrosintesis de Compuestos Organicos e InorganicossantiagoAún no hay calificaciones
- Determinación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaDocumento3 páginasDeterminación de La Constante de Velocidad Mediante La Cinética de La Hidrólisis de Un Ester Por Conductividad EléctricaSebas Soto0% (1)
- Práctica 11. Propiedades Coligativas PDFDocumento10 páginasPráctica 11. Propiedades Coligativas PDFing AlimentosAún no hay calificaciones
- Taller de ElectroquímicaDocumento5 páginasTaller de ElectroquímicaPaula HerreraAún no hay calificaciones
- Extracción de CafeínaDocumento5 páginasExtracción de CafeínaRoberto Muñoz100% (1)
- PRÁCTICA 1. Cinética Química Reacciones de RelojDocumento8 páginasPRÁCTICA 1. Cinética Química Reacciones de RelojPaola100% (1)
- Diagrama de Fases de Un Sistema TernarioDocumento13 páginasDiagrama de Fases de Un Sistema TernarioJohn Montellanos100% (2)
- Informe #16 - Estudio de La Velocidad de Descomposición Catálica Del Peróxido de HidrógenoDocumento12 páginasInforme #16 - Estudio de La Velocidad de Descomposición Catálica Del Peróxido de HidrógenoDevra GomezAún no hay calificaciones
- Miscibilidad Parcial 1 TrueDocumento10 páginasMiscibilidad Parcial 1 TrueChino HptaAún no hay calificaciones
- Práctica de Laboratorio de Fisicoquímica - Volumen Molar Parcial de Una Mezcla Binaria (Picnómetro)Documento7 páginasPráctica de Laboratorio de Fisicoquímica - Volumen Molar Parcial de Una Mezcla Binaria (Picnómetro)Maria D'Los Angeles Lista50% (2)
- Cinetica LactasaDocumento122 páginasCinetica LactasaalvarezriAún no hay calificaciones
- Informe Miscibilidad Parcial G4 SG4Documento10 páginasInforme Miscibilidad Parcial G4 SG4Nicole AguilarAún no hay calificaciones
- Acti #3 PADRON CALDERON JOSE RAULDocumento5 páginasActi #3 PADRON CALDERON JOSE RAULLUAR PADRONAún no hay calificaciones
- Informe de Fico II N°5 - Diagrama de Fase Etanol-AguaDocumento14 páginasInforme de Fico II N°5 - Diagrama de Fase Etanol-Aguatalia rodriguezAún no hay calificaciones
- Equilibrio Liquido LiquidoDocumento2 páginasEquilibrio Liquido Liquidozerachiel17Aún no hay calificaciones
- VISCOSIDADDocumento6 páginasVISCOSIDADRafael GonzálezAún no hay calificaciones
- Perkin Acido CinamicoDocumento5 páginasPerkin Acido CinamicoFernanda DomínguezAún no hay calificaciones
- Prac 6 - Secado de SólidosDocumento12 páginasPrac 6 - Secado de SólidosConchita ParedesAún no hay calificaciones
- L B Volumenes Molares ParcialesDocumento7 páginasL B Volumenes Molares Parcialesfabrycio chAún no hay calificaciones
- Evaporación SimpleDocumento18 páginasEvaporación SimpleDuber Julian Martinez GrandaAún no hay calificaciones
- Variación de La Conductividad Con La Temperatura: ObjetivosDocumento10 páginasVariación de La Conductividad Con La Temperatura: ObjetivosAnonymous ExcNQWv7PAún no hay calificaciones
- Problemario de Balance IDocumento4 páginasProblemario de Balance IConrrado Ramirez RivasAún no hay calificaciones
- Informe Destilación Simple, Fraccionada, Presión Reducida y Por ArrastreDocumento13 páginasInforme Destilación Simple, Fraccionada, Presión Reducida y Por ArrastreGiovanny GranadosAún no hay calificaciones
- Preinforme Calor de CombustiónDocumento5 páginasPreinforme Calor de CombustiónJ Díaz MendozaAún no hay calificaciones
- MetiltrifenilestañoDocumento9 páginasMetiltrifenilestañooscarAún no hay calificaciones
- PRACTICA #10 ElectroquimicaDocumento9 páginasPRACTICA #10 ElectroquimicaMiriam Vasquez Bravo100% (1)
- Mecanismo de Reacción Nylon 6,6Documento10 páginasMecanismo de Reacción Nylon 6,6ايفونكهرلمذبذبAún no hay calificaciones
- PrevioPractica3 BelmontVázquezJesúsDocumento9 páginasPrevioPractica3 BelmontVázquezJesúsLeslie Karina De León SánchezAún no hay calificaciones
- Práctica 9. Reacciones de Oxido-ReducciónDocumento9 páginasPráctica 9. Reacciones de Oxido-ReducciónBrenda HernandezAún no hay calificaciones
- Equilibrio Quimico InformeDocumento11 páginasEquilibrio Quimico InformeAndrés AnayaAún no hay calificaciones
- 4.2.2 Modelo de Michaellis MenteDocumento11 páginas4.2.2 Modelo de Michaellis MenteDiana Akatzukis Gusemëz50% (2)
- Aumento Del Punto de EbulliciónDocumento2 páginasAumento Del Punto de EbulliciónAbril AguilarAún no hay calificaciones
- Cristalizacion y SecadoDocumento44 páginasCristalizacion y SecadoVanessa Alicia Catazi AnampaAún no hay calificaciones
- Seminario de DestilacionDocumento66 páginasSeminario de DestilacionLarissa Pérez GonzalezAún no hay calificaciones
- Laboratorio de Volumen Molar ParcialDocumento7 páginasLaboratorio de Volumen Molar ParcialNachoo DiazAún no hay calificaciones
- Reporte - CLAR. Quimica Analitica 3Documento3 páginasReporte - CLAR. Quimica Analitica 3Atzin LedesmaAún no hay calificaciones
- Reporte Práctica 9 - Obtención de Ácido Fumárico (Isomería Cis - Trans)Documento4 páginasReporte Práctica 9 - Obtención de Ácido Fumárico (Isomería Cis - Trans)zackdricklAún no hay calificaciones
- Informe 2 PH, Acidez, SinéresisDocumento6 páginasInforme 2 PH, Acidez, SinéresisDeisy GonzalezAún no hay calificaciones
- Yodación de AcetonaDocumento10 páginasYodación de AcetonaUriel RamosAún no hay calificaciones
- Laboratorio Ley de RaoultDocumento14 páginasLaboratorio Ley de RaoultDaniela RamosAún no hay calificaciones
- Volumen Molar ParcialDocumento3 páginasVolumen Molar ParcialIsa UrbinaAún no hay calificaciones
- Practica 3 Experiencia Cualitativa de Ácido-Base Sobre Fuerza y AcidezDocumento14 páginasPractica 3 Experiencia Cualitativa de Ácido-Base Sobre Fuerza y AcidezJManuelFCAún no hay calificaciones
- Preinforme 10Documento10 páginasPreinforme 10Sergio Ivan Morales GonzalezAún no hay calificaciones
- Práctica 7. Estudio de La Cinetica de Yodacion de La Acetona PDFDocumento4 páginasPráctica 7. Estudio de La Cinetica de Yodacion de La Acetona PDFCristian ArámbulaAún no hay calificaciones
- Determinación de La Constante de Equilibrio QuímicoDocumento6 páginasDeterminación de La Constante de Equilibrio QuímicoAlejandro GonzalezAún no hay calificaciones
- Estudio de La Cinética de La Inversión de La SacarosaDocumento13 páginasEstudio de La Cinética de La Inversión de La Sacarosajorge11da0% (1)
- Informe No 6 Frontera MovilDocumento5 páginasInforme No 6 Frontera MovilAndrea diazAún no hay calificaciones
- Liquidos Parcialmente MisciblesDocumento6 páginasLiquidos Parcialmente MisciblesYozelin Brenda JoselinAún no hay calificaciones
- Informe Fisicoquimica: Sistemas BinariosDocumento7 páginasInforme Fisicoquimica: Sistemas BinariosAngel Bryan Ñahuis OrtizAún no hay calificaciones
- Elinjertoenplantasdetomate PDFDocumento16 páginasElinjertoenplantasdetomate PDFCaleb Juárez ReyesAún no hay calificaciones
- Evaluacion de Una TablaDocumento9 páginasEvaluacion de Una TablaCaleb Juárez ReyesAún no hay calificaciones
- ContentDocumento581 páginasContentCaleb Juárez ReyesAún no hay calificaciones
- Evaporador de Pelicula AscendenteDocumento24 páginasEvaporador de Pelicula AscendenteMarco Antonio A RAún no hay calificaciones
- El UniversoDocumento3 páginasEl UniversoCaleb Juárez ReyesAún no hay calificaciones
- Calculo de Una Cinta TransportadoraDocumento34 páginasCalculo de Una Cinta TransportadorathexsamAún no hay calificaciones
- Ejercicos Naysha 3Documento2 páginasEjercicos Naysha 3Naysha Condori RamosAún no hay calificaciones
- Factor de Potencia-Equipo 6Documento4 páginasFactor de Potencia-Equipo 6Franck JavierAún no hay calificaciones
- EJERCICIOSCIRCUITOSDocumento15 páginasEJERCICIOSCIRCUITOSRogelio Ayala GarcíaAún no hay calificaciones
- Isotermas BETDocumento55 páginasIsotermas BETManuel IgnacioAún no hay calificaciones
- Procedimiento RPC S y Camas CARMDocumento14 páginasProcedimiento RPC S y Camas CARMIng. CamachoAún no hay calificaciones
- Practica 3-1p - Tratamiento de Datos CineticosDocumento7 páginasPractica 3-1p - Tratamiento de Datos CineticosMelisa ParedesAún no hay calificaciones
- P5 - Impacto de Chorro - Grupo 2 - Ojeda - Acosta-BecerraDocumento17 páginasP5 - Impacto de Chorro - Grupo 2 - Ojeda - Acosta-BecerraJose antonio Acosta pinzonAún no hay calificaciones
- Viscosidad y Tension Superficial - Abraham Abel Choque ZambranaDocumento5 páginasViscosidad y Tension Superficial - Abraham Abel Choque ZambranaAbraham ZambranaAún no hay calificaciones
- Circuitos RC, RL y RCLDocumento4 páginasCircuitos RC, RL y RCLJuliana PinedaAún no hay calificaciones
- Evaluación Ciencias Unidad 1 Tema 2 4° BásicoDocumento6 páginasEvaluación Ciencias Unidad 1 Tema 2 4° BásicoAlejandra Gutierrez RiveraAún no hay calificaciones
- Powest Ea 9900 30-100 KvaDocumento2 páginasPowest Ea 9900 30-100 KvaCarlos ArbelasAún no hay calificaciones
- Lab 3. Demostración Del Experimento de ReynoldsDocumento10 páginasLab 3. Demostración Del Experimento de ReynoldsAlexanderCaicedoAún no hay calificaciones
- Guia de Electricidad ContestadaDocumento5 páginasGuia de Electricidad ContestadaArmando Sandoval100% (9)
- Laboratorio Fisica 3 #3 DDDocumento9 páginasLaboratorio Fisica 3 #3 DDDayana Figueredo DiazAún no hay calificaciones
- Marco Teorico 4Documento26 páginasMarco Teorico 4Jackeline Mercedes Martinez DumAún no hay calificaciones
- Short Killer Fuente para Deteccion de Cortos Circuitos Manual Completo de Usuario en EspañolDocumento6 páginasShort Killer Fuente para Deteccion de Cortos Circuitos Manual Completo de Usuario en Españolaries mxAún no hay calificaciones
- Nose 1BCHDocumento138 páginasNose 1BCHsologuebAún no hay calificaciones
- Iiee 4Documento1 páginaIiee 4IVAN HERBERT MONTENEGRO VARGASAún no hay calificaciones
- Cap 6 y 7Documento29 páginasCap 6 y 7EilithAún no hay calificaciones
- Ejercicio 7,2 SeaderDocumento15 páginasEjercicio 7,2 SeaderAndruws OrellanaAún no hay calificaciones
- Ejercicios de Unidades de MedidasDocumento5 páginasEjercicios de Unidades de MedidasLujaris HicianoAún no hay calificaciones
- Informe Previo 4Documento17 páginasInforme Previo 4Marco Saldaña RiosAún no hay calificaciones
- C) Partículas Cargadas XDocumento10 páginasC) Partículas Cargadas XLaLo Martiinez LopeezAún no hay calificaciones
- 3-LineasTransmision Ideal Regimen TransitorioDocumento14 páginas3-LineasTransmision Ideal Regimen TransitorioGamalier3Aún no hay calificaciones
- Fis 200 (Ex 2-2021)Documento5 páginasFis 200 (Ex 2-2021)FredyAún no hay calificaciones
- Cómo Se Calcula La Transmitancia Térmica en Las Fachadas - FicherotecniaDocumento4 páginasCómo Se Calcula La Transmitancia Térmica en Las Fachadas - Ficherotecniaabrahamrv44Aún no hay calificaciones
- Tipos Arranque Motocompresores MonofasicosDocumento7 páginasTipos Arranque Motocompresores Monofasicosaucadenas100% (10)
- Practica 2 LEY DE HESSDocumento10 páginasPractica 2 LEY DE HESSyuliana melchor melchorAún no hay calificaciones