Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Compuestos Ionicos Relación de Radios
Cargado por
Dario DoriaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Compuestos Ionicos Relación de Radios
Cargado por
Dario DoriaCopyright:
Formatos disponibles
Los compuestos iónicos están formados por un empaquetamiento compacto, es
decir que los átomos o iones están ocupando la mayor fracción del espacio total.
De allí que el arreglo más estable en los compuestos iónicos es aquel en donde los
aniones y los cationes se tocan simultáneamente entre si.
Los iones se mantienen unidos solo mediante fuerzas electrostáticas , ello hace que
tiendan a ordenarse en un arreglo geométrico tal que las repulsiones entre cargas
similares sean mínimas y las atracciones entre cargas distintas sean máximas.
El agrupamiento de las partículas más sencillas dentro de un ensamble cristalino
se llama RED CRISTALINA .
Cada red cristalina es un empaque tridimensional de bloques idénticos llamados
CELDAS UNITARIAS.
PROPIEDADES DE LOS COMPUESTOS IONICOS
El empaquetamiento compacto confiere a los compuestos iónicos una serie de propiedades
así:
1. Los enlaces iónicos son bastante fuertes y unidireccionales.
2. Altos puntos de ebullición y de fusión.
En relación a estos compuestos se ha observado que el p.e y el p.f son proporcionales con:
El incremento de la carga al mantenerse constante la distancia.
Con el incremento de la energía de red cristalina(|uo|) al mantenerse constante la carga y la
distancia.
Con la disminución de la distancia al mantenerse constante la carga.
3. Altos calores de vaporización.
4. Altas durezas en proporción a la disminución de las distancias interionicas y con el aumento
de la carga iónica . Los iones con 8 e-s producen cristales más duros que los poseen 18 e-s.
5. Alta solubilidad en compuestos polares o que tengan una alta constante dieléctrica.
6. Fragilidad : Cuando se le suministra suficiente energía a la capa cristalina de una celda
unitaria, las fuerzas de atracción se hacen de repulsión y el cristal se quiebra.
REDES CRISTALINAS IÓNICAS Y RELACIÓN DE RADIOS
Las redes cristalinas iónicas más estables y más comunes son la tetraédrica,
octaédrica y la cúbica que corresponden a los números de coordinación 4, 6 y
8.
Las redes cristalinas iónicas se denominan según el nombre del mineral común
que cristaliza en la misma forma de la red cristalina:
RED CRISTALINA Relación de radios No. de Coord.
CsCl, fluorita Más de 0,73 8 = cúbica
NaCl, rutilo 0,41 -0.73 6 = octaédrico
Wurlzita, Cuarzo 0.22 – 0.41 4 = Tetraédrica
La RELACIÓN DE RADIOS se define como el radio del catión respecto al radio
del anión y se deduce asi:
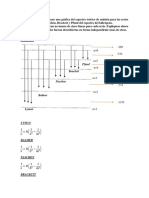
RED CRISTALINA CUBICA
Aquí los aniones se encuentran en los vértices de un cubo y los cationes en el centro.
La arista del cubo es igual al doble del radio del anión, b = 2ra y la diagonal más larga es igual
a d’ = 2ra + 2rc , puesto que:
Usando Pitágoras, se tiene que
d’
para la cara:
d2 = b2 + b2
d = b√2 d b
para la diagonal más larga se tiene :
d’2 = (b√2)2 + b2. d’ = b√3, por consiguiente b√3 = 2ra+ 2rc y b = 2ra de donde:
√3 = 1 + rc/ra y rc/ra = 0.732
Para las otras estructuras cristalinas, se sigue un procedimiento similar y el valor de la
relación de radios para estas estructuras es:
Red cristalina tetraédrica = 0.221 Red cristalina Octaédrica = 0.414
Red cristalina trigonal plana = 0.155
ENERGÍA DE RED CRISTALINA
Se define como la energía que se libera cuando un mol de un compuesto ionico se
forma en el cristal a partir del número de iónes requeridos en el estado gaseoso.
Puesto que la determinación de la energía de red cristalina (uo) es en muchos casos
deficil y a veces imposible, se determina indirectamente mediante 2 vías a saber:
1. En términos de la interacción de los iones en los cristales.
2. En términos del proceso cíclico de Born-Haber.
ENERGÍA DE RED EN FUNCIÓN DE LA INTERACCIÓN DE IONES
Para calcular la energía durante la formación de un sólido iónico se deben
considerar dos tipos de contribuciones:
a) La energía de atracción coulombica entre iones de carga opuesta, conocida como
energía de MADELUNG:
Ke 2 NAZ 2
E=
r
Donde: N = Número de Avogadro, A = Constante de Madelung, característica para cad
cristal, Z = carga del ión
EJERCICIOS
1. Señale explicando su respuesta para cada par, el compuesto con más alto punto de
fusión:
a) NaCl – KBr
b) CaO – MgO
c) MgO – ZnO
d) NaCl - CaO
2: El MgO es más duro y tiene un punto de fusión más alto que el NaF. Como se podría
explicar esta diferencia.
3. Las distancias entre iónes y el punto de fusión de las sales de Na son las siguientes:
COMPUESTO NaF NaCl NaBr NaI
Distancia entre iones (Å ) 2.3 2.8 2.9 3.2
Punto de fusión(ºC) 988 801 740 660
Explicar la variación de estas cantidades con el número atómico del halógeno.
También podría gustarte
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Materiales 3, 4, 5Documento55 páginasMateriales 3, 4, 5Fernando J. Vásconez80% (15)
- Actividades Resueltas Enlace QuímicoDocumento24 páginasActividades Resueltas Enlace QuímicomonchoAún no hay calificaciones
- Caracterización química, morfológica y estructural de materialesDe EverandCaracterización química, morfológica y estructural de materialesAún no hay calificaciones
- Clasificacion de Estructuras CristalinasDocumento62 páginasClasificacion de Estructuras CristalinasBerenice Acevedo HerreraAún no hay calificaciones
- Tema 3 Enlace QuimicoDocumento19 páginasTema 3 Enlace Quimicopaulagarcia343Aún no hay calificaciones
- Enlace químico: ionico y covalenteDocumento10 páginasEnlace químico: ionico y covalenteAbril HerreraAún no hay calificaciones
- Enlace Químico: Cuestiones Enlace IónicoDocumento13 páginasEnlace Químico: Cuestiones Enlace IónicolauranoecepedaAún no hay calificaciones
- Abbaschian R. Physical Metallurgy Principles 4ed., Capitulo 3 Español - (081-100)Documento20 páginasAbbaschian R. Physical Metallurgy Principles 4ed., Capitulo 3 Español - (081-100)Moisés Morera AlfaroAún no hay calificaciones
- Química Bachillerato 2º ParteDocumento5 páginasQuímica Bachillerato 2º PartekklsvAún no hay calificaciones
- 2.2.-A. - Enlaces IonicosDocumento13 páginas2.2.-A. - Enlaces IonicosIvonne De la RosaAún no hay calificaciones
- Cristales IonicosDocumento3 páginasCristales IonicosPablo Andres VintimillaAún no hay calificaciones
- Modulo 06 - Enlaces y Estructuras PDFDocumento47 páginasModulo 06 - Enlaces y Estructuras PDFMaylencita VirgoliniAún no hay calificaciones
- Tema 2 La Escala Atómica de Los Materiales Cerámicos 2020-2021 Nuevo PDFDocumento44 páginasTema 2 La Escala Atómica de Los Materiales Cerámicos 2020-2021 Nuevo PDFBrian EstacioAún no hay calificaciones
- Guía de Estudio No.1 QI 2 2019 18e TEV y TCCDocumento6 páginasGuía de Estudio No.1 QI 2 2019 18e TEV y TCCArévaloAún no hay calificaciones
- ESTADOSOLIDODocumento16 páginasESTADOSOLIDOConstanza Droguett San MartínAún no hay calificaciones
- QGI 16-17 Tema 2BDocumento29 páginasQGI 16-17 Tema 2BFernando López ExpósitoAún no hay calificaciones
- Redes de BravaisDocumento13 páginasRedes de BravaisYhoan Miller Lujan GomezAún no hay calificaciones
- 08 Enlace I Nico PDFDocumento4 páginas08 Enlace I Nico PDFCM TSAún no hay calificaciones
- Carácter covalente de los enlaces predominantemente iónicosDocumento21 páginasCarácter covalente de los enlaces predominantemente iónicosviridianasaucedoAún no hay calificaciones
- Sesion-06 EstructuraDocumento8 páginasSesion-06 EstructuraasdAún no hay calificaciones
- Enlace IonicoDocumento21 páginasEnlace IonicopatriciaAún no hay calificaciones
- Cap. 5 Enlace IonicoDocumento6 páginasCap. 5 Enlace IonicoCarlos Gracia CardosoAún no hay calificaciones
- Sitios intersticiales y estructuras cristalinas en materialesDocumento25 páginasSitios intersticiales y estructuras cristalinas en materialesJuan Sebastian Reyes MartinezAún no hay calificaciones
- Cristales IonicosDocumento3 páginasCristales IonicosPablo Andres VintimillaAún no hay calificaciones
- Materiales 2Documento13 páginasMateriales 2Kristian Rock AndreeAún no hay calificaciones
- Unidad 2 P. MaterialesDocumento84 páginasUnidad 2 P. MaterialesRoberto HdzAún no hay calificaciones
- Teoría de Campo CristalinoDocumento2 páginasTeoría de Campo CristalinoAnonymous eZB6YajtBnAún no hay calificaciones
- Características estructurales de los sólidos iónicosDocumento15 páginasCaracterísticas estructurales de los sólidos iónicoscristiangggAún no hay calificaciones
- Tema 44Documento10 páginasTema 44Mar Espinosa GómezAún no hay calificaciones
- Tema 5 Solidos Ionicos14Documento17 páginasTema 5 Solidos Ionicos14DokamAún no hay calificaciones
- Quimica InorganicaDocumento74 páginasQuimica InorganicaEduardo Condeña CachayAún no hay calificaciones
- Capitulo 12Documento25 páginasCapitulo 12Brian Meza CanepaAún no hay calificaciones
- Cristales SolidosDocumento10 páginasCristales SolidosValdr Nilsen StiglitzAún no hay calificaciones
- Cristaloquímica del vidrio: Polarización iónica y coordinaciónDocumento22 páginasCristaloquímica del vidrio: Polarización iónica y coordinaciónSelma RodriguezAún no hay calificaciones
- Cristales Iónicos ExpDocumento18 páginasCristales Iónicos ExpWilliam ValenciaAún no hay calificaciones
- Tema 3 EnlaceDocumento34 páginasTema 3 Enlacejrb759Aún no hay calificaciones
- Inorganica Solidos Cristalinos y IonicosDocumento25 páginasInorganica Solidos Cristalinos y Ionicosbrayan huancaAún no hay calificaciones
- 2.estructura de Las CeramicasDocumento124 páginas2.estructura de Las Ceramicasjonan1991Aún no hay calificaciones
- SOBRE EL ENLACE IÓNICO Y SUS MÉTODOS DE ESTIMACIÓNDocumento17 páginasSOBRE EL ENLACE IÓNICO Y SUS MÉTODOS DE ESTIMACIÓNMario Jesus Mamani HuayllaniAún no hay calificaciones
- Ecuacion de Born-Lande 19748Documento6 páginasEcuacion de Born-Lande 19748Gustavo PorrasAún no hay calificaciones
- QGI-Tema5 Relacion de ProblemasDocumento11 páginasQGI-Tema5 Relacion de ProblemasMayte Olenka Miranda BandaAún no hay calificaciones
- 20tema 2.-Los Enlaces QuímicosDocumento39 páginas20tema 2.-Los Enlaces QuímicosHCK DGU3RR4SAún no hay calificaciones
- Tecnología de Materiales Semana 1Documento62 páginasTecnología de Materiales Semana 1Feliciano BernuiAún no hay calificaciones
- Curso: Refractarios Y Hornos Metalúrgicos: Modulo IDocumento48 páginasCurso: Refractarios Y Hornos Metalúrgicos: Modulo IPiero MendozaAún no hay calificaciones
- Enlace 4ESODocumento26 páginasEnlace 4ESODouaa AjoulasAún no hay calificaciones
- Reglas de PaulingDocumento4 páginasReglas de PaulingLuis Carlos BerlangaAún no hay calificaciones
- Redes de Bravais y estructuras cristalinasDocumento14 páginasRedes de Bravais y estructuras cristalinasyamily888Aún no hay calificaciones
- Estructura Cristalina - Tipos - de - EnlacesDocumento16 páginasEstructura Cristalina - Tipos - de - EnlacesHJKB1975Aún no hay calificaciones
- Clase 1 - Unidad 2Documento47 páginasClase 1 - Unidad 2Ivan CandelarioAún no hay calificaciones
- Teoría del campo cristalino: explica la relación entre el color y los complejos metálicosDocumento66 páginasTeoría del campo cristalino: explica la relación entre el color y los complejos metálicosNava AngeAún no hay calificaciones
- Tema Enlace QuimicoDocumento26 páginasTema Enlace QuimicoliceomariaAún no hay calificaciones
- Estructuras CristalinasDocumento31 páginasEstructuras CristalinasEdgar De la OAún no hay calificaciones
- Enlace Químico: Tipos de Enlace Iónico y CovalenteDocumento11 páginasEnlace Químico: Tipos de Enlace Iónico y CovalenteSara SanchezAún no hay calificaciones
- Apuntes Enlace Quimico 2ºDocumento25 páginasApuntes Enlace Quimico 2ºbenedictAún no hay calificaciones
- Enlace QuímicoDocumento11 páginasEnlace Químicoceo_quercusAún no hay calificaciones
- Análisis químico del aceite de semillas y torta de Samanea samanDocumento17 páginasAnálisis químico del aceite de semillas y torta de Samanea samanGeraldine DoriaAún no hay calificaciones
- Análisis químico del aceite de semillas y torta de Samanea samanDocumento17 páginasAnálisis químico del aceite de semillas y torta de Samanea samanGeraldine DoriaAún no hay calificaciones
- Taller de Fisicoquimica - CuanticaDocumento2 páginasTaller de Fisicoquimica - CuanticaDario DoriaAún no hay calificaciones
- Taller InstitucionalDocumento7 páginasTaller InstitucionalDario DoriaAún no hay calificaciones
- Trabajo BiologiaDocumento5 páginasTrabajo BiologiaDario DoriaAún no hay calificaciones
- Requisitos Relativos A Los Recursos Laboratorio de SuelosDocumento7 páginasRequisitos Relativos A Los Recursos Laboratorio de SuelosDario DoriaAún no hay calificaciones
- Trabajo BiologiaDocumento5 páginasTrabajo BiologiaDario DoriaAún no hay calificaciones
- Qué Significa e Implica Ser Un Ingeniero Con Sentido Humanista y SocialDocumento2 páginasQué Significa e Implica Ser Un Ingeniero Con Sentido Humanista y SocialDario DoriaAún no hay calificaciones
- Crisis en Las Empresas Por Riesgo Biológica PandemiaDocumento3 páginasCrisis en Las Empresas Por Riesgo Biológica PandemiaDario DoriaAún no hay calificaciones
- Taller BioquímicaDocumento1 páginaTaller BioquímicaIzela Vanessa ArciniegasAún no hay calificaciones
- Taller Organica 3Documento4 páginasTaller Organica 3Dario DoriaAún no hay calificaciones
- Fundamentos TeóricosDocumento1 páginaFundamentos TeóricosDario DoriaAún no hay calificaciones
- HTTPDocumento1 páginaHTTPDario DoriaAún no hay calificaciones
- JoseDocumento4 páginasJoseDario DoriaAún no hay calificaciones
- Practica N°8Documento5 páginasPractica N°8Dario DoriaAún no hay calificaciones
- Q QDocumento1 páginaQ QDario DoriaAún no hay calificaciones
- Taller LINADocumento8 páginasTaller LINADario DoriaAún no hay calificaciones
- Q QDocumento1 páginaQ QDario DoriaAún no hay calificaciones
- HhhyyyDocumento4 páginasHhhyyyDario Doria100% (1)
- ContenidoDocumento5 páginasContenidoDario DoriaAún no hay calificaciones
- PreinformeDocumento2 páginasPreinformeDario DoriaAún no hay calificaciones
- Taller # 2 - 02 - 2018Documento4 páginasTaller # 2 - 02 - 2018Dario DoriaAún no hay calificaciones
- JoseDocumento4 páginasJoseDario DoriaAún no hay calificaciones
- Lab 8 Cambios Fisicos y Quimicos PDFDocumento6 páginasLab 8 Cambios Fisicos y Quimicos PDFDario DoriaAún no hay calificaciones
- PreinformeDocumento2 páginasPreinformeDario DoriaAún no hay calificaciones
- ContenidoDocumento5 páginasContenidoDario DoriaAún no hay calificaciones
- PreinformeDocumento2 páginasPreinformeDario DoriaAún no hay calificaciones
- PreinformeDocumento1 páginaPreinformeDario DoriaAún no hay calificaciones
- Nomeclatura QuimicaDocumento29 páginasNomeclatura QuimicaAlfonso Martinez RoblesAún no hay calificaciones
- Guia de Orientacion Modulo de Ingles Saber Pro 2016 2Documento15 páginasGuia de Orientacion Modulo de Ingles Saber Pro 2016 2Luisa Fernanda DiazAún no hay calificaciones
- Campo Eléctrico ExperimentoDocumento13 páginasCampo Eléctrico ExperimentoLisandro VilhAún no hay calificaciones
- Cinemática Del RobotsDocumento3 páginasCinemática Del RobotsAlexis RiveraAún no hay calificaciones
- Selección de tarifa eléctrica BT para suministro 1468745Documento12 páginasSelección de tarifa eléctrica BT para suministro 1468745Luis Palacin HuamanAún no hay calificaciones
- Informe #1, Maria Rojas 3er Corte 10%Documento10 páginasInforme #1, Maria Rojas 3er Corte 10%María RojasAún no hay calificaciones
- Practica de Quimica Viernes Si o SiDocumento7 páginasPractica de Quimica Viernes Si o SiCrissAngelChambiAún no hay calificaciones
- Tiempo de secado desde curva de velocidad decrecienteDocumento18 páginasTiempo de secado desde curva de velocidad decrecienteGABRIEL VIVANCO CUARESMAAún no hay calificaciones
- Capitulo I ChapmanDocumento2 páginasCapitulo I ChapmanDanLeo17Aún no hay calificaciones
- TErmodinámica 1Documento34 páginasTErmodinámica 1Inma OrtigosaAún no hay calificaciones
- Tesis MBMDocumento175 páginasTesis MBMMariana CifuentesAún no hay calificaciones
- 1.4 A y 1.4 B CALCULO DEL COSTO DE PRODUCCIÓN EstudiantesDocumento9 páginas1.4 A y 1.4 B CALCULO DEL COSTO DE PRODUCCIÓN EstudiantesYugeniaMoraMendozaAún no hay calificaciones
- Cinemática y dinámica de partículas: Velocidad y aceleraciónDocumento66 páginasCinemática y dinámica de partículas: Velocidad y aceleraciónDAVID ISAIAS ZITLE ARROYOAún no hay calificaciones
- Medición viscosidad glicerina StornerDocumento5 páginasMedición viscosidad glicerina StornerCobracelticAún no hay calificaciones
- Numeros ComplejosDocumento11 páginasNumeros ComplejosJESON MIGUEL OLVERA RAMIREZAún no hay calificaciones
- SEGUNDO Informe de Fisica IIIDocumento37 páginasSEGUNDO Informe de Fisica IIIcorpses88100% (2)
- Examen Final Física de OndaDocumento2 páginasExamen Final Física de OndaDaniel Camilo SalamancaAún no hay calificaciones
- Quimica 5°Documento170 páginasQuimica 5°JOSECARLOSBL_30037065Aún no hay calificaciones
- Refrigeración: Diagrama de Mollier y ciclo idealDocumento34 páginasRefrigeración: Diagrama de Mollier y ciclo idealEdwin Angel Solis VitorAún no hay calificaciones
- Reporte Proyecto 2parcialDocumento9 páginasReporte Proyecto 2parcialChampi RomanAún no hay calificaciones
- Trigonometría 3roDocumento88 páginasTrigonometría 3roLiFloresMamani100% (1)
- Circuitos limitadores diodosDocumento13 páginasCircuitos limitadores diodosVictor Victor Iguaran CampoAún no hay calificaciones
- Diseño Compensador en Adelanto Victor CamachoDocumento16 páginasDiseño Compensador en Adelanto Victor CamachoVictor Camacho AmadorAún no hay calificaciones
- Mecánica Newtoniana UNALDocumento3 páginasMecánica Newtoniana UNALDannyAún no hay calificaciones
- Flujograma DerivadasDocumento1 páginaFlujograma DerivadasJorge Eliecer Acevedo PinedaAún no hay calificaciones
- Calor de combustión experimental ácido ascórbico y pentanoDocumento14 páginasCalor de combustión experimental ácido ascórbico y pentanoLINDER ANTONIO LOPEZ DOMINGUEZAún no hay calificaciones
- Lecci N 11 Transformaciones de FasesDocumento18 páginasLecci N 11 Transformaciones de FasesLeonardo MuñozAún no hay calificaciones
- Practica 3 DensidadDocumento7 páginasPractica 3 DensidadJAMJ2001 Two TimerAún no hay calificaciones
- Mate AplicadaDocumento14 páginasMate AplicadaByron GuamánAún no hay calificaciones
- Calor Molar de Vaporizacion y Punto de Ebullicion PDFDocumento7 páginasCalor Molar de Vaporizacion y Punto de Ebullicion PDFVictor HernandezAún no hay calificaciones
- Recuperacion Fisica 11Documento1 páginaRecuperacion Fisica 11carlos300106Aún no hay calificaciones